菌藻共生系统削减抗生素类污染物的去除途径及胁迫响应
2023-03-01应璐瑶王荣昌
应璐瑶,王荣昌
(同济大学环境科学与工程学院 长江水环境教育部重点实验室,上海 200092)
近几十年来,抗生素在人类和动物医学中得到广泛的应用。由于抗生素未经彻底降解而排入环境中,导致许多自然环境中可检测到各类抗生素的赋存,包括土壤、地下水、地表水和地表水沉积物等[1−3]。磺胺类药物、β−内酰胺类抗生素、四环素类抗生素等都是众所周知的牲畜农场排放的微污染物[4]。然而,传统的污水处理工艺(WWTP)对这些抗生素类微污染物的去除效果有限。目前,污水中抗生素的去除技术主要包括:物理法、化学法和生物处理法。物理法主要有过滤,可以去除但并没有降解污染物;化学法主要有混凝、絮凝、沉淀等,这些过程需要继续处理浓缩了污染物的固相。生物处理法中最常见的是活性污泥处理工艺,其有较好的处理效果,但当污染物毒性过大或浓度过高时,仍然需要寻找有效的强化措施或者组合工艺[5]。
微藻是一种广泛存在于多种水基质中的光合微生物,近年来逐渐被应用于污水处理过程中。微藻生长需要吸收氮、磷、二氧化碳等物质用于合成细胞中的蛋白质、磷酸和磷脂等[6],因此可以在污水处理过程中高效去除氮磷等营养物质的同时,实现二氧化碳固定和微藻生物质资源回收。例如,附着在聚氨酯材料上生长的微藻生物量和脂质质量分别可以达到(812±12)mg 和(376±37)mg[7]。但在污水处理的工程应用中,由于环境的开放性导致纯藻系统很难维持,一般都是菌藻共生的系统。菌藻共生系统不仅在废水处理中对营养物质的去除效率高,且能够一定程度上解决纯藻系统中难以控制杂菌污染的难题。此外,与单一纯培养系统相比,菌藻共生系统拥有更强的抗冲击负荷能力和运行稳定性。
已有许多研究表明菌藻共生系统在去除抗生素上有显著效果。在水力停留时间(HRT)为3~4d的情况下,搅拌罐光生物反应器(STPBR)菌藻系统对扑热息痛、阿司匹林和酮洛芬的混合物能够起到75%~100%的去除效果[8]。此外,菌藻共生体在光照和黑暗实验条件下对磺胺甲唑(SMX)浓度去除率分别为54.34%±2.35%和42.31%±2.59%,头孢氨苄(CFX)和红霉素(ERY)去除率分别达到96.54%和92.38%[9−10]。但是,目前对菌藻共生系统去除水体中抗生素的去除机制以及菌藻系统对抗生素胁迫的响应机制地尚缺乏系统的论述。因此,本综述旨在总结菌藻共生系统对抗生素类污染物的去除机制,介绍现有的降解抗生素的生物反应器类型,同时揭示菌藻共生系统应对抗生素胁迫的短期和长期的响应机制。
1 菌藻对抗生素类污染物的去除机制
研究表明,菌藻共生系统去除抗生素的途径主要包括生物吸附、生物累积和生物降解[11−12],如图1所示,其中生物累积主要发生在微藻系统中。此外,在菌藻共生系统中,一些抗生素可以通过光降解和挥发进一步间接去除[13]。
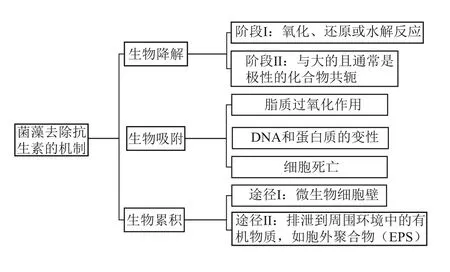
图1 菌藻共生系统去除抗生素的途径及机制
1.1 生物降解
生物降解是微生物分解有机污染的过程[14],也是大部分生物系统中去除抗生素的最主要机制。
氨氧化微生物可以降解抗生素已经被广泛报道。Dawas−Massalha 等[15]认为硝化菌代谢中,氨氮是主要的电子供体,但在高浓度氨环境下,会抑制药物活性化合物(PhACs)的共代谢转化。Wang等[16]对比了有无氨情况下硝化系统对头孢氨苄(CFX)的去除率,有氨情况下去除率远高于无氨,证明了氨氧化细菌(AOB)可以实现对CFX 的共代谢。硝化过程受到抑制时,CFX的下降主要归因于异养生物的生物降解和吸附。Xu 等[17]的研究证明,AOB 对药物的生物降解遵循共代谢路径,其中氨是微生物生长和酶诱导的主要底物和能量来源。Yang等[18]在序批式活性污泥反应器(SBR)中同时处理了磺胺甲唑(SMX)、磺胺二甲氧嘧啶(SDM)和磺胺间甲氧嘧啶(SMM)三种磺胺类抗生素,并观察到几小时内便达到吸附平衡,却在11~13d 内才实现对三种抗生素的完全去除。此外,对比有菌和无菌系统中SMX 的降解情况,可证明SMX的生物降解是其去除的主要途径[19]。同时研究得出温度对SMX 的生物降解有显著影响,且污染物的初始浓度对生物降解速率影响不显著。此外,添加其他碳源增加了SMX 的去除,也证实了抗生素共代谢机制的存在。Liu 等[20]研究发现,由Fe3+/g−C3N4和生物膜组成的光催化和生物降解系统(ICPB)中对COD的去除途径主要为生物降解,对SMX 的去除则包括光催化降解、生物降解和吸附等途径。
生物降解已被证明是微藻去除抗生素的最有效的机制。Xie 等[21]报道了衣藻(Chlamydomonassp.)对环丙沙星的100%去除效率。对于磺胺甲唑,雨生红球藻(Haematococcus pluvialis)、铜绿微囊藻(Microcystis aeruginosa)对其的生物降解率分别达到了90%、70%以上[22]。Kiki 等[23]调查了4 种微藻菌株去除10 种抗生素的能力,分别为雨生红球藻(Haematococcus pluvialis)、 山 羊 草(Selenastrum capricornutum)、栅 藻(Scenedesmus quadricauda)和小球藻(Chlorella vulgaris),发现生物降解贡献了23%~99%的去除效率。有研究利用莱茵衣藻(Chlamydomonas reinhardtii)、小球 藻(Chlorella sorokiniana)、杜氏盐藻(Dunaliella tertiolecta)和月牙藻(Pseudokirchneriella subcapitata)4种藻类对多种抗生素进行去除,发现其中大环内酯(阿奇霉素、克拉霉素、红霉素)的去除途径以生物降解为主[24]。
1.2 生物吸附
抗生素可在微生物细胞壁或者胞外聚合物(EPS)上发生生物吸附[13],这主要是由于带正电荷的基团与微生物细胞壁或EPS 表面带负电荷基团(如氨基)相互作用的结果[25]。
生物吸附是微生物去除某些抗生素的主要机制之一。研究表明,β−内酰胺类的氨苄青霉素(AMP)、氟喹诺酮类的诺氟沙星(NOR)、氧氟沙星(OFL)和环丙沙星(CIP)、四环素类(TC)抗生素、大环内酯类的罗红霉素(ROX)和脱水红霉素(ERY−H2O)的主要去除途径是生物吸附[26]。活性污泥会在短时间内快速吸附大量抗生素,并在10h 之内达到吸附平衡,其中四环素(TC)在15min内吸附率高达90%以上。而磺胺类抗生素不易被吸附。研究发现,在Fe3+/g−C3N4与生物膜耦合的光催化生物降解系统(ICPB)中SMX 的去除作用最主要的是光催化,载体的吸附作用最少[20]。
微藻的生物吸附能力是可变的。Guo 等[27]研究发现,小球藻(Chlorellasp.)、衣藻(Chlamydomonassp.)、麦可属(Mychonastessp.)对7−氨基头孢烷酸的吸附在最初10min内非常迅速,其吸附容量分别为4.74mg/g、3.09mg/g 和2.95mg/g。无生命的小球藻对480mg/L左右的头孢氨苄生物吸附去除率能达到71%[28]。普通的小球藻对甲硝唑、四环素的去除中也观察到生物吸附[29−30]。此外,由于生物吸附是热力学过程,且依赖水性介质中的电离或水解,因此温度、pH 等因素都会影响抗生素生物吸附去除的效果[31]。
1.3 生物累积
生物累积是指活微藻细胞吸收抗生素后,抗生素与与细胞内蛋白质或其他化合物结合的代谢过程[11]。抗生素进入微藻细胞的途径主要有三种:被动扩散、被动促进扩散和主动吸收[13]。被动扩散主要是由于抗生素胁迫会改变细胞膜的通透性,从而引起污染物扩散的过程。被动促进扩散是指污染物在转运蛋白的作用下跨过细胞膜的过程,此过程不消耗能量。而主动吸收则是消耗细胞内能量,污染物通过转运蛋白完成跨细胞膜的过程。利用普通小球藻和驯化的小球藻对左氧氟沙星进行去除的过程中观察到生物累积[32]。有研究在去除磺胺甲唑、磺胺二甲嘧啶的过程中也观察到生物累积,其中抗生素通过被动扩散进入微藻细胞[33]。
2 处理抗生素的菌藻生物反应器类型及特点
生物反应器的类型及其特性会影响菌藻系统的生理生化代谢活性。根据反应器内微生物的生长状态,菌藻生物反应器分为悬浮生长系统和固定化生长系统两大类。生物反应器中菌藻的生长方式不同会影响整个系统对污染物的去除效率。不同类型的菌藻生物反应器对抗生素的降解情况如表1 所示。
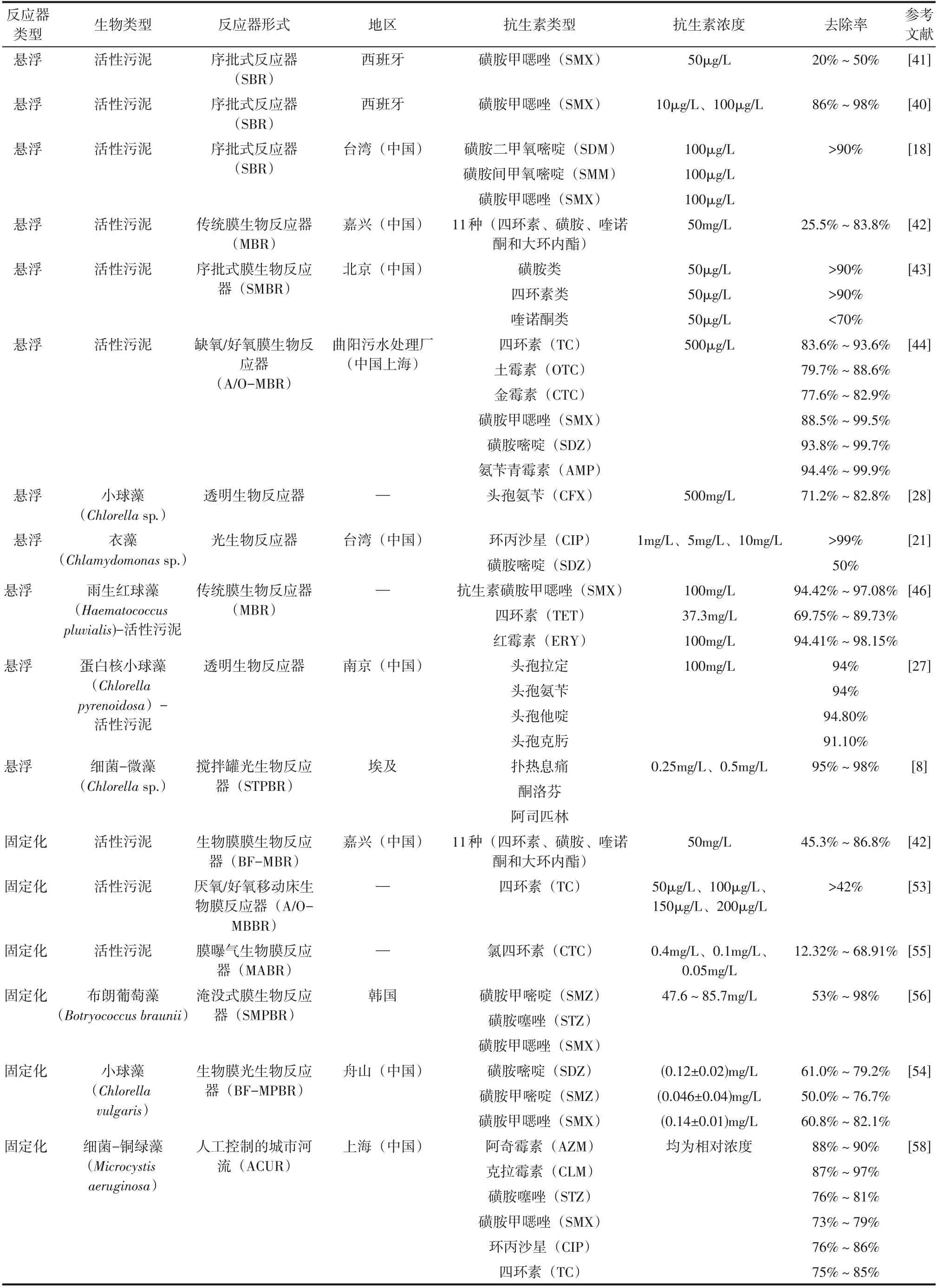
表1 降解抗生素的生物反应器类型及其去除效果
2.1 悬浮生长系统
目前最常见的悬浮光生物反应器是序批式反应器(SBR),此操作系统可以去除聚集和沉降的微藻及细菌群落[34]。已有报道称,SBR操作的水力停留时间(HRT)在1.4~8.0d 均可实现对氮、磷良好的去除效果[35−38]。在菌藻共生体已经成熟的情况下,HRT可以缩短至0.67d[39]。
已经有研究表明,悬浮活性污泥系统可以有效
去除不同种类的抗生素。接种了来自污水处理厂活性污泥的SBR 系统,对磺胺甲唑(SMX)、磺胺二甲氧嘧啶(SDM)和磺胺甲氧嘧啶(SMM)等磺胺类抗生素具有良好的去除效果,其中磺胺甲唑的长期运行降解效率高达86%[40−41]。有研究表明,实验室规模的SBR 对浓度为50μg/L 的磺胺甲唑(SMX) 水样的去除效率在20%~50% 之间[41]。Song等[42]利用传统膜生物反应器(MBR)去除消化后的猪场废水,其中包括四环素、磺胺类、喹诺酮类和大环内酯类等11 种抗生素,并最高得到了83.8%的去除率。Xu等[43]利用序批式膜生物反应器(SMBR)去除猪废水处理中的抗生素,包括磺胺类、四环素类和氟喹诺酮类等9种抗生素,其中磺胺类和四环素都被有效去除(>90%),而氟喹诺酮类药物的去除率(<70%)较低。Xia等[44]构建了缺氧/好氧膜生物反应器(A/O−MBR),探究了500μg/L 浓度下四环素(TC)、土霉素(OTC)、金霉素(CTC)、磺胺甲唑(SMX)、磺胺嘧啶(SDZ)和氨苄青霉素(AMP)的处理效果,去除率均在75%以上,且磺胺嘧啶(SDZ)和氨苄青霉素(AMP)的去除率在污泥停留时间(SRT)为60d的情况下能达到99.7%以上。
近期研究发现,悬浮菌藻共生系统在去除抗生素方面取得良好效果。Ismail等[8]利用微藻−细菌系统降解人工废水中一些常用镇痛剂(扑热息痛、阿司匹林和酮洛芬)的混合物,在连续光照条件下,以相对较短的3~4d 的HRT 在STPBR 中对上述三种抗生素起到了75%~100%的去除效果。对于污水处理厂出水[9−10],活性微藻−细菌聚生体的在光照和黑暗实验条件下对SMX 去除率分别为54.34%±2.35% 和 42.31%±2.59%, 头 孢 氨 苄(CFX)和红霉素(ERY)几乎被完全去除,总去除率分别达到96.54%和92.38%。同时有研究表明,在升流式厌氧污泥床(UASB)中加入小球藻(Chlorellasp.)对猪废水中所含四环素(TC)、氧四环素(OTC)、氯四环素(CTC)和多西环素(DC)等抗生素进行了去除,其中四环素的去除效率 最 高[45]。 在 MBR 中 加 入 雨 生 红 球 藻(Haematococcus pluvialis)后构建了菌藻共生系统,对磺胺甲唑(SMX)、四环素(TET)和红霉素(ERY)的去除效果有所提高,其中TET 的抗生素去除率从69.75%增加到89.73%[46]。
总体来说,悬浮生长系统对氮、磷等营养素及抗生素等污染物的去除效果较好。纯菌的悬浮生长系统对抗生素的去除效果会受到SRT 和HRT 等因素影响,且维持生物絮体颗粒悬浮所需的能耗较高。菌藻悬浮生长系统的絮凝沉淀特性良好,但沉降的菌藻固体颗粒易产生重返悬浮现象,悬浮生长系统的固液分离效果不稳定。
2.2 固定化生长系统
相比悬浮生长的活性污泥反应器系统,固定化生长的生物膜反应器系统对污染物的承受能力和降解效果有所提高。Song 等[42]研究发现,生物膜−膜生物反应器(BF−MBR) 的平均总氮去除率为23.5%~40.3%,显著高于相同条件下未生长生物膜的膜生物反应器(MBR)中的8.5%~21.3%。这可能是由于生物膜中同时发生硝化和反硝化作用。生物膜最内层为缺氧或厌氧环境,细菌得以进行反硝化,因此对总氮的去除大大增强。在抗生素去除方面,固定化生长的系统表现出了更好的去除效果,这可能是由于固定化细胞即生物膜所处的微环境与悬浮生长的细胞有所区别,而这种微环境的变化可能导致微生物形态结构、生理特性及代谢活性的改变[47]。例如,外层的细菌起到保护最内层细菌的作用,从而逐步建立耐受性以更好地应对抗生素的胁迫。
长期以来,人们一直在研究利用菌藻固定化系统去除地表水和废水中的养分[48−49]。例如,Adey等[50]利用藻类草坪洗涤器(ATS)装置去除氮、磷等河流污染物。Su等[51]在实验室条件下利用罐式生物反应器去除模拟废水中的总悬浮物、碳、氮、磷等物质,总悬浮物含量由1.84g/L降至0.016g/L,化学需氧量、凯氏氮和磷酸盐的平均去除率分别达到98.2%±1.3%、 88.3%±1.6% 和 64.8%±1.0%。 De Godos 等[52]在管状生物膜光生物反应器中预处理猪场废水,对氮、磷的去除能力分别稳定在94%~100%和70%~90%,在改善水质的同时积累了生物质产品。
在去除抗生素方面,Chen 等[53]构建了厌氧/好氧移动床生物膜(A/O−MBBR)反应器系统,对四环素类抗生素(TCs)的去除进行了一系列实验研究。在低浓度(10μg/L)和高浓度(500μg/L)的四环素存在条件下,降解率分别是72%和21%。Peng 等[54]构建了新型微藻生物膜光生物反应器(BF−MPBR),用于去除海洋水产养殖废水中的养分和磺酰胺(SA)等,对抗生素的去除能够达到50%~60%。Song 等[42]的研究表明,利用生物膜−膜生物反应器(BF−MBR)处理多种抗生素(四环素、磺胺、喹诺酮和大环内酯类)时,在HRT 为5~4d、3~2d 和1d 时 的 去 除 率 分 别 为86.8%、80.2%和45.3%,而相同条件下MBR中只有83.8%、57.0% 和25.5%。在利用膜曝气生物膜反应器(MABR)中,提高HRT 和进气压力均能对氧四环素(CTC)的去除起到积极作用[55]。HRT 在2.5h 和10h 下,CTC 去 除 负 荷 分 别 为0.68mg/(m2·d)和2.72mg/(m2·d);进气压力在0.28atm(1atm=101325Pa)和0.41atm(HRT=2.5h)的情况下,CTC 出水负荷分别为1.66mg/(m2·d)和1.49mg/(m2·d)。有研究利用淹没式膜生物反应器(SMPBR)对含有磺胺类抗生素的牲畜废水进行了处理,结果表明,布朗葡萄藻(Botryococcus Braunii)可以在此过程中生物降解磺胺[56],去除率可达50%以上。也有采用菌藻共生体在搅拌罐光生物反应器(STPBR)中对镇痛剂(酮洛芬、扑热息痛和阿司匹林)的混合物进行去除,并去除了95%以上的混合药物[8]。
相比悬浮生长系统,固定化生长系统对去除混合抗生素更具优势(见表1),同时还可通过改变HRT 和进气量等工艺参数来进一步强化系统对抗生素的去除效果。其中,固定化菌藻系统如流化床光生物反应器、水力藻类床等,其系统较为稳定,污水处理效果好;但需考虑生物膜与载体分离的情况,需要控制生物膜的厚度等[57]。总而言之,高效菌藻光生物反应器能够发挥菌藻共生系统的优势,在高效去除废水中的氮磷和抗生素等污染物的同时,还能够产生微藻生物质能源物质。
3 菌藻系统应对抗生素胁迫的响应机制
菌藻共生系统应对抗生素胁迫响应机制包括短期响应和长期响应两种类型。其中,短期响应主要是通过产生活性氧(reactive oxygen species, ROS)响应从而激活SOS响应,长期响应则具体表现在抗生素抗性基因的富集转移和微生物群落的演替进化等方面,如图2所示。
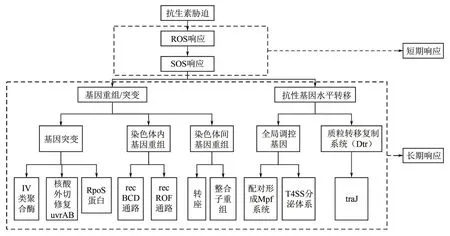
图2 菌藻共生系统应对抗生素胁迫的响应机制
3.1 应对抗生素胁迫的短期响应机制
耐药性指的是细菌在抗生素存在的环境中仍能生长,最小抑菌浓度(minimal inhibitory concentration,MIC)明显升高。耐受性指的是在MIC固定的某一浓度下,细菌不会被抗生素杀死[59]。而获得耐药性的过程中,细菌、微藻的耐受性起着主要作用。微生物应对抗生素胁迫的短期响应机制包括产生活性氧(ROS)响应和SOS响应。
活性氧(ROS)是通过连续的单电子还原所产生,包括超氧化物(O−2·)、过氧化氢(H2O2)和羟基自由基(OH·)[60]。有研究表明[61],ROS 的产生与抗性基因的接合转移频率有关,添加ROS 清除剂后,抗性基因的接合转移频率显著降低。ROS可以直接破坏DNA、脂质和蛋白质,或通过氧化脱氧核苷酸并间接破坏DNA[62]。抗生素胁迫可能会导致TCA循环、NADH 过程中产生ROS[63]。有研究表明,藻类系统中,抗生素的刺激会阻断光合作用过程中电子传输,导致电子的累积,从而诱导ROS的产生[64]。同时,低浓度的ROS诱导可能会促进耐药性,即促进抗性基因水平转移[60,65]。但高浓度抗生素胁迫产生的过量ROS 可能会导致严重的细胞损伤或死亡[66]。
SOS 响应是一种诱导型DNA 修复系统,由ROS 引起,通过修复受损的基因组来促进细胞存活[67−68]。在大肠杆菌的SOS系统中,存在40多种基因[69]。包括LexA阻遏蛋白和与之共同作用用于分离DNA 的RecA原体。此外,还有参与核苷酸切除修复的uvrABC、参与同源重组的recA和编码转移DNA 聚合酶的基因如dinA、dinB和umuDC等。研究表明,β−内酰胺能够诱导金黄色葡萄球菌中的SOS反应,能够激活RecA和LexA蛋白[70]。受到铜绿假单胞菌菌株感染的小鼠,在氧氟沙星的作用下能够观察到relA和spoT的调节[71]。多种抗生素药物如环丙沙星、呋喃妥因等,均可触发金黄色葡萄球菌中的SOS 反应,具体表现在活化了RexAB,以对DNA双链断裂进行处理[72]。
一般来说,ROS的产生和SOS响应都与抗生素胁迫引起的细胞损伤有关联。ROS的产生是抗生素与其经典靶点相互作用的结果。低浓度的ROS 诱导对微生物耐药性的提高可能起到促进作用,而高浓度ROS 则不利于微生物耐药性的提高。ROS 引起的SOS 响应则可以修复DNA,以达到修复细胞并应对抗生素胁迫的目的。
3.2 应对抗生素胁迫的长期响应机制
3.2.1 抗性基因富集及转移
抗生素的存在对菌藻共生系统中抗性基因的富集和转移有一定的影响。微生物通过三种机制产生对特定抗生素的抗性[73]:①转座因子(MGEs)上的水平转移;②染色体上的基因突变;③微生物群落的进化等。菌藻共生系统中抗生素抗性基因水平转移机制如图3所示。首先,整合酶将游离基因盒插入整合子中;然后整合子转移至转座子中;最后通过转座酶和解离酶将转座子插入质粒中,完成抗性基因在细胞内的水平转移,最终实现在微生物群落中的扩散。
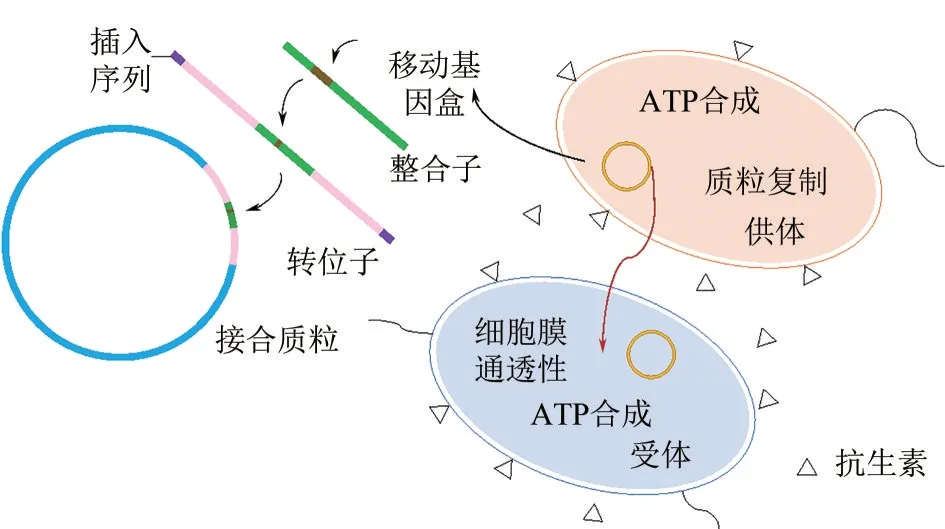
图3 菌藻共生系统中抗生素抗性基因水平转移机制示意图
Yang等[74]通过宏基因组测序得到了污水处理厂活性污泥中的抗性基因,并观察到三种抗生素耐药基因(ARGs)的季节性波动。有研究发现,废水处理过程中ARGs 的丰度有所增加[75]。Yuan 等[76]在南极土壤中也发现了大量抗生素耐药基因(ARGs),其中某些ARG 亚型(例如bacA,ceoB,dfrE,mdtB,amrB和acrB)在南极土壤中比其他亚型更丰富。污水处理厂中观察到随着磺胺甲唑(SMX)的降解,群落中磺胺基因(sulI)的绝对丰度有所上升[77]。已有磺胺甲唑抗性基因的转移机制表明[78],在intI上携带sulI,但是在质粒中也检测到了sulII,这可能导致在水生环境中sulI的泛滥。Wang 等[16]通过定量逆转录PCR 分析表明,头孢氨苄(CFX)的添加使amoA基因的表达水平显著上调(高达3 倍,p<0.05),而一旦CFX 减少,氨氧化细菌(AOB)降至正常水平,这表明AOB 通过更有效地代谢氨来中和CFX 的毒性。在萘普生(NPX)和磺胺甲唑(SMX)的刺激下,微生物电化学反应器中总ARGs 丰度、ARGs 多样性菌有所上升[79]。
但在厌氧消化池中,通过三氯卡班(TCC)、三氯生(TCS)的刺激,仍然未观察到intI1相对丰度的变化[80−81]。在菌藻系统中,微藻和细菌之间的共生相互作用不仅在头孢氨苄(CFX)和红霉素(ERY)的动力学去除中起作用,而且培养一段时间后ARGs 的丰度下降,其中ermB的减少高于blaTEM
[10]。短期实验中,菌藻系统去除SMX 的过程中没有观察到sulI相对丰度的变化,但绝对丰度有所增加[9]。
大部分研究表明,在抗生素去除过程中ARGs的丰富均有所增加,同时在转座子上也发现了转移的抗性基因,但不同的抗生素作用下对抗性基因的丰度差异影响较大,且菌藻系统对抗性基因丰度的增加有一定的抑制作用。
3.2.2 微生物群落演替及进化
作为外源性刺激,抗生素会对菌藻共生系统产生选择压力,从而促进微生物群落演替和进化,即改变微生物群落的结构和功能[73]。
在菌藻共生系统中,陶厄氏菌属(Thauera phenylacetia)是在菌藻中发现的最丰富的细菌种类[82],菌毛单胞菌(Fimbriimonas ginsengisoli)是第二丰富的细菌,可以利用各种碳源[83]。因此,它们可能是微藻将有机物转化为CO2的原因。番荔枝属(Pantanalinema rosaneae)是含量最丰富的微藻物种[84],主要负责吸收二氧化碳和养分,同时通过光合反应产生氧气。此外,在菌藻共生体的内层检测到真核微藻(如绿藻),其有助于加强颗粒结构和沉降性[85−86]。在除磷方面,番荔枝属(Pantanalinema rosaneae)是主要贡献者,其次是绿藻[87]。
而抗生素的胁迫可以改变群落内细菌、微藻的分布和种类,且菌藻共生体可以对抗生素做出防御反应。一方面,有些物种,如属于β−变形细菌类的陶厄氏菌属(Thaurea),仅在暴露于磺胺异唑(SFX)之前才能检测到,它代表了污水处理系统中的典型反硝化细菌[88]。另一方面,β−变形菌(Betaproteobacteria)和γ−变形菌(Gammaproteobacteria)据报道是对抗生素具有抗性的优势菌种[41,89]。丙型变形菌 纲(Gammaproteobacteria) 的 丝 硫 细 菌 属(Thiothrixspp.)能够降解含硫化合物[90],并且随着SMX 浓度增加它们的丰度增加。在门水平上,菌藻系统中的变形菌门(Proteobacteria)含量(质量分数77%)显著高于活性污泥系统中(48%)[46]。
在菌藻系统中,在四环素浓度为10mg/L 时,绿藻和变形菌的相对丰度仍然保持稳定,但蓝藻的丰度显著下降[91]。此外,四环素的存在促进了胞外聚合物(EPS)的分泌,可作为减轻四环素毒性作用的保护屏障,同时促进了松散相互连接的团聚体的形成,进一步减少了与四环素的比接触面积。
细菌和微藻在共存期间可以交换各种营养元素以及分泌信号物质,以达到更好的协同作用。微藻会通过某种机制来响应细菌群体感应QS信号分子。细菌能够产生酰基均质内酯(AHL),这是一种能促进藻类形成细胞膜的化学信号,从而影响微藻的新陈代谢[92−93]。紫球藻属(Porphyridium cruentumUTEX 161 菌株) 和假交替单胞菌属(Pseudoalteromonassp.MEBiC 03485 菌株)的共生对P. cruentum的EPS分泌有正向影响[94]。有研究发现[95],微藻生物量浓度与Pusillimonas属细菌有密切联系。同时,藻类产生的信号物质也会对细菌的生长产生影响。小球藻(Chlorella saccharophilaCCAP211/48)和小球藻(Chlorella vulgarisCCAP211/12)能够抑制假单胞菌中AHL 信号分子的活性[96]。总之,在菌藻共生系统中,细菌和微藻之间的信号调节仍然有待进一步深入探究。
细菌−微藻共生体的研究表明,菌藻共生体在污水处理过程中,尤其在污水中抗生素的去除方面拥有广阔的应用前景。尽管已有大量关于菌藻共生体对抗生素去除的研究,但大多仍处于实验室阶段,而达到工业化应用的案例还不多,且菌藻共生系统应对抗生素胁迫的具体机制目前尚未彻底探明。因此,深刻分析菌藻共生系统应对抗生素的内在生理生态学机制,将有助于将菌藻共生系统应用于实际废水污染物的去除以及微藻生物质资源的回收利用。
4 结语
(1)生物降解、生物吸附和生物累积是菌藻系统中最为常见的去除抗生素的途径,此外还存在光降解和挥发等其他途径。
(2)利用生物反应器降解抗生素的类型主要有悬浮生长系统和固定化生长系统。悬浮系统处理效果好但不够稳定,固定化生长系统较为稳定但需要优化载体和生物的固定等。由于藻类的固碳特性以及菌藻系统的高效去除优势,菌藻光生物反应器在去除抗生素方面具有一定的优势。
(3)在抗生素胁迫下,细菌和微藻会产生短期和长期的响应以产生耐药性,ROS的产生和SOS响应都与短期抗生素胁迫引起的细胞损伤有关。抗生素抗性基因富集转移和微生物群落演替进化是菌藻共生系统应对抗生素胁迫的长期响应。
