合成气的生物利用与定向转化
2023-03-01李婉麒杨凤娟贾德臣姜卫红顾阳
李婉麒,杨凤娟,贾德臣,姜卫红,顾阳
(1 中国科学院分子植物科学卓越创新中心,中国科学院合成生物学重点实验室,上海 200032;2 中国科学院大学,北京 100039;3 上海师范大学生命科学学院,上海 200234)
合成气是一类以一氧化碳、二氧化碳和氢气为主要组分、可用于化工生产的原料气。其来源广泛,可由含碳矿物质如煤、石油、天然气、污泥和生物质等制备而来,且根据来源、组成和用途的不同,又被称为煤气、合成氨原料气、甲醇合成气等。此外,钢铁、煤化工企业排放的废气也是合成气的来源之一。在化工生产领域,以合成气为原料合成氨、含氧化合物和烃类等技术已投入商业运行。基于化学催化路线的合成气转化利用虽然效率高,但对于不同的目标产品而言所需的合成气成分并不一样,因此需要调整气体组成。合成气化学转化涉及的反应均在高温高压下完成,条件苛刻,产物种类也比较有限。
近年来,合成气的生物转化技术引起了极大关注。自然界中存在可利用合成气中一氧化碳和二氧化碳的化能自养型细菌,主要为梭菌属、醋酸杆菌属和穆尔氏菌属[1−3]。这类微生物在吸收、利用合成气的同时能够生成少量有机酸(如乙酸和丁酸)和有机醇(如乙醇、丁醇、己醇),因而具有潜在的工业应用价值(图1)。与化学催化过程相比,化能自养微生物介导的合成气催化、转化路径具有独特的优势,主要包括:①微生物可利用各种类型的合成气,且能够适应合成气中各组分比例的较大变化;②较低的能耗和运行成本;③可合成化学催化难以获得的中、长碳链化合物,且产物合成的选择性较好。

图1 合成气发酵示意图
2017 年,美国朗泽公司和首钢集团有限公司合作建设了4.6万吨/年规模的钢厂尾气制乙醇生产线,并正式运行。2021 年,朗泽公司又在宁夏平罗建立了4.5 万吨/年规模的钢厂尾气制乙醇生产线。上述气体转化工艺所采用发酵菌株均为食气梭菌,表明基于梭菌的工业含碳尾气转化制造化学品的技术路线具有工业应用的可行性,但目前的商业化产品只局限于乙醇。显然,将合成气通过生物转化生产价值更高的中、长碳链燃料以及大宗化学品,对于拓展合成气转化途径、实现合成气高值化利用具有重要意义。需要指出的是,生物催化路线也存在不足,主要体现在较低的气体吸收、转化效率和产物合成速率,从而阻碍了这类技术的广泛应用,亟需改进和优化。
近年来,随着我国“碳达峰、碳中和”目标的提出,基于生物路线的合成气利用技术及相关研究愈发凸显其重要性。同时,得益于以CRISPR(clustered regularly interspaced short palindromic repeats,成簇规律间隔的短回文重复序列)−Cas基因组编辑工具为代表的高效分子遗传操作技术的开发,化能自养细菌这类难操作微生物的分子改造及合成生物学研究也取得了较大的进展。基于此,本文对这一领域的研究现状和存在的问题进行梳理和总结,并展望未来的发展前景和方向。
1 合成气的来源与制备
煤气化和天然气转化是目前化工路线生产合成气的两种主要方法[4]。煤气化是指以煤或煤焦为原料,以氧气(空气、富氧或工业纯氧)、水蒸气作为气化剂,在高温条件下通过化学反应将煤或煤焦中的可燃部分转化为可燃性气体,所获得的合成气又被称之为煤气。这也是20 世纪50 年代以前主流的合成气制备技术。此外,天然气中的主要成分——甲烷,在高温条件下与氧气、水蒸气或二氧化碳进行重整反应也可制得合成气,主要的制备路径包括甲烷水蒸气重整制合成气、甲烷−二氧化碳重整制合成气以及甲烷部分氧化制合成气等[5]。其中,甲烷水蒸气重整和甲烷−二氧化碳重整制合成气均是强吸热过程,在高温条件下进行,因此整个工艺过程能耗高。而甲烷部分氧化法制合成气则是一个温和放热反应过程,可在相对较低的温度(750~800℃)进行,因此该法具有能耗低、反应速率快、生产强度大等优点。与水蒸气重整法相比,甲烷部分氧化制合成气的反应器体积小、效率高、能耗低,可显著降低设备投资和生产成本。不同原料来源的合成气组成见表1。
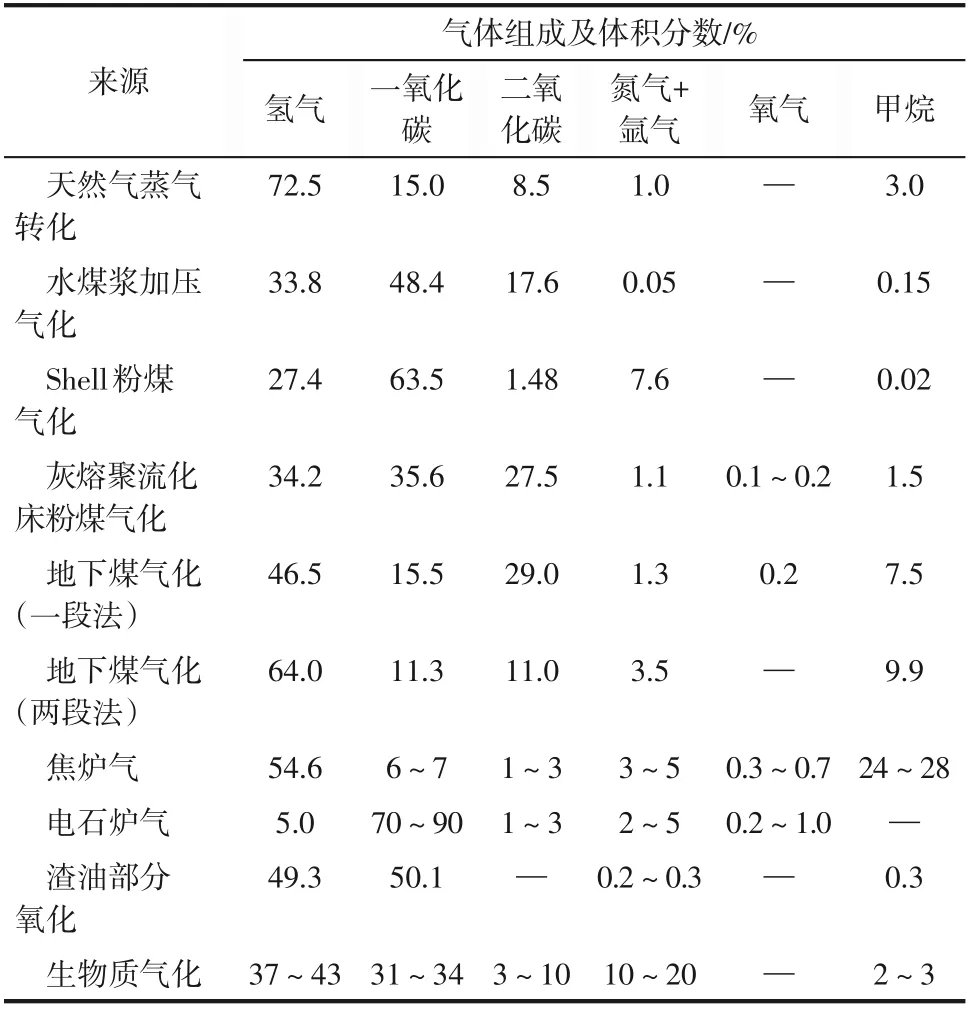
表1 不同原料来源的合成气组成[5]
生物质气化也是制备合成气的一个重要途径。目前,生物燃料如乙醇的发酵生产仍主要依赖糖类和淀粉质原料,较高的原料价格影响了这一技术路线的经济性。各种农林废弃生物质(例如玉米秸秆、小麦和大麦秸秆)、农业加工副产品(例如玉米纤维、甘蔗渣、种子饼等)以及能源作物(例如柳枝稷、杨树、香蕉草、芒草等)等价格低廉,储量丰富,亟待得到有效利用。热化学途径可以将这些木质纤维素类原料热裂解成以一氧化碳(CO)、氢气(H2)和二氧化碳(CO2)为主并含有少量甲烷(CH4)的合成气(表2)[6],从而被进一步转化和利用。

表2 来自各种木质纤维素生物质来源的合成气组成[7]
2 合成气的生物利用及定向转化
2.1 可利用合成气的微生物及其代谢特点
目前已知的合成气发酵微生物主要是产乙酸菌(Acetogens)。产乙酸菌是厌氧菌,可通过Wood−Ljungdahl(WL)途径同化CO和CO2(图2),该途径也被称为还原性乙酰辅酶A 途径[8]。这些产乙酸菌普遍存在于土壤、海洋沉积物和粪便等环境中,表现出各种形态(如杆状、球菌或螺旋体),且具有比较宽泛的最佳生长温度(嗜冷、嗜温或嗜热)[9]。绝大多数产乙酸菌属于厚壁菌门,且分布于二十多种细菌属[10],其中比较有代表性的是醋杆菌属(Acetobacterium)和梭菌属(Clostridium)(表3)。

图2 产乙酸菌Wood−Ljungdahl途径
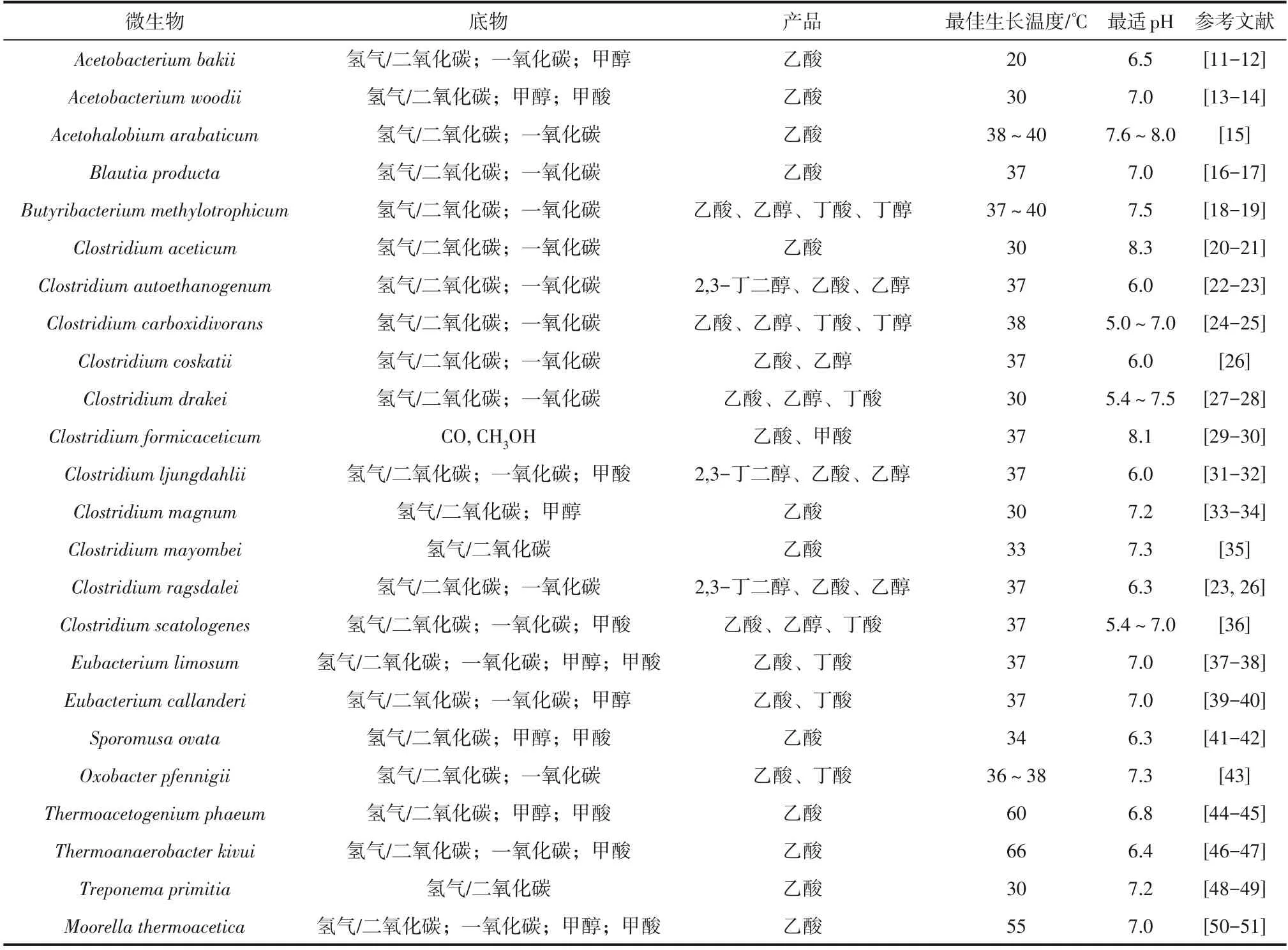
表3 不同产乙酸菌的特征
产乙酸菌利用Wood−Ljungdahl 途径同化CO 和CO2生产乙酰辅酶A,并进一步合成有机醇(乙醇、丁醇、己醇等)以及有机酸(乙酸、乳酸、丁酸、己酸等)(图2)。而在以糖为碳源的异养生长过程中,产乙酸菌的糖酵解途径产生的CO2可被Wood−Ljungdahl 途径重新吸收利用,从而避免了过多的碳流失,这也是相对于异养微生物的一大优势。但产乙酸菌的固碳是一个能量净消耗过程,其通过建立跨膜离子梯度驱动ATP合成以维持基本能量需求[9]。研究者在热乙酸穆尔氏菌(Moorella thermoacetica)、热自养穆尔氏菌(Moorella thermoautotrophica)、甲酸梭菌(Clostridiumformicoaceticum)和醋酸梭菌(Clostridium aceticum)中检测到甲基萘醌或细胞色素[52−54],因此推测它们可能利用这些电子载体辅助铁氧还蛋白、黄素氧还蛋白、黄素蛋白和红素氧还蛋白等完成各种氧化还原反应。而木醋杆菌(Acetobacterium woodii)不含有细胞色素和醌,因此其可能主要通过钠动力铁氧还蛋白−NAD氧化还原酶(Rnf)在细胞膜上产生钠离子电位,并进一步通过膜整合型Na+F1F0ATP 合酶驱动ATP的合成。与A. woodii一样,食气永达尔梭菌C. ljungdahlii也不含细胞色素,而是主要依赖Rnf产生跨膜离子梯度驱动ATP 合成;但不同的是,C. ljungdahlii中的Rnf 复合物依赖于质子而不是钠离子生成ATP[10]。
合成气中的CO2分子具有高度的热力学稳定性,其还原和转化需要较多的能量输入。然而,天然固碳微生物中负责能量传递的电子通道效率较低以及固碳生物元件活性普遍不高,从而限制了微生物对合成气中所有组分的高效利用和转化。
大多数产乙酸菌如A. woodii、C. aceticum和M. thermoacetica合成乙酸作为其主要产物[55−57]。这类产乙酸菌可以通过Wood−Ljungdahl 途径使用一分子ATP 将一碳气体固定为乙酰辅酶 A,然后通过乙酸激酶(ACK)将其转化为乙酸,从而获得一分子ATP。而有些产乙酸菌,如C. ljungdahlii、C. autoethanogenum和C. ragsdalei除了合成乙酸外,还可合成以乙醇为主的醇类产物。乙醇合成可以通过两种代谢途径完成;第一条途径由乙酰辅酶A经乙醛/乙醇脱氢酶两步催化完成;第二条途径则依靠醛铁氧还蛋白氧化还原酶(AOR)催化乙酸生成乙醇。
丁酸也是产乙酸菌的产物之一, 在C. carboxidivorans、C. drakei、C. magnum、C. scatologenes、C. methoxybenzovorans的气体发酵产物中均可检测到丁酸的存在[58]。在丁酸合成过程中,电子转运黄素蛋白(EtfA和EtfB)对丁酰辅酶A脱氢酶(Bcd)的活力起着至关重要的作用[59]。C. ljungdahlii、C. autoethanogenum和C. ragsdalei还能够产生2,3−丁二醇。2,3−丁二醇的合成过程需要三种酶:丙酮酸:乙酰乳酸合酶、乙酰乳酸脱羧酶和2,3−丁二醇脱氢酶。丙酮酸首先脱羧形成乙酰乳酸,进一步脱羧产生乙偶姻,乙偶姻最终被还原生成2,3−丁二醇[23]。上述三种菌株还可以从丙酮酸通过乳酸脱氢酶产生乳酸。此外,B. methylotrophicum、E. limosum和B. producta也能够利用一碳气体产生乳酸[60−62]。
总体而言,上述自养细菌合成的产物中乙酸占据了主导地位,主要原因是其合成路径短(由乙酰辅酶A 经两部催化),效率高,且在合成过程中生成ATP,这对于能量净消耗的固碳代谢过程至关重要。而对于其他产物,由于反应路径较长且需消耗较多能量,因此其合成水平受到较大限制。
2.2 食气梭菌的生理生化特征
食气梭菌是目前最主要的合成气发酵微生物,属于革兰氏阳性、厌氧梭状芽胞杆菌。已报道的食气梭菌主要包括永达尔梭菌(C. ljungdahlii)、自产乙醇梭菌(C. autoethanogenum)、食一氧化碳梭菌(C. carboxidivorans)等。
C. ljungdahlii最初是从养鸡场废弃物中分离出来的,后续的研究揭示其可利用 H2和 CO2、CO、甲酸盐、乙醇、丙酮酸、延胡索酸以及糖(包括果糖和木糖)等碳源支持其生长[31]。随后,有研究者从兔子粪便中也分离出一种与C. ljungdahlii高度相似的细菌[22],并命名为C. autoethanogenum。最新的基因组测序结果表明,这两种食气梭菌的基因组序列相似度达到99.3%,具有极高的亲缘关系。C. ljungdahlii和C. autoethanogenum的 产 物 种 类相同,都产生大量的乙酸和乙醇以及少量的2,3−丁二醇和乳酸。值得一提的是,研究者发现C. ljungdahlii除了可以利用合成气生产乙醇外,在发酵后期还会启动乙醇的回用,对这一乙醇合成与消耗的动态变化机制的理解有助于构建乙醇高产菌株[63]。此外,食气梭菌在发酵不同成分组成的气体时其合成的产物类型也存在较大差异。例如,C. ljungdahlii在发酵CO 时主要产生乙醇,而在利用CO2/H2时主要合成乙酸,这可能与两种气体条件下细胞内能量供应的差异有关[64]。
由于以C. ljungdahlii和C. autoethanogenum为代表的食气梭菌可将一碳气体转化为醇类化合物,因而相关技术和工艺具有良好的应用前景。目前,基于食气梭菌的钢厂尾气制乙醇技术已经在国内实现工业化生产,充分表明这一生物技术路线产业化的可行性。然而,食气梭菌的主要天然产物是乙酸和乙醇,能合成的高值长碳链化学品极为有限且产量较低,这也是亟待解决的问题。
2.3 食气梭菌分子遗传操作工具
电穿孔和电转化是将外源DNA 引入食气梭菌最常用的方法,这些策略已在C. ljungdahlii、C. autoethanogenum、C. acetum、A. woodii等菌中得到应用[65]。此外,第三代测序技术如单分子实时测序 (Single molecule real−time sequencing)的出现,为鉴定细菌的限制性修饰位点提供了可靠的帮助。2014 年,研究者使用该技术成功鉴定了C. autoethanogenum基因组中的甲基化修饰位点,并将相关的甲基化酶在大肠杆菌中表达用于穿梭质粒的甲基化修饰,从而提高了这些质粒对于该菌的电转化效率[66]。
基于上述的外源DNA 转化方法,研究者逐步建立了适用于食气梭菌的基因失活技术。2007年,Heap 等[67]开发了一种基于乳酸乳球菌二类内含子的ClosTron基因敲除技术,并首先用于构建丙酮丁醇梭菌和艰难梭菌的突变体。后期,这一方法在C. autoethanogenum和C. ljungdahlii等中也得到了成功应用[68−69],为这类自养细菌的分子操作提供了新的路径。需要指出的是,尽管也有单纯依靠同源重组实现C. ljungdahlii中基因缺失的研究报道[70],但效率较低,需要进行改良和优化。此外,Cre−lox系统也已被应用于食气梭菌中实现了基因在染色体上的整合。2014年,Ueki等[71]将异源丁酸合成途径整合到永达尔梭菌C. ljungdahlii的染色体上,实现了工程菌发酵气体合成丁酸。
CRISPR−Cas 系统已被广泛应用于微生物的基因组编辑。2016 年,国内的研究者首次在C. ljungdahlii中建立了基于CRISPR/cas9 的基因组编辑技术,实现4个基因的缺失[72]。除了最常用的Cas9 蛋白外,Cas12a(原名Cpf1)也被应用C. ljungdahlii中,可以更好地满足梭菌低GC 含量的特点。2019年,Zhao 等[73]在C. ljungdahlii中建立了基于CRISPR−Cas12a 的基因组编辑方法,实现了有效的基因删除和转录干扰(CRISPRi)。此外,Huang 等[74]将噬菌体来源的Att/Int 元件引入了C. ljungdahlii,并结合CRISPR−Cas9 系统,实现了将9.1kb 大小的丁酸合成途径整合至该菌染色体上,并实现工程菌发酵气体合成丁酸。
研究者在开发食气梭菌适用的诱导型启动子方面也取得了进展。Areen Banerjee 等[75]将来自产气荚膜梭菌的乳糖诱导系统(bgaR-PbgaL) 引入C. ljungdahlii,用于调控胞内代谢流优化丙酮等产物的合成。此外,四环素诱导的启动子被用于C. ljungdahlii和C. autoethanogenum中 以 实 现CRISPRi 系统的诱导表达[76]。
除了上述理性改造技术外,基于转座子的染色体上DNA随机整合方法也被用于食气梭菌的改造。近年来,研究者针对食气梭菌开发了多种基于Himar1 转座酶的转座子随机突变系统,并借助这一系统,成功实现了基因的失活和大片段DNA 在基因组的插入和整合[77]。例如,Philipps 等[78]在C. ljungdahlii中建立了一种有效的基因转移和基因组整合系统。该系统通过诱导Himar1 转座酶的表达将大片段DNA(>5kb)整合到染色体上。除整合大片段基因的功能外,转座子也可用于功能基因组学研究,如利用转座子插入测序技术(TIS)快速高效地筛选重要表型相关的功能基因[79]。这一技术已被用于发掘和鉴定C. autoethanogenum中与一氧化碳代谢相关的必需基因[80]。
2.4 食气梭菌代谢工程改造
对于食气菌而言,其遗传改造的目的主要涵盖两个方面:增强固碳效率和提高产物定向合成能力。例如,为增强A. woodii的固碳效率,研究者在该菌中过量表达了Wood−Ljungdahl 途径的关键基因,从而显著提高了工程菌在自养生长条件下的乙酸产量[81]。此外,鉴于一氧化碳脱氢酶/乙酰辅酶A合酶(CODH/ACS)复合体在食气梭菌转化CO 或CO2为乙酰辅酶A 的过程中起着重要作用,研究者在C. autoethanogenum中过表达CODH/ACS 编码基因(CAETHG_1620−1621)时,可有效加速菌株在气体发酵中的生长速度,提高乙醇和乳酸产量[77]。研究者还在C. ljungdahlii中引入了丙酮丁醇梭菌来源的丙酮合成途径,并采用混合碳源 (糖/一碳气体)发酵策略,使得糖酵解途径产生的CO2被重新利用,减少了糖酵解途径的碳流失,并通过高密度连续发酵实现丙酮的高产[82]。
此外,合适的启动子元件对于食气梭菌的基因表达优化也极为重要。2017 年,研究者构建了C. ljungdahlii的启动子文库,将原始启动子Pthl的−35区、−10区以及两者之间的间隔序列进行随机突变,得到一系列不同强度的启动子,并利用catP−lacZ双报告系统来表征启动子强度,从而筛选到了比原始启动子活性高出一个数量级的人工启动子。这些人工启动子被用于在C. ljungdahlii中表达驱动热休克蛋白基因dnaK,显著提高了主要产物乙酸和乙醇的产量[83]。
就新产物合成而言,研究者近年来已经实现了食气梭菌合成丁醇、2,3−丁二醇、丙酮、异丙醇、3−羟基丁酸、3−羟基丙二酸、甲羟戊酸等[65,84](图3)。例如,研究者将来源于丙酮丁醇梭菌(C. acetobutylicum) 的丁醇合成基因簇导入C. ljungdahlii和C. autoethanogenum中表达,并强化表达相关的电子转运蛋白编码基因etfAB,实现了这两株食气梭菌中的丁醇合成,产量分别为0.36g/L和1.54g/L[85−86];而研究者将C. acetobutylicum的丙酮合成基因簇在C. aceticum、C. ljungdahlii和C. autoethanogenum中进行表达,也实现了这三种梭菌发酵一碳气体合成丙酮,产量分别为9mg/L、0.76g/L 和5.8g/L[56,75,87]。此外,研究人员在C. ljungdahlii中以来源于C. acetobutylicum的丁酸合成基因簇替代其自身乙酸合成途径中的磷酸乙酰基转移酶基因pta,实现了丁酸的合成,产量达到1.32g/L[88]。除了这些有机酸/醇以外,C. autoethanogenum作为底盘细胞被改造用于表达聚3−羟基丁酸(PHB)合成途径的三个关键基因,即phaA、phaB 和phaC,并在优化的培养条件下进行气体发酵,实现了PHB的生产[89]。

图3 食气梭菌合成产物的代谢途径
抑制或敲除旁路途径也是提高代谢途径中目标产物产量的方法之一。研究者利用同源重组和二类内含子介导的基因失活方法抑制了C. autoethanogenum丁二醇合成途径中乙酰乳酸脱羧酶基因(budA)的表达,提高了乙醇产量[86]。另一项研究表明,在C. autoethanogenum中抑制乳酸脱氢酶基因(ldhA)同样使乙醇产量得到了提高[86]。此外,产物毒性也会制约菌株的合成能力。为减弱高浓度乙醇对于菌株的抑制作用,研究者们在C. autoethanogenum中过表达了两个与蛋白折叠相关的辅因子GroES 和GroEL,有效提高了菌株对乙醇的耐受能力[86]。
值得一提的是,在最近的一项研究中,新西兰朗泽公司联合多家研究团队开发了一种针对食气梭菌的产物合成途径体外测试方法(iPROBE)。基于该方法,研究者先后实现了3−羟基丁酸、丙酮、丁醇、己醇等产物途径关键酶的体外测试和优化,并将最优途径转化到梭菌宿主中表达,成功实现了上述产物的高效合成[87−88,90],产量分别达到15g/L、5.8g/L、1.6g/L 和0.26g/L;其中,3−羟基丁酸的合成水平是已报道的合成气发酵研究中最高的。
总体而言,目前的合成气发酵生产长碳链化合物的水平距离工业化应用还有一定距离,在产量和和合成效率方面仍有待提升。
2.5 其他合成气发酵微生物及改造优化
如上所述,A. woodii也是主要的产乙酸菌,可以利用CO 和CO2作为碳源合成较高浓度的乙酸[13]。为了对该菌进行有效的遗传改造,研究者借鉴了梭状芽孢杆菌的同框缺失方法[91],使用pyrE基因依次作为正筛选和负筛选标记来指示重组事件。基于该方法,A. woodii中涉及糖转运和乙醇利用的基因被成功敲除[92]。
研究者也利用A. woodii合成了一些新产物。2016 年,Sabrina 等[93]将丙酮丁醇梭菌的丙酮合成途径导入A. woodii中实现气体发酵生产丙酮,在连续气体发酵条件下的丙酮浓度最高达到52mmol/L。此外,也有研究者[94]在A. woodii中通过组合使用来自丙酮丁醇梭菌(Clostridium acetobutylicum)和醋酸梭菌(Clostridium aceticum)的基因构建了丙酮合成途径,重组菌株在生产乙酸和丙酮的同时还生成了异丙醇,暗示该菌中含有可将丙酮合成途径产生的丙酮催化为异丙醇的功能酶伯/二芳醇脱氢酶(sadh)。
合成气中CO 对自养细菌的毒性是限制发酵效率的一个重要因素。产乙酸菌的生长通常受到高浓度CO 的抑制。为了解决这个问题,Kang 等[95]应用实验室适应性进化策略来增强E.limosum对CO的适应能力。该菌在含有较高浓度CO 的合成气条件下被连续传代(150 代),最终能够有效利用含CO的合成气作为碳源支持其生长。同时,为了探究导致上述表型变化的基因突变,研究者通过基因组测序结合遗传学实验揭示了编码CODH/ACS复合物亚单位的基因的突变导致了菌株对CO 适应能力的增强。基于该突变菌株,研究者导入了合成乙偶姻所需的alsS和alsD基因,实现了比原始菌株更多的产物合成。
嗜热菌在降低发酵过程染菌风险、提高底物溶解度以及提高代谢率和蛋白质表达方面具有明显优势。为评估嗜热菌在一碳气体利用方面的潜力,研究者通过同源重组将编码α−淀粉酶的基因整合到超嗜热羧基营养型氢古细菌Thermococcus onnurineus的染色体上,实现其利用CO 发酵合成α−淀粉酶[96]。该工程菌株还可作为全细胞生物催化剂用于淀粉糖化[96]。此外,研究者在另一种嗜热产乙酸菌Thermoanaerobacter kivui中发现了具有依赖氢气作为还原力的CO2还原酶(HDCRs),可以催化CO2生成甲酸,并且甲酸盐的滴度最高可达130mmol/L[97]。
3 合成气发酵系统的优化
为了利用已有设备实现最长的生产时间从而节省单位产品的固定资产投资、设备维护成本等,工业规模的气体发酵必然要采用连续发酵模式。连续搅拌釜式反应器(continuous stirred−tank reactor,CSTR)是目前实验室使用较多的气体反应器,可通过机械搅拌将通入的气体变成微小气泡,从而增大气液接触面积,达到较好的气液传递效果。与连续搅拌釜式反应器相比,鼓泡塔反应器通过喷射方式将气体注入培养基,气体分散效果较好,无需机械搅拌,具有良好的传热和传质效率[98]。除上述反应器外,单片生物膜反应器(monolithic biofilm reactors)和滴床生物反应器也在合成气的发酵中得以应用[99]。其中,单片生物膜反应器在常压下运行,可让微生物依附在生物膜上生长,无需对气体进行搅拌,降低了发酵能耗。在滴床反应器中,液体培养基通过填充介质向下流动,而合成气可以向下(共流)或向上(逆流)移动,培养基和发酵气体可不需要机械搅拌自发混合,从而显著降低能耗[100]。
研究者还借鉴了化工中流化床和固定床的概念,采用填料在厌氧反应器中固定化Moorella thermoacetica进行气体发酵。数据表明,在采用海藻酸钙包埋法固定化细胞进行的半连续发酵中,乙酸浓度可达32.3g/L,乙酸平均空时产率达3.20g/(L·d)[101]。采用固定化细胞进行合成气发酵,不仅提高了菌体的重复利用率,而且简化了细胞和产物的分离工序[101]。
气液传质效率是一碳气体发酵的主要限速步骤之一。高效的气液传质效率是气体生物反应器设计的关键,给予更多的能量供体、加快气体流通速度或增加发酵罐内压力等均可以提升气液传质效率。目前,微气泡分散技术在合成气发酵中被广泛应用。微气泡又称胶体气泡,平均直径约为50μm,远小于传统生物反应器中的气泡直径(3~5mm),因此可显著提升气液传质效率[102]。此外,为了解决食气梭菌发酵中的低生物量问题,研究者在气体发酵装置中加入一些吸附菌体的填料和介质来提升细胞密度。例如,采用中空纤维膜富集细胞,可有效提高发酵气体时的丙酮产量[82]。
发酵优化如改良培养基以及过程控制对于气体发酵同样重要。虽然化能自养细菌以CO、CO2、H2为碳源和能源,但仍需要其他成分如维生素、微量元素、矿物质元素和还原剂等保持菌种的代谢活性[26,103−106]。例如,Kundiyana 等[107]在C. carboxidivoransP7 的培养基中使用棉花籽提取物替代酵母提取物等成分,使得合成气发酵的乙醇产量得到明显提高。其他的一些有效策略还包括:调整培养基中的微量金属离子浓度能够提高某些金属离子依赖的氧化还原酶的活力,可提升食气梭菌中乙醇的产量[108];优化发酵培养基中各矿质元素的浓度,同时采用低温培养的方式能提高食气梭菌的产物合成能力[26];在培养基中加入还原剂,如甲基紫精、Na2S 以及生物碳等也能显著提升菌株的气体发酵水平[109−111]。在培养基中添加少量甲醇可促进Eubacterium limosum对合成气的利用效率[112];调整合成气中的氢气和一氧化碳的配比会显著影响发酵产物中的有机酸/醇的比例[113]。此外,pH和温度等对食气梭菌的生长也有重要的影响。研究发现,在pH=6.8时,C. ljungdahlii的细胞密度和乙醇产量均高于pH=5.5 时的水平[114]。食气梭菌最适生长温度在30~40℃之间,培养温度不仅影响底物利用率、生长率和膜脂组成,而且影响气体碳源在培养中的溶解度。已经发现,适当降低培养温度虽然会造成食气梭菌生长速率的一定延迟[115−116],但最终的产物合成量相对于常规培养温度有显著提高。例如,研究者发现当培养温度从37℃降至30℃时,C. carboxidivoransP7发酵合成气的己醇产量显著升高[117],这一现象背后的分子机制尚待解析。
4 结语
绿色生物制造从根本上改变了传统制造业加工模式的弊端,是工业可持续发展最有希望的领域之一。富含CO2/CO 的合成气生物转化代表着绿色生物制造领域的前沿技术,引领了新一代的生物制造产业模式,对于提升我国生物制造产业创新发展能力意义重大。此外,从全生命周期分析的角度来看,利用各种来源的合成气(如工业废气和气化生物质)进行发酵是接近“零碳”甚至是“负碳”的技术路线,即整个生产过程的碳排放量极低甚至为负,这是与传统发酵产业的最大区别之一,有望在助力我国“双碳”目标的实现过程中发挥重要作用。
目前,合成气生物发酵技术的研究取得长足进展,工业应用已初具规模,但仍只局限于乙醇、乙酸等少数产品。因此,核心微生物底盘细胞和分子元件的开发与设计方面需要进一步突破,从而解决基于合成气的生物制造产业的瓶颈问题,拓展产品种类,抢占这一生物制造领域的制高点。此外,不同来源的合成气组成成分差异较大,通常含有一氧化碳、二氧化碳和氢气中的一种或多种,并且还存在一些杂质,比如烷烃、烯烃、焦油等。因此,在工艺和工程方面,需要针对不同的气源,选择适合的净化设备,并调整优化相应的工艺参数,以实现较高的气体转化率和目标产品的产率。在产品提取方面,也需要耦合微生物生长和代谢的参数,优化后处理方法,在过程中减少能耗,提高得率,兼顾效率和经济性。总体而言,今后需要针对合成气生物转化过程的共性关键技术设置任务模块,建立核心技术与装备体系,并进行基础研究−技术创新−产业示范的全链条设计,从而为工业低碳/零碳制造提供新的示范。
