空心类水滑石对重金属的吸附性能研究
2023-02-28崔国居李家亮
崔国居 ,李家亮
(1.中国石化胜利油田石油化工总厂,山东东营 257000;2.山东理工大学化学化工学院,山东淄博 255000)
水体重金属污染是全球性问题,一直受到世界各国的高度重视〔1-2〕。重金属污染物是一类具有致畸性、致癌性和诱变性的危险废物,可随水流迁移进入食物链并在生物体内积累,最终危及人体健康〔3-4〕。由于实际水体条件复杂多变,有毒重金属离子的净化仍然是一个严峻的挑战。因此,探索合适的方法去除实际水体中的重金属离子具有重要意义。层状双氢氧化物(LDHs)通常被称为类水滑石化合物或阴离子黏土〔5〕。LDHs的化学式一般为[M2+1-xM3+(xOH)2]x+(An-)x/n·mH2O,其 中M2+和M3+是二价和三价阳离子,An-是平衡电荷的层间阴离子〔6〕。LDHs因比表面积大、制备简单、环境友好等特性在吸附领域受到了广泛关注〔7〕,然而有限的吸附位点限制了其吸附能力。
为改善LDHs的吸附效果,本研究制备了具有更多吸附位点的空心类水滑石(LDHs-H)并用于吸附废水中的重金属离子Cu2+、Pb2+、Zn2+和Ni2+,探究了初始重金属离子浓度、吸附时间、溶液pH和竞争离子等因素对LDHs-H吸附废水中重金属离子的影响,并表征了吸附机理。
1 实验部分
1.1 LDHs-H的制备
将0.512 g Mg(NO3)2·6H2O和0.375 g Al(NO3)3·9H2O分别溶于40 mL去离子水中,然后将40 mL 0.12 kg/L的尿素溶液逐滴加入上述盐溶液;超声30 min后,将混合物转移到高压釜中,密封,于120 ℃反应10 h;待反应釜自然冷却至室温后,离心,用去离子水洗涤,80 ℃烘干,即得LDHs-H。另外,在相同条件下,在高压釜中120 ℃反应2 h制备LDHs作为对照组。
1.2 重金属吸附实验
通过批次实验比较LDHs和LDHs-H对重金属离子Cu2+、Pb2+、Zn2+和Ni2+的吸附能力。将40 mg吸附剂和50 mL不同浓度的重金属离子溶液混合于150 mL锥形瓶中,使用0.1 mol/L的HCl或NaOH调节pH;将锥形瓶放在25 ℃恒温摇床上以300 r/min的速度振荡一定时间后,离心(5 000 r/min,5 min),取上层溶液检测剩余重金属离子的浓度,并计算去除率。
此外,本研究还考察了废水中其他常见离子,如Mg2+、K+、Ca2+、Na+、Cl-、NO3-和PO43-,对重金属离子Cu2+、Pb2+、Zn2+和Ni2+去除效果的影响,实验过程与吸附实验过程相同,干扰离子投加量为300 mg/L。
1.3 表征方法
采用日本SU-8010型扫描电子显微镜(SEM)对材料的形貌进行表征;采用德国Bruker D8 Advance X射线衍射仪(XRD)在Cu Kα辐射下对材料的晶型及结构进行表征;采用Micromeritics ASAP 2020 BET系统对材料进行N2吸附-脱附等温线测定。
2 结果与讨论
2.1 LDHs-H的基本特征
图1(a)为LDHs和LDHs-H的XRD谱图。采用氮气吸附-脱附等温实验分别测定了LDHs和LDHs-H的孔径分布和比表面积,结果见图1(b)。利用扫描电镜分析了LDHs和LDHs-H的表面形貌,结果见图1(c)~(d)。
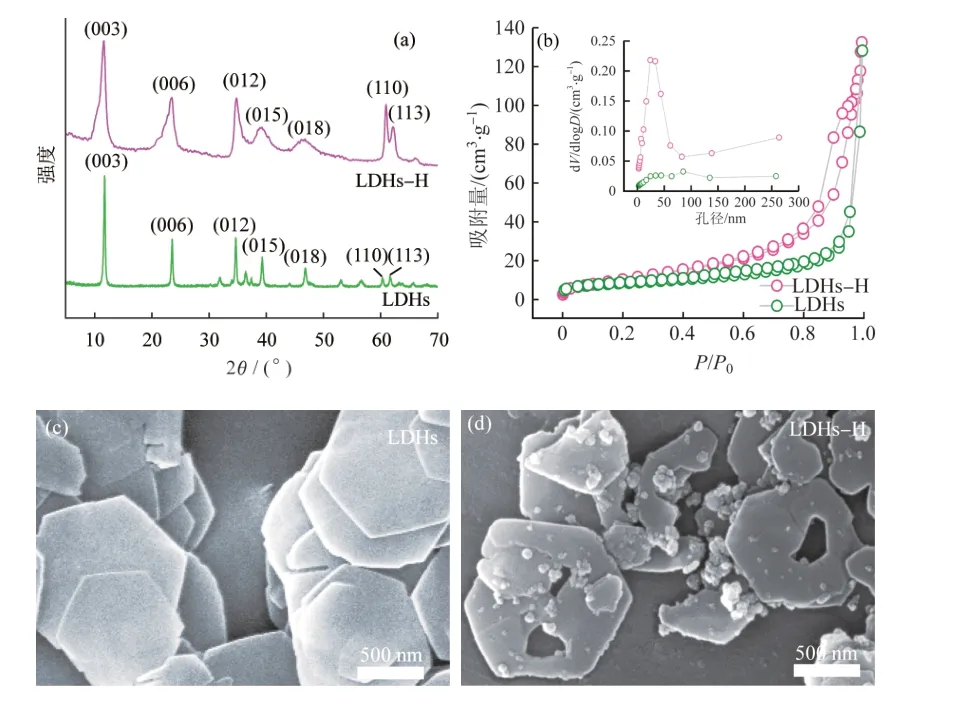
图1 LDHs和LDHs-H的XRD(a)、氮气吸附-脱附等温线(b)和SEM(c~d)Fig. 1 XRD(a),N2 adsorption-desorption isotherms(b) and SEM(c~d) of LDHs and LDHs-H
如图1(a)所 示,2θ=11.23°、23.26°、35.19°、39.12°、46.96°、61.23°和61.97°附近的衍射峰分别对应LDHs的(003)、(006)、(012)、(015)、(018)、(110)和(113)晶面,LDHs和LDHs-H样品均具有典型的LDHs衍射峰(JCPDS 89-0461),同时也证明了样品具有良好的晶体结构。
BET结果〔图1(b)〕表明,相比LDHs,LDHs-H具有更大的比表面积和良好的孔结构,LDHs-H的比表面积(43.31 m2/g)和孔体积(0.089 cm3/g)均大于LDHs的比表面积(23.33 m2/g)和孔体积(0.034 cm3/g)。
图1(c)中LDHs的形貌规则,呈六边形晶体形态,尺寸为800~1 000 nm,有典型的LDHs结构。图1(d)中,LDHs-H层的中心存在孔洞,但仍保留了LDHs的六边形纳米片结构,变为空心六方纳米片。这是因为随着反应时间的延长,体系中尿素分解产生了过量的OH-,LDHs体系中的Al(OH)3转化为AlO2-,导致LDHs结构中心被蚀刻,从而产生孔洞。
2.2 pH对LDHs-H吸附性能的影响
在对废水进行处理时,废水pH对整个吸附过程具有较大影响。因此,探究不同pH下吸附剂对重金属离子的吸附效果具有重要意义。在重金属离子质量浓度为300 mg/L、吸附剂投加量为0.8 g/L、吸附时间为12 h的条件下,分别调节溶液pH为1~13,考察pH对LDHs-H吸附Cu2+、Pb2+、Zn2+和Ni2+行为的影响,结果见图2。
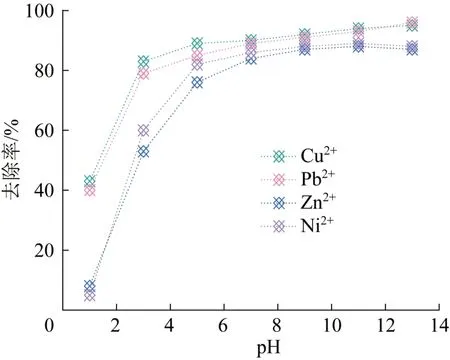
图2 pH对LDHs-H吸附Cu2+、Pb2+、Zn2+和Ni2+的影响Fig. 2 Effects of pH on adsorption of Cu2+,Pb2+,Zn2+ and Ni2+ by LDHs-H
从图2可以看到,在酸性较高的条件下,4种重金属离子的去除率均较低,这是由于在酸性条件下,LDHs层板上的羟基发生质子化带正电荷,对重金属离子的吸附产生较大影响。随着pH的增加,LDHs-H对Zn2+和Ni2+的去除率先增大后趋于稳定,在pH=9时达到最大,随后几乎保持不变;而LDHs-H对Cu2+和Pb2+的去除率则随着pH的增加一直上升,但上升趋势逐渐变缓。
2.3 吸附动力学
在重金属离子质量浓度为300 mg/L、吸附剂投加量为0.8 g/L、pH=7条件下,分别于反应10 min、20 min、30 min、1 h、2 h、3 h、5 h、7 h和9 h取样,考察吸附时间对LDHs-H和LDHs吸附Cu2+、Pb2+、Zn2+和Ni2+行为的影响,结果见图3。LDHs对4种重金属离子的去除具有相似的趋势,吸附速率均在反应前1 h较快,随后逐渐缓慢,最终在4 h左右达到平衡。
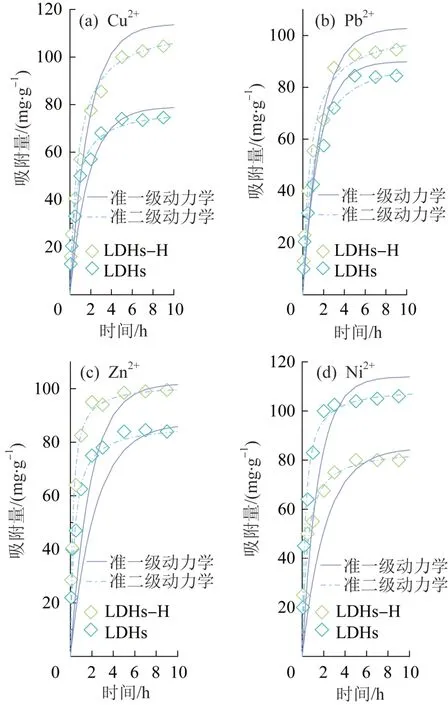
图3 吸附时间对LDHs-H和LDHs吸附Cu2+、Pb2+、Zn2+和Ni2+行为的影响Fig. 3 Effect of adsorption time on adsorption behavior of Cu2+,Pb2+,Zn2+ and Ni2+ by LDHs-H and LDHs
利用准一级和准二级动力学模型〔式(1)和式(2)〕描述整个吸附过程〔8-9〕。LDHs-H和LDHs对Cu2+、Pb2+、Zn2+和Ni2+的动力学拟合参数见表1。
式中:qt、qe——分别为t时刻和平衡时重金属离子的吸附量,mg/L;
k1——准一级反应动力学速率常数,h-1;
k2——准二级反应动力学速率常数,g/(mg·h)。
从表1可以看出,对于LDHs-H和LDHs这2种吸附剂,其吸附行为与准一级动力学模型的相关性(R2≤0.941)较差,而与准二级动力学模型的相关性(R2=0.995~0.999)较高,且准二级动力学模型中吸附剂对重金属离子的理论吸附量与实验得到的实际吸附量更相近,说明吸附过程受不同样品上有效活性位点数量控制,化学吸附占主导地位。

表1 LDHs-H和LDHs吸附Cu2+、Pb2+、Zn2+和Ni2+的动力学拟合参数Table 1 Kinetic fitting parameters of adsorption for Cu2+,Pb2+,Zn2+ and Ni2+ by LDHs-H and LDHs
2.4 等温吸附线
在吸附剂投加量为0.8 g/L、pH=7、吸附时间为12 h、温度为25 ℃的条件下,分别设定重金属离子的初始质量浓度为50~1 000 mg/L,考察了LDHs-H和LDHs对Cu2+、Pb2+、Zn2+和Ni2+的等温吸附行为,结果见图4。随着平衡质量浓度的不断增加,吸附剂对Cu2+和Pb2+的吸附量一直增加,而对Zn2+和Ni2+的吸附量则呈现先增加后基本保持不变的趋势,不同的吸附趋势表明吸附剂与重金属离子之间存在不同的相互作用。

图4 LDHs-H和LDHs对Cu2+、Pb2+、Zn2+和Ni2+的等温吸附线Fig. 4 The isothermal adsorption lines of LDHs-H and LDHs for Cu2+,Pb2+,Zn2+ and Ni2+
为进一步描述吸附过程,阐明吸附机理,采用Langmuir和Freundlich等温模型〔式(3)和式(4)〕〔10-11〕对实验数据进行拟合,结果见表2。

表2 LDHs-H和LDHs吸附Cu2+、Pb2+、Zn2+和Ni2+的等温吸附模型参数Table 2 Parameters of isothermal adsorption model for Cu2+,Pb2+,Zn2+ and Ni2+ adsorbed by LDHs-H and LDHs
式中:qe——吸附剂对重金属离子的平衡吸附量,mg/g;
ce——重金属离子吸附平衡时的质量浓度,mg/L;
KL——Langmuir模型亲和性参数,L/mg;
qm——Langmuir模型理论最大吸附容量,mg/g;
KF——Freundlich模型亲和性参数,(mg1-1/n·L1/n)/g;
n——Freundlich模型线性常数。
由表2可知,Cu2+和Pb2+在LDHs-H上的吸附更符 合Freundlich模 型(R2≥0.991),Cu2+和Pb2+在LDHs-H表面的非均相活性位点上发生多层吸附,LDHs-H与Cu2+和Pb2+之间存在一定相互作用。Langmuir模型能较好地描述Zn2+和Ni2+在LDHs-H上的吸附行为(R2≥0.992),表明LDHs-H对Zn2+和Ni2+的吸附更符合均相活性位点上的单层吸附,且LDHs-H对Zn2+和Ni2+的最大吸附量(qm)分别为130.48 mg/g和156.38 mg/g,与实验结果(132.56 mg/g和153.89 mg/g)接近。此外,LDHs对Cu2+、Pb2+、Zn2+和Ni2+等温吸附模型的拟合结果与LDHs-H相同。不同模型的拟合结果表明LDHs-H和LDHs对4种重金属离子存在不同的吸附机理。
2.5 LDHs-H对重金属离子的吸附机理
为讨论LDHs-H对Cu2+、Pb2+、Zn2+和Ni2+的吸附机理,对吸附重金属离子后的LDHs-H进行了一系列表征,XRD结果如图5所示。

图5 LDHs-H吸附Cu2+、Pb2+、Zn2+和Ni2+后的XRDFig. 5 XRD patterns after adsorption of Cu2+,Pb2+,Zn2+ and Ni2+ on LDHs-H
由图5可知,LDHs-H吸附Zn2+和Ni2+前后的XRD没有发生明显变化,说明反应后LDHs-H的结构保持不变且没有生成新物质。但与反应前相比,与Zn2+和Ni2+反应后,LDHs-H的(003)特征峰发生了左移,层间距由0.760 nm分别增加到0.812 nm和0.847 nm,表明LDHs-H与Zn2+和Ni2+之间存在一定的相互作用。与Cu2+和Pb2+反应后,LDHs特征峰消失的同时出现了一些新峰,说明在LDHs-H吸附Cu2+和Pb2+后LDHs的结构被破坏并生成了新的物相,且新生成的物相是Cu(OH)2和Pb(OH)2、Pb3(CO3)2(OH)2,说明LDHs-H对Cu2+和Pb2+的吸附过程是生成沉淀的过程。
图6为LDHs-H吸附Cu2+、Pb2+、Zn2+和Ni2+后的扫描电镜图。
由图6可知,LDHs-H吸附Zn2+和Ni2+后,形貌由原来的空心六方结构变为完整六方片状结构,且六方片相互交叉,没有生成其他结构;对应XRD可知,新生成的六方片状交叉结构为LDHs。由于与Mg2+(0.078 nm)具有相似的离子半径,Zn2+(0.074 nm)和Ni2+(0.069 nm)的去除主要是通过发生同晶替代以及被用于空心晶体生长为六方片状结构。LDHs-H与Cu2+和Pb2+反应后,原先的空心六方片状结构消失并生成了明显的沉淀;结合XRD可知,LDHs-H与Cu2+反应后,LDHs-H表面新生成了形状不规则的Cu(OH)2棒状结构,与Pb2+反应后则生成了明显的Pb(OH)2、Pb3(CO3)2(OH)2块状结构。

图6 LDHs-H吸附重金属离子后的SEMFig. 6 SEM of heavy metal ions adsorption by LDHs-H
因此,LDHs-H吸附Zn2+和Ni2+的机理为同晶替代及晶体生长,吸附Cu2+和Pb2+的机理为与LDHs层板上的羟基反应生成沉淀。该吸附机理更好地解释了在碱性条件下Cu2+和Pb2+去除效果较好的原因。
2.6 共存离子影响
水环境中往往存在多种离子,共存离子是影响重金属离子去除的重要因素之一,它们会与重金属离子竞争吸附剂的吸附位点,因此探究不同共存离子对LDHs-H去除4种重金属离子的影响显得尤为重要。在吸附剂投加量为0.8 g/L、重金属离子质量浓度为300 mg/L、pH=7、吸附时间为12 h的条件下,分别投加300 mg/L的Mg2+、K+、Ca2+、Na+、Cl-、NO3-和PO43-,考察干扰离子对LDHs-H和LDHs吸附Cu2+、Pb2+、Zn2+和Ni2+行为的影响,并以相同条件下不添加重金属离子的实验作为对照组,结果见图7。
如图7所示,干扰阳离子Mg2+、K+、Ca2+和Na+以及干扰阴离子NO3-、Cl-和PO43-对LDHs-H吸附4种重金属离子造成的影响均小于10%,表明当其他竞争离子与重金属离子共存时,LDHs-H对重金属离子仍具有较高的选择性。

图7 竞争离子对LDHs-H吸附Cu2+,Pb2+,Zn2+和 Ni2+的影响Fig. 7 Effects of coexisting cations on adsorption of Cu2+,Pb2+,Zn2+ and Ni2+ by LDHs-H
3 结论
本研究成功合成了具有更多吸附位点的六方空心类水滑石LDHs-H。对于LDHs-H,Cu2+和Pb2+的等温吸附线更符合Freundlich模型,Langmuir等温吸附模型则更好地描述了Zn2+和Ni2+的吸附过程;LDHs-H对4种重金属的吸附动力学数据更符合准二级动力学模型,且吸附能在较短的时间内达到平衡。LDHs-H吸附Zn2+和Ni2+的机理为同晶替代及晶体生长,吸附Cu2+和Pb2+的机理为与LDHs层板上的羟基反应生成沉淀。竞争离子实验表明LDHs-H对重金属离子的吸附具有优先选择性,且在pH为7~10的范围内LDHs-H对重金属离子都具有较高的去除效率。