PGM5-AS1抑制miR-4728-5p对宫颈癌细胞侵袭、转移的影响
2023-02-28余萍杨银杨发珍
余萍 杨银 杨发珍
(青海红十字医院妇科,青海 西宁 810000)
宫颈癌是全球最常见的妇科癌之一,2018年总共报告了570 000例宫颈癌新病例和311 000例死亡病例,成为癌症相关死亡的第四大主要原因〔1〕。在过去的几十年中,宫颈癌的预防和治疗取得了巨大的进步,特别是人乳头瘤病毒(HPV)疫苗的出现〔2〕。然而中晚期宫颈癌患者的5年生存率并没有显著提高〔3〕。因此,进一步探索宫颈癌发生和转移的分子生物学机制对于其早期预防和精准治疗具有重要意义。长非编码RNA(lncRNA)是一类长度超过200个核苷酸的内源非编码RNA。新兴证据表明,lncRNA可作为微小RNA(miRNA)海绵,参与各种重要的生理和病理调节,在人类癌症的发生发展过程发挥关键作用〔4,5〕。葡萄糖磷酸变位酶样蛋白5反义(PGM5-AS)1在食管鳞状细胞癌组织、血浆和细胞系中表达下调,其过表达显著抑制了体外食管鳞状细胞癌细胞的增殖、迁移、侵袭及体内肿瘤的生长,作用机制与调节miR-466/第10号染色体同源丢失性磷酸酶-张力蛋白基因(PTEN)轴有关〔6〕。但尚不清楚PGM5-AS1在宫颈癌组织中的表达和确切作用。本研究的生物信息学预测表明,PGM5-AS1与miR-4728-5p存在靶向结合位点。miR-4728-5p已被证明在乳腺癌组织中高表达,可作为癌基因调控乳腺癌细胞的增殖和迁移〔7〕。因此,本实验针对PGM5-AS1是否通过靶向miR-4728-5p,从而影响宫颈癌细胞的增殖和转移进行研究,以期为宫颈癌发病机制的深入探讨提供新的启示。
1 材料与方法
1.1组织、细胞与试剂 从青海红十字医院获得42对经病理学确认的宫颈癌样本及其相邻的无肿瘤宫颈组织(距离肿瘤部位>5 cm处的癌旁组织)。将这些样本在液氮中快速冷冻并保存,直至提取总RNA。获取所有患者的知情同意书,并通过医院临床伦理委员会批准。宫颈肿瘤细胞系SiHa获自美国典型培养物保藏中心ATCC。RPMI1640培养基获自美国Gibco公司,Lipofectamine 2000试剂、TRIzol试剂盒获自美国Invitrogen公司,pcDNA3.1-PGM5-AS1质粒和对照空载质粒pcDNA3.1、miR-4728-5p模拟物/抑制剂及各自阴性对照miR-NC、anti-miR-NC获自上海GenePharma公司,放射免疫沉淀(RIPA)缓冲液、二喹啉甲酸(BCA)蛋白检测试剂盒获自Beyotime生物技术研究所,鼠抗细胞增殖抗原Ki67抗体获自美国Santa Cruz公司,鼠抗E钙黏蛋白(E-cadherin)抗体、鼠抗N钙黏蛋白(N-cadherin)抗体获自美国Cell Signaling Technology公司,山羊抗鼠IgG二抗获自美国Abcam公司,双荧光素酶报告试剂盒获自美国Promega公司。
1.2细胞培养 将SiHa细胞在RPMI1640培养基中培养,并将1%青霉素/链霉素和10%胎牛血清添加到该培养基中。细胞生长于37℃,5% CO2/95%空气的培养箱。
1.3细胞分组与转染 将对数生长期的SiHa细胞分为pcDNA3.1组(转染pcDNA3.1),pcDNA3.1-PGM5-AS1组(转染pcDNA3.1-PGM5-AS1),anti-miR-4728-5p组(转染miR-4728-5p抑制剂anti-miR-4728-5p),anti-miR-NC组(转染anti-miR-NC)。细胞转染时,遵循Lipofectamine 2000试剂说明书的步骤进行。在6孔板中接种1×105个SiHa细胞,待其生长至60%汇合时,根据上述分组将pcDNA3.1-PGM5-AS1、pcDNA3.1、anti-miR-4728-5p、anti-miR-NC转染到细胞中,48 h后进行各项指标的检测。
1.4实时定量PCR(qRT-PCR)检测组织或细胞中PGM5-AS1、miR-4728-5p表达 根据制造商的说明,使用TRIzol试剂盒从组织或SiHa细胞中提取用于lncRNA或miRNA测定的总RNA。使用2 μg RNA合成互补DNA(cDNA)。按照制造商的说明,使用SYBR试剂盒与ABI PRISM 7500序列检查系统来进行qRT-PCR分析。甘油醛-3-磷酸脱氢酶(GAPDH)或U6分别用作PGM5-AS1和miR-4728-5p标准化的内源对照。PGM5-AS1、miR-4728-5p的相对表达水平由2-ΔΔCt定量。使用的引物:PGM5-AS1 5′-GCCCTACCAGGAGTGAATGA-3′(正义链)和5′-TTCCTGGTTTTGGAGTTTGG-3′(反义链)。miR-4728-5p 5′-GTGGGAGGGGAGAGGCA-3′(正义链)和5′-GTCAGCATGCTAGTCCCAGG-3′(反义链)。GAPDH 5′-ACCCAGAAGACTGTGGATGG-3′(正义链)和5′-TTCAGCTCAGGGATGACCTT-3′(反义链)。U6 5′-CTCGCTTCGGCAGCACA-3′(正义链)和5′-AACGCTTCACGAATTTGCGT-3′(反义链)。
1.5噻唑蓝(MTT)法检测SiHa细胞的增殖 将转染的SiHa细胞以1×104个细胞/孔的密度接种在96孔板中。培养48 h后,加入20 μl MTT溶液孵育4 h,之后加入二甲基亚砜,剧烈震荡10 min,于酶标仪测定细胞在490 nm处的吸光度OD值,计算细胞存活率(%)。
1.6平板克隆形成实验检测SiHa细胞的克隆形成 将转染的SiHa细胞以500个细胞/孔的密度接种在6孔板中。培养2 w后,将克隆的细胞用4%多聚甲醛固定20 min,并在室温下用0.5%结晶紫染色15 min。在Olympus倒置显微镜下计数大于50的细胞克隆形成数。
1.7Western印迹检测SiHa细胞中Ki67、E-cadherin、N-cadherin蛋白表达 收集转染的SiHa细胞,用RIPA缓冲液裂解,获得细胞蛋白。根据制造商的协议,使用BCA试剂盒对蛋白进行定量。通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质(30 μg/泳道)。将分离的蛋白转移到聚偏二氟乙烯膜上,并在室温下用5%封闭液封闭1 h。用相应的Ki67、E-cadherin、N-cadherin和对照GAPDH一抗(均为1∶1 000稀释)标记膜,并在4℃下孵育过夜。第2天将膜与山羊抗鼠IgG二抗(1∶10 000稀释)在室温下孵育1 h。使用电化学发光(ECL)液显示蛋白条带,分析Ki67、E-cadherin、N-cadherin蛋白表达。
1.8Transwell小室法检测SiHa细胞的迁移、侵袭 将转染后的SiHa细胞悬浮于无血清的RPMI1640培养基中,并调节至3×104个细胞/ml的密度。在Transwell小室的上腔室中接种100 μl细胞悬液,下腔室中添加600 μl含10%胎牛血清的RPMI1640培养基,在5% CO2下于37℃孵育。细胞培养24 h后,将迁移细胞在室温下用100%甲醇固定20 min,并用0.5%结晶紫染色10 min,在光学显微镜观察迁移细胞的数目。对于侵袭测定,实验前,上室用与无血清培养基混匀的Matrigel基质胶涂覆,其余步骤同迁移测定。
1.9双荧光素酶报告实验验证PGM5-AS1对miR-4728-5p的靶向调控 通过Starbase(http://starbase.sysu.edu.cn/)预测了PGM5-AS1与miR-4728-5p结合序列。将含有假定的miR-4728-5p结合位点的PGM5-AS1片段克隆到pmirGLO载体中,构建野生型PGM5-AS1(WT-PGM5-AS1),同样构建带有突变位点片段的突变型PGM5-AS1(MUT-PGM5-AS1)报告基因。然后将构建的报告基因分别与miR-4728-5p模拟物或miR-NC共转染到SiHa细胞中,分别记为miR-4728-5p组或miR-NC组。48 h后通过双荧光素酶报告试剂盒测定相对荧光素酶活性。
1.10统计学分析 采用SPSS22.0软件进行独立样本t检验。
2 结 果
2.1PGM5-AS1在宫颈癌中的表达 如表1所示,与癌旁组织组(1.04±0.12)相比,42例宫颈癌组织中PGM5-AS1的表达水平明显降低(0.20±0.01,P<0.05)。
2.2PGM5-AS1对SiHa增殖的影响 如表1、图1所示,与pcDNA3.1组相比,pcDNA3.1-PGM5-AS1组SiHa细胞中PGM5-AS1表达量明显增加,细胞存活率和克隆形成数显著减少,并且Ki67蛋白表达水平明显降低(P<0.05)。
2.3PGM5-AS1对SiHa迁移、侵袭的影响 如表1、图2所示,与pcDNA3.1组相比,pcDNA3.1-PGM5-AS1组的SiHa细胞迁移细胞数和侵袭细胞数明显减少,E-cadherin蛋白表达量显著增加,N-cadherin蛋白水平明显降低(P<0.05)。

表1 PGM5-AS1对SiHa增殖、迁移、侵袭的影响
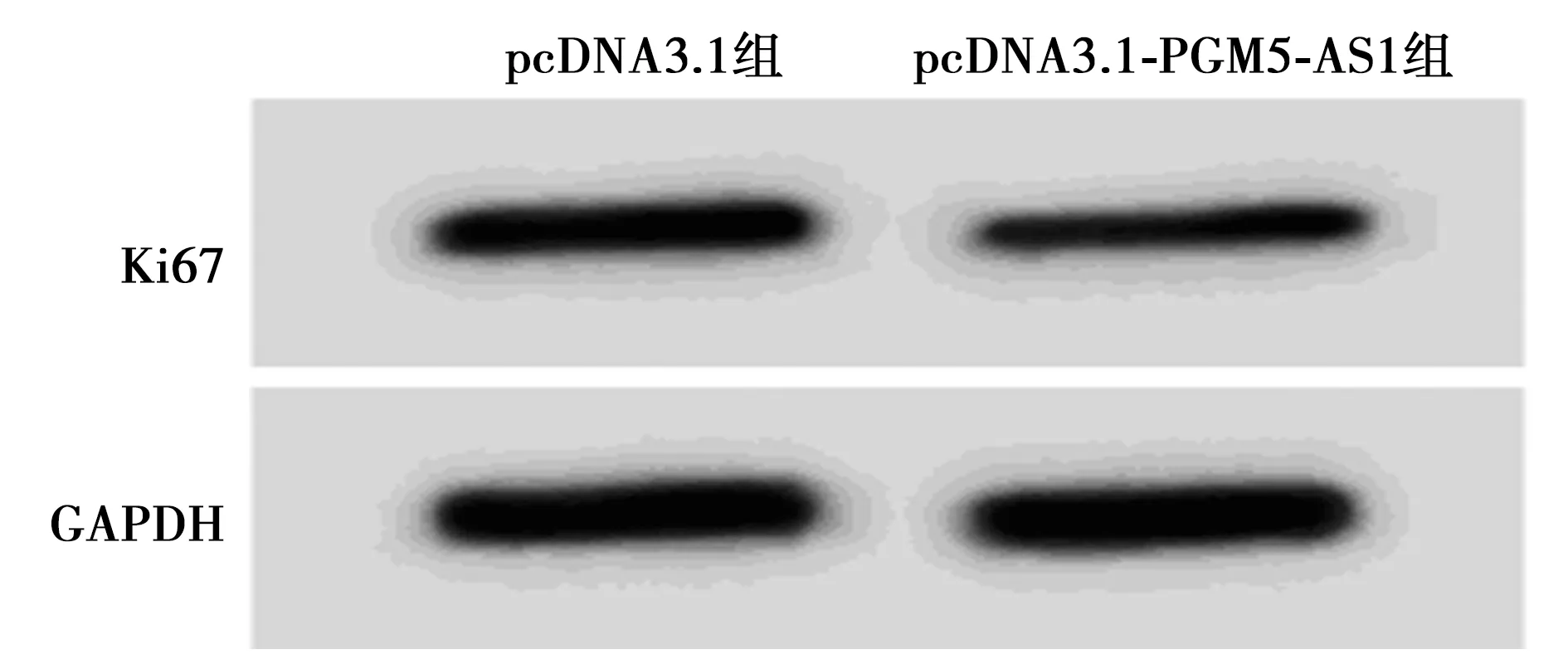
图1 两组Ki67蛋白的表达
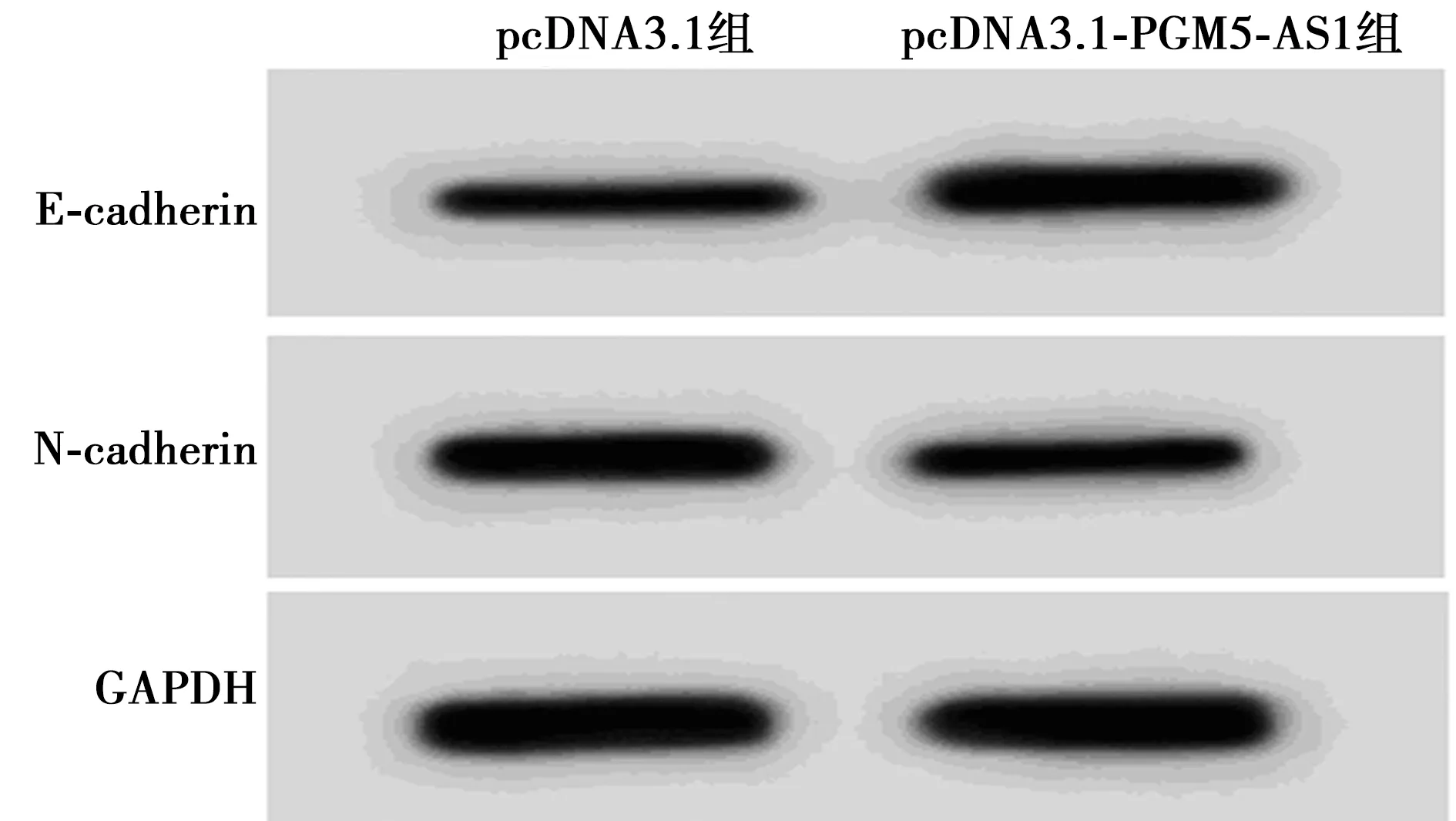
图2 两组E-cadherin、N-cadherin蛋白的表达
2.4PGM5-AS1靶向miR-4728-5p Starbase在线预测结果如图3所示,PGM5-AS1与miR-4728-5p具有靶向结合位点。双荧光素酶报告实验结果如表2所示,与转染miR-NC相比,转染miR-4728-5p明显降低转染WT-PGM5-AS1的SiHa细胞荧光素酶活性(P<0.05),对转染MUT-PGM5-AS1的SiHa细胞荧光素酶活性无显著影响(P>0.05)。qRT-PCR检测结果显示,与转染pcDNA3.1相比,转染pcD-NA3.1-PGM5-AS1后SiHa细胞中miR-4728-5p表达水平明显降低(1.02±0.04 vs 0.38±0.02,P<0.05)。
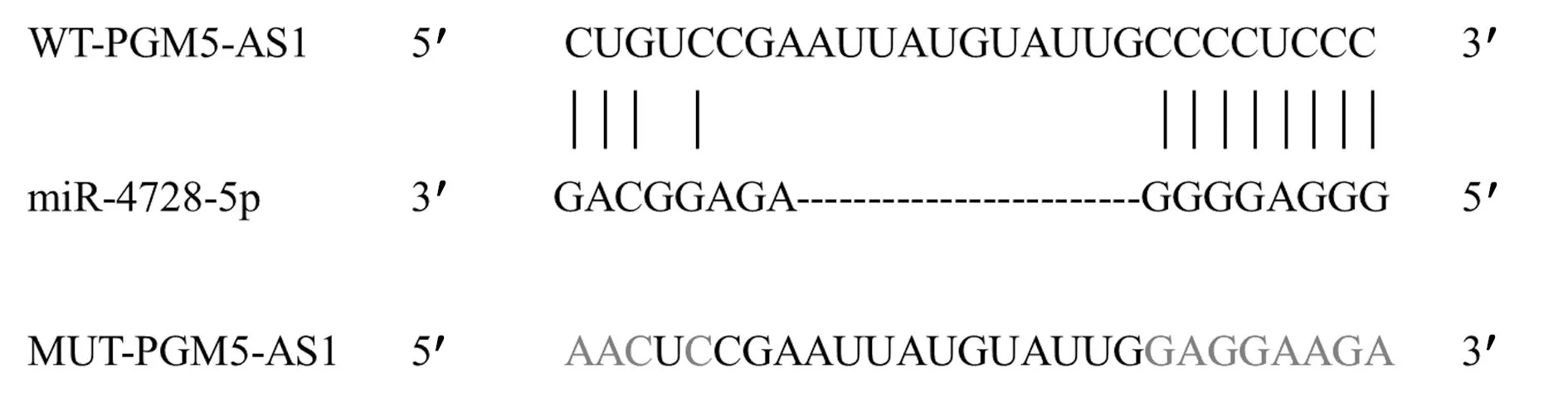
图3 PGM5-AS1靶向miR-4728-5p

表2 双荧光素酶报告实验
2.5抑制miR-4728-5p对SiHa增殖的影响 如图4、表3所示。与anti-miR-NC组相比,anti-miR-4728-5p组明显减少miR-4728-5p表达量、细胞存活率、克隆形成数、Ki67蛋白表达量(P<0.05)。
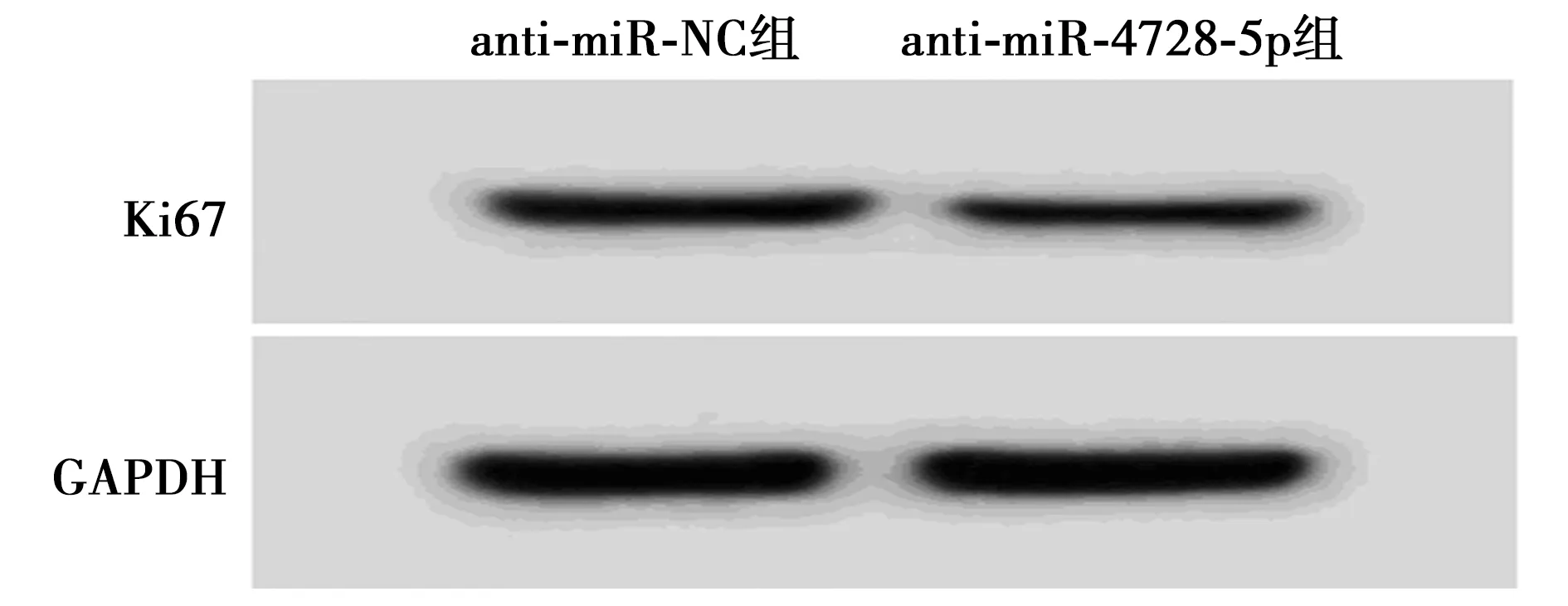
图4 两组Ki67蛋白的表达

表3 抑制miR-4728-5p对SiHa增殖、迁移、侵袭的影响
2.6抑制miR-4728-5p对SiHa迁移侵袭的影响 如表3、图5所示,与anti-miR-NC组相比,anti-miR-4728-5p组SiHa细胞迁移细胞数、侵袭细胞数、N-cadherin蛋白表达量降低,E-cadherin蛋白水平提高,差异均有统计学意义(均P<0.05)。
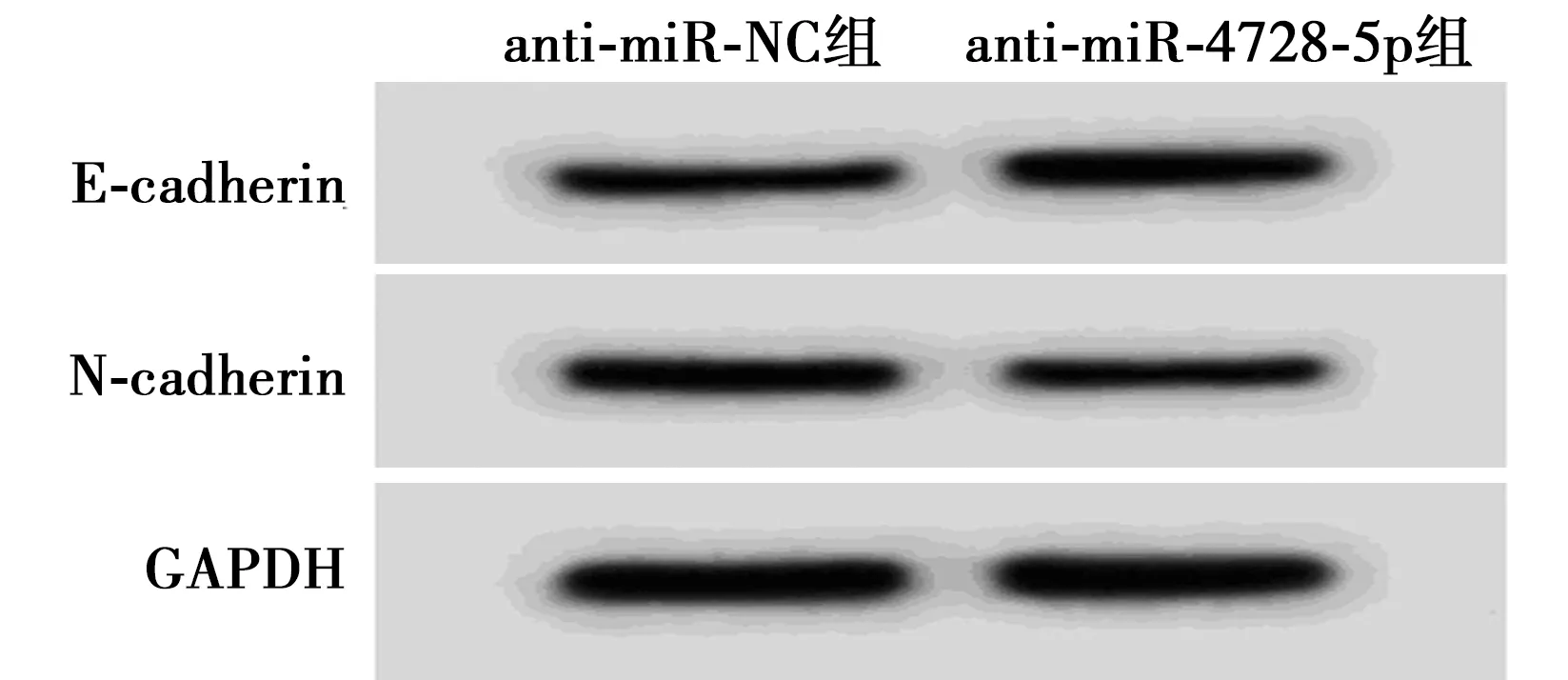
图5 两组E-cadherin、N-cadherin蛋白的表达
3 讨 论
子宫切除术及放化疗是治疗早期宫颈癌的最广泛的治疗手段〔8〕。然而,由于复发和转移,宫颈癌患者的预后仍然不能令人满意〔9〕。现阶段,宫颈癌的分子基础尚未得到很好的阐明。更深入地了解宫颈癌发生和发展的分子机制将有助于发现新型的分子治疗靶标。越来越多的数据突出了lncRNA在宫颈癌肿瘤进展,侵袭和转移,细胞凋亡和放射抵抗等方面的重要性〔10,11〕。本研究揭示了宫颈癌组织中lncRNA PGM5-AS1表达水平的变化及对宫颈癌SiHa细胞增殖、迁移和侵袭的影响,结果证实,PGM5-AS1具有抑制宫颈癌进展的作用,另外,其机制与抑制miR-4728-5p表达有关。
lncRNA是癌症发展和进展的基本调节剂,可能在宫颈癌进程中充当癌基因或抑癌基因。本项研究发现PGM5-AS1在宫颈癌组织中表达下调。最近,PGM5-AS1被发现参与乳腺癌〔12〕、胃癌〔13〕、黑色素瘤〔14〕等一些肿瘤的进展。例如,Qian等〔15〕报告,透明细胞肾细胞癌组织中PGM5-AS1的表达低于匹配的非肿瘤标本,其下调与淋巴结转移和远处转移密切相关,PGM5-AS1是透明细胞肾细胞癌患者的独立预后因素。张霖等〔16〕证明PGM5-AS1在非小细胞肺癌中表达下调,可以抑制细胞的克隆增殖能力,发挥一定抗癌作用。与相应的正常组织相比,结直肠癌组织中PGM5-AS1的表达水平显著下调,在功能上,PGM5-AS1的过表达可诱导结直肠癌细胞的凋亡和细胞周期停滞,还可抑制体内肿瘤的生长〔17〕。这些研究证实,PGM5-AS1可能是潜在的肿瘤抑制剂。然而,PGM5-AS1在宫颈癌中的功能和机制尚不清楚。本研究的功能实验测定显示,PGM5-AS1过表达抑制宫颈癌SiHa细胞的增殖、迁移和侵袭,并抑制细胞增殖抗原Ki67和迁移侵袭相关蛋白N-cadherin表达,促进E-cadherin蛋白表达。这表明,PGM5-AS1在宫颈癌中起着抑癌lncRNA的作用,与前人报道〔16,17〕相同。
证据表明,lncRNA可作为miRNA海绵调节肿瘤进展〔18〕。如lncRNA PTENP1通过竞争性结合miR-106b抑制宫颈癌的进展,导致细胞增殖减少和细胞凋亡增加〔19〕,lncRNA CRNDE通过海绵化miR-183调节CCNB1表达,在宫颈癌中起癌基因的作用,促进细胞增殖、迁移和侵袭〔20〕。本研究生物信息学预测和双荧光素酶报告实验阐明了miR-4728-5p是PGM5-AS1的靶基因,并且宫颈癌SiHa细胞miR-4728-5p的表达水平被PGM5-AS1所抑制。提示宫颈癌中的PGM5-AS1可能通过调控miR-4728-5p发挥抗肿瘤活性。近年来,一些研究表明了miR-4728-5p可能在肿瘤进展中起促癌作用〔7〕。但是,其对宫颈癌细胞增殖和转移的作用仍然未知。在这项研究中,显示抑制miR-4728-5p减少SiHa细胞的增殖、迁移和侵袭,与其在乳腺癌〔7〕中的作用相同。
综上所述,PGM5-AS1是宫颈癌中的一种新型肿瘤抑制因子,可以靶向抑制miR-4728-5p的表达,从而抑制宫颈癌细胞的增殖和转移。
