下调lncRNA ZEB1-AS1靶向促进miR-133a-3p表达抑制口腔鳞癌细胞SCC15侵袭和迁移的分子机制
2023-02-28王海琴闫冰李成
王海琴 闫冰 李成
(西宁市口腔医院口腔外科,青海 西宁 810000)
口腔鳞癌是常见的口腔颌面恶性肿瘤,其发病率在口腔颌面全部恶性肿瘤中占80%,口腔鳞癌的发病率不断攀升〔1〕。近些年来,基因在口腔鳞癌中的作用得到了人们的广泛重视,口腔鳞癌中异常表达的基因参与影响肿瘤细胞的恶性生长和转移,分子靶向基因治疗口腔鳞癌成为近些年研究的热点〔2〕。长链非编码RNA(lncRNA)的转录本大于200 nt,没有开放阅读框、起始密码子、终止密码子,因此也没有编码蛋白质的功能,lncRNA蕴含信息丰富,其在人体组织中的表达具有数量多、作用模式多、种类多等特点,lncRNA在细胞内的各种活动如细胞分化、细胞生长、染色质修饰等过程中发挥作用〔3〕。lncRNA锌指E-盒结合同源异形盒1-反义链(ZEB1-AS)1又称为ZEB1的反义RNA1,其长度为2 232 bp,其首次发现于肝癌中,后续在膀胱癌、肺癌等肿瘤中也发现ZEB1-AS1表达上调,ZEB1-AS1具有促进肿瘤恶性生长的作用〔4~6〕。目前尚不明确ZEB1-AS1在口腔鳞癌细胞生长和侵袭中的作用。前期的预实验发现,ZEB1-AS1和miR-133a-3p存在互补结合位点,二者可能互为靶向关系。miR-133a-3p是一个具有抑制口腔鳞癌细胞恶性生长和转移作用的小分子RNA,其在口腔鳞癌中表达下调〔7〕。本研究旨在探讨下调ZEB1-AS1对口腔鳞癌细胞增殖、迁移和侵袭的作用及作用机制。
1 材料与方法
1.1材料 口腔鳞癌细胞系CAL27购自上海晶莱生物技术有限公司;E-钙黏蛋白(cadherin)抗体购自美国Abbkine;口腔鳞癌细胞系HN-6购自上海宾穗生物科技有限公司;口腔鳞癌细胞系SCC15购自美国ATCC;基质金属蛋白酶(MMP)-2抗体购自北京天根;ZEB1-AS1 shRNA、shRNA control由上海吉玛构建;N-cadherin抗体购自以色列Alomone;inhibitor control、miR-133a-3p inhibitor购自上海晨晔生物;正常口腔上皮细胞系HOK购自上海榕柏生物技术有限公司;MMP-9抗体购自美国GeneTex;miR-133a-3p mimics、mimics control由北京吉田生物科技有限公司构建。
1.2实时荧光定量聚合酶链反应(Rt-PCR)检测口腔鳞癌细胞中ZEB1-AS1表达变化 用Trizol试剂提取口腔鳞癌细胞CAL27、HN-6、SCC15及正常口腔上皮细胞HOK内的RNA,RNA放在-80℃保存。制备逆转录体系,包括:2 μl的PrimeSLipt mix、2 μl的RNA,最后添加焦碳酸二乙酯(DEPC)水至8 μl,逆转录反应的条件为:37℃孵育15 min,85℃孵育5 s,4℃保存。PCR体系如下:2 μl的cDNA、0.4 μl的上游引物、5 μl的SYBR Ⅱ、0.4 μl的下游引物,加入适量的DEPC水至10 μl。PCR条件如下:95℃预变性5 min,95℃变性10 s,60℃孵育1 min,72℃孵育1 min。根据样本反应得到的Ct值,以GAPDH作为内参,按照2-△△Ct法计算ZEB1-AS1的表达水平。引物为:GAPDH上游:5′-GTCAACGATTTGGTCTGTATT-3′,下游:5′-AGTCTTCTGGGTGGCAGTGAT-3′,ZEB1-AS1上游:5′-TTCAAACCCATAGTGGTTGCT-3′,下游:5′-TGGGAGATACCAAACCAAC-TG-3′。
1.3细胞转染和分组 口腔鳞癌细胞SCC15种植到6孔板中,分别把ZEB1-AS1 shRNA及shRNA control至细胞内,依照转染试剂(Lipofectamine 2000)说明进行转染。将转染了ZEB1-AS1 shRNA、shRNA control以后的口腔鳞癌细胞SCC15分别命名为sh-ZEB1-AS1组、sh-NC组,设置没有进行细胞转染操作的口腔鳞癌细胞SCC15为Control组。各组细胞在转染后继续培养24 h,根据1.2中Realtime PCR方法检测细胞中ZEB1-AS1表达水平。
1.4CCK-8方法检测细胞增殖 以96孔板,按照每孔接种105个将细胞分成Control组、sh-NC组、sh-ZEB1-AS1组,细胞放在37℃,5% CO2培养箱内常规方法培养24 h。分别在每个孔内小心的加CCK-8溶液(10 μl),反应4 h(37℃)。然后放在酶标仪上测定波长为450 nm的OD值。计算各组细胞的存活率变化。
1.5利用Transwell小室方法分析检测细胞的迁移以及侵袭水平 把Control组、sh-NC组、sh-ZEB1-AS1组细胞用不添加胎牛血清的细胞培养液悬浮,细胞密度为每毫升含有105个细胞。将冻存在-80℃冰箱中的基质胶取出,放在4℃过夜。取300 μl的不含血清的细胞培养液,添加60 μl的基质胶,混合后,添加到上室中,置于37℃孵育4 h。于上室缓缓加100 μl的细胞溶液,吸取500 μl细胞培养液至下室,置于37℃条件下孵育24 h。将Transwell小室取出,磷酸盐缓冲液(PBS)洗涤2次,用棉签把没有穿过膜的细胞擦掉,然后置于中性的甲醛溶液中孵育15 min。添加结晶紫染色30 min,PBS洗涤,风干以后,将小室放在显微镜下进行观察,计数细胞穿膜的数目作为细胞侵袭数目。在细胞迁移实验检测以前需要将基质胶包被的步骤省去。
1.6利用Western印迹分析并检测N-cadherin、MMP-2、MMP-9、E-cadherin蛋白表达 按照100∶1的比例将放射免疫沉淀(RIPA)裂解液和苯甲基磺酰氟(PMSF)混合,放在冰上备用。将Control组、sh-NC组、sh-ZEB1-AS1组培养24 h,然后弃掉培养液上清,将配制好的蛋白抽提试剂添加到细胞内,放在冰上裂解20 min,期间每隔3 min吹打1次。12 000 r/min,4℃高速离心10 min,将上清溶液吸取并保存在-80℃。利用二喹啉甲酸(BCA)方法检测蛋白的浓度。将蛋白溶液和5×上样缓冲液按照4∶1的比例混合,然后放在100℃加热5 min,置于-80℃保存。制备12%的分离胶及5%的浓缩胶。每个上样孔中加入40 μg的蛋白样品,初始电压设置为70 V,电泳30 min以后,调整电压至90 V,电泳到凝胶的底部以后,停止电泳。依照预染蛋白分子量的大小,将对应的胶块切下,裁剪聚偏氟乙烯(PVDF)膜,把转膜装置放在4℃进行,设置300 mA恒流进行常规转膜。小心把PVDF膜浸泡于5%牛血清白蛋白配制的封闭液内,然后将装置置于室温内、摇床孵育2 h。将一抗按照1∶1 000的比例稀释,继续放置PVDF膜于一抗内,4℃过夜。PVDF膜于1∶5 000稀释后二抗结合后。电化学发光(ECL)显色。利用ImageJ对各个条带进行灰度值检测,内参是GAPDH。
1.7ZEB1-AS1靶基因的预测及鉴定 本次实验利用软件starbase预测ZEB1-AS1靶基因,将ZEB1-AS1-WT、ZEB1-AS1-MUT分别和mimics control、miR-133a-3p mimics小心的共转染至口腔鳞癌细胞SCC15内,转染24 h后,以荧光素酶活性检测试剂盒对各组细胞的荧光素酶活性进行分析。ZEB1-AS1-WT、ZEB1-AS1-MUT分别为含有ZEB1-AS1结合位点、含有突变以后的ZEB1-AS1结合位点的荧光素酶报告载体。将Control组、sh-NC组、sh-ZEB1-AS1组培养24 h,用Realtime PCR方法检测细胞中miR-133a-3p表达水平,步骤完全按照1.2中进行,内参为U6。引物为:U6上游:5′-GTCAACGATTTGGTCTGTATT-3′,下游:5′-CTCGCTTTCGGCAGCACA-3′;miR-133a-3p上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGA-CAGCTGG-3′。
1.8miR-133a-3p inhibitor对下调ZEB1-AS1 shRNA口腔鳞癌细胞的作用检测 在口腔鳞癌细胞SCC15中分别将miR-133a-3p inhibitor、ZEB1-AS1 shRNA和inhibitor control、ZEB1-AS1 shRNA共转染,命名为sh-ZEB1-AS1+Anti-miR-133a-3p组、sh-ZEB1-AS1+Anti-miR-NC组,细胞培养24 h以后,利用Realtime PCR方法测定miR-133a-3p表达水平(步骤参照1.2),CCK-8方法分析检测各细胞的增殖水平(步骤按照1.4中进行),利用Transwell小室方法分析并检测各组细胞迁移及侵袭水平(步骤参按照1.5中进行),利用Western印迹检测细胞内MMP-2、N-cadherin、MMP-9、E-cadherin蛋白的水平(步骤参按照1.6中进行)。
1.9统计学方法 采用SPSS21.0软件进行t检验、方差分析。
2 结 果
2.1ZEB1-AS1在口腔鳞癌细胞中的表达变化 口腔鳞癌细胞CAL27、HN-6、SCC15中ZEB1-AS1水平(1.58±0.13、2.15±0.16、2.78±0.22)均明显高于正常口腔上皮细胞HOK中ZEBI-ASI水平(1.00±0.12,P<0.05)。ZEB1-AS1在口腔鳞癌细胞中表达上调。口腔鳞癌细胞CAL27、HN-6中ZEB1-AS1水平明显低于口腔鳞癌细胞SCC15(P<0.05)。选择表达水平最高的口腔鳞癌细胞SCC15用于后续实验。
2.2下调ZEB1-AS1对口腔鳞癌细胞增殖、侵袭和迁移影响 与Control组、sh-NC组比较,sh-ZEB1-AS1组口腔鳞癌细胞SCC15中ZEB1-AS1水平明显减少,细胞存活率明显下降,迁移及侵袭数目明显降低,蛋白MMP-9、N-cadherin、MMP-2表达水平明显降低,E-cadherin蛋白表达水平明显增强(P<0.05)。见图1、表1。
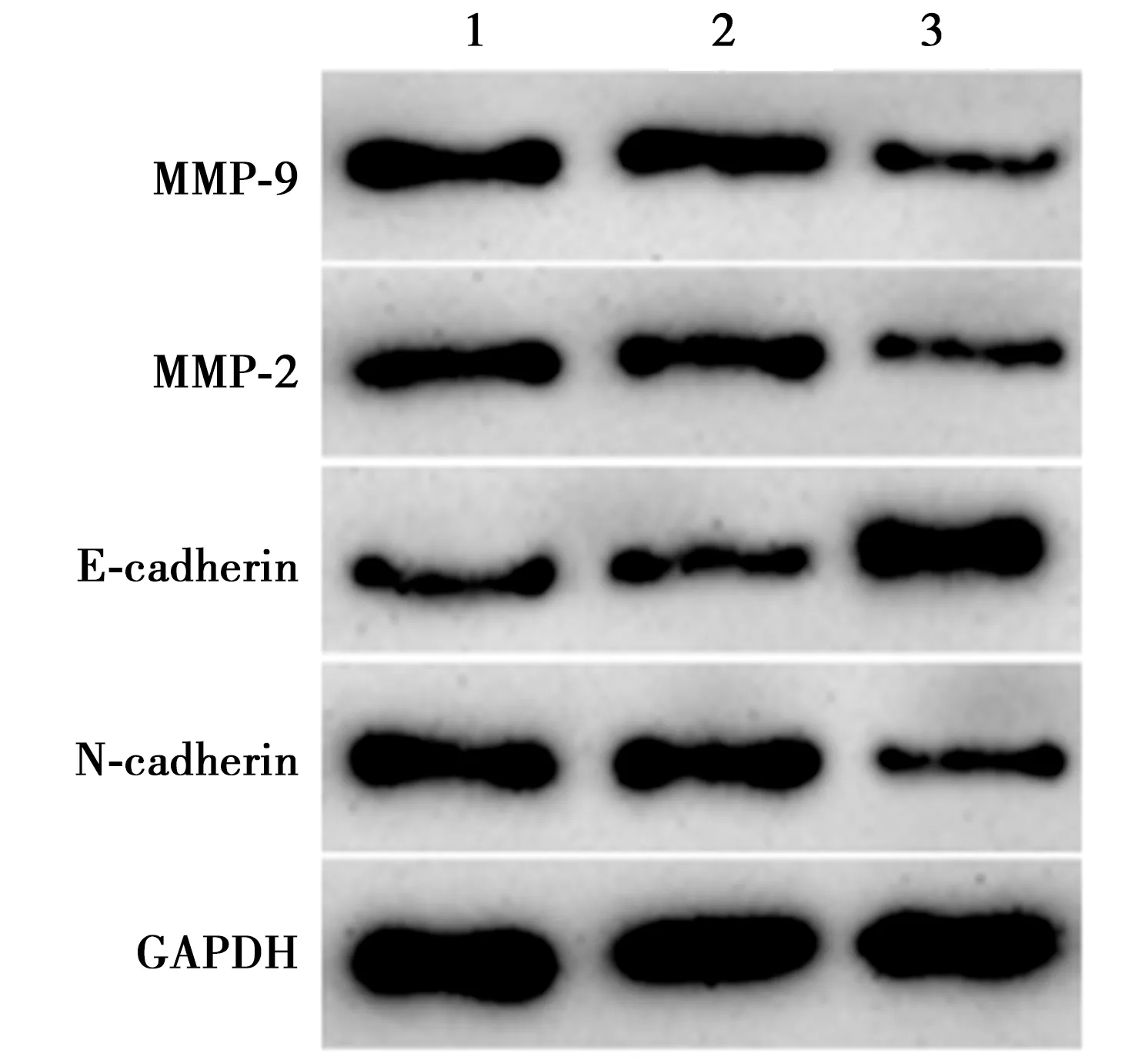
1~3:Control组,sh-NC组,sh-ZEB1-AS1组图1 Western印迹检测各组MMP-2、MMP-9、 N-cadherin、E-cadherin蛋白表达

表1 各组细胞存活率和迁移、侵袭数目以及MMP-2、N-cadherin、MMP-9、E-cadherin蛋白表达量
2.3ZEB1-AS1和miR-133a-3p互为靶向关系 生物信息学软件发现ZEB1-AS1和miR-133a-3p存在互补结合位点。见图2。miR-133a-3p mimics和WT共转染以后的荧光素酶活性降低,差异有统计学意义(P<0.001)。见表2。ZEBI-AS1 shRNA转染后,sh-ZEB1-AS1组口腔鳞癌细胞SCC15中miR-133a-3p水平(1.89±0.16)高于Control组、sh-NC组(1.00±0.10、0.98±0.12),差异均有统计学意义(均P<0.05)。
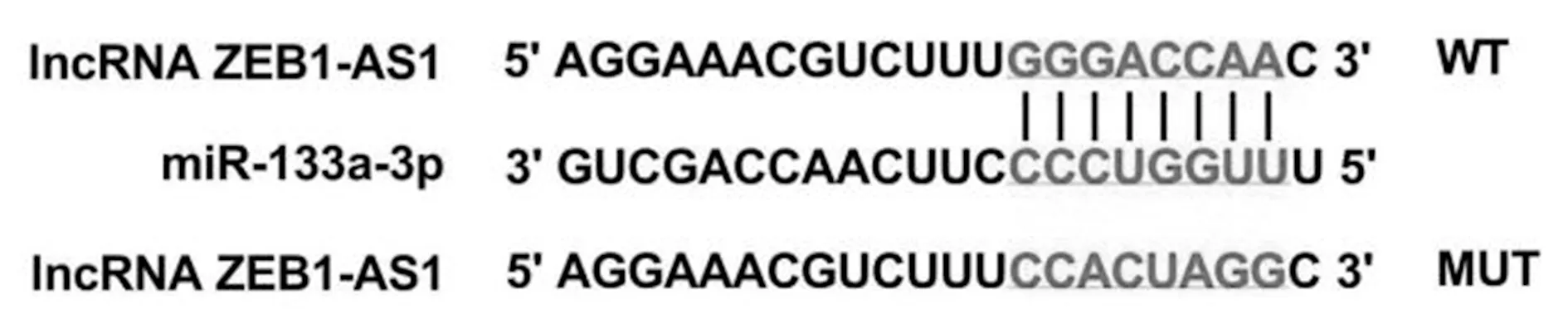
图2 ZEB1-AS1和miR-133a-3p靶向结合位点

表2 荧光素酶活性
2.4miR-133a-3p inhibitor对下调ZEB1-AS1影响口腔鳞癌细胞SCC15增殖、迁移和侵袭的影响 与sh-ZEB1-AS1+Anti-miR-NC组比较,sh-ZEB1-AS1+Anti-miR-133a-3p组口腔鳞癌细胞SCC15中miR-133a-3p表达明显减少,而细胞存活率明显变大,细胞迁移及侵袭数目明显增加,细胞内MMP-9、N-cadherin、MMP-2蛋白量明显变大,E-cadherin蛋白表达明显减少(均P<0.001)。见表3、图3。

表3 各组细胞存活率和迁移、侵袭数目及N-cadherin、MMP-9、E-cadherin、MMP-2蛋白表达比较
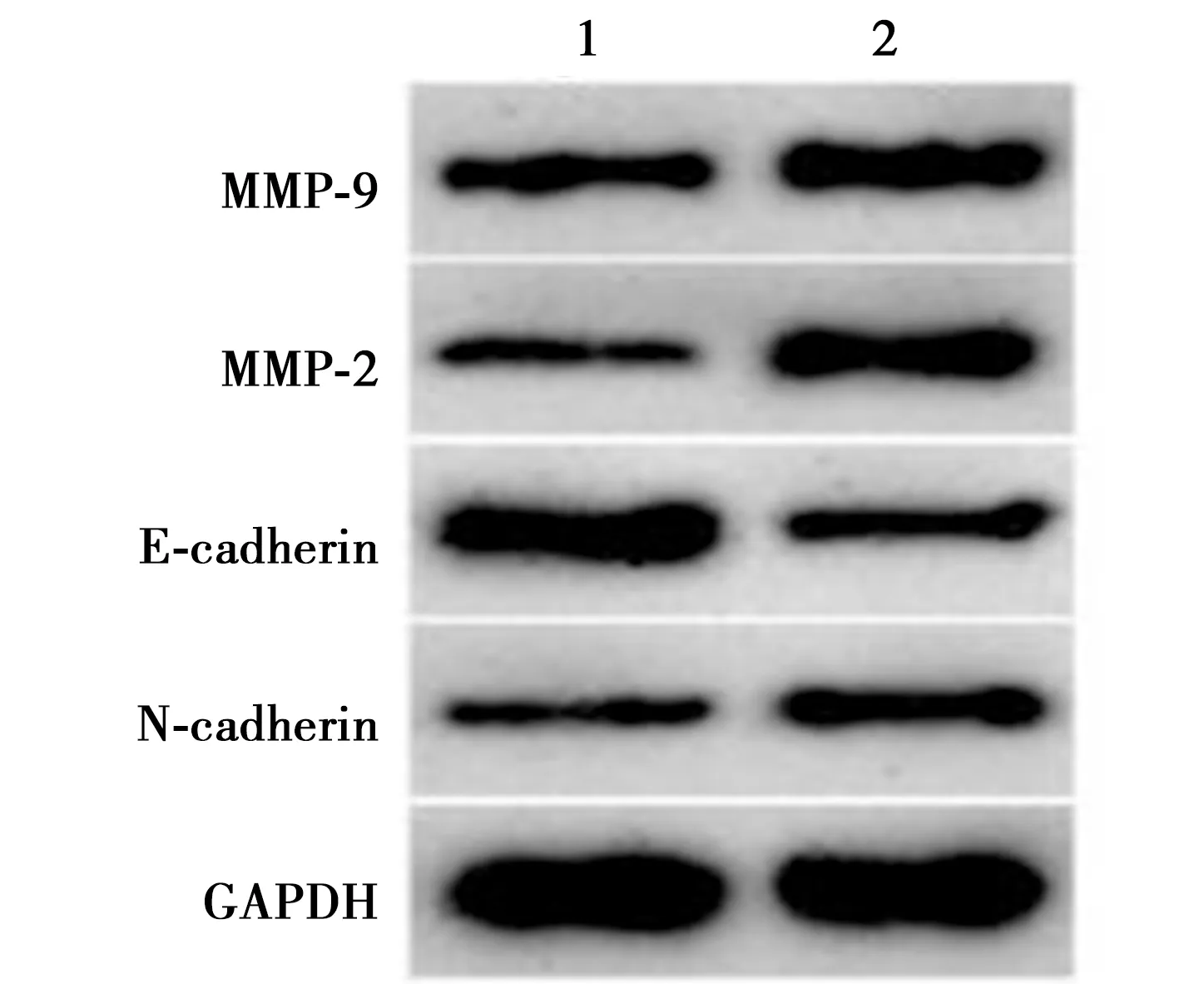
1~2:sh-ZEB1-AS1+Anti-miR-NC组,sh-ZEB1-AS1+Anti-miR-133A-3p组图3 Western印迹检测两组MMP-2、MMP-9、 N-cadherin、E-cadherin蛋白表达
3 讨 论
肿瘤的恶性生长是一个极为复杂的过程,受到很多基因的表达调控作用。伴随着基因测序技术的不断进步和发展,人们发现非编码RNA占人类基因组的98%,而且这些非编码RNA在细胞发育、组织稳态、细胞生长等过程中发挥作用〔8〕。lncRNA是一种大于200 nt的核苷酸转录本,绝大多数的lncRNA在组织中的表达具有组织特异性,lncRNA通过调控表观遗传学、细胞质转运、印迹缺失等发挥生物学功能〔9〕。最初人们发现,ZEB1-AS1参与肝癌细胞生长和恶性表型转化〔6〕。后续在胶质瘤、胃癌等肿瘤中证明ZEB1-AS1高表达促进肿瘤恶性生长,而下调ZEB1-AS1具有抑制肿瘤进展的功能〔10,11〕。本实验表明,口腔鳞癌细胞中ZEB1-AS1表达上调,并且下调ZEB1-AS1能够在体外抑制口腔鳞癌细胞的增殖能力,提示ZEB1-AS1是口腔鳞癌中的促进因子。
肿瘤细胞从原病发灶脱落,通过降解细胞外基质进入微循环系统,随着微循环系统达到新的组织和器官,形成新的病灶〔12〕。肿瘤转移的基础条件之一是细胞外基质降解,MMPs是常见的细胞外基质降解酶,其含有很多蛋白成员,分别能够将不同的细胞外基质成分降解〔13〕。MMP-2和MMP-9是与肿瘤转移关系最为密切的MMPs成员,其表达水平升高促进肿瘤转移〔14〕。还有研究报道显示,EMT是肿瘤转移的早期标志,发生EMT的肿瘤细胞转移能力也大大增加〔15〕。N-cadherin是间质细胞标志蛋白,其在EMT过程中表达水平上调〔16〕。E-cadherin是上皮细胞标志蛋白,其在EMT过程中表达下调〔17〕。本实验结果说明,下调ZEB1-AS1降低口腔鳞癌细胞侵袭、迁移和EMT水平。
lncRNA的作用机制复杂,目前研究最多的是其可以通过与miRNA结合发挥作用,而且在不同的生理以及病理过程中,lncRNA调控的miRNA不同,且lncRNA可以同时影响多个miRNA的表达,一个miRNA也可以同时受到多个lncRNA的调控作用〔18~20〕。本实验发现,ZEB1-AS1和miR-133a-3p存在互补结合位点,而且下调ZEB1-AS1靶向促进miR-133a-3p表达,ZEB1-AS1作用机制可能与miR-133a-3p有关。miR-133a-3p是一个长度在20nt左右的非编码RNA,具有很多生理功能,在人体组织中广泛表达〔21〕。以前的研究发现,miR-133a-3p在肿瘤中扮演抑制因子的角色,其能够抑制卵巢癌、膀胱癌、口腔鳞癌、结肠癌等多种肿瘤细胞的生长〔7,22~24〕。本研究结果提示,下调ZEB1-AS1靶向促进miR-133a-3p表达降低口腔鳞癌细胞生长和转移能力。
综上,ZEB1-AS1可能是一个口腔鳞癌促进因子,下调其表达通过靶向促进miR-133a-3p抑制口腔鳞癌细胞增殖、迁移和侵袭,ZEB1-AS可能是未来口腔鳞癌治疗的靶点。现阶段对于ZEB1-AS1靶向miR-133a-3p的下游具有机制还不清楚,在以后的实验中会进行探讨。
