室旁核TLR4阻断改善2型糖尿病大鼠糖代谢及机制
2023-02-28梁伟陈艳妹齐杰康玉明
梁伟 陈艳妹 齐杰 康玉明
(1西安医学高等专科学校医学技术学院,陕西 西安 710309;2西安交通大学医学部基础医学院)
糖尿病(DM)是以机体常年糖代谢紊乱为典型症状的代谢性疾病〔1,2〕。目前有证据显示DM 及其并发症的生理病理性发展与Toll样受体(TLR)4密切相关:DM时机体存在 TLR4 高表达,激活的 TLR4 及其相关信号通路可通过调控多种炎性细胞因子的释放参与 DM 病理性进展,也可通过介导氧化应激和细胞异常凋亡引发DM不良转归〔3~5〕。特异性阻断 TLR4 或敲除相关基因,DM 时期的胰岛素抵抗得以改善〔6~8〕。然而相关研究多集中于外周,中枢研究较少。下丘脑室旁核(PVN) 是调节机体能量代谢的主要中枢核团之一〔9~12〕。然而PVN TLR4 是否参与DM不良病变,将其阻断后能否成为治疗 DM 的新靶点,目前尚未见到相关研究报道。本研究以2型DM(T2DM) 大鼠为实验对象,通过PVN靶向给予TLR4特异性抑制剂(TAK-242),研究PVN TLR4 阻断对T2DM大鼠糖代谢的影响,并从神经-内分泌角度探讨可能的相关机制。
1 材料与方法
1.1动物及分组 健康雄性、体重160~180 g的SD大鼠由西安交通大学实验动物中心购入。基础饲料饲喂大鼠1 w后,利用随机数表法将大鼠分为:正常对照(NC+PVN vehicle)组、正常干预(NC+PVN TAK-242)组、DM(DM+PVN vehicle)组、DM干预(DM+PVN TAK-242)组。
1.2主要试剂仪器 TAK-242购自美国MCE公司;链脲佐菌素(STZ)购自美国Sigma公司;葡萄糖和丙酮酸购自上海金赛医药化工有限公司;胰岛素购自赛诺菲。大鼠脑立体定位仪MP-8003和动物手术显微镜 XTL-3400购自深圳瑞沃德生命科技有限公司;稳豪/倍易型血糖仪和血糖试纸购自强生(中国)医疗器材有限公司;冷冻切片机 CM1900购自德国 LEICA;Western印迹电泳槽、转膜机、成像分析仪等购自美国伯乐公司。
1.3主要实验方法
1.3.1T2DM大鼠模型制备 高脂高糖饲料〔13〕饲喂SD大鼠4 w。饲喂结束后大鼠禁食 12 h,腹腔注射小剂量 STZ(35 mg/kg) 1次,3 d 后经尾静脉采血检测大鼠空腹血糖(FBG),血糖水平 ≥11.1 mmol/L的大鼠认为建模成功。正常组大鼠则饲喂正常饲料,根据体重给予同等体积比例的柠檬酸-柠檬酸钠缓冲液。
1.3.2PVN插管术及给药 大鼠称重后施行腹腔麻醉(盐酸氯胺酮90 mg/kg 和乙酰丙嗪7.5 mg/kg),剃毛后将头部固定在脑立体定位仪上,参照 Paxinos 和 Watson 的大鼠脑立体定位图谱定位PVN区域(前囟后 1.6~2.1 mm,中线两侧0.3~0.5 mm,垂直7.0~8.0 mm),将套管植入大鼠PVN中,并利用树脂胶和螺钉在头盖骨上固定,微型渗透微泵(2006型)连接PVN套管后埋入皮下。手术成功率约为68%,术后大鼠分笼饲养,以 0.11 μl/h连续28 d输注TAK-242或人工脑嵴液(ACSF)。经PVN输注治疗的大鼠用于研究分析。
1.3.3大鼠体重和FBG监测 在大鼠开始给药后每周固定时间测量各组体重和FBG。利用体重计称取大鼠体重;大鼠禁食不禁水12 h,尾静脉取血测量大鼠FBG。测量4 w。
1.3.4大鼠糖代谢水平监测 葡萄糖耐量试验(GTT)、胰岛素耐量试验(ITT)和丙酮酸耐量试验(PTT)检测各组大鼠体内糖代谢水平。大鼠禁食不禁水 12 h,腹腔注射15%葡萄糖(2 g/kg)、胰岛素(1 U/kg)、丙酮酸(2 g/kg),鼠尾静脉采血记录各组大鼠0、15、30、60、120 min 的血糖值,计算相对血糖变化比值(相对血糖变化=即时血糖/0 min血糖),以算出的数值为统计值绘制曲线,以血糖曲线下面积进行统计学意义比较。
1.3.5肾交感神经放电(RSNA)检测 大鼠称重后施行腹腔麻醉,剃毛、固定、消毒后,右侧腰部纵形切口后清楚暴露肾脏,分离肾交感神经并浸润石蜡油后,将分离出的肾交感神经悬空挂于银丝电极,利用BL-420S 监测记录RSNA。实验结束时,滴加硝普钠测量最大RSNA,后切断肾交感神经,记录背景噪音。实际RSNA减去背景噪音后占最大RSNA的百分比,用作统计学意义比较。
1.3.6Western印迹检测 Western印迹检测PVN中还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)4(Santa Cruz)、Cu-Zn 超氧化物歧化酶(SOD,Santa Cruz)、酪氨酸羟化酶(TH,Abcam)、谷氨酸脱羧酶67(GAD67,Abcam)蛋白表达。参照Kang等〔14〕所述提取PVN中总蛋白,将稀释的总蛋白载入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上,电泳分离目的蛋白,采用半干转的方法将目的蛋白转置聚偏氟乙烯(PVDF)膜上,5%牛血清白蛋白封闭后孵育一抗(β-actin 1∶2 000,NADPH 1∶1 000,Cu-Zn SOD 1∶800,TH 1∶1 000,GAD67 1∶800)过夜,磷酸盐缓冲液(PBS)洗涤(6 min×4次),用稀释的二抗(1∶2 000)孵育2 h,洗涤后滴加现配的电化学发光(ECL)液并置于Western成像分析仪中发光、观察并保存结果。采用 NIH ImageJ软件进行图像灰度分析,以目的蛋白占β-actin的百分比用作统计学意义比较。
1.3.7二氢乙啶(DHE)、免疫荧光和免疫组化 参照Kang〔14〕所述收集各组大鼠PVN区域的脑部切片,DHE(sigma,1∶300)检测活性氧簇(ROS)水平,免疫荧光检测TLR4(abcam,1∶50)和TH(1∶200)阳性神经元表达,免疫组化检测神经元激活标志物(c-FOS,Santa Cruz,1∶100)、NF-κB通路激活标志物(p-IKKβ,Santa Cruz,1∶100)。在Nikon 荧光显微镜下观察组织各抗体阳性神经元数量表达并拍照记录。对脑组织切片PVN核团部位5个视野进行荧光强度分析作为DHE数据结果,对脑组织切片PVN核团部位5个视野进行TLR4、TH、c-FOS、p-IKKβ阳性神经元计数作为免疫荧光和免疫组化数据结果。
1.4统计学方法 采用SPSS13.0 统计软件进行两两比较的方差分析,所有定量资料正式统计分析之前,均经正态性检验和方差齐性检验。
2 结 果
2.1慢性输注TAK-242对T2DM大鼠PVN中TLR4阳性神经元的影响 如图1、表1所示:与NC+PVN vehicle和NC+PVN TAK-242组相比,DM+vehicle和DM+TAK-242组PVN中TLR4阳性神经元显著高表达(P<0.05)。DM+PVN TAK-242相比于DM+PVN vehicle组,PVN中TLR4阳性神经元数目显著降低(P<0.05),表明TLR4被有效阻断。
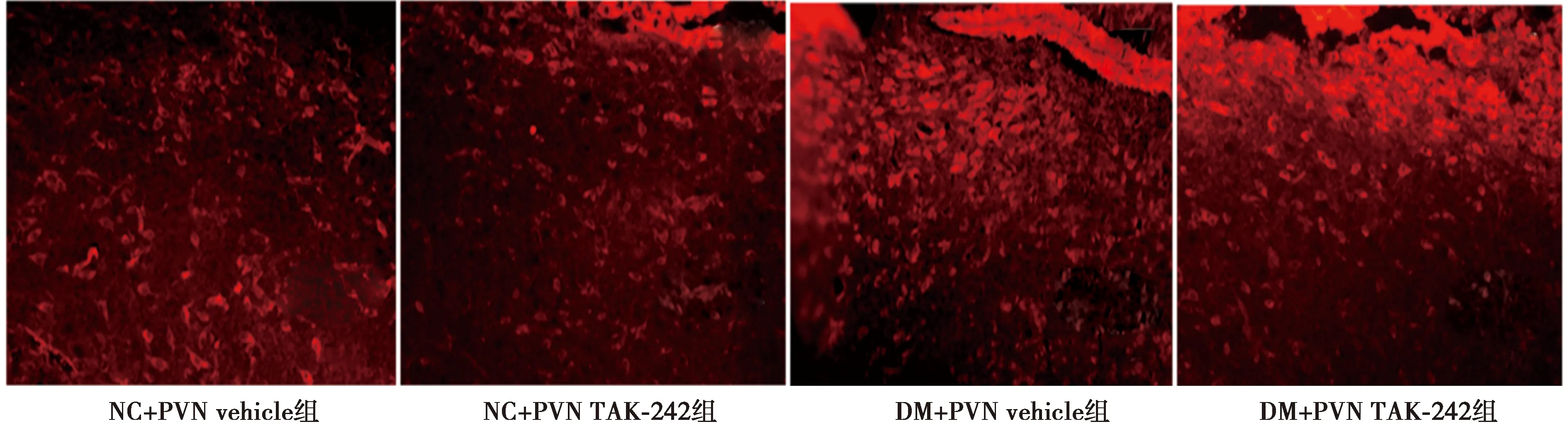
图1 免疫荧光检测各组PVN中TLR4 阳性神经元表达(×200)
2.2PVN阻断TLR4对T2DM大鼠体重的影响 如表1所示:DM+PVN vehicle组和 DM+PVN TAK-242组给药后2~4 w体重较NC+PVN vehicle和NC+PVN TAK-242组显著下降(P<0.05)。DM+PVN TAK-242组较DM+PVN vehicle组给药后体重下降减缓,并在给药后4 w时体重有显著差异(P<0.05)。表明PVN靶向给TAK-242可有效控制T2DM大鼠体重的减少。
2.3PVN阻断TLR4对T2DM大鼠空腹血糖的影响 如表2所示:DM+PVN vehicle组和 DM+PVN TAK-242组较NC+PVN vehicle组和NC+PVN TAK-242组给药期间FBG显著升高(P<0.01)。DM+PVN TAK-242组较DM+PVN vehicle组,慢性输注TAK-242后3~4 w时,FBG并未继续升高并且逐渐趋于平稳,但血糖值没有出现显著差异,表明PVN给予TAK-242一定程度上可控制T2DM大鼠FBG的上升。
2.4PVN阻断TLR4对T2DM大鼠糖代谢的影响 与NC+PVN vehicle和NC+PVN TAK-242组比较,DM+PVN vehicle组和 DM+PVN TAK-242组在空腹注射15%葡萄糖60 min和120 min时,相对血糖变化值出现显著性差异(P<0.05),在空腹注射胰岛素30 min、60 min和120 min时,相对血糖变化值出现显著性差异(P<0.05),表明T2DM大鼠体内存在胰岛素抵抗。DM+PVN TAK-242组相比DM+PVN vehicle组,在空腹注射15%葡萄糖120 min时相对血糖变化值出现显著性差异(P<0.05),表明PVN给予TAK-242可有效增加T2DM大鼠机体内胰岛素敏感性,抑制胰岛素抵抗,然而在空腹注射胰岛素后的各时间点的相对血糖变化值无统计学差异,表明PVN给予TAK-242对T2DM大鼠肌肉等组织摄取葡萄糖的敏感性改善作用不显著。与NC+vehicle和NC+TAK-242组比较,DM+PVN vehicle和 DM+PVN TAK-242组在空腹注射丙酮酸60 min和120 min时,相对血糖变化值出现显著性差异(P<0.05),表明T2DM大鼠体内存在糖异生。与DM+PVN vehicle组比较,DM+PVN TAK-242组在空腹注射丙酮酸后的120 min相对血糖变化值出现显著性差异(P<0.05),表明PVN给予TAK-242可显著降低T2DM大鼠体内的糖异生能力。见图2。
表1 各组PVN中TLR4阳性神经元表达及给药后不同时间体重比较
表2 各组给药不同时间FBG比较
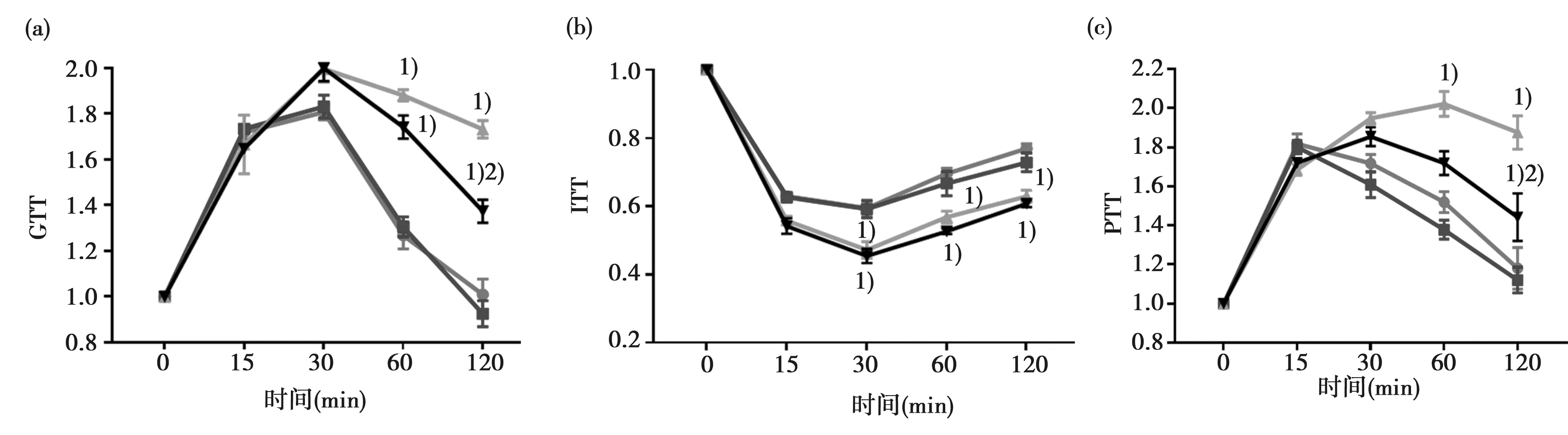
(a)各组不同时刻GTT变化;(b) 各组不同时刻葡萄糖耐量变化;(c)各组不同时刻PTT变化; NC+PVN vehicle组, NC+PVN TAK-242组, DM+PVN vehicle组, DM+PVN TAK-242组图2 室旁核TLR4阻断对T2DM大鼠胰岛素抵抗的影响
2.5PVN阻断TLR4对T2DM大鼠肾交感神经活性的影响 与NC+vehicle和NC+TAK-242组比较,DM+PVN vehicle和 DM+PVN TAK-242组RSNA最大百分比显著增加(P<0.05),表明T2DM大鼠体内存在交感神经激活;与DM+PVN vehicle 组比较,DM+PVN TAK-242 组RSNA最大百分比显著降低(P<0.05),表明PVN阻断TLR4可降低T2DM大鼠交感神经活性。见表3、图3。
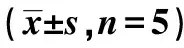
表3 各组RSNA最大百分比、PVN中NOX4、Cu-Zn SOD蛋白相对表达、ROS活性、TH及 GAD67蛋白表达
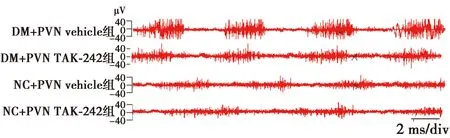
图3 各组RSNA
2.6PVN阻断TLR4对T2DM大鼠中枢氧化应激的影响 与NC+vehicle和NC+TAK-242组比较,DM+PVN vehicle和 DM+PVN TAK-242组NOX4 蛋白表达水平显著升高,Cu-Zn SOD 蛋白表达水平显著降低,ROS活性显著升高(P<0.05),表明T2DM
大鼠PVN中存在氧化应激。与DM+vehicle组比较,DM +TAK-242组NOX4 蛋白表达和ROS活性显著降低(P<0.05)。表明PVN阻断TLR4可降低T2DM大鼠中枢氧化应激。见表3、图4、图5。
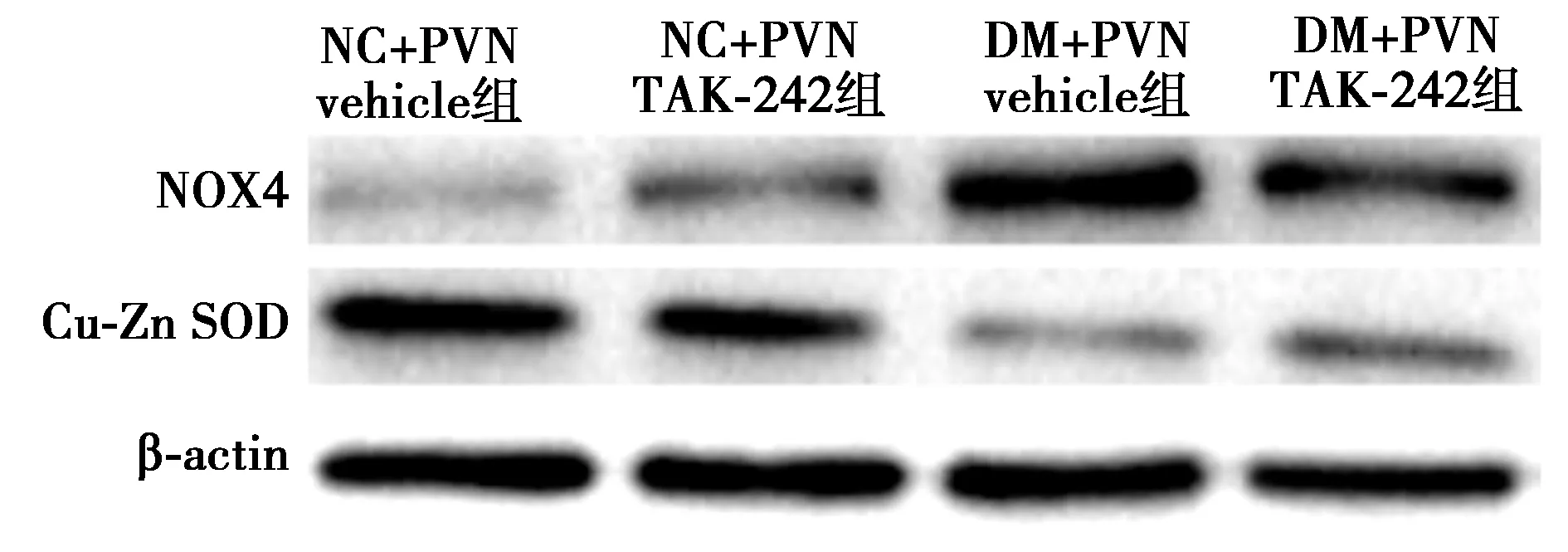
图4 各组PVN中NOX4、Cu-Zn SOD蛋白表达
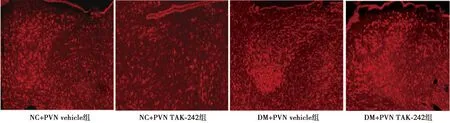
图5 各组PVN中ROS活性表达(DHE,×40)
2.7PVN阻断TLR4对T2DM大鼠中枢神经递质的影响 与NC+vehicle和NC+TAK-242组比较,DM+PVN vehicle和 DM+PVN TAK-242组TH蛋白表达水平显著升高,GAD67蛋白表达水平显著降低,TH阳性神经元数量显著增多(P<0.05)。表明T2DM大鼠PVN中枢存在兴奋性神经递质和抑制性神经递质的失平衡。与DM+vehicle组比较,DM+TAK-242组TH蛋白表达水平降低,GAD67蛋白表达水平升高,但差异无统计学意义(P>0.05);TH阳性神经元数量显著减少(P<0.05),表明PVN阻断TLR4可改善T2DM大鼠中枢神经递质的失平衡,进而降低外周交感神经活性。见表3、图6、图7。

图6 各组PVN中TH、GAD67蛋白表达
2.8PVN阻断TLR4对T2DM大鼠中枢神经元凋亡的影响 DM+PVN vehicle组和 DM+PVN TAK-242组相比于NC+vehicle和NC+TAK-242组PVN 中 P-IKKβ、c-FOS阳性神经元数目明显增多(P<0.05),提示T2DM时 PVN 神经元中 TLR4/NF-κB信号通路被显著激活,神经元出现大范围凋亡;DM+PVN TAK-242组P-IKKβ、c-FOS阳性神经元数目显著低于DM+PVN vehicle组(P<0.05)。见图8、表4。

图7 免疫荧光检测各组PVN中TH阳性神经元表达(×400)
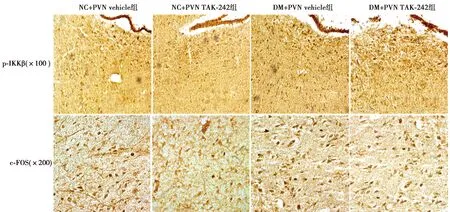
图8 免疫组化检测各组PVN中P-IKKβ、c-FOS阳性神经元表达
表4 各组PVN中P-IKKβ、c-FOS阳性神经元 表达
3 讨 论
本研究结果表明PVN TLR4阻断改善T2DM大鼠糖代谢。PVN是交感神经系统重要的整合中枢,直接或者间接参与交感神经的调控〔14~16〕,提示PVN可能通过调控交感神经活性影响DM进程。本研究结果发现,T2DM 大鼠肾交感神经存在过度激活,证明了外周交感神经激活是 T2DM 发病的重要机制之一,这与以往学者的观点是相一致的〔17,18〕;特异性阻断T2DM大鼠PVN TLR4后,可显著降低外周交感神经活性,改善T2DM大鼠糖代谢。
交感神经活性受中枢各种神经内分泌因素调控。氧化应激是ROS蓄积损伤组织的病理状态。机体ROS的产生主要依赖机体细胞利用葡萄糖时进行的氧化磷酸化反应,NADPH参与其中主要担当递氢体的角色;ROS的清除则主要依赖于SOD、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-px)等抗氧化酶系。本研究结果说明PVN TLR4阻断能降低中枢氧化应激,进而降低交感神经活性。
中枢神经递质的异常紊乱可以造成机体交感神经活性发生异常。去甲肾上腺素是一种重要的兴奋性神经递质,体内调控去甲肾上腺素合成的关键限速酶之一是TH,脑内TH含量可以反映去甲肾上腺素能神经纤维终末中枢分布情况。γ-氨基丁酸是一种重要的抑制性神经递质,始终贯穿于神经系统发育过程中并控制γ-氨基丁酸合成的关键限速酶之一是GAD67。本研究结果表明,T2DM大鼠PVN内兴奋性神经递质和抑制性神经递质发生紊乱;PVN TLR4阻断对中枢神经递质有影响,但不明显。
中枢神经元非正常、大范围的凋亡是DM引发的神经退行性疾病的重要发病机制〔19,20〕。TLR4/NF-κB信号通路激活可诱导细胞凋亡〔20〕,P-IKKβ是NF-κB活化经典途径的关键亚基;神经元c-Fos表达一定程度上可预测细胞凋亡即将发生。本研究发现T2DM大鼠相比于正常大鼠TLR4/NF-κB信号通路过度激活、PVN神经元凋亡异常。特异性阻断T2DM大鼠室旁核TLR4后发现,T2DM大鼠中枢TLR4/NF-κB信号通路不能建立,PVN神经元异常凋亡现象被逆转。
综上,下丘脑PVN TLR4阻断可一定程度改善T2DM大鼠糖代谢,其可能通过抑制中枢氧化应激和神经元凋亡,平衡兴奋性神经递质和抑制性神经递质,降低外周交感神经活性机制展开。本研究为中枢使用TLR4特异性抑制剂治疗T2DM提供了相应实验证据。
