错配修复基因MLH1、MLH2、MHL6、PMS2在胃癌组织中的表达及与上皮间质转换相关性
2023-02-28申志华王贺花海洋李常洲段思杰
申志华 王贺 花海洋 李常洲 段思杰
(承德市中心医院 1病理科,河北 承德 067000;2消化血液内科;3体检科)
胃癌(GC)为临床最常见消化系统恶性肿瘤,为我国第三高发恶性肿瘤,具有较高的发病率及死亡率,严重威胁人们身心健康〔1,2〕。目前关于GC的发病机制尚未完全阐明,普遍认为发生上皮间质转化(EMT)在GC的发生及发展过程中占据重要地位,肿瘤细胞的侵袭和转移、放化疗过程中肿瘤出现适应性及肿瘤干细胞的产生均与EMT关系密切〔3~5〕。DNA作为遗传信息的载体,DNA结构的高度保守性是维持机体健康的重要保障,在肿瘤发生过程中涉及多种癌基因和抑癌基因的突变和积累。错配修复基因(MMR)是机体保证遗传信息高度保守性的重要机制,MMR可通过修复DNA复制过程中因碱基错配导致的基因突变或异常,从而保证DNA复制的稳定及准确性〔6〕。MMR蛋白表达的缺失,可引起多种致癌基因的激活及抑癌基因活性的丧失,最终诱发肿瘤的发生〔7〕。
目前MMR表达和突变检测已被规范地应用于结直肠癌患者筛查。GC组织中同样存在MMR异常表达情况〔8〕,但关于MMR异常表达对GC发生影响的相关研究鲜有报道,本研究观察GC组织标本中MLH1、MSH2、MSH6和PMS2蛋白的表达并对其与EMT的相关性进行分析,以探讨MMR异常表达与GC发生发展的关系及其影响。
1 资料与方法
1.1一般资料 选取2019年12月至2021年6月承德市中心医院行GC根治性手术患者127例,所有入选病例临床资料完整,术前均未接受过特殊药物治疗或放化疗。127例GC患者中,男88例,女39例;年龄52~69岁,平均(61.2±21.3)岁;肿瘤直径≥5 cm者57例,<5 cm者70例;低分化72例、中分化39例、高分化16例;黏膜层浸润21例、肌层浸润33例、浆膜层及以上73例;TNM分期:Ⅰ~Ⅱ期48例,Ⅲ期79例;淋巴结转移者86例,无淋巴结转移者41例。
1.2仪器及试剂 Minux FS800/FS800A冷冻切片机(瑞沃德),ZY-TH-80恒温培养箱(深圳市正源设备科技有限公司),BX53型显微成像系统(奥林巴斯),PATH自动免疫组化仪(Biocare);MLH1、 MSH2、MSH6、PMS2抗体(上海钰博生物科技有限公司)。
1.3标本免疫组化检测
1.3.1MMR蛋白表达检测 严格按照免疫组化试剂盒操作说明书进行操作,测定MMR蛋白(MLH1、MSH2、MSH6、PMS2)表达情况,MMR蛋白阳性表达为细胞核出现棕黄色颗粒。
1.3.2上皮间质转换标志物检测 采用免疫组化法检测E-钙黏蛋白(cadherin)及波形蛋白(Vimentin)表达情况,E-cadherin阳性表达为细胞膜呈棕褐色或黄色,Vimentin阳性表达为细胞质呈棕褐色或黄色。Vimentin评分采用染色强度评分,评分0~1分为阴性,2~3分为阳性;E-Cadherin采用染色强度与阳性细胞数百分比评价,<10%为0分,10%~24%为1分,25%~49%为2分,50%~74%为3分,75%~100%为4分。
1.4MMR蛋白表达对患者生存周期的影响 根据MMR蛋白表达情况,跟踪随访MMR蛋白表达缺失患者与MMR蛋白表达非缺失组患者在12个月内生存情况,采用Kaplan-Meier生存曲线,评价MMR蛋白表达对患者生存周期的影响。
1.5统计学方法 采用SPSS22.0软件进行χ2检验、秩和检验、Spearman相关性分析。
2 结 果
2.1MMR在GC及癌旁组织表达情况 127例GC组中MMR蛋白缺失率为31.5%(40/127),MLH1、MSH2、MSH6、PMS2表达缺失率分别为20.47%(26/127)、14.17%(18/127)、8.66%(11/127)、16.54%(21/127),MLH1/PMS2联合缺失率为13.39%(17/127),MLH2/MLH6联合缺失率为5.51%(7/127)。
2.2MMR蛋白表达缺失率与GC临床病理特征关系 MMR蛋白缺失与淋巴结转移、肿瘤分化程度、TNM分期有关(P<0.05)。见表1。
2.3MMR表达与上皮间质转换相关性 MMR蛋白表达与上皮标志物E-cadherin呈正相关(r=0.524,P<0.05),MMR蛋白表达与间质标志物Vimentin呈负相关(r=-0.471,P<0.05)。见表2。
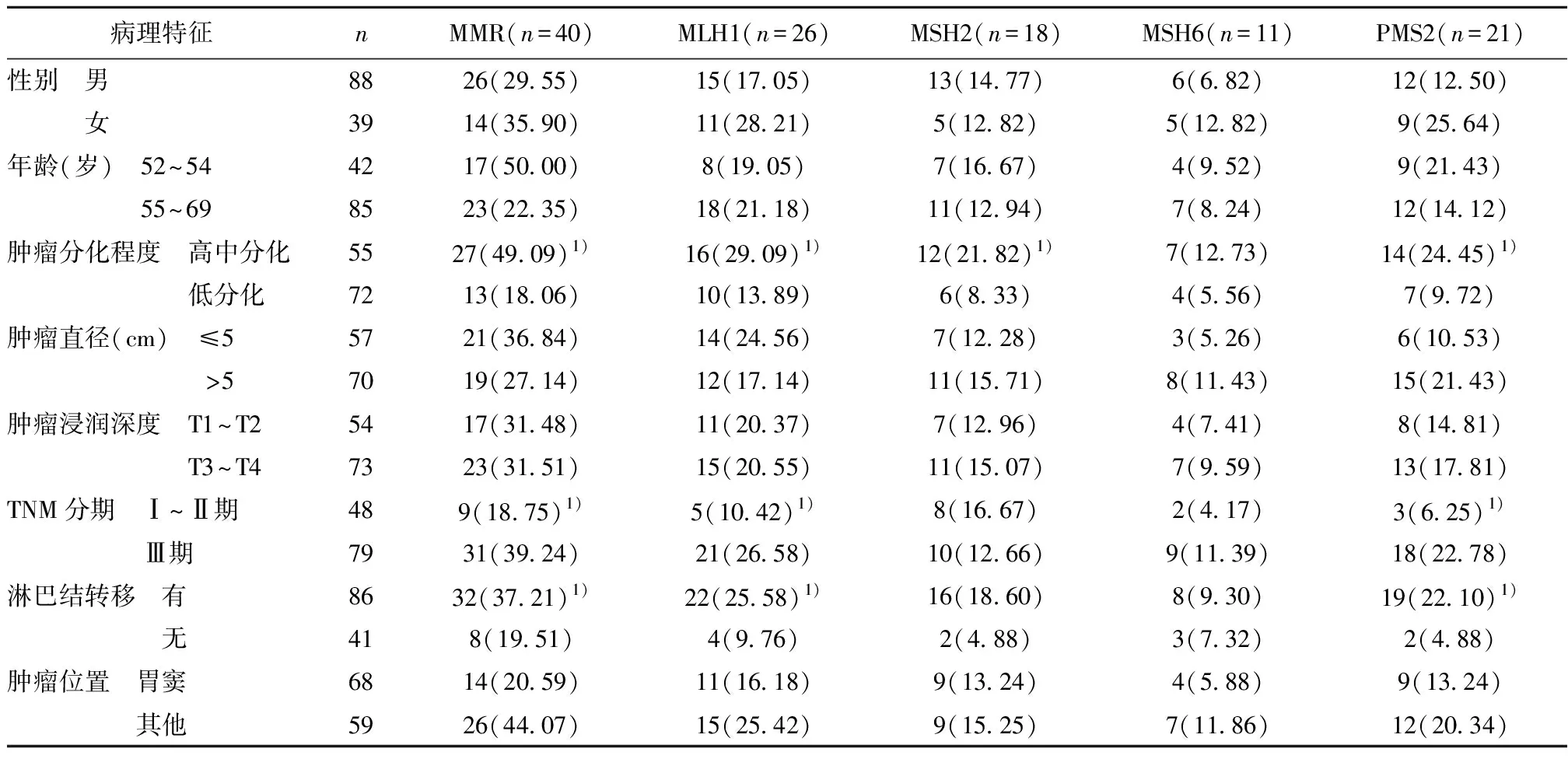
表1 MMR蛋白表达缺失率与临床病理情况的关系〔n(%)〕
2.4生存周期比较 MMR蛋白表达缺失组12个月生存率为62.5%(25/40),生存中位期为8.79个月;MMR蛋白表达非缺失组12个月生存率为81.61%(71/87),生存中位期为11.07个月,MMR蛋白表达非缺失组生存率及生存中位期均明显高于MMR蛋白表达缺失组(P<0.05)。见图1。
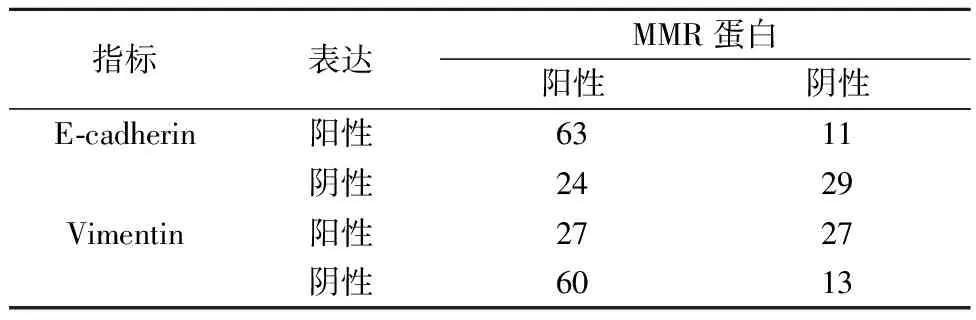
表2 MMR蛋白缺失率与E-cadherin、Vimentin表达的 相关性(n)
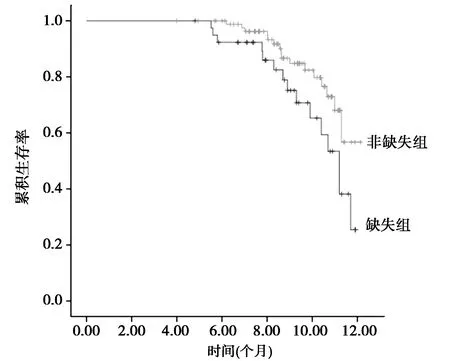
图1 MMR蛋白表达缺失与MMR 蛋白表达非缺失患者 Kaplan-Meier生存曲线
3 讨 论
GC为临床高发的消化系统恶性肿瘤,目前胃癌居我国恶性肿瘤发病率第三位,GC前期诊断难度大,患者确诊时多为进展期,导致患者丧失最佳治疗时机,GC患者死亡率居恶性肿瘤死亡率第二位,严重威胁患者生命安全〔9,10〕。肿瘤细胞的局部浸润及远处转移是导致患者死亡的主要原因,在肿瘤细胞侵袭及转移过程中EMT占据极为重要的环节,是发生肿瘤细胞侵袭及转移的关键步骤〔11〕。EMT是指在上皮细胞在多种因素作用下向间质细胞瘤转化的过程,EMT的发生可导致上皮细胞丧失细胞极性,进而引起细胞黏附性改变,细胞内原有的肌动蛋白发生重新排列,使肿瘤细胞侵袭及迁移能力提升,诱发肿瘤细胞远处转移的出现〔12〕。
E-cadherin及Vimentin在EMT发生过程中具有重要作用,与EMT的发生关系密切。E-cadherin为跨膜糖蛋白,在调节正常细胞形态、细胞运动能力及黏附能力方面具有重要作用。E-cadherin可介导细胞间黏附功能的降低,使肿瘤细胞更易从原发病灶剥离,从而向周围组织侵袭并发生远端器官转移,E-cadherin介导的细胞间黏附功能降低是肿瘤细胞获得侵袭和转移能力的关键步骤〔13,14〕。Vimentin为中间丝蛋白,在所有正常间质细胞中均存在Vimentin表达,对维持细胞完整性、降低应激损伤具有重要意义〔15〕。E-cadherin及Vimentin已经成为发生EMT的重要标志。
在发生DNA碱基错配时正常机体内存在一系列能够识别并修复相应错误的系统蛋白,这类系统蛋白被称为错配修复蛋白。MMR是细胞发生异常复制后的一种修复机制,在维持遗传稳定性和完整性方面发挥着重要作用〔16,17〕。机体MMR功能异常可造成细胞DNA修复错误,促进肿瘤的发生。错配修复蛋白包含以MLH1、MLH3、PMS1、PMS2等为代表的MutL蛋白家族及以MSH2/MSH3、MSH6等为代表的MutS蛋白家族〔18〕。在上述MMR蛋白中,任何单一MMR基因表达的缺失均可导致MMR系统功能异常,使得基因变异及不良突变逐渐积累,机体自发突变率显著增加,最终出现细胞增殖分化紊乱,从而增加罹患各种恶性肿瘤的风险。目前MMR表达和突变检测已被规范地应用于结直肠癌患者筛查,研究显示,20%~30%的GC患者存在MMR基因突变〔19〕。
本研究结果表明GC患者存在明显的MMR蛋白缺失,其中MLH1、PMS2缺失率最高。MMR蛋白缺失在淋巴结转移、肿瘤分化过程中具有重要作用,是预测淋巴结转移、肿瘤分化的重要指标。同时本研究结果表明MMR蛋白的表达与EMT的发生关系密切,MMR蛋白表达的缺失可导致EMT的发生。本研究结果表明,MMR 蛋白表达情况与GC患者预后情况关系密切,MMR蛋白表达的缺失可导致GC患者死亡风险的增加。
