基于网络药理学探讨红花治疗缺血性脑卒中的机制
2023-02-28张玉东吴仁愿赵怡滕飞何毅陈冲王亮王忠诚
张玉东 吴仁愿 赵怡 滕飞 何毅 陈冲 王亮 王忠诚
(1徐州医科大学第一临床医学院,江苏 徐州 221004;2中国矿业大学安全工程学院;徐州医科大学;3影像学院;4医学信息学院;5基础医学院)
缺血性脑卒中是由于各种原因引起的脑组织局部供血减少或中断导致的缺血缺氧性改变,缺血组织出现相应区域神经功能缺损症状的临床表现。该病好发于老年人,男性多于女性。在全球范围内,缺血性脑卒中约占脑卒中总发生率的84%〔1〕,而脑卒中则是导致死亡的疾病及导致残疾的主要因素〔2〕。临床上缺血性脑卒中的治疗方案有改善脑血循环(包括静脉溶栓、血管内治疗、抗血小板、抗凝、降纤等)、他汀药物、神经保护及行为康复治疗,目的是迅速恢复缺血区的血供,挽救缺血半暗带,缓解脑组织缺血缺氧引起的神经功能损害症状和体征。
中药在缺血性脑卒中的临床治疗中发挥重要作用。一些复方注射液具有活血化瘀、抗血小板聚集、扩张血管改善脑微循环和清除氧自由基等功效,对缺血性脑卒中治疗、预防及改善患者的神经功能损伤〔3〕均有一定的作用。红花作为一味重要的传统中药材,味辛性温,归心经、肝经,具有活血通经、祛瘀止痛等功效,常用于治疗痛经闭经、跌打损伤和缺血性心血管疾病〔4,5〕。红花含有多种化学成分,如槲皮素、木脂素、β-谷甾醇、豆甾醇、山奈酚、黄芩苷、羟基红花黄色素A等。近年来,对红花、羟基红花黄色素A及红花黄色素等有效成分的效用、作用靶点及作用机制进行了大量的研究,发现红花及其有效成分羟基红花黄色素A具有抗炎症〔6〕、抗凝〔5,7〕、抗氧化〔8〕、抗肿瘤〔9〕、抗脑缺血再灌注损伤及保护神经元〔10〕等药理作用,且红花黄色素被国家食品药品监督管理局批准用于治疗心绞痛等缺血性心脏病。虽然,临床上已将红花注射液应用于治疗缺血性脑卒中,但总体的机制还不是很明确。利用网络药理学技术构建多层次网络模型,从整体角度对中药进行解析,已成为一种科学解释中药有效性和科学性的新策略。因此,本研究基于网络药理学的方法,探讨红花治疗缺血性脑卒中的作用靶点和相关信号通路,为精确探讨其作用机制和药效物质基础提供依据。
1 资料与方法
1.1红花活性成分及作用靶点筛选 联合应用中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/tcmsp.php)、中药分子机制的生物信息学分析工具(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)检索红花的所有活性成分,筛选出符合条件〔口服生物利用度(OB)≥30%和类药性(DL)≥0.18〕的候选化学成分及其对应靶点;结合文献报道的红花有效成分,在有机小分子生物活性数据库(PubChem)和中药分子机制的生物信息学分析工具(BATMAN-TCM)查找羟基红花黄色素A、红花黄色素A、红花黄色素B、红花醌苷A、红花醌苷B、脱水红花黄色素B、红花素、红花酮和6-羟基山奈酚等成份的化学结构和预测靶点。最后,借助 UniProt 数据库(https://www.uniprot.org)查询靶点对应基因名的简称。
1.2缺血性脑卒中疾病靶点筛选 GeneCards(https://www.genecards.org)和OMIM(https://www.omim.org)数据库中设置检索词为“ischemic stroke”和“ischemia reperfusion injury”,检索缺血性脑卒中疾病相关靶点,并应用 Uniprot 数据库(https://www.uniprot.org)对疾病靶点进行标准化,获得 Swiss-Prot ID。
1.3红花活性成分作用靶点与疾病靶点的交集筛选 应用 R 语言软件(版本3.6.1)及 Perl 语言程序(版本5.34.0)将疾病靶点与药物靶点取交集,得到红花-缺血性脑卒中交集靶点。
1.4红花活性成分-缺血性脑卒中-靶点网络构建 利用Cytoscape3.7.1软件的merge功能构建红花活性成分-缺血性脑卒中-靶点(基因)网络。网络图中“node”代表活性成分和靶点,“edge”代表活性成分-缺血性脑卒中-靶点之间的相互关系。基于构建的网络探讨红花治疗缺血性脑卒中的潜在机制。
1.5蛋白相互作用网络构建 将1.3中得到的红花-缺血性脑卒中交集靶点导入 String(https://string-db.org/)数据平台,构建共同靶点蛋白相互作用(PPI) 网络,将蛋白种类设置为“Homo sapiens”,Settings设为“high confidence:0.4”,去除离散的结点,其他参数保持默认设置,获得 PPI 网络。利用R 语言软件的插件count.R对获得的PPI 网络数据进行蛋白靶点出现频次的分析。
1.6GO分析和KEGG通路富集分析 应用R语言软件插件(clusterProfilerGO.R)及 Perl 语言对红花活性成分与缺血性脑卒中的共同靶点进行GO分析;应用插件 (clusterProfilerKEGG.R)进行 KEGG 通路富集分析,并利用R 语言软件对其分析结果进行可视化。根据富集因子值分析富集程度,探究红花治疗缺血性脑卒中可能的生物功能及信号通路机制。
2 结 果
2.1红花活性成分及作用靶点筛选结果 通过TCMSP、BATMAN-TCM数据库对红花组成药物已报道的活性成分进行检索、并以OB≥30%和DL≥0.18为条件进行筛选;同时,根据文献报道的成分在PubChem数据库中进行结构查找并在BATMAN-TCM数据库中进行检索,去掉重复成分后最终得到22个有效活性成分,靶点共220个。红花的22个活性成分和分子编号分别为:木脂素(MOL002695)、除虫菊酯Ⅱ(MOL002710)、6-羟基山奈酚(MOL002712)、黄芩素(MOL002714)、qt_红花醌苷(MOL002717)、7,8-二甲基-1H-嘧啶并〔5,6-g〕喹喔啉-2,4-二酮(MOL002757)、六羟基黄酮(MOL002721)、黄芩苷(MOL002776)、β-谷甾醇(MOL000358)、山奈酚(MOL000422)、豆甾醇(MOL000449)、木犀草素(MOL000006)、CLR(MOL000953)、 槲皮素(MOL000098)、红花红色素(MOL002780)、β-胡萝卜素(MOL002773)、羟基红花黄色A (MOL002690)、Saffloquinoside A(45276863)、Saffloquinoside B(101501319)、Kinobeon-A(MOL002694)、红花黄色素B( 101241647)、 脱水红花黄色素B (102240413)。对应的靶点数目较多的活性成分依次为:槲皮素、山奈酚、木犀草素、β-谷甾醇、黄芩素、羟基红花黄色素A、红花红色素、红花黄色素B和红花醌苷B。
2.2缺血性脑卒中靶点 通过检索GeneCards、OMIM数据库并设置Relevance score≥5.0筛选,删去重复靶点,共得到1 072个缺血性脑卒中的治疗靶点。
2.3红花-缺血性脑卒中交集靶点筛选结果 应用R语言软件及Perl语言程序分析1 072个缺血性脑卒中治疗靶点与220个红花活性成分作用靶点,共筛选出100个共同靶点。
2.4红花-活性成分-靶点-缺血性脑卒中网络 通过Cytoscape 3.7.1 软件构建“红花-活性成分-作用靶点-缺血性脑卒中”网络,如图1所示。有效化学成分中,按作用靶点数从高到低排序依次为:槲皮素、山奈酚、木犀草素、β-谷甾醇、豆甾醇、β-胡萝卜素、黄芩苷、羟基红花黄色素A、红花红色素、红花黄色素B和红花醌苷B。这些可能是红花治疗缺血性脑卒中的关键化学成分。其中,羟基红花黄色素A、红花红色素、红花黄色素B和红花醌苷B的作用靶点都基本相似,包括谷胱甘肽还原酶(GSR)、腺苷A2A受体(ADORA2A)、微管相关蛋白(MAP)2、单胺氧化酶(MAO)B、短链酰基辅酶A脱氢酶(ACADS)、MAOA、微管相关tau蛋白(MAPT)、外核苷酸焦磷酸酶/磷酸二酯酶(ENPP)1、黄嘌呤脱氢酶(XDH)和一氧化氮合酶(NOS)1等。
2.5PPI网络的构建结果 运用 String 在线数据平台对红花-缺血性脑卒中交集靶点进行分析,在“high confidence:0.4”模式下构建出的PPI 网络。应用 count.R 插件统计出现频次居前 30 位的蛋白靶点(频次)依次为:丝氨酸/苏氨酸激酶(AKT)1(76次)、白蛋白(ALB,75次)、白细胞介素(IL)-6(68次) 、肿瘤坏死因子(TNF,67次)、血管内皮生长因子(VEGF)A(62次)、胱天蛋白酶(CASP)3(61次)、丝裂原活化蛋白激酶(MAPK)8(60次)、丝裂原活化蛋白激酶(MAPK)1(55次)、环加氧酶(PTGS)2(54次)、表皮细胞生长因子受体 (EGFR,53次)、FOS(53次)、NOS3(51次)、基质金属蛋白酶(MMP)9(50次)、MYC(47次)、IL-10(45次)、MMP2(45次)、血红素加氧酶(HMOX)1(44次)、雌激素受体(ESR)1(42次)、过氧化物酶体增殖激活受体γ(PPARG,42次)、细胞周期蛋(CCN)D1(41次)、胱天蛋白酶(CASP8,40次)、细胞间黏附分子(ICAM)1(40次)、IL-4(40次)、APP(38次)、转化生长因子(TGF)B1(38次)、Bcl2样蛋白(Bcl2L)1(37次)、髓过氧化物酶(MPO,37次)、RELA(37次)、小窝蛋白(CAV)1(36次)和干扰素γ(IFNG,36次)。出现频次较高的有ALB、AKT、IL6、TNF、VEGFA、FOS、CASP3、EGF、MAPK8和NOS3等,可作为红花治疗缺血性脑卒中的潜在靶点。
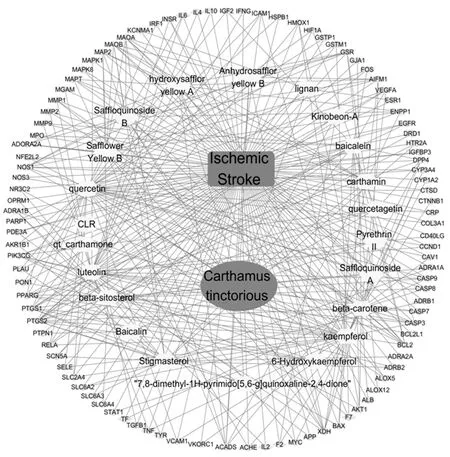
图1 红花-有效成分-作用靶点-IS网络
2.6红花治疗缺血性脑卒中GO分析及核心通路筛选共同靶点 对100个红花-缺血性脑卒中交集靶点基因进行生物学过程富集(GO)分析,分别选取P值较小的前20位作可视化展示,得到的气泡图见图2。其中,主要富集过程涉及蛋白磷酸酶2A结合、细胞因子受体结合、磷酸酶结合、蛋白磷酸酶结合、黄素腺嘌呤二核苷酸结合、G蛋白耦联胺受体活性、DNA结合转录因子结合、儿茶酚胺结合、血红素结合、半胱氨酸型内肽酶活性参与细胞凋亡过程、四吡咯结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、信号受体激活剂活性、生长因子活性、氧化还原酶活性(分子氧的掺入或还原)、抑制转录因子结合、内肽酶活性、激活转录因子结合、细胞因子活性和肿瘤坏死因子受体超家族结合等。这表明红花可能通过调控多个复杂的生物过程治疗缺血性脑卒中。

图2 红花-缺血性脑卒中交集基因GO功能 富集结果(气泡图)
通过对红花-缺血性脑卒中交集靶点基因进行 KEGG 通路富集分析的气泡图的结果见图3。节点大小表示富集的靶点数量,节点颜色由红色至深蓝色表示P值由小到大,因此红色节点越大表示信号通路的显著性越高,该条信号通路越重要。筛选出富集基因数居前20 位的通路,主要分布在流体剪应力与动脉粥样硬化、肿瘤坏死因子信号通路、细胞凋亡、结直肠癌、乙型肝炎、IL-17信号通路、胰腺癌、癌症中的蛋白多糖、肺结核、松弛素信号通路、HIF-1信号通路、凋亡(多物种)、C型凝集素受体信号通路、丙型肝炎和疟疾等多条信号通路中,提示红花通过作用于多条信号通路治疗缺血性脑卒中。
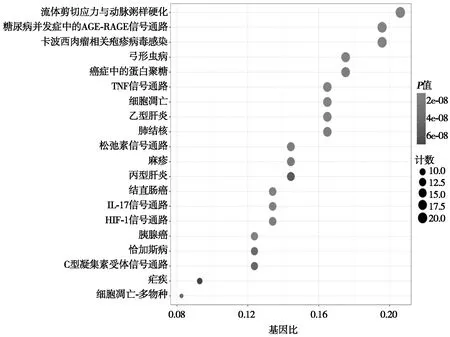
图3 红花-缺血性脑卒中交集基因KEGG通路富集 分析结果(气泡图)
3 讨 论
本研究通过构建PPI网络并预测潜在靶点,分析出红花治疗缺血性脑卒中的关键靶点主 要为 ALB、AKT、IL6、TNF、VEGFA、FOS、CASP3、EGF、MAPK8和NOS3等;KEGG 富集通路分析发现,TNF信号通路、细胞凋亡、IL-17信号通路、HIF-1信号通路和动脉粥样硬化等多条关键通路与红花治疗缺血性脑卒中显著相关,这表明红花治疗缺血性脑卒中的作用机制呈多成分、多靶点、多通路且相互关联的特点。
脑组织在供血减少或者中断后,缺血缺氧是引发组织损伤的直接原因,细胞凋亡在脑卒中缺血半暗带的细胞生物学活动中起着关键作用。处于缺血半暗带中的细胞由许多促凋亡蛋白和抗凋亡蛋白的表达共同决定细胞命运。在这些信号蛋白中,促凋亡蛋白Bax的上调和抗凋亡Bcl-2的下调会导致神经元凋亡。同时,Caspase-3位于Bax/Bcl-2的下游,并在凋亡发生过程中发挥重要作用。降低Bax/Bcl-2的比值,阻断Caspase-3诱导的细胞凋亡能够保护缺血性脑卒中缺血半暗带中的神经元〔11〕。
短暂性缺血后,脑组织恢复血液和氧气供应产生过量活性氧(ROS)和活性氮(RNS)自由基,攻击重新获得血液供应的组织内的细胞造成组织缺血再灌注损伤。自由基产生细胞氧化损伤的毒性,诱发炎症反应,破坏血脑屏障,从而引起脑组织的水肿。在缺血性脑卒中的急性期,自由基触发血管源性水肿,VEGF-A表达增高,MMP表达上调,VEGF-A诱导血脑屏障通透性增加;由于内皮细胞的细胞间连接断裂和血管渗漏,VEGF-A参与了脑水肿的发展。晚期增加的VEGF-A又促进神经元保护、功能恢复和血管生成〔12〕。
PI3K与生长因子受体(如EGFR)结合后,可改变丝氨酸/AKT的蛋白结构并使其活化,从而以磷酸化形式作用于下游一系列底物,如改变凋亡相关蛋白Bad、Caspase活性,从而调节细胞的增殖、分化、凋亡及迁移等生物学过程。黄芩素、β-胡萝卜素、山奈酚、木犀草素等成分可作用于AKT,调节发生缺血的脑组织细胞中葡萄糖代谢、凋亡、细胞增殖、转录和细胞迁移等生物学功能。
PI3K/Akt下游靶点是雷帕霉素靶蛋白(mTOR),而mTOR的下游转录因子则包括了HIF1α、c-Myc等分子。PI3K/AKT/mTOR信号途径能够促进HIF-1α的表达及稳定。HIF-1α在体内普遍表达,在多种肿瘤、炎症及缺血缺氧性疾病的细胞中过表达。脑组织对低氧十分敏感,氧浓度降低可诱导脑组织中HIF-1α表达显著增加,从而促进神经细胞的凋亡,加重脑组织的损伤,这可能与HIF-1α过表达诱导了促凋亡调节蛋白Bcl2的表达有关。HIF-1α表达水平增高还会促进BNIP3的表达,调控自噬体的形成与成熟,介导了非Caspase依赖性细胞凋亡〔13〕。在发生缺氧或炎症时,HIF-1α水平增加,启动下游基因的转录表达,如VEGF〔14〕,并激活HIF-1α/VEGF信号通路,从而诱导血管生成。VEGF的产生能够负反馈调节HIF-1α。有研究表明,缺氧能够诱导内皮细胞产生大量的TNFα,而通过下调TNF的受体阻断TNFα/NF-κB/HIF/VEGF通路减轻缺氧诱导的血管生成〔15〕。
缺血性脑卒中的发生、发展进程中也会出现明显的炎症和免疫反应。大鼠永久性中脑动脉栓塞(MCAO)可诱导缺血半球IL-6 mRNA表达和IL-6生物活性〔16〕;缺血损伤也增加了大脑皮质TNFα mRNA的表达,是缺血性神经炎症反应的一部分。Aliena-Valero等〔17〕在小鼠缺血性脑卒中的模型中发现,内源性 IL-6能够促进STAT3磷酸化,从而可以通过激活神经元中的IL-6/STAT3途径、抑制VEGF-A/MMP-9信号的来保护神经,减轻脑损伤〔18〕。作为一种促炎细胞因子,IL-17在缺血性脑卒中的急性期其mRNA和蛋白表达均上调,过度表达可能与治疗效果较差相关,表达降低与小鼠运动功能改善有关〔19〕,IL-17作为预后不良的重要指标。Sun等通过敲除小鼠IL-17有助于上调PI3K/AKT通路,激活神经干细胞,促进缺血性脑卒中后的神经再生,但梗死面积增加;通过上调AKT/GSK-3β和Wnt/β-catenin通路,从而对神经发生起到保护作用〔20〕。
缺血性脑卒中的病理机制十分复杂,涉及炎症反应、氧化应激、线粒体损伤、细胞凋亡和兴奋性氨基酸的毒性等许多生物学过程。而红花的有效成分较多,可作用于AKT、IL6、TNF、VEGFA、CASP3和NOS等多靶点。运用网络药理学的方法发现红花的有效成分通过PI3K/AKT、IL-6/STAT3、HIF-1α/VEGF、AKT/GSK-3β和Wnt/β-catenin信号通路及多通路间相互交叉、关联,是以多成分、多靶点、多通路特点的药理机制网络模式抑制细胞凋亡、保护神经元、促进神经元再生,减轻脑损伤、改善神经功能缺损及降低脑卒中复发率,达到疾病治疗和二级预防的效果。既往的研究对羟基红花黄色素A的关注较多,有关槲皮素、山奈酚、木犀草素等活性成分与缺血性脑卒中的相关性研究还很少,这为进一步的实验探讨提供了新方向。
