保健食品原料大黄及其制剂的质量一致性研究
2023-02-27高艳琳崔邶周陈岑程巧鸳
高艳琳,崔邶周,陈岑,程巧鸳
1.浙江中医药大学药学院,浙江 杭州 310053;2.浙江省食品药品检验研究院,浙江 杭州 310052
随着社会经济快速发展,物质不断丰富,超重和肥胖已成为世界性的健康问题[1]。由于植物具有绿色、天然、副作用小等特点,近年来人们不断从中药中寻找具有减肥作用的保健食品以达到健康瘦身的目的。据国家市场总局数据库显示,目前以中药为原料的减肥通便类保健食品的注册数量约占6%,常用原料有大黄、决明子、番泻叶等[2-3]。大黄、决明子和番泻叶等均为常用的泻下药,泻下成分主要为蒽醌类化合物,具有一定的使用禁忌[4-5]。由于绝大多数植物保健食品原料尚未建立统一的原料目录标准,行业规范性和产品质量均处于较低水平,存在较大的隐患[6-7]。2017年,我国首次启动了保健食品原料目录研究专项课题,细化了保健食品原料研究的主要技术要求,至今已发布破壁灵芝孢子粉等5种保健食品原料目录[8]。本课题在前期工作基础上,对大黄的水提取工艺和胶囊制剂工艺进行优化,以总蒽醌含量为指标,对原料与制剂的质量一致性进行评价,为保健食品原料目录大黄品种的制定提供科学依据。
1 材料与方法
1.1 材料与仪器 (1)材料:1,8-二羟基蒽醌对照品(批号110829-9702)购自中国食品药品检定研究院;大黄药材(批号TQ201912160301、TQ201912160302、TQ201912160303)来源于甘肃,经浙江省食品药品检验研究院郭增喜教授鉴定为蓼科植物掌叶大黄(Rheum palmatum L.)的干燥根和根茎;大黄制剂(批号2020030101、2020030102、2020030103)由浙江寿仙谷药业有限公司提供;所有溶剂均为国产分析纯。(2)仪器:XPE205 型电子天平(瑞士梅特勒公司);P300H 型超声波清洗器(北京汉达森机械技术有限公司);DK-S26 型数显电热恒温水浴锅(上海浦东荣丰科学仪器有限公司);TU-1950 型紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 实验方法
1.2.1 提取工艺考察
1.2.1.1 大黄吸水率工艺考察 取大黄(批号:TQ201912160301),粉碎成粗粉,按照每份样重25 g,加500 mL水浸泡,观察浸泡程度,并每隔1 h测量未吸收水的体积。
1.2.1.2 正交试验因素水平的选择 根据文献[9-10]报道,采用正交试验设计优选提取工艺,以大黄粗粉进行投料,提取工艺采用水为提取溶媒,以提取次数、加水量、提取时间作为考察因素,每个因素选择3个水平,按L9(34)正交试验表安排实验。因素水平表见表1。
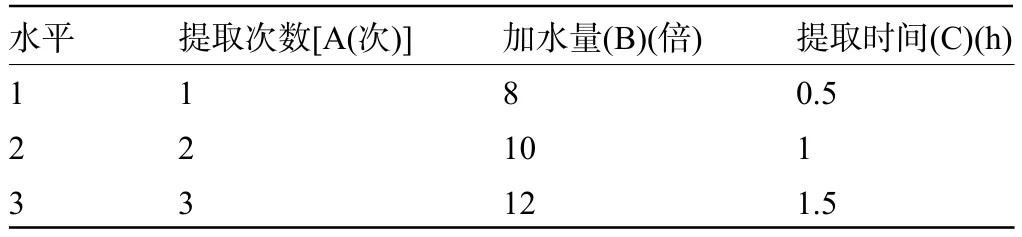
表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal design
1.2.2 胶囊制剂工艺考察
1.2.2.1 干燥工艺研究 取工艺验证所得提取液,分别于70℃条件下减压浓缩至适当程度,以物料流动性良好、挂壁不明显、物料耗损少作为浓缩终点的判断标准,测定所得浓缩液的相对密度。
1.2.2.2 提取物喷干粉的物理指标测定 测定物料细粉的流动性、堆密度和振实密度以考察提取物喷干粉在胶囊填充时的情况,其中流动性用测定物料的休止角衡量。
1.2.3 总蒽醌的测定[11-12]
1.2.3.1 对照品溶液的制备 精密称取1,8-二羟基蒽醌对照品12.69 mg 置于25 mL 容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
1.2.3.2 标准曲线的制备 精密量取对照品溶液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1 mL于25 mL容量瓶中,加混合碱溶液至刻度,混匀,于暗处放置30 min。以混合碱液为空白,在526 nm波长处分别测定吸光度。以浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
1.2.3.3 样品测定 精密称取大黄原料粗粉、胶囊各三批,置100 mL圆底烧瓶中,精密加入甲醇-盐酸(10∶1)混合溶液25 mL,称重,在80℃水浴中加热回流30 min,放冷,加甲醇补足减失的重量,摇匀,滤过,弃去初滤液,精密量取续滤液15 mL至分液漏斗中,加水25 mL,用二氯甲烷萃取3次(50 mL、40 mL、30 mL),合并提取液,并用水洗涤三次,每次40 mL,洗涤至中性,弃去水洗液,二氯甲烷层转移至蒸发皿中水浴蒸干或转移至圆底烧瓶于40℃水浴中减压蒸馏至干,残渣加甲醇使溶解并转移至20 mL 容量瓶中,用甲醇定容至刻度,摇匀。精密量取2 mL,至25 mL容量瓶中,加混合碱液至刻度,混匀,按1.2.3.2项中方法测定。
1.3 统计学方法 每个实验重复3 次。采用Excel 2010统计分析软件进行基础数据整理、分析,运用SPSS25.0对结果进行方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 提取工艺
2.1.1 大黄吸水率 5 h 后测得吸水量分别为90 mL、100 mL、100 mL。根据公式:被吸收水的体积/药材重量×100%计算药材的吸水率,结果见表2。结果表明,大黄在达到吸水平衡后,其吸水率约为386.7%。由于大黄有一定吸水率,第一次提取时外加3倍水。
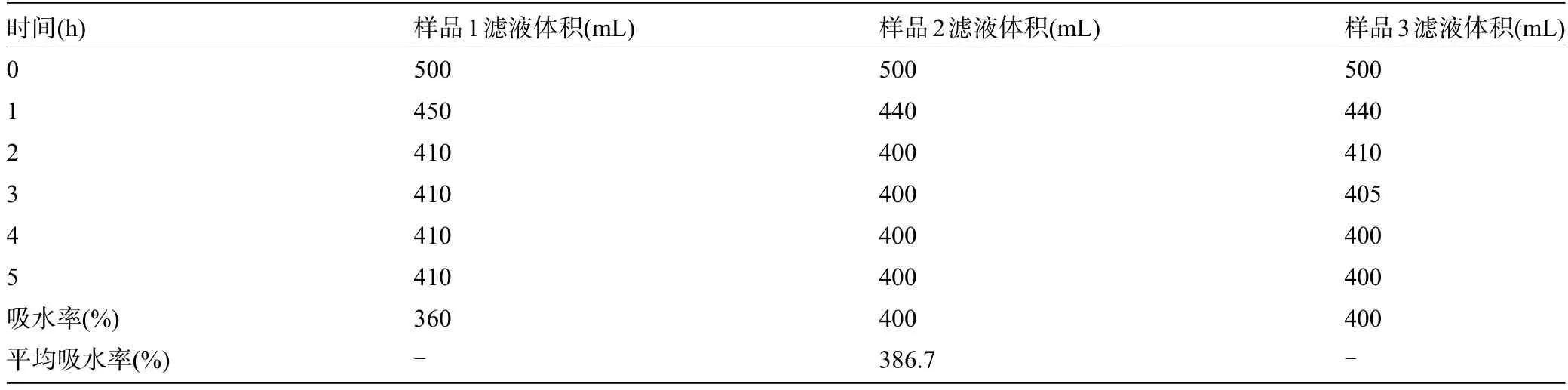
表2 药材吸水率考察结果Table 2 Results of water absorption rate of raw materials
2.1.2 正交试验结果及验证 取同一批大黄粉碎成粗粉,按每份25 g,共称取9份,按L9(34)正交试验表安排的方法提取,以出膏率为考察指标,结果见表3,方差分析见表4。结合极差R 值的大小对比可知,影响大黄出膏率的3个因素主次排序为:因子A(提取次数)>因子C(提取时间)>因子B(加水量)。三个因素对出膏率均随因素水平的升高而呈增加的趋势。结合出膏率方差分析结果可知,A 因素对出膏率在0.05水平上有显著影响,B 因素对出膏率的影响不显著。三个因素对出膏率均随因素水平的升高而呈增加的趋势。最优组合为A3B3C3,但B因素影响较小,结合生产实际及产品特性,拟定最佳工艺为A3B1C3,即提取3次,每次1.5 h,加水量分别为11 倍、8 倍、8 倍。根据以上最优条件进行最佳工艺验证,三组平行实验得到的结果见表5,三批工艺验证样品得膏率基本一致,变化幅度在5%范围内,进一步证明该工艺稳定可行。

表3 正交试验设计与结果Table 3 Design and results of orthogonal experiment
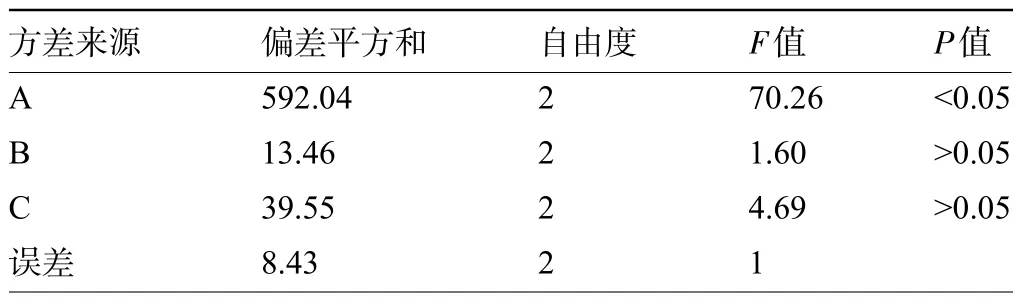
表4 出膏率方差分析结果Table 4 Variance analysis results of paste rate

表5 工艺验证结果Table 5 Results of process verification
2.2 胶囊制剂工艺
2.2.1 干燥工艺 结果见表6。把药液浓缩至相对密度为1.07~1.12(50℃)的流浸膏,浓稠适中,不易出现挂壁现象,物料浓缩过程损耗小,可以保证生产的可行性。本品浓缩液相对密度定为1.10(50℃),浓缩温度70℃以下。因此,在制备大黄提取物时,采用喷雾干燥,干燥过程进风温度170℃,出风温度90℃。

表6 浓缩液比重考察结果Table 6 Results of the specific gravity of concentrated liquid
2.2.2 提取物喷干粉的物理指标测定 取上述粉碎所得的物料进行实验,结果表明,大黄提取物喷干粉的堆密度平均值为0.307 4 g/mL,振实密度平均值为0.493 6 g/mL,物料流动性良好,因此以0 号胶囊壳直接进行填充,填充量约为0.35 g。见表7。
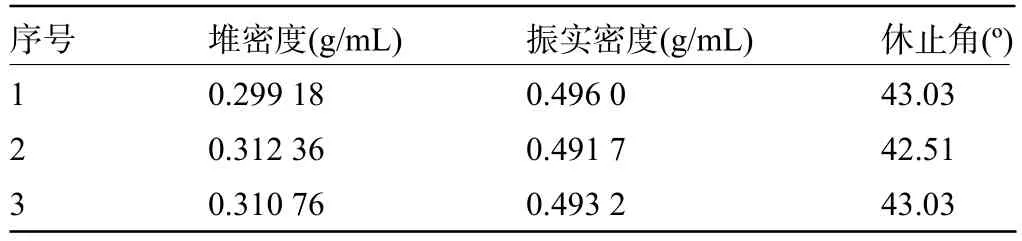
表7 提取物喷干粉物理指标测定结果Table 7 Testing results of the physical indexes of the spray-dried powder of the extract
2.3 质量一致性研究
2.3.1 标准曲线的制备 以浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,回归方程为y=0.048 52x+0.009 35,R2=0.999 9,线性范围为2.030 4~20.304 0 μg/mL。
2.3.2 样品测定 三批大黄原料粗粉的总蒽醌含量分别为15.0 mg/g、15.3 mg/g、16.0 mg/g,三批胶囊总蒽醌含量分别为7.6 mg/g、7.6 mg/g、7.6 mg/g。
3 讨论
3.1 提取工艺 大黄为我国传统中药,公认其有效成分为大黄蒽醌类。文献报道常采用水或乙醇为溶剂对大黄药材进行提取,以水为溶剂时,控制煎煮次数是提高出膏率的关键,且在大黄提取过程中,温度与时间对大黄蒽醌类成分的影响甚大,长时间受热会破坏有效成分[13]。本实验通过正交试验,比较了提取次数、提取时间、加水量三个因素对大黄提取效率的影响,结果表明,提取次数增加在一定程度上提高了出膏率,提取时间与加水量对出膏率无较大影响。结合生产成本与时间成本,研究得出大黄提取工艺为:水提3 次,每次1.5 h,加水量分别为11 倍、8 倍、8倍,该水提工艺重复性较好,操作简单且在降低成本的同时,也提高了大黄有效成分的溶出。
3.2 胶囊制剂工艺 为保证在干燥过程中颗粒质量较好且干燥效率较高,文献报道将药液温度控制在50℃[14]。本实验考察了浓缩液比重、物料细粉的流动性、堆密度和振实密度对制剂成型工艺的影响,密度过大或过小均会影响制剂成型,当药液浓缩至相对密度为1.07~1.12(50℃)的流浸膏时,浓稠适中,物料浓缩过程损耗小,可以保证生产的可行性。堆密度、振实密度和休止角可用以表征颗粒堆积能力及流动性,是影响胶囊填充效果的重要指标[15]。综合考察结果,拟定大黄胶囊制剂工艺为浓缩液相对密度1.10(50℃),浓缩温度70℃以下,采用喷雾干燥,进风温度170℃,出风温度90℃,直接装0号胶囊。该工艺合理,稳定可行。
3.3 质量一致性 由于含蒽醌类成分的保健食品日益增多,其配方成分也较为复杂,本实验借鉴我国保健食品理化及卫生指标检验与评价技术原则及文献资料中总蒽醌含量测定方法以及蒽醌类化合物的理化性质,采用紫外分光光度法测定大黄原料及制剂中总蒽醌的含量,方法简便,结果准确。从测定结果看,大黄原料经过水提取、浓缩和喷雾干燥后制备成大黄胶囊,主要有效成分总蒽醌的转移率为50.67%,与出膏率为55.09%接近,表明大黄从原料到制剂具有良好的质量一致性。在制定保健食品原料大黄的目录标准时,可将总蒽醌作为水提取工艺的质控指标,并结合出膏率制定合理的限度。
