多样性混合间栽对水稻根际细菌群落结构与功能的影响
2023-02-25唐文强张文龙朱晓乔董必正李勇成王云月韩光煜
唐文强 张文龙 朱晓乔 董必正 李勇成 杨 楠 张 耀 王云月,* 韩光煜,*
多样性混合间栽对水稻根际细菌群落结构与功能的影响
唐文强1,**张文龙1,**朱晓乔1董必正1李勇成2杨 楠1张 耀2王云月1,*韩光煜1,*
1云南农业大学农业生物多样性与病虫害控制教育部重点实验室/ 云南生物资源保护与利用国家重点实验室, 云南昆明 650201;2红河州农业科学院, 云南蒙自 661100
为了明确水稻多样性混合间栽对稻瘟病防治及根际细菌群落结构和功能的影响, 利用Illumina Hiseq测序技术, 对筛选的高防治效果(E=54.48%)组合(汕优63||黄壳糯)和低防治效果(E=14.12%)组合(合系39||黄壳糯)分别在间栽和净栽下进行水稻根际土壤细菌16S rRNA测序分析。结果表明, 多样性间栽系统中水稻根际共检测到土壤细菌37门116纲244目384科689属, 绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)为主要细菌优势类群, 相对丰度均在15%以上。Alpha多样性分析显示, 高防效组合在间栽条件下可显著提高水稻根际细菌群落香农指数和Chao1指数(<0.05), 而低防效组合无差异(>0.05)。ANOSIM及PCoA分析发现, 净栽条件下各品种根际细菌群落结构差异显著(= 0.48,<0.01), 间栽后高防效组合和低防效组合根际细菌群落结构无显著差异(>0.05), 即间栽增加了组配品种间细菌群落结构的相似性。细菌优势类群组成结果表明, 与净栽相比高防效组合中汕优63根际中酸杆菌门(Acidobacteriota)相对丰度显著降低, 放线菌门(Actinobacteriota)和厚壁菌门(Firmicutes)显著上升, 黄壳糯各优势菌门无显著差异; 低防效组合中合系39根际中Patescilbacteria显著下降, 黄壳糯芽单胞菌门(Gemmatimonadota)显著上升。PICRUSt2功能预测表明, 间栽系统中主栽品种次生代谢产物的合成相对丰度显著下降, 间栽品种转录、辅酶和维生素的代谢相对丰度显著上升。综上, 高防效组合通过混合间栽, 能改善水稻根际菌群多样性、细菌群落结构及功能, 从而有效降低稻瘟病病害发生, 为利用改良土壤微生物提高植物抗病性提供应用途径和多样性间栽防治病害理论提供数据支撑。
水稻; 多样性混合间栽; 高通量测序; 细菌群落; 细菌多样性; 功能预测
水稻()作为最重要的粮食作物之一, 为世界半数以上人口提供主食[1]。由子囊真菌引起的稻瘟病, 是制约水稻高产稳产的重要因子, 依靠大量化学农药能有效控制稻瘟病发生, 但使用不当不仅造成农业生态环境的严重污染, 而且会导致水稻品种产生抗药性, 对粮食安全和农业可持续发展造成威胁, 也会给人类健康带来直接影响且存在长期隐患[2-5]。通过提高系统内生物多样性水平, 可有效控制病害流行[6]。利用水稻混合间栽技术, 提高农田生态系统的生物多样性, 既能有效降低稻瘟病发生, 还能有效抑制其传播及扩展, 减少农药使用, 自然达到抗病稳产与可持续发展的效果, 可作为绿色农业和生态农业的重要举措[7]。
关于水稻多样性间栽控制病害地上部分机理已有丰富的理论基础, 如稀释效应[8]、物理阻隔[9]、微生态效应[10]和营养生理[11]等, 但混合间栽导致的土壤微生物群落结构变化对水稻抵御病害的作用了解仍然有限。大量研究表明, 植物根部的一部分微生物能促进植物生长, 帮助植物根部更好地吸收养分[12-13]。有益的根际细菌能帮助抵御病原菌的侵入、提高寄主的抗病性。另外, 根际微生物还可以刺激宿主免疫系统, 诱导系统性抗性抑制病害发生[14]。同时, 通过间栽改变根际微生物多样性及群落结构, 从而减轻病害发生的例子也屡见不鲜[15-17]。譬如, 烟草与万寿菊间栽, 可显著提高烟草根际微生物群落多样性, 有效降低烟草青枯病发生[18]。不同水稻根际微生物存在差异[19], 与单一品种种植相比, 多样性混合间栽以一定的比例种植不同水稻品种, 由于根系间接触频繁并相互影响, 可能导致水稻根际微生物的多样性水平发生变化。另外, 间栽系统中水稻感病品种与抗病品种搭配种植时, 其根际微生物结构与功能的改变, 可能会提高感病品种抵御病害的能力。目前有关多样性混合间栽对水稻根际细菌群落结构与功能的报道尚处于空白阶段。因此, 以水稻多样性混合间栽为例, 开展种内间栽对根际微生物相关因子的变化研究, 不仅可以揭示不同水稻品种间栽对根际微生物的影响, 还可以补充通过多样性混合间栽控制水稻病害的微生物作用原理。
为此, 本研究利用Illumina Hiseq测序技术分析净栽和间栽下各品种水稻的根际土壤微生物多样性和群落组成, 比较不同栽培模式下根际土壤微生物群落的变化, 探明不同间栽组合对根际微生物多样性和群落组成影响差异, 并结合稻瘟病防治效果, 探究抑制稻瘟病发生的关键因素, 为揭示抑制稻瘟病发生的根际微生态机制以及研发稻瘟病绿色防控技术提供理论支撑。
1 材料与方法
1.1 试验设计
于2020年在云南省建水县高营村(23°36′08′′N, 102°46′04′′E)进行。根据水稻多样性混合间栽3年田间试验数据, 选择抗稻瘟病现代品种汕优63和合系39作为主栽品种, 感稻瘟病传统品种黄壳糯作为间栽品种。试验采用完全随机区组设计, 共设置5个处理: 汕优63净栽(Mono_SY63)、合系39净栽(Mono_HX39)、黄壳糯净栽(Mono_HKN)、黄壳糯||汕优63 (Mix1_HKN/SY63)和黄壳糯||合系39 (Mix2_HKN/HX39), 各处理进行3次重复。小区设计如图1所示, 多样性混合间栽种植: 主栽品种每2列为一组, 组内株距为13.33 cm, 组间株距为26.67 cm, 行距为16.67 cm, 之后在每2组的中间一列种植间栽品种。主栽品种单作: 单作品种每2列为一组, 组内株距为13.33 cm, 组间株距为26.67 cm, 行距为16.67 cm。间栽品种单作: 单作方式与主栽品种单作方式完全相同。2个单作小区为一个整体, 同一组合的多样性混合间栽小区和单作小区相邻。并在田块四周设置2行诱发行, 诱发行种植当地黄壳糯以利于稻瘟病发生。各小区水肥管理措施保持一致, 不使用生长调节剂, 全生育期防治虫害而不防治病害, 采取有效措施防止鸟害。
1.2 根际土壤样品收取及病害调查
参考Zhang[19]的方法收取水稻根际土样。于水稻抽穗初期收取根际土壤样品, 将图1标注取样点中的水稻根系完整拔出, 摇动根系去除大块土壤, 剪取2~3个分蘖的全根于装有35 mL 1×PBS溶液的离心管中, 摇晃至根际土壤脱离后, 弃去水稻根系并将剩余液体置于–80℃保存。
水稻孕穗期、黄熟期分别调查试验品种叶瘟、穗颈瘟发生情况, 稻瘟病调查标准按照中华人民共和国国家标准(GB/T 15790-2009)的5级分级标准执行。
1.3 DNA抽提和PCR扩增
利用E.Z.N.A. soil DNA kit (OMEGA, 美国)试剂盒进行微生物群落总DNA抽提, 利用1%琼脂糖凝胶电泳和NanoDrop 2000 (Thermo Scientific, 美国)分光光度仪检测DNA含量和纯度; 使用338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因V3~V4可变区进行PCR扩增[20], PCR反应体系为: 5× TransStart FastPfu缓冲液4 μL, 2.5 mmol L–1dNTPs 2 μL, 上游引物(5 μmol L–1) 0.8 μL, 下游引物(5 μmol L–1) 0.8 μL, TransStart FastPfu DNA聚合酶0.4 μL, 模板DNA 10 ng, 补足至20 μL。每个样本3个重复, 扩增程序如下: 95℃预变性3 min, 27个循环(95℃ 变性30 s, 55℃退火30 s, 72℃延伸30 s), 然后72℃延伸10 min, 最后4℃保存(PCR仪, ABI GeneAmp 9700型)。

图1 水稻种植模式及取样点示意图
a: 水稻混合间栽示意图; b: 水稻净栽示意图; c: 水稻种植小区示意图。空心圆为主栽品种, 实心圆为间栽品种, 方框为根际土壤取样点; SY63: 汕优63; HX39: 合系39; HKN: 黄壳糯。
a: diagram of mixture intercropping of rice; b: diagram of monoculture of rice; c: diagram of the paddy experiment plot. Hollow circles are main cultivars, solid circles are intercropping cultivars; boxes are rhizosphere soil sampling points. SY63: Shanyou 63; HX39: Hexi 39; HKN: Huangkenuo.
1.4 高通量测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences公司)进行回收产物纯化, 2%琼脂糖凝胶电泳检测, 并用Quantus Fluorometer (Promega, 美国)对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库: (1) 接头链接; (2) 使用磁珠筛选去除接头自连片段; (3) 利用PCR扩增进行文库模板的富集; (4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司)。
1.5 数据处理
使用fastp软件[21]对原始测序序列进行质控, 使用FLASH软件进行拼接: 过滤掉低质量reads, 随后根Barcode序列将reads拆分并截去引物序列和Barcode标签, 得到原始数据(raw reads), 再通过去除嵌合体序列处理, 最终得到有效数据(clean reads)使用UPARSE软件, 根据97%的相似度对序列进行 OTU 聚类并剔除嵌合体[22]。利用RDP classifier对每条序列进行物种分类注释, 比对Silva 16S rRNA数据库(v138), 设置比对阈值为70%。
通过数据分析软件SPSS 18.0对供试水稻品种的田间病情指数进行方差分析; 使用OriginPro 9.1对田间病情指数绘制柱状图。
使用Mothur (http://www.mothur.org/wiki/Schloss_ SOP#Alpha_diversity)进行Alpha指数分析; R语言vegan包进行ANOSIM分析; 利用FastUniFrac (http://UniFrac.colorado.edu/)分析得到样本间Bray- Curtis距离矩阵并使用R语言绘图。R语言stats包进行组间显著差异物种分析。使用Galaxy网站进行PICRUSt2功能基因预测分析。
2 结果与分析
2.1 田间不同多样性间栽组合对稻瘟病防效存在差异
图2显示, 3个供试品种田间稻瘟病抗性存在显著差异, 并且不同多样性混合间栽组合对稻瘟病防效也存在差异。黄壳糯叶瘟病情指数(leaf blast disease index, LDI)为38.46, 穗颈瘟病情指数(panicle blast disease index, PDI)为15.69, 汕优63 LDI、PDI分别为1.06、0.93, 合系39 LDI、PDI分别为0.24、0.20。因此, 可将间栽品种黄壳糯视为田间感病品种,主栽品种汕优63及合系39视为田间抗病品种。黄壳糯与汕优63间栽, 其LDI显著下降至13.18(<0.05), 防效达65.73%, PDI显著下降至8.48(<0.05), 防效为54.48%, 而间栽与否对汕优63无显著影响(>0.05)。黄壳糯与合系39的间栽组合中, 无论是黄壳糯还是合系39, 与净栽相比LDI和PDI都没有显著变化(>0.05)。因而, 我们将黄壳糯||汕优63定义为田间稻瘟病高防效组合(Mix1), 黄壳糯||合系39定义为田间稻瘟病低防效组合(Mix2)。
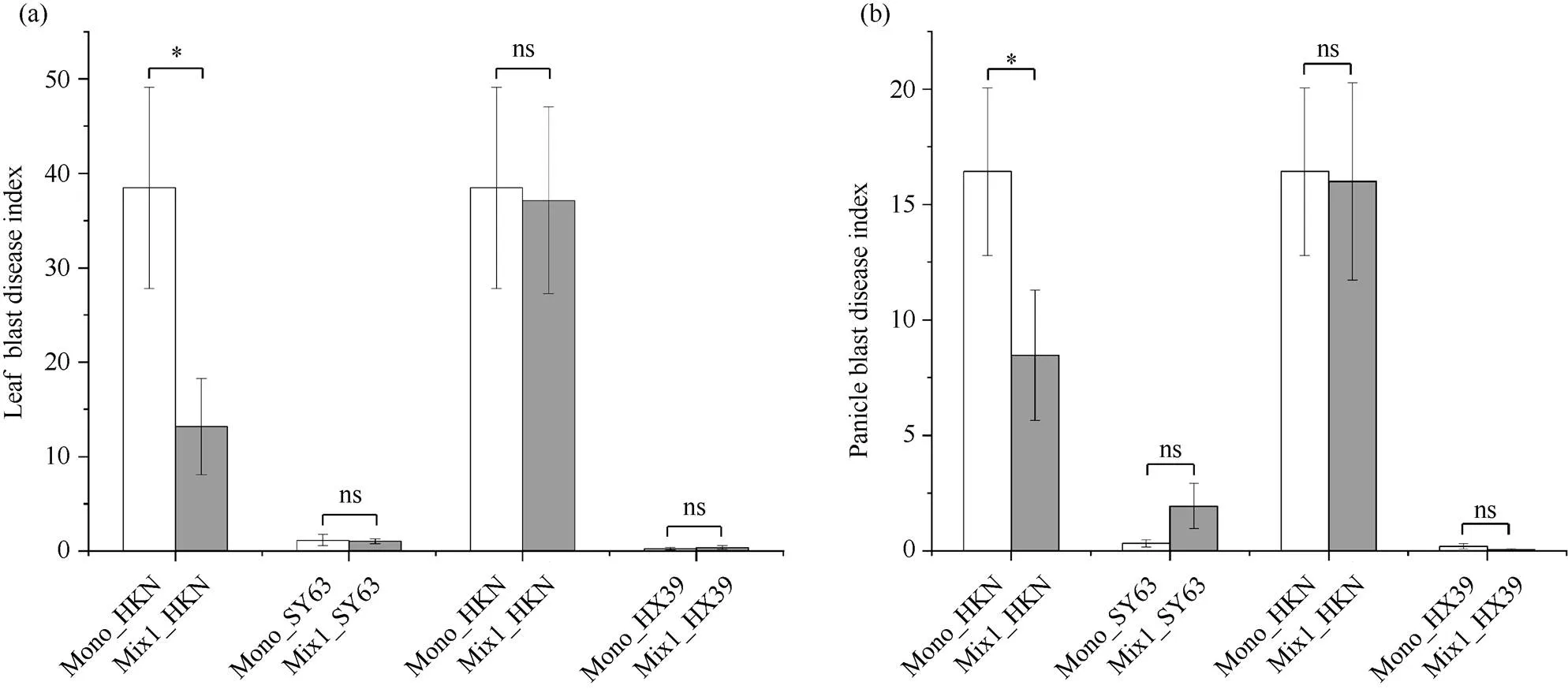
图2 不同间栽组合稻瘟病病情指数
a: 叶瘟病情指数; b: 穗颈瘟病情指数。Mono: 净栽处理; Mix1: 黄壳糯||汕优63; Mix2: 黄壳糯||合系39; “_”后为品种名称; 缩写同图1。*:< 0.05;ns: 差异不显著。
a: leaf blast disease index; b: panicle blast disease index. Mono: monoculture; Mix1: HKN||SY63; Mix2: HKN||HX39. “_” followed by the variety name. Abbreviations are the same as those given in Fig. 1. *:< 0.05; ns: no significance.
2.2 根际土壤细菌群落Alpha多样性分析
通过对7个根际土壤样本细菌16S rRNA的V3~V4区测序, 结果显示所获细菌优化序列数范围为41,566~57,114, 统计各土壤样品的Alpha多样性指数于表1。此外, 各样品覆盖率均大于97%, 说明本研究获得的细菌序列覆盖度较好, 其测序深度可以满足细菌群落结构组成及多样性分析。
细菌群落结构多样性结果表明, 高防效组合能够显著提高间栽品种黄壳糯根际细菌群落丰富度和均匀度, 其香农指数和Chao1指数分别由间栽前的6.75、4879.60显著上升至6.90、5465.00 (<0.05)。而对主栽品种汕优63的根际细菌群落多样性无明显影响。尽管低防效组合对黄壳糯与合系39根际细菌群落多样性均无显著影响(>0.05), 但是仍然呈现间栽可以提高两者香农指数和Chao1指数的趋势。因此, 间栽处理在一定程度上可提高水稻根际细菌多样性, 并且不同间栽组合对水稻根际细菌多样性影响存在差异。
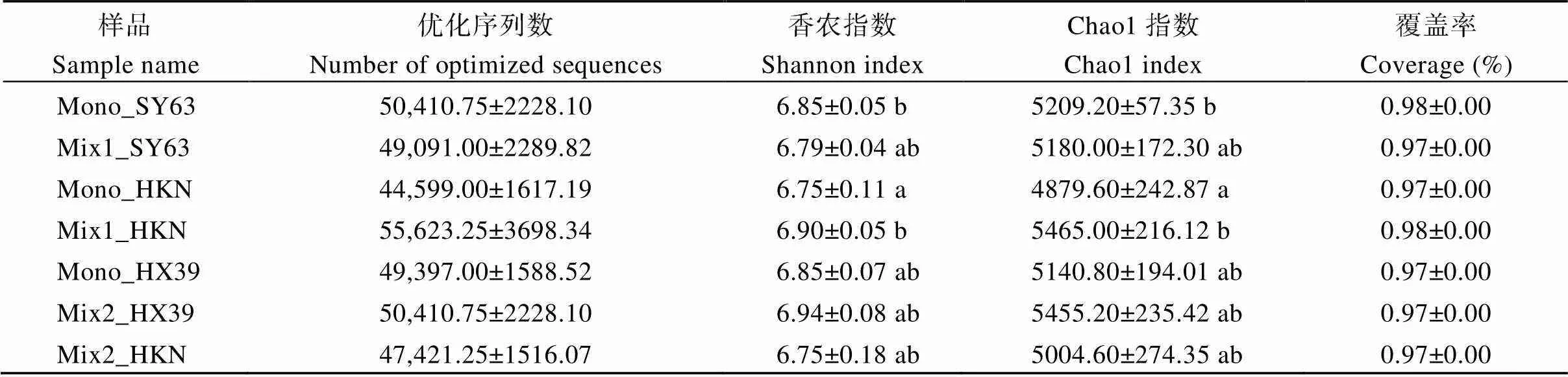
表1 各样品优化序列及Alpha多样性指数
缩写同图1和图2。同列不同字母表示在0.05概率水平差异显著。
Abbreviations are the same as those given in Figs. 1 and 2. Different lowercase letters in the same column indicate significant difference at the 0.05 probability level.
2.3 根际土壤细菌群落Beta多样性分析
相似性分析(ANOSIM)表明, 不同水稻品种根际细菌群落结构间存在极显著差异(= 0.48,<0.01)。基于OTU的微生物群落主坐标分析(PCoA)显示, 在第1主成分PC1 (差异解释率为28.77%)上合系39与汕优63、黄壳糯分离, 第2主成分PC2 (差异解释率为20.42%)上黄壳糯与合系39分离, 与汕优 63根际细菌群落未分离(图3-a)。对于不同间栽组合(图3-b~e), 汕优63与黄壳糯根际细菌群落结构无显著差异(= 0.25,>0.05), 两者间栽后同样不存在差异(= –0.05,> 0.05)。合系39与黄壳糯根际细菌群落结构间存在显著差异(= 0.76,<0.05), 间栽后二者无显著差异(= 0.30,>0.05)。综上, 相较于合系39, 汕优63根际细菌群落结构与黄壳糯更为接近, 并且多样性间栽后不同品种水稻根际细菌群落会相互影响, 两者根际细菌群落结构差异减小, 甚至趋于一致。
2.4 根际土壤细菌群落组成及差异微生物分析
从门的分类水平看, 3个供试水稻品种细菌群落组成相似(图4-a)。主要包含绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、脱硫菌门(Desulfobacterota)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、黏球菌门(Myxococcota)、Patescibacteria、芽单胞菌门(Gemmatimonadota)、疣微菌门(Verrucomicrobiota)、硝基螺旋菌门(Nitrospirota)、扁平菌门(Planctomycetota) 13个细菌门, 约占全部细菌丰度的96%以上。其中, 3个供试水稻品种根际细菌群落优势菌门中拟杆菌门、芽单胞菌门相对丰度存在显著差异(<0.05)。
差异分析结果如图4-b~e所示, 与净栽相比高防效组合中汕优63根际酸杆菌门相对丰度显著降低3.54%, 放线菌门和厚壁菌门分别显著上升3.69%、2.51% (<0.05), 黄壳糯各优势菌门无显著差异; 低防效组合中合系39根际Patescilbacteria显著下降1.05%, 黄壳糯芽单胞菌门显著上升0.48% (<0.05)。
如图5-a所示, 相对丰度前10的优势菌目为伯克氏菌目(Burkholderiales)、厌氧绳菌目(Anaerolineales)、根瘤菌目(Rhizobiales)、分枝杆菌目(Corynebacteriales)、Vicinamibacterales、SJA-15、Gaiellales、纤线杆菌目(Ktedonobacterales)、酸杆菌目(Acidobacteriales)和互营杆菌目(Syntrophobacterales)。3个供试水稻品种根际细菌群落优势菌目中厌氧绳菌目存在显著差异。
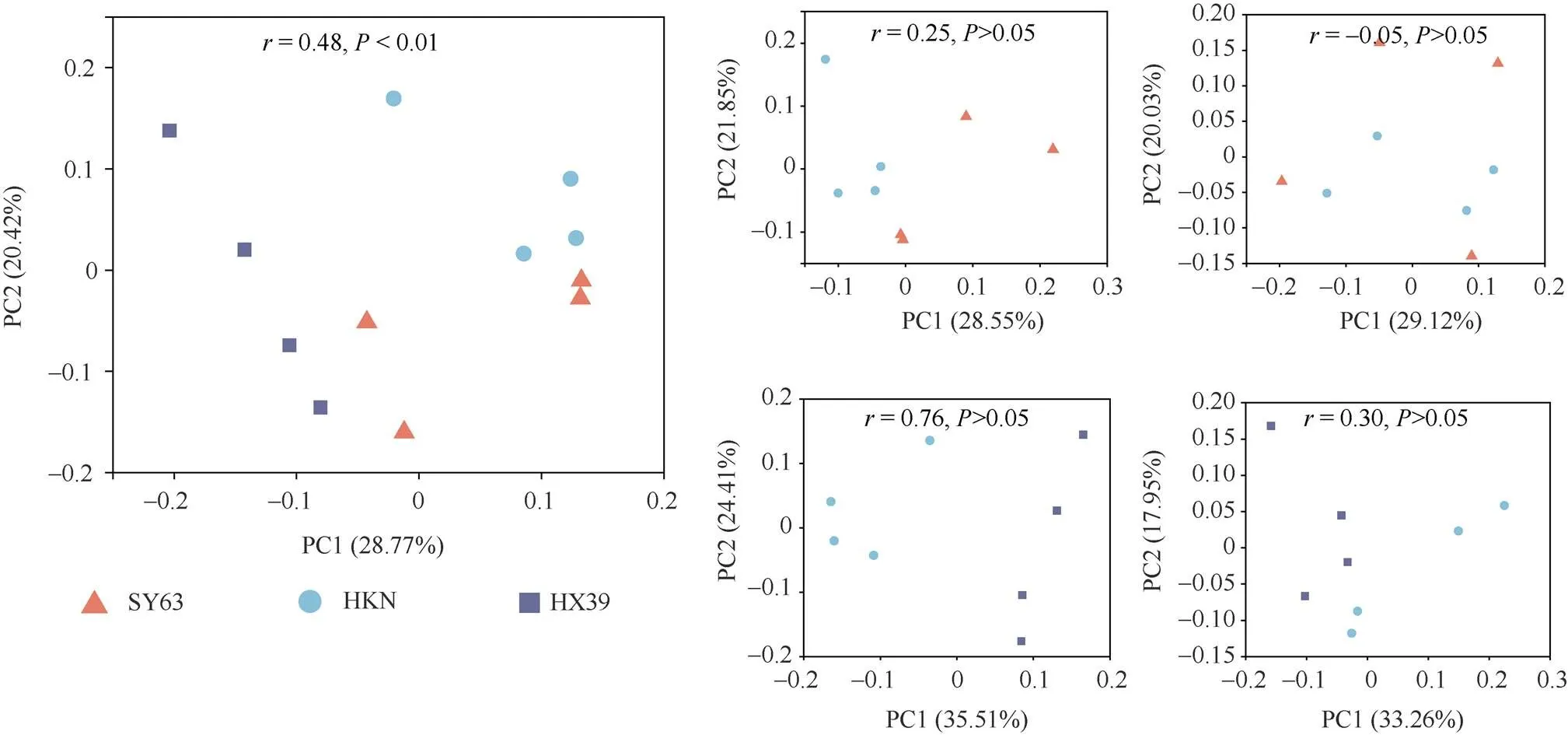
图3 根际细菌群落结构PCoA及ANOSIM分析
a: 3个品种水稻净栽处理; b: 汕优63与黄壳糯净栽处理; c: 汕优63与黄壳糯间栽处理; d: 合系39与黄壳糯净栽处理; e: 合系39与黄壳糯间栽处理; 缩写同图1。
a: the monoculture treatments for three varieties in rice; b: the monoculture treatments of SY63 and HKN; c: the intercropping treatment of SY63 and HKN; d: the monoculture treatments of HX39 and HKN; e: the intercropping treatment of HX39 and HKN. Abbreviations are the same as those given in Fig. 1.

图4 优势菌门及其差异
a: 3个品种水稻净栽处理; b: 汕优63间栽处理; c: 与汕优63间栽的黄壳糯; d: 合系39间栽处理; e: 与合系39间栽的黄壳糯; 缩写同图1。*:< 0.05。
a: the monoculture treatments for three varieties in rice; b: SY63 intercropping treatment; c: HKN intercropped with SY63; d: HX39 intercropping treatment; e: HKN intercropped with HX39; Abbreviations are the same as those given in Fig. 1. *:< 0.05.
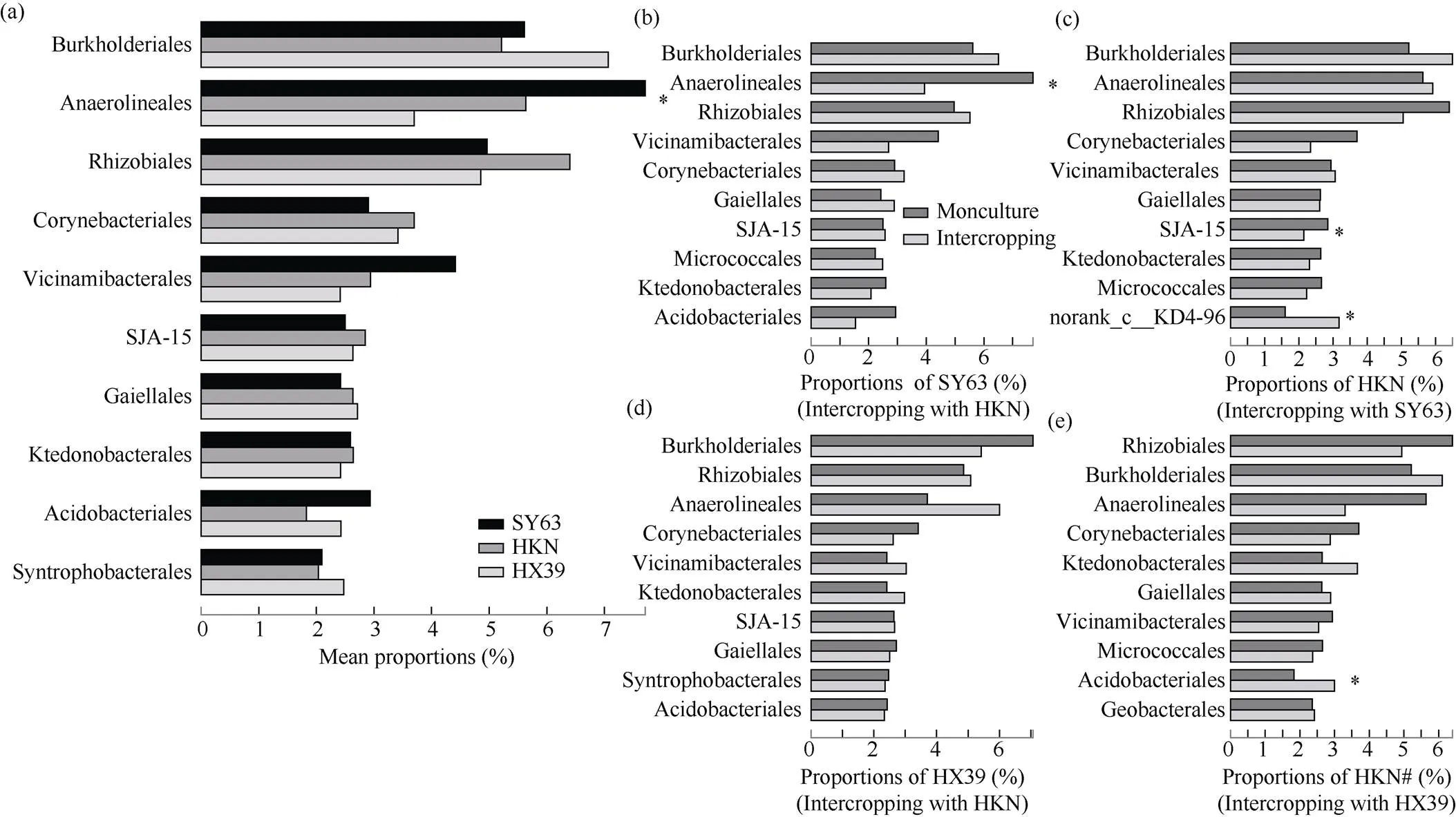
图5 优势菌目及其变化
a: 3个品种水稻净栽处理; b: 汕优63间栽处理; c: 与汕优63间栽的黄壳糯; d: 合系39间栽处理; e: 与合系39间栽的黄壳糯; 缩写同图1。*:< 0.05。
a: the monoculture treatments for three varieties in rice; b: SY63 intercropping treatment; c: HKN intercropped with SY63; d: HX39 intercropping treatment; e: HKN intercropped with HX39; Abbreviations are the same as those given in Fig. 1. *:< 0.05.
差异分析结果如图5-b~e所示, 与净栽相比高防效组合中汕优63根际厌氧绳菌目相对丰度显著降低3.77%, 黄壳糯根际SJA-15相对丰度显著降低0.70%, KD4-96 (绿弯菌门Chloroflexi未分类目)相对丰度显著上升1.58% (<0.05); 低防效组合中合系39根际优势菌目无显著变化, 黄壳糯根际酸杆菌目相对丰度显著上升1.17% (<0.05)。
综上所述, 不同品种水稻多样性混合间栽时, 其根际细菌群落会相互影响, 优势细菌类群相对丰度会更加接近邻近水稻植株, 两者细菌各门、目相对丰度更为接近。
2.5 根际土壤细菌功能预测
基于KEGG数据库, 通过PICRUSt2工具对16S的OTU信息进行功能预测, 共得到6个生物代谢通路, 去除有机系统和人类疾病等无关的功能基因后, 共包含22种二级(Level 2)功能分组。高防效组合中(图6-a, b), 相较于间栽前汕优63其他次生代谢产物的生物合成相对丰度显著下降(<0.05), 黄壳糯萜类和多酮类代谢、生物降解和代谢、脂质代谢的相对丰度显著下降(<0.05), 转录、折叠, 分类和降解、辅酶和维生素的代谢、能量代谢的相对丰度显著上升(<0.05)。低防效组合中(图6-c, d), 相较于间栽前合系39细胞活性、辅酶和维生素的代谢相对丰度显著下降(<0.05), 碳水化合物代谢的相对丰度显著上升(<0.05)。黄壳糯在转录、核苷酸代谢、辅酶和维生素的代谢相对丰度显著上升(<0.05)。
3 讨论
3.1 水稻品种的合理组配是抗病的关键
水稻多样性混合间栽, 作为一种可以减轻病虫害、增加单位面积产量的可持续栽培措施, 已经在生产应用中得到反复验证[7,23]。其中, 合理的品种组配是间栽系统控制稻瘟病的中心环节, 在我们的混合间栽系统中, 选择的主栽品种为抗病品种汕优63和合系39, 而与其搭配的品种为同一感病品种黄壳糯, 在这样的品种组配下, 尽管2个组合均使间栽感病品种黄壳糯的LDI和PDI呈下降趋势, 但在降低病害发生的程度上存在明显差异, 表现出汕优63与黄壳糯搭配控病效果好, 合系39与黄壳糯组合控病效果差。我们的结果与前人研究的水稻混合间栽田间试验的防治效果数据相互对应[24], Li等[25]也在不同作物搭配体系中发现不同品种组配, 其防效存在明显差异的相似报道。有研究表明, 群体内的遗传多样性或群落结构越丰富, 其对环境变化的适应能力就越强, 表现出抗病能力增强[6], 这说明造成抵御病害能力的差异, 不但与品种抗性和自身的遗传特性有关, 混合间栽系统的土壤微生物多样性和群体结构也不容忽视。

图6 KEEG预测功能基因在不同处理水稻根际细菌群落之间的差异
a: 汕优63; b: 与汕优63间栽的黄壳糯; c: 合系39; d: 与合系39间栽的黄壳糯; BOSM: 其他次生代谢产物的生物合成; EM : 能量代谢; MCV : 辅酶和维生素的代谢; LM : 脂质代谢; XBM : 生物降解和代谢; FSD : 折叠, 分类和降解; MTP : 萜类和多同类代谢; T : 转录; CAM : 碳水化合物代谢; CEM : 细胞活性; NM : 核苷酸代谢; *:< 0.05。
a: SY63; b: HKN intercropped with SY63; c: HX39; d: HKN intercropped with HX39. BOSM: biosynthesis of other secondary metabolites; EM: energy metabolism; MCV: metabolism of cofactors and vitamins; LM: lipid metabolism; XBM: xenobiotics biodegradation and metabolism; FSD: folding, sorting, and degradation; MTP: metabolism of terpenoids and polyketides; T: transcription; CAM: carbohydrate metabolism; CEM: cell motility; NM: nucleotide metabolism; *:< 0.05.
3.2 水稻根际细菌群落多样性与水稻抗稻瘟病能力密切相关
土壤微生物群落多样性对于土壤生态及作物健康至关重要, 当根际微生物结构合理, 多样性水平越高, 作物抗病能力就越强[26]。与其他作物相同, 提高水稻根际微生物群落多样性, 可以增加其对多种病害的抗性[27-28]。Alpha多样性分析显示, 间栽处理可提高水稻根际细菌群落Alpha多样性水平, 由于汕优63和合系39基因型不同, 根系分泌物谱存在差异, 塑造出不同的根际微环境, 致使根际微生物数量及种类发生特定变化, 改善感病水稻品种抗稻瘟病能力, 从而导致黄壳糯LDI和PDI下降。此外, 高防效组合在抑制病害发生, 提高间栽品种根际细菌群落多样性方面表现更为突出。汕优63根际细菌Alpha多样性显著高于黄壳糯, 而合系39根际细菌Alpha多样性与黄壳糯无显著差异, 这可能是导致不同多样性混合间栽组合中间栽品种抗病水平出现差异的原因。ANOSIM和PCoA分析表明, 多样性混合间栽能改变水稻根际细菌群落结构, 黄壳糯间栽后根际细菌群落结构出现显著变化, 与主栽品种根际细菌群落结构相似, 说明黄壳糯间栽后具有与主栽品种相似的根际细菌群落结构, 这可能是黄壳糯表现出抗病能力的原因。值得注意的是, 低防效组合中主栽品种根际细菌群落结构出现显著变化, 而高防效组合却未出现显著变化, 因此主栽品种根际细菌群落稳定性可能与改善感病品种抗病能力相关。综上所述, 我们推测根际细菌群落Alpha多样性及其结构稳定性可能是影响作物抗病能力的关键。
3.3 混合间栽的优势菌门将严重影响水稻的生长和抗病性
根际微生物群落结构改善对植物抵御病原侵染同样有积极作用[29]。Zhou等[30]和郝海平等[31]的研究显示, 间栽处理可以显著改变根际微生物的群落结构。本研究基于高通量测序技术的研究结果显示, 3个供试水稻品种根际优势细菌门为变形菌门、绿弯菌门、放线菌门、酸杆菌门和脱硫菌门, 胡蓉等[28]和张静等[32]对稻田微生物群落的研究发现, 变形菌门、绿弯菌门、酸杆菌门、放线菌门、脱硫菌门和拟杆菌门是稻田内的优势群落, 本研究与这些研究结果的细菌群落主要构成类似。变形菌门是植物根际土壤中最丰富的菌群, 主要原因是其生长速度快, 且能充分利用植物根际分泌的各种物质[33]。
大量研究表明, 酸杆菌门的作用主要是降解植物残体多聚物[34]和参与铁循环[35-36], 放线菌能够分解纤维素和木质素, 丰富的放线菌有利于土壤中植物有机残体的分解[37], 厚壁菌门中大部分细菌主要是将多种碳源降解转化为小分子物质[38]。本研究高防效组合中, 主栽品种稻瘟病发病率有上升趋势, 可能是因为其根际放线菌门和厚壁菌门相对丰度显著上升而酸杆菌门相对丰度显著下降, 减弱了水稻生长必需物质的循环, 导致水稻正常生长受到一定阻碍, 降低其抗病性, 说明放线菌门和厚壁菌门相对丰度提高不能完全抵消酸杆菌门相对丰度下降所造成影响, 酸杆菌门可能在水稻根际微生物中扮演了不可缺少的角色, 后续相关研究可关注酸杆菌门内成员。高防效组合中间栽品种根际各优势菌门并无显著变化, 但是其稻瘟病发病率却显著降低, 可能是在更低分类水平才有显著变化。芽单胞菌门一般可以将各种糖分子转化为维生素[39], 王珂等[40]发现培养液中添加适量维生素, 可显著改善小麦生长状况, 提高小麦内源激素含量。因此, 在本研究低防效组合中, 间栽品种根际芽单胞菌门相对丰度的提高可能是其稻瘟病发病率呈现下降趋势的原因。
微生物群落结构的改变, 会导致微生物功能发生改变。本研究通过PICRUSt2进行功能预测, 高防效组合和低防效组合黄壳糯根际转录、辅酶和维生素的代谢相对丰度均显著上升, 而分类和降解、能量代谢的相对丰度仅在高防效组合中的黄壳糯根际中显著上升, 说明利用水稻多样性混合间栽, 可提高间栽品种根际微生物与代谢相关功能基因丰度以抵御逆境。此外, 分类和降解、能量代谢的相对丰度的变化很可能是导致高防效组合黄壳糯具有更高抗病性的主要因素。
通过合理组配间栽不同抗稻瘟病能力的品种, 可以提高土壤细菌群落多样性, 改善土壤质量, 进而增强水稻对稻瘟病的防治效果。
4 结论
合理组配不同抗稻瘟病能力的水稻品种,可提高土壤细菌群落多样性,有效改善水稻根际土壤环境。多样性混合间栽高防效组合能明显促进根际转录、辅酶和维生素的代谢、分类和降解、能量代谢等功能基因在感病品种根际土壤中的富集。因此,选择适合的多样性混合间栽组合是提高感病品种抗病能力的可行途径。
[1] Redoña E D. Rice Biotechnology for Developing Countries in Asia. Science City of Muñoz: NABC, 2004. pp 201–201.
[2] Talbot N J. On the trail of a cereal killer: exploring the biology of., 2003, 57: 177–202.
[3] Pennisi E. Armed and dangerous., 2010, 327: 804–805.
[4] Liu W D, Liu J L, Triplett L, Leach J E, Wang G L. Novel insights into rice innate immunity against bacterial and fungal pathogens., 2014, 52: 213–241.
[5] Fernandez J, Orth K. Rise of a cereal killer: the biology ofbiotrophic growth., 2018, 26: 582–597.
[6] Keesing F, Belden L K, Daszak P, Dobson A, Harvell C D, Holt R D, Hudson P, Jolles A, Jones K E, Mitchell C E, Myers S S, Bogich T, Ostfeld R S. Impacts of biodiversity on the emergence and transmission of infectious diseases., 2010, 468: 647–652.
[7] Zhu Y Y, Chen H R, Fan J H, Wang Y Y, Li Y, Chen J B, Fan J X, Yang S S, Hu L P, Leung H, Mew T W, Teng P S, Wang Z H, Mundt C C. Genetic diversity and disease control in rice., 2000, 406: 718–722.
[8] Van Bruggen A H C, Finckh M R. Plant diseases and management approaches in organic farming systems., 2016, 54: 25–54.
[9] 朱有勇. 遗传多样性与作物病害持续控制. 北京: 科学出版社, 2007. pp 364–385.
Zhu Y Y. Genetic Diversity for Corps Diseases’ Sustainable Management. Beijing: Science Press, 2007. pp 364–385 (in Chinese).
[10] 骆世明. 农业生物多样性利用的原理与技术. 北京: 化学工业出版社, 2010. pp 1–251.
Luo S M. Principles and Techniques of Agrobiodiversity Utilization. Beijing: Chemical Industry Press, 2010. pp 1–251 (in Chinese).
[11] Qin J H, He H Z, Luo S M, Li H S. Effects of rice-water chestnut intercropping on rice sheath blight and rice blast diseases., 2013, 43: 89–93.
[12] Trivedi P, Leach J E, Tringe S G, Sa T, Singh B K. Plant-microbiome interactions: from community assembly to plant health., 2020, 18: 607–621.
[13] Richardson A E, Simpson R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus., 2011, 156: 989–996.
[14] Rodriguez P A, Rothballer M, Chowdhury S P, Nussbaumer T, Gutjahr C, Falter-Braun P. Systems biology of plant-microbiome interactions., 2019, 12: 804–821.
[15] Jin X, Shi Y J, Wu F Z, Pan K, Zhou X G. Intercropping of wheat changed cucumber rhizosphere bacterial community composition and inhibited cucumber Fusarium wilt disease., 2020, 77: e20190005.
[16] Shi Y J, Wang J, Jin X, Wang Z L, Pan D D, Zhuang Y, Wu F Z, Zhou X G. Effects of intercropping of wheat on composition of cucumber seedling rhizosphere fungal community., 2019, 46: 97–106.
[17] Wu H M, Lin M H, Rensing C, Qin X J, Zhang S K, Chen J, Wu L K, Zhao Y L, Lin S, Lin W X. Plant-mediated rhizospheric interactions in intraspecific intercropping alleviate the replanting disease of., 2020, 454: 411–430.
[18] Li Y Y, Feng J, Zheng L, Huang J B, Yang Y, Li X H. Intercropping with marigold promotes soil health and microbial structure to assist in mitigating tobacco bacterial wilt., 2020, 102: 731–742.
[19] Zhang J Y, Liu Y X, Zhang N, Hu B, Jin T, Xu H R, Qin Y, Yan P X, Zhang X N, Guo X X, Hui J, Cao S Y, Wang X, Wang C, Wang H, Qu B Y, Fan G Y, Yuan L X, Garrido-Oter R, Chu C C, Bai Y.is associated with root microbiota composition and nitrogen use in field-grown rice., 2019, 37: 676–684.
[20] Xu N, Tan G C, Wang H Y, Gai X P. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure., 2016, 74: 1–8.
[21] Chen S F, Zhou Y Q, Chen Y R, Gu J. fastp: an ultra-fast all-in-one FASTQ preprocessor., 2018, 34: i884–i890.
[22] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads., 2013, 10: 996–998.
[23] 胡汉升, 宁万光, 徐畅, 余开会, 史洪中, 刘红敏. 水稻杂糯间作栽培防治稻瘟病的效果. 江苏农业科学, 2015, 43(4): 127–128.
Hu H S, Ning W G, Xu C, Yu K H, Shi H Z, Liu H M. Effectiveness of intercropping hybrids rice with glutinous rice for the control of rice blast., 2015, 43(4): 127–128 (in Chinese).
[24] Han G Y, Lang J, Sun Y, Wang Y Y, Zhu Y Y, Lu B R. Intercropping of rice varieties increases the efficiency of blast control through reduced disease occurrence and variability., 2016, 15: 795–802.
[25] Li Z F, Wang T, He C L, Cheng K L, Zeng R S, Song Y Y. Control of Panama disease of banana by intercropping with Chinese chive (Rottler): cultivar differences., 2020, 20: 432.
[26] 蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究. 土壤学报, 2016, 53: 305–310.
Cai Z C, Huang X Q. Soil-borne pathogens should not be ignored by soil science., 2016, 53: 305–310 (in Chinese with English abstract).
[27] 杨俊, 王星, 付丽娜, 汪娅婷, 刘棋, 苗新利, 王凡, 魏兰芳, 姬广海. 水稻条斑病抗感品种根际微生物群落结构和功能分析. 生态科学, 2019, 38(1): 17–25.
Yang J, Wang X, Fu L N, Wang Y T, Liu Q, Miao X, Wang F, Wei L F, Ji G H. Study on rhizosphere microbial community and functional diversity of different resistant rice varieties to rice leaf streak disease., 2019, 38(1): 17–25 (in Chinese with English abstract).
[28] 胡蓉, 郑露, 刘浩, 黄俊斌. 秸秆还田对水稻根际微生物多样性和水稻纹枯病发生的影响. 植物保护学报, 2020, 47: 1261–1269.
Hu R, Zheng L, Liu H, Huang J B. Effects of straw returning on microbial diversity in rice rhizosphere and occurrence of rice sheath blight., 2020, 47: 1261–1269 (in Chinese with English abstract).
[29] 杨阳, 姚槐应. 间作下根际微生物控制土传病害的研究进展. 武汉工程大学学报, 2021, 43: 381–390.
Yang Y, Yao H Y. Progress in control of soil-borne diseases by rhizosphere microorganisms under intercropping., 2021, 43: 381–390 (in Chinese with English abstract).
[30] Zhou L J, Wang Y J, Xie Z K, Zhang Y B, Malhi S S, Guo Z H, Qiu Y, Wang L. Effects of lily/maize intercropping on rhizosphere microbial community and yield ofvar.., 2018, 58: 892–901.
[31] 郝海平, 白红彤, 夏菲, 郝渊鹏, 李慧, 崔洪霞, 谢晓明, 石雷.茶-山苍子间作对茶园土壤微生物群落结构的影响. 中国农业科学, 2021, 54: 3959–3969.
Hao H P, Bai H T, Xia F, Hao Y P, Li H, Cui H X, Xie X M, Shi L. Effects of tea-intercropping on soil microbial community structure in tea plantation., 2021, 54: 3959–3969 (in Chinese with English abstract).
[32] 张静, 可文静, 刘娟, 王留行, 陈浩, 彭廷, 赵全志. 不同深度土壤控水对稻田土壤微生物区系及细菌群落多样性的影响. 中国生态农业学报, 2019, 27: 277–285.
Zhang J, Ke W J, Liu J, Wang L X, Chen H, Peng T, Zhao Q Z. Influence of water controlling depth on soil microflora and bacteria community diversity in paddy soil., 2019, 27: 277–285 (in Chinese with English abstract).
[33] 艾超, 孙静文, 王秀斌, 梁国庆, 何萍, 周卫. 植物根际沉积与土壤微生物关系研究进展. 植物营养与肥料学报, 2015, 21: 1343–1351.
Ai C, Sun J W, Wang X B, Liang G Q, He P, Zhou W. Advances in the study of the relationship between plant rhizodeposition and soil microorganism., 2015, 21: 1343–1351 (in Chinese with English abstract).
[34] Pankratov T A, Ivanova A O, Dedysh S N, Liesack W. Bacterial populations and environmental factors controlling cellulose degradation in an acidicpeat., 2011, 13: 1800–1814.
[35] Lu S, Gischkat S, Reiche M, Akob D M, Hallberg K B, Küsel K. Ecophysiology of Fe-cycling bacteria in acidic sediments., 2010, 76: 8174–8183.
[36] Coates J D, Ellis D J, Gaw C V, Lovley D R.gen. nov., sp. nov., a novel Fe(III)-reducing bacterium from a hydrocarbon-contaminated aquifer., 1999, 49: 1615–1622.
[37] Kanokratana P, Uengwetwanit T, Rattanachomsri U, Bunterngsook B, Nimchua T, Tangphatsornruang S, Plengvidhya V, Champreda V, Eurwilaichitr L. Insights into the phylogeny and metabolic potential of a primary tropical peat swamp forest microbial community by metagenomic analysis., 2011, 61: 518–528.
[38] Gu Y, Ding Y, Ren C, Sun Z, Rodionov D A, Zhang W W, Yang S, Yang C, Jiang W H. Reconstruction of xylose utilization pathway and regulons in Firmicutes., 2010, 11: 255.
[39] 徐佳迎, 周金蓉, 吴杰, 王珏, 程粟裕, 赵鸽, 蒋静艳. 磺胺二甲嘧啶对稻田土壤微生物的中长期效应. 农业环境科学学报, 2020, 39: 1757–1766.
Xu J Y, Zhou J R, Wu J, Wang J, Cheng S Y, Zhao G, Jiang J Y. Medium- and long-term effects of the veterinary antibiotic sulfadiazine on soil microorganisms in a rice field., 2020, 39: 1757–1766 (in Chinese with English abstract).
[40] 王珂, 杨玉爱, 袁可能. 维生素(B6, C, PP)对小麦生理特性及生长的影响. 科技通报, 1995, 11: 301–305.
Wang K, Yang Y A, Yuan K N. Effects of three vitamins on the growth and physiological properties in wheat., 1995, 11: 301–305 (in Chinese with English abstract).
Effects of diverse mixture intercropping on the structure and function of bacterial communities in rice rhizosphere
TANG Wen-Qiang1,**, ZHANG Wen-Long1,**, ZHU Xiao-Qiao1, DONG Bi-Zheng1, LI Yong-Cheng2, YANG Nan1, ZHANG Yao2, WANG Yun-Yue1,*, and HAN Guang-Yu1,*
1Key Laboratory of the Ministry of Education for Agricultural Biodiversity and Pest Management, Yunnan Agricultural University / State Key Laboratory for Bio-resource Protection and Utilization in Yunnan, Yunnan Agricultural University, Kunming 650201, Yunnan, China;2Honghe Academy of Agricultural Sciences, Mengzi 661100, Yunnan, China
In order to clarify the effects of mixture intercropping on the control of rice blast and the structure and function of the rhizosphere bacterial community, the 16S rRNA sequencing analysis of bacteria in rhizosphere soil of the selected high control efficiency (E=54.48%) (Shanyou 63/Huangkenuo) and low control efficiency (E=14.12%) combinations (Hexi 39/Huangkenuo) under the intercropping and monoculture treatments were performed with Illumina Hiseq sequencing technology. The results showed that soil bacteria, from 37 phyla, 116 classes, 244 orders, 384 families, 689 genera, were obtained in the intercropping system. Chloroflexi, Proteobacteria, and Actinobacteriota were the dominant bacterial groups. The relative abundance was higher than 15%. Alpha diversity analysis discovered that high-efficacy combination significantly increased the Shannon index and Chao1 index of rice rhizosphere bacterial community in intercropping conditions (<0.05), whereas there was no difference at>0.05 in low-efficiency combination. ANOSIM and PCoA analyses revealed that there was significant difference in the structure of the species in the rhizosphere bacterial community in monoculture (= 0.48,<0.01), but no significant difference in the rhizosphere bacterial community structure between the high- and low-efficiency combinations following intercropping (>0.05), which indicating that intercropping increased the similarity of bacterial community structure between both combinations. Comparison to monoculture, the dominant bacterial group composition proved that the relative abundance of Shanyou63 Acidobacteriota decreased significantly, while the relative abundance of Shanyou 63 Actinobacteriota and Firmicutes increased significantly, but there was no significant difference among the dominant bacteria in Huangkenuo. Hexi 39 rhizosphere Patescilbacteria exhibited the significant decrease in low-efficiency combinations, whereas Gemmatimonadota showed the significant increase. PICRUSt2 function prediction discovered that the relative abundance of biosynthesis of other secondary metabolites in the main cultivars decreased significantly in the intercropping system, while the relative abundance of transcription, metabolism of cofactors and vitamins in intercropping cultivars increased significantly. In conclusion, to increase plant disease resistance and to provide data support for the theory of diverse intercropping for disease control, the high-efficacy combination had the ability to improve the diversity of rice rhizosphere bacteria and the structure and function of bacterial community by mixture intercropping, which effectively reduced the occurrence of rice blast and provided an application pathway for the improvement of soil microorganisms.
rice (); mixture intercropping; high-throughput sequencing; bacterial community; bacterial diversity; functional prediction
10.3724/SP.J.1006.2023.22001
本研究由云南省基础研究计划项目(202201AT070265), 国家自然科学基金项目(31800451)和云南省“高层次人才培养支持计划”青年拔尖人才专项(YNWRQNBJ2020296)资助。
This study was supported by the Yunnan Fundamental Research Projects (202201AT070265), the National Natural Science Foundation of China (31800451), and the “High-level Talent Training Support Program” Specialized Project for Young Top Talents in Yunnan (YNWRQNBJ2020296).
韩光煜, E-mail: hanguangyu9745@163.com; 王云月, E-mail: 1371209436@qq.com
**同等贡献(Contributed equally to this work)
唐文强, E-mail: 1092297272@qq.com
2022-01-02;
2022-09-05;
2022-09-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220920.0938.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
