黄芪多糖通过PI3K/AKT/mTOR促进激素性骨质疏松症大鼠成骨细胞增殖
2023-02-25孙文星黄万新刘传慧陈建停
孙文星 黄万新 刘传慧 陈建停
郑州市骨科医院综合内外科,河南 郑州 450015
骨质疏松症是一种全身代谢性疾病,伴有骨丢失和与代谢异常相关的骨组织结构损伤[1]。糖皮质激素性骨质疏松症(glucocorticoid-induced osteoporosis,GIOP)是最常见的继发性骨质疏松症,主要表现为成骨细胞和破骨细胞共同维持骨形成和骨吸收之间的平衡。双膦酸盐被认为是GIOP最常用的药物[2],但双膦酸盐类药物也存在诸多不良反应,亟需探索更健康、更安全的治疗方案。
目前,天然药物是各种疾病的热门研究课题。黄芪是黄芪Astragalusmembranaceus(Fisch.)Bunge的干燥根,是一种用于中药的草本植物[3]。黄芪多糖是黄芪的有效成分,具有多种药理活性。黄芪多糖最近已被用于治疗骨质疏松[4]。Li等[5]发现黄芪多糖能有效缓解去卵巢大鼠氧化应激介导的骨质疏松症,与其调节FoxO3a/Wnt2/β-catenin通路的抑制有关。此外,黄芪多糖通过减少骨吸收和抑制破骨细胞生成对小鼠卵巢切除致骨质疏松症小鼠的骨丢失具有保护作用[6]。
总之,黄芪多糖能够抑制骨质疏松症,但黄芪多糖在GIOP中的作用尚未得到明确研究。PI3K/AKT/mTOR信号通路在包括GIOP在内的多种疾病中发挥重要作用[7]。Zhang等[8]发现PI3K/AKT/mTOR信号通路调节成骨细胞的增殖、迁移和侵袭。此外,Lin等[9]发现抑制转录的沉默信息调节因子1激活PI3K/AKT/mTOR信号通路,进一步增强成骨细胞的自噬,从而保护成骨细胞。
本研究通过PI3K/AKT/mTOR信号通路探讨黄芪多糖对GIOP的保护作用及相关机制。
1 材料与方法
1.1 试剂和主要耗材
黄芪多糖(≥98%,美国Selleck Chemicals公司);地塞米松磷酸钠(北京索莱宝生物工程有限公司);DMEM(南京森博生物科技有限公司);胎牛血清(北京索莱宝生物工程有限公司);β-甘油磷酸钠、骨形态发生蛋白、抗坏血酸(美国Sigma-Aldrich公司);PI3K/AKT/mTOR通路抑制剂LY294002(美国Selleck Chemicals公司);CCK-8试剂盒(南京建成工程技术有限公司);酶标仪(上海美谷分子仪器有限公司);碱性磷酸酶染色试剂盒(上海碧云天生物技术有限公司);单丹磺酰尸胺(Monodansylcadaverine,MDC)染色溶液(北京索莱宝生物工程有限公司);荧光显微镜(德国Leica公司);Rapid Gold BCA试剂盒(美国Thermo Fisher公司);PVDF膜(美国Thermo Fisher公司);一抗p-PI3K、p-AKT、p-mTOR、Beclin-1、p62和GAPDH以及辣根过氧化物酶标记的抗兔二抗IgG(英国Abcam公司);增强的化学发光液、iBrightTMFL1500gel成像系统(美国Thermo Fisher公司);DXA小动物骨密度仪(中国上海冉哲仪器设备有限公司)。
1.2 GIOP大鼠模型的建立
动物实验按照郑州市骨科医院伦理委员会关于实验动物饲养和使用的原则进行,动物伦理审查号为:ZZSGKYY20190031。将60只体重(220±25)g、6~7周龄的SD雌性大鼠随机分为5组。PBS组大鼠正常喂养,肌肉注射PBS缓冲液(与地塞米松磷酸钠等量);其他组大鼠以1 mg/kg的剂量每周两次肌肉注射地塞米松磷酸钠,建立GIOP模型[10],在胫骨近端测量骨矿物质密度(BMD),以确认模型已成功建立。大鼠常规喂养8周。然后,测量骨矿物质密度。用戊巴比妥钠(100 mg/kg)麻醉后处死大鼠,取所需组织。
1.3 含有黄芪多糖的血清制备
含有黄芪多糖的血清获自GIOP大鼠。GIOP大鼠分为3组,分别以5、10、15 μmol/L的黄芪多糖灌胃,每天2次,连续3 d。第4天,在给药后1 h后采集大鼠主动脉血样(将大鼠麻醉并固定在平板上。腹部消毒,切开皮肤暴露腹主动脉。使用采血针采集动脉血。离心后收集血清,过滤,-80 ℃保存)。
1.4 成骨细胞分化
BM-MSCs获自上海复盛实业有限公司并被诱导分化为成骨细胞。传代后将BM-MSCs接种到96孔板中,密度为1×104/cm2。诱导培养基的成分主要包括DMEM,10-8mol/L地塞米松,20 mL/L胎牛血清,50 mmol/L β-甘油磷酸钠、25 μL骨形态发生蛋白和50 μmol/L抗坏血酸。每4天更换一次诱导培养基。在第15天和第25天进行碱性磷酸酶(alkaline phosphatase,ALP)染色以鉴定成骨细胞。培养30 d后,观察细胞形态变化。当细胞质中出现蓝色和紫色颗粒时,认为成骨细胞分化成功,取细胞进行后续研究[16]。
1.5 细胞培养和分组
成骨细胞在含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基中培养。当融合度达到80%~90%时,将成骨细胞以4×105个细胞/孔的密度接种到96孔板中。然后对细胞进行处理,分为PBS组、模型组、黄芪多糖组、LY294002组、LY294002+黄芪多糖组。在PBS组中,PBS处理细胞作为对照。模型组细胞给予地塞米松(10-5mol/L)48 h。黄芪多糖(5、10、15 μmol/L)组在模型组细胞分别用含5、10、15 μmol/L黄芪多糖的血清培养48 h。在模型组治疗的基础上,LY294002组细胞用20 μmol/L PI3K/AKT/mTOR通路抑制剂干预48 h。LY294002+黄芪多糖组的细胞用20 μmol/L的LY294002和15 μmol/L含黄芪多糖的血清处理48 h。
动物分组:PBS组(注射PBS缓冲液);模型组(地塞米松肌注);LY294002组(GIOP大鼠模型腹腔注射PI3K/AKT/mTOR通路抑制剂LY294002);黄芪多糖组(GIOP大鼠模型口服黄芪多糖20 g/kg);LY294002+黄芪多糖组(GIOP大鼠模型肌注LY294002,黄芪多糖20 g/kg口服)。注射地塞米松磷酸钠1 h后,LY294002组大鼠腹腔注射PI3K/AKT/mTOR通路抑制剂,剂量为5 mg/(kg·d)[11]。黄芪多糖组大鼠口服黄芪多糖,剂量为20 g/(kg·d)[12-13];LY294002+黄芪多糖组大鼠腹腔注射PI3K/AKT/mTOR通路抑制剂,灌胃服用黄芪多糖。大鼠常规喂养并给药8周。
1.6 CCK-8
连续干预48 h后,用0.25%胰蛋白酶消化细胞,接种至96孔板,密度为5×103/孔。24 h后,更换新的DMEM培养基(含1% FBS),每孔加入10 μL CCK-8溶液。孵育4 h后,用酶标仪检测450 nm处的吸光度。
1.7 通过ALP染色检测细胞分化能力
连续干预48 h后,通过5-Bromo-4-Chloro-3-Indolyl Phosphate(BCIP)/Nitroblue tetrazolium chloride(NBT)ALP染色试剂盒检测细胞分化。然后将处理过的细胞接种到96孔板中,用PBS洗涤3次并用多聚甲醛固定。再用PBS洗涤3次后,将细胞与BCIP/NBT染色液混合,避光孵育30 min。然后弃去染料溶液,用蒸馏水洗涤细胞以终止反应。细胞用核固红染色液孵育3 min,PBS洗涤后显微镜下观察反应。
1.8 MDC染色
干预48 h后,细胞用0.25%胰蛋白酶消化1 min,然后接种到6孔板中。24 h后,将装有细胞的板放入培养箱中避光30 min。离心后,将细胞用1×洗涤缓冲液重新悬浮。然后收集90 μL细胞悬液并与10 μL MDC染色溶液在暗室中混合30 min。将细胞在800 g中离心5 min,用1×洗涤缓冲液洗涤,然后重新悬浮。将细胞悬液滴在载玻片上并密封。使用荧光显微镜(在355 nm和512 nm)观察染色结果。按照常规程序将组织制成石蜡切片,固定、包埋、脱水,然后按照试剂盒说明书进行染色。
1.9 蛋白质印迹
将细胞用预冷的PBS洗涤,然后与细胞裂解液混合后在冰上完全裂解。离心后获得蛋白质样品(组织样品在含有蛋白酶抑制剂的缓冲溶液中切成片,然后在液氮中研磨。离心10 min后,收集上清液用于后续实验)。通过Rapid Gold BCA 试剂盒对蛋白质进行定量分析。在10% SDS-GAGE中分离蛋白质进行电泳,然后转移到PVDF膜。在5%脱脂牛奶中密封1 h后,将膜与靶向p-PI3K、p-AKT、p-mTOR、Beclin-1、p62和GAPDH一抗在4 ℃过夜;TBST洗3次后,用辣根过氧化物酶标记的抗兔二抗IgG孵育1 h。然后将膜与增强的化学发光液一起孵育。使用iBrightTMFL1500gel成像系统和Image J软件对蛋白质条带进行灰度分析。结果显示为目标蛋白的灰度与内参GAPDH的比值。
1.10 测量骨密度
大鼠胫骨骨密度采用DXA小动物骨密度仪测定。大鼠保持仰卧位,后肢向外旋转。根据说明书扫描胫骨。
1.11 骨形态学分析
胫骨远端结构通过微型CT(SkyScan 1272,Bruker,Germany)测量。分析骨小梁间距(Tb.Sp)、骨小梁数(Tb.N)、骨小梁厚度(Tb.Th)和骨表面积与骨体积比(bone surface/bone volume,BS/BV)并绘制相应图表。具体操作按照CT操作手册进行。
1.12 统计学分析
数据采用SPSS 23.0软件进行分析。每个实验一式三份进行,结果以平均值±标准差表示。采用独立样本t检验分析两组间的差异,采用单因素方差分析结合LSD-t检验比较组间差异。P<0.05表示差异具有统计学意义。
2 结果
2.1 黄芪多糖增强成骨细胞增殖和分化能力
通过CCK-8和ALP染色法评价成骨细胞的增殖和分化能力。结果显示,与对照组相比,其余各组细胞增殖分化能力均降低(P<0.05)。此外,黄芪多糖治疗组细胞增殖分化能力较模型组增强(P<0.05)。同时,随着黄芪多糖用量的增加,细胞的增殖分化能力也增强,15 μmol/L处理的细胞增殖分化能力最强(图1)。
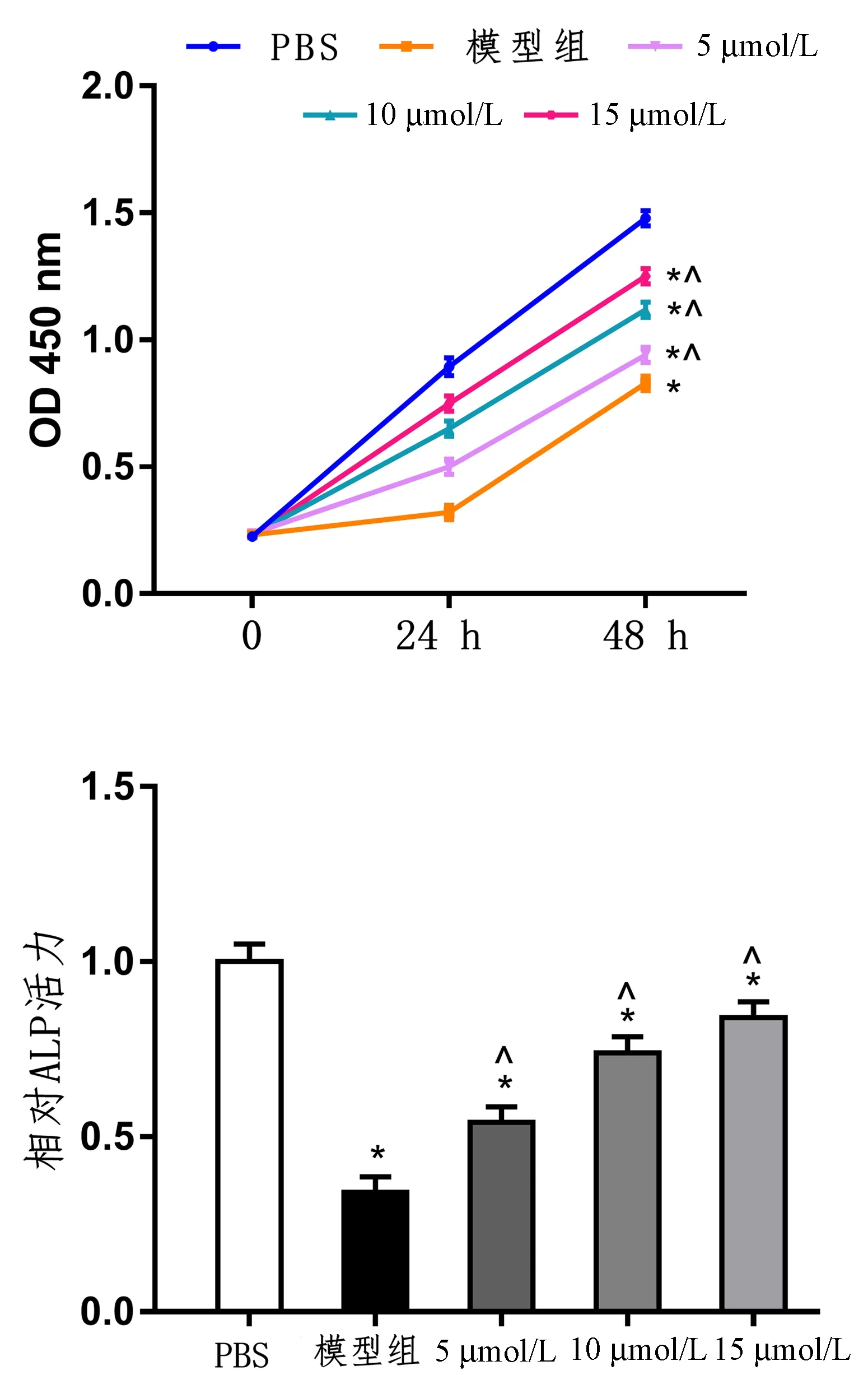
图1 不同组别黄芪多糖增强成骨细胞增殖和分化能力Fig.1 Astragalus polysaccharide enhances the proliferation and differentiation of osteoblasts注:与PBS组比较,*P<0.05;与模型组比较,^P<0.05。
2.2 黄芪多糖激活PI3K/AKT/mTOR信号通路
为进一步探讨黄芪多糖对成骨细胞的作用机制,采用Western blot检测PI3K/AKT/mTOR信号通路相关蛋白的表达。结果显示,与对照组相比,其他各组PI3K、AKT、mTOR蛋白表达,以及p-PI3k、p-AKT、p-mTOR蛋白表达均降低(P<0.05)。与模型组比较,黄芪多糖治疗组PI3K、AKT、mTOR蛋白表达无明显变化(P>0.05),而p-AKT、p-mTOR表达均升高(P<0.05)。此外,15 μmol/L黄芪多糖处理组增加最为明显(图2)。
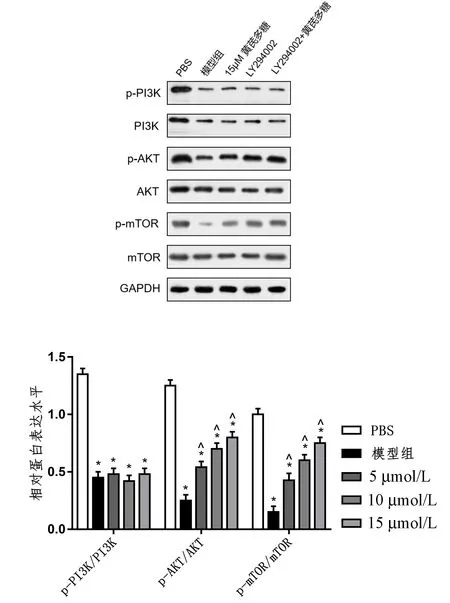
图2 黄芪多糖激活PI3K/AKT/mTOR信号通路Fig.2 Astragalus polysaccharide activates PI3K/AKT/mTOR signaling pathway注:与PBS组比较,*P<0.05;与模型组比较,^P<0.05。
2.3 黄芪多糖可能挽救了PI3K/AKT/mTOR信号通路抑制剂的作用
如图3所示,采用PI3K/AKT/mTOR信号通路抑制剂进一步探索黄芪多糖对成骨细胞的作用机制。与模型组相比,黄芪多糖处理组细胞增殖分化能力增强(P<0.05),而LY294002组结果正好相反(P<0.05)。与LY294002组相比,LY294002+黄芪多糖处理组细胞增殖和分化能力也增强(P<0.05),说明黄芪多糖部分逆转了PI3K/AKT/mTOR信号通路抑制剂的作用。
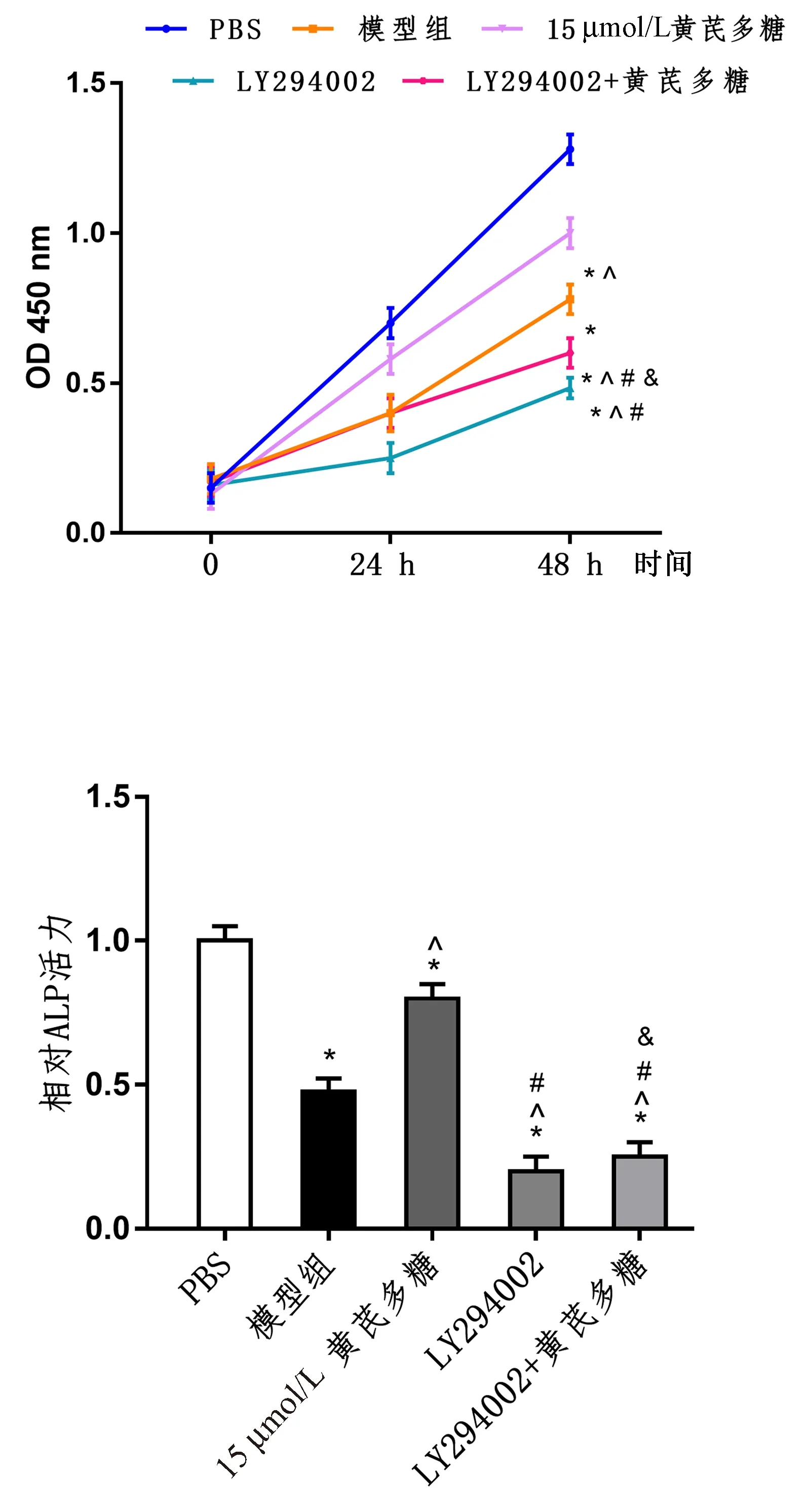
图3 黄芪多糖可能挽救了PI3K/AKT/mTOR信号通路抑制剂的作用Fig.3 Astragalus polysaccharide may rescue the effect of PI3K/AKT/mTOR signaling pathway inhibitor注:与PBS组比较,*P<0.05;与模型组比较,^P<0.05;与15 μmol/L黄芪多糖组比较,#P<0.05;与LY294002组比较,&P<0.05。
2.4 黄芪多糖诱导成骨细胞自噬
自噬是维持成骨细胞稳定状态的机制之一,因此还研究了黄芪多糖对成骨细胞自噬体形成以及自噬相关因子Beclin-1和p62表达的影响。MDC染色和Western blot结果显示,与模型组相比,黄芪多糖处理组阳性细胞率升高,自噬体数量增加,Beclin-1表达升高,p62表达降低(P<0.05)。同时,与模型组相比,LY294002组阳性细胞率降低,自噬体数量减少,Beclin-1表达降低,p62表达升高(P<0.05)。与LY294002组相比,LY294002+黄芪多糖处理组的Beclin-1表达更高(P<0.05)。见图4。
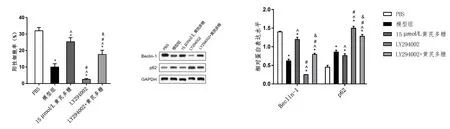
图4 黄芪多糖诱导成骨细胞自噬Fig.4 Astragalus polysaccharide induces autophagy in osteoblasts注:与PBS组比较,*P<0.05;与模型组比较,^P<0.05;与15 μmol/L黄芪多糖组比较,#P<0.05;与LY294002组比较,&P<0.05。
2.5 黄芪多糖改善GIOP大鼠的骨质疏松症
建立GIOP大鼠模型,分析骨密度和骨形态。结果显示,黄芪多糖处理组BMD、BS/BV、Tb.N、Tb.Th值高于模型组,Tb.Sp值低于模型组,LY294002组则相反(P<0.05)。与LY294002组相比,LY294002+黄芪多糖处理组上述指标被逆转,BMD、BS/BV、Tb.N、Tb.Th升高,Tb.Sp降低(P<0.05)。见图5。
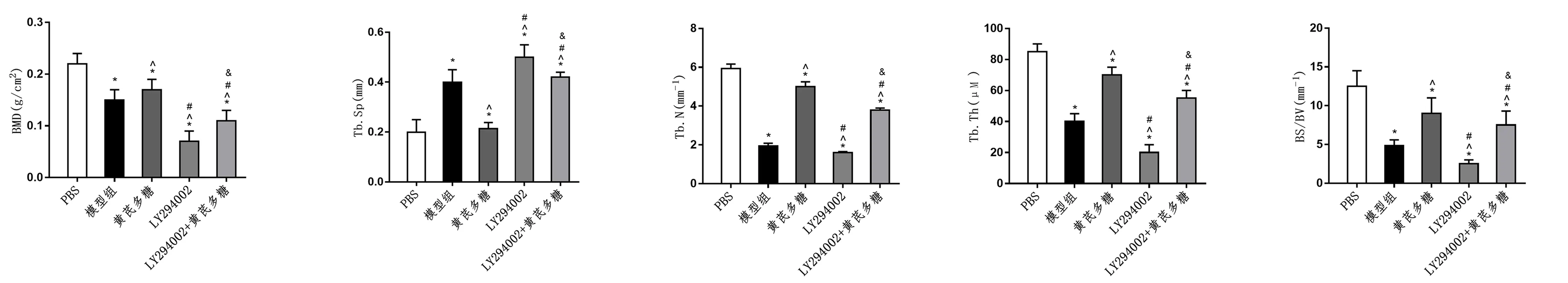
图5 黄芪多糖改善GIOP大鼠的骨质疏松症Fig.5 Astragalus polysaccharide relieves osteoporosis in GIOP rats注:与PBS组比较,*P<0.05;与模型组比较,^P<0.05;与黄芪多糖组比较,#P<0.05;与LY294002组比较,&P<0.05。
3 讨论
黄芪多糖关节腔注射治疗大鼠骨关节炎可促进退变软骨的修复。有研究发现黄芪多糖干预可以缓解小鼠软骨损伤,抑制了膝关节组织基质金属蛋白酶3和基质金属蛋白酶13水平,增加了蛋白聚糖和Ⅱ型胶原表达水平[14]。首先在细胞水平上分析了黄芪多糖的功能。结果表明,随着黄芪多糖剂量的增加,成骨细胞的增殖、分化能力和碱性磷酸酶活性均增加,表明黄芪多糖具有治疗GIOP的潜力。然后分析了黄芪多糖的相关机制。一些研究报道,地塞米松通过抑制PI3K/AKT信号通路抑制成骨分化[15]。其他一些研究指出,CS-NPs通过激活mTOR/ULK1通路诱导自噬来促进成骨细胞分化[16]。本研究中,黄芪多糖处理后与PI3K/AKT/mTOR相关的磷酸化和蛋白的表达增加,说明黄芪多糖处理激活了PI3K/AKT/mTOR信号通路。此外,成骨细胞的增殖分化能力和碱性磷酸酶活性均被通路抑制剂抑制,而通路抑制剂的抑制作用被黄芪多糖部分逆转。因此,笔者推测黄芪多糖通过激活PI3K/AKT/mTOR信号通路促进成骨细胞增殖和分化。
自噬是一种应激防御机制,通过降解受损细胞和细胞器形成自噬体来维持细胞的稳定状态[17]。据报道,自噬促进成骨细胞的形成和晚期成骨[18]。本研究发现成骨细胞自噬被黄芪多糖促进,而被PI3K/Akt/mTOR通路抑制剂抑制。黄芪多糖治疗部分逆转了通路抑制剂对自噬的抑制作用。因此,本研究表明黄芪多糖通过激活PI3K/AKT/mTOR信号通路促进成骨细胞自噬。骨质疏松症的主要特征是骨骼中大孔和不完整的骨骼结构,为体内实验构建了GIOP大鼠模型。骨密度测定和显微CT显示黄芪多糖治疗后BMD、BS/BV、Tb.N、Tb.Th值升高,Tb.Sp值降低,进一步证明黄芪多糖在GIOP中的作用。
综上所述,黄芪多糖通过激活PI3K/Akt/mTOR信号通路、促进成骨细胞自噬、促进增殖分化、增加骨密度等对GIOP的治疗具有价值。然而,该药物的作用机制非常复杂。除了本研究中提到的机制外,黄芪多糖达到治疗目的的其他机制也可能存在。因此,未来还将结合临床病例进一步探索其他机制。
