基因组稳定性影响水稻生长发育的机制综述
2023-02-24王梦娜刘康伟王冷静代强冯海洋张超于恒秀
王梦娜 刘康伟 王冷静 代强 冯海洋 张超 于恒秀


摘要:基因组包含生物体的全部遗传信息(部分病毒是RNA),维持染色体的结构、数目及遗传信息的相对稳定,是物种得以生存和延续的前提与保障。水稻作为重要的粮食作物之一,其基因组稳定是保障粮食生产和发展现代农业的重要前提。DNA损伤是一种危害性很高的损伤形式,及时、正确的修复是维持基因组稳定的基础。DNA损伤首先会激活DNA损伤反应(DDR),DDR一方面阻止受损细胞携带错误信息继续分裂,另一方面積极促进各种修复途径,如非同源末端连接(NHEJ)、同源重组(HR)和核苷酸切除修复(NER)等,这些修复途径相互协调,相互竞争。本文简述影响基因组稳定性的多种因素,重点是DNA损伤和修复的分子机制,以及在水稻生长发育过程中各关键基因对于维持基因组稳定的重要性,并探讨水稻基因组稳定性研究的未来方向。
关键词:水稻;基因组稳定性;DNA损伤;DSB修复
中图分类号:S336 文献标志码:A
文章编号:1002-1302(2023)23-0001-08
水稻(Oryza sativa L.)是世界上最主要的粮食作物之一,其产量约占世界粮食总产量的1/4,世界上有一半以上人口以水稻为主食。自1998年实施“国际水稻基因组测序计划(IRGSP)”到2004年完成水稻基因组序列全图绘制,水稻成为第1个完成全基因组测序的作物,也是继拟南芥之后第2个完成基因组测序的植物,高度准确和公开的IRGSP序列,为水稻基因组的功能研究打开了大门。利用基因组信息,我们可以了解自然界和农业生产中的各种表型变异是如何产生的。在此基础上,利用生物技术和分子育种技术,有望筛选出极端自然环境下基因组稳定性较高的品种,从而实现丰产、稳产、优质的目标;与此同时,影响基因组不稳定的机理也被缓缓揭开。
1 基因组稳定性对生物体具有重要作用
基因组(genome) 包含生物所有遗传物质的总和。每种生命形式的首要目标是将其遗传物质完整无缺地传递给下一代,积极维持基因组稳定性是个体生长发育的先决条件;基因组不稳定是导致生物体走向凋亡的重要因素。
已知酿酒酵母全基因组有6 275个基因,其中超过80%的预测基因是非关键基因,这些基因的存在表明基因组能够缓冲基因损伤对基因组稳定性的危害,而一些必需基因的缺失对酵母细胞来说是致命的;研究发现,有151个基因中任何1个缺失或者多个改变,都会引起基因组结构的变化或基因组不稳定性的产生[1-2]。如RecQ介导的基因组不稳定蛋白1(Rmi1),缺乏Rmi1的酵母细胞对羟基脲和其他遗传毒性物质过敏,自发DNA损伤频率增加,表现为Rad52病灶增加、染色体重排增加、DNA损伤检查点激酶Rad53活化不足。Rmi1与RecQ解旋酶Sgs1、拓扑异构酶Top3α形成STR复合物,可以解旋各种停滞或塌陷的复制叉引起的结构,这些复制叉多是由DNA变异引起的[3]。因此,这些必需基因及其产物可以保护基因组免受不稳定性因素的影响。
在人体细胞中,每天约有1013个细胞受到损伤,其中大多数细胞都能得到有效修复,但仍有部分未被及时修复或修复不正确,低水平的突变使个体之间自然变异,并导致进化[4-5]。然而突变也会导致人类疾病发生,包括以基因组不稳定性升高为代表的癌症。例如,在免疫球蛋白基因(Ig)中发现的胸腺嘧啶/鸟嘌呤碱基的高比例突变,引起慢性淋巴细胞白血病;在乳腺癌、卵巢癌、胰腺癌病例中发现大量较大片段的基因缺失,最终导致病变发生[6]。这些突变将会阻碍基因组复制及转录,导致基因组不稳定或严重突变的发生,从而威胁细胞甚至生物体的活力。
在植物中,基因和基因调控网络功能的多样化和完整性,是维持基因组稳定的决定因素,许多对细胞产生不利影响的因素终将被消除。玉米中大部分基因组由逆转录元素组成,由于反转录作用,基因组在进化过程中不断“壮大”,DNA双链断裂(DSB)修复过程将有助于基因组的“缩小”,以维持基因组稳定。SMC5/6复合物参与DNA双链断裂修复;在拟南芥中,SWI3B作为SWI/SNF复合体的一个亚基,与SMC5相互作用,促进SMC5与染色体的解离[7]。SWI3B的功能缺失或过表达,都会破坏SMC5在DSB上的募集以响应DNA损伤,通过影响DNA的修复过程,对基因组稳定产生威胁。
水稻基因组的稳定性体现在多个方面,如表观遗传是否变化、染色质结构是否改变、基因调控之间联系是否稳定等。基因组不稳定,不仅改变水稻的生长特性,更可能对其遗传发育进程产生影响,并且大多数是不利影响。因此,了解水稻基因组的稳定性,对水稻生长发育、抗逆抗病研究及发展现代育种意义重大。
2 影响基因组稳定的因素
2.1 DNA复制的随机误差
如同所有的天然化合物,DNA也经历自然衰变过程,如烷基化、氧化和脱氨。从分子水平上看,DNA十分稳定,能准确地复制和转录,但这种稳定性是相对的。DNA在复制过程中会出现误差,如基因结构上碱基对的组成或排列顺序改变,这些误差造成个体间的遗传学差异,是遗传多样性和自然选择的来源,因此突变有利于进化;但大多数基因突变会对生物体带来不利影响,除了引起病变外,还可能造成生物死亡等;在细胞正常生长过程中,DNA复制错误是基因组不稳定的主要来源[8]。
2.2 染色体的空间排列及结构
全基因组中被称为脆性位点(fragile site)的各个区域都容易发生染色体断裂,特别是当细胞处在快速分裂的压力下。有研究证实,DNA结构在共同脆性位点(CFS)中起着重要作用[9];基因组中的重复序列是内源性DNA损伤的主要来源,其中许多序列倾向于形成与B-DNA不同的二级结构,这些结构可以干扰复制、转录和DNA修复,导致基因组重排、形成染色体桥和染色体断裂[10]。此外,这些重复序列容易断裂(脆性)和不稳定(重复次数发生变化)。
转录过程会形成一个特殊结构,即R-loop,R-loop 是细胞内的一种特殊三链核酸结构(图1)。该结构大量存在于着丝粒周围的DNA、端粒、核糖体DNA以及转录起始和终止子附近,在 R-loop 形成过程中,暴露的单链DNA(ssDNA)可延伸至数百个碱基对,DNA极易受到损伤[11]。转录复制冲突(TRC)是基因组不稳定的另一个重要来源,由于DNA复制和RNA转录过程中使用相同的基因组作为模板,复制和转录同时存在时争夺相同的DNA模板,2种复合物之间的碰撞(无论是同向还是反向)导致复制叉折叠,诱导DNA复制叉停滞、DNA重组、DNA断裂和突变,从而导致基因组不稳定[12]。
2.3 物理化学因素影响基因组稳定性
物理和化学因素都会对DNA造成损伤。物理因素主要是各种放射源,如紫外线、X射线。紫外线会使DNA链中相邻的胞嘧啶与嘧啶交联,生成共价键。电离辐射(IR)可以通过对DNA糖骨架的直接高能损伤来诱导DSB,也可通过细胞中产生的自由基制造活性氧(ROS)来诱导DSB[13]。ROS是需氧生物细胞呼吸过程中电子传递链(ETC)的典型副产物,另外还来源于氧化酶分解代谢过程、合成代谢过程和过氧化物酶体代谢过程[14]。生物体具有精细的调节系统,可以保持非常低的ROS水平,即它们的产生和消除是平衡的,从而产生一定的稳态ROS水平。在低水平上,ROS执行重要的细胞功能,如在氧化还原信号传导反应中充当细胞信使等。高水平的ROS会损伤DNA,包括糖和碱基的氧化、链断裂和交联键。鸟嘌呤是最容易被氧化的碱基之一,它的氧化还原电位很低,8-氧代-7,8-二氢鸟嘌呤(8-oxoG)是最丰富和最具特征性的损伤之一,ROS的产生是对基因组稳定性的重要威胁[15]。
化学诱变剂包括烷化剂、碱基类似物等,烷化剂主要由厨房油烟、烟草烟雾、化工实验和医疗过程等产生,其能够在体内外或代谢活化后直接与DNA反应,如二烷基亚硝胺、甲磺酸乙酯、硫酸二乙酯、乙烯亚胺等,这些化学物质中的大多数表现出不同程度的致癌性和致突变性,并表现出化合物特异性结合模式[16-17]。碱基类似物是一类结构与碱基相似的人工合成物,如二氨基嘌呤、5-溴尿嘧啶等,这些物质进入细胞后能掺入到DNA链中与正常碱基竞争,取代其位置发生碱基替换或引起配对错误,进而产生突变。
2.4 各种胁迫引起基因组不稳定
植物在长期进化过程中与大自然和谐共生,随着自然环境的日益变化,植物在生长发育过程中频繁遭受不利因素的侵扰,按其来源可分为生物和非生物因素。生物胁迫多是由于植物遭受病虫害(主要包括害虫、病毒、细菌、真菌)的威胁,而非生物性胁迫则来自其生长环境,即逆境(less favorable environments),包括高温、低温、干旱、盐碱胁迫等。这些逆境极大限制了植物的分布,降低其生长和发育活性,并威胁基因组的稳定性[18]。
高温使水稻產生热应激,限制其生长和新陈代谢,并导致产量损失。植物在生殖阶段对温度更敏感,高温可以引起重组率和重组模式的变化,使轴蛋白聚集和突触形成失败,增加DNA修复过程的偏差,受精过程受损,最终导致败育[19]。在种子填充过程中,高温减缓了种子生长从而影响籽粒大小[20-21]。致力于抗热种质资源的寻找及发掘,探究耐热通路调控的机理,培育具有综合耐热能力的作物品种,在全球气温不断攀升的今天意义重大。
植物的另一关键威胁是盐胁迫,盐胁迫可导致植物产生渗透胁迫、离子胁迫和氧化胁迫。渗透胁迫在盐胁迫产生时立即发生,由水分利用率降低引起,涉及气孔关闭、叶片温度升高、细胞周期抑制和细胞凋亡。气孔关闭显著降低了光合作用,从而降低生物量和产量。细胞周期抑制、细胞凋亡也会抑制植物生长。当叶片中的盐分过量积累时产生离子胁迫,导致叶片衰老和过早脱落。由于能量传递和电子传递的限制,渗透胁迫、离子胁迫都会导致活性氧(ROS)的积累,从而造成DNA损伤,威胁植物基因组的稳定性。
物竞天择,适者生存。植物在漫漫时间长河中进化出复杂的防御系统,以适应多种逆境胁迫,维持自身基因组的稳定。
3 基因组稳定性与DNA损伤修复机制
DNA骨架断裂有单链断裂、双链断裂2种形式,根据细胞周期、遗传背景、DNA损伤类型,DNA修复途径主要有5种:核苷酸切除修复(NER)、碱基切除修复(BER)、错配修复(MMR),主要负责单链损伤(SSBs);非同源末端连接(NHEJ)、同源重组(HR),主要负责双链损伤(DSBs)。各种修复途径相互协调,共同维持基因组稳定[22]。
3.1 DNA单链断裂修复 (SSBR) 机制
细胞每天会遭遇到上万种不同的DNA损伤,其中单链断裂(SSBs)相对于双链断裂(DSBs)更加频繁,SSBR可以去除不同的DNA单链损伤[23]。主要有以下几种机制。
3.1.1 NER途径
核苷酸切除修复(NER)是一种多蛋白修复系统(图2),可切除大片段的DNA损伤,在紫外线诱导的损伤修复中至关重要[24]。NER在真核细胞中被研究得最充分,人类NER基因的缺陷导致光敏综合征,如着色性干皮病(XP)。
NER系统首先识别DNA双螺旋结构的扭曲,在全基因组NER修复(GG-NER)中,XPC是第1个到达病变的蛋白质因子,经过泛素化修饰,形成XPC-HR23B-CEN2复合物,增加其对DNA的亲和力。在转录偶联的核苷酸损伤修复(TC-NER)中,识别由CSB、CSA、XAB2促进,随后DNA双链局部展开,多亚基转录因子TFIIH通过XPC(在GG-NER中)或CSB、CSA(在TC-NER中)募集到损伤部位,TFIIH的XPB、XBD亚基分在DNA损伤附近处解旋,由此产生单链DNA(ssDNA),XPA和ssDNA结合蛋白RPA组成XPA复合物。RPA和XPA稳定开放结构,XPA招募异二聚体XPF-ERCC1核酸内切酶和XPG的核酸内切酶一起切除跨越病变的短寡核苷酸,至此,损伤片段从基因组中切除,留下单链间隙,最后以未受损的链为模板,由DNA聚合酶复合物(Polδ/κ/ε)进行修复受损单链[25-26]。通过这种方式,许多不同的病变可以由一组共同的酶来处理,因此,它具有高度通用性。
植物中包含所有NER蛋白的同系物,但损伤识别蛋白XPA除外。可能有相似性质的蛋白质替代XPA,以帮助在切除修复过程中招募和靶向关键的切除修复因子TFIIH和XPF[27]。
3.1.2 BER途径
碱基切除修复(BER)可处理由内源性或外源性因素诱导的各种DNA损伤。BER是一个复杂的过程(图2),目前在微生物和动物中得到广泛研究,但在植物中的研究一直滞后。下文涉及的修复因子主要是细菌和哺乳动物系统的研究结果。
BER由特异性DNA糖基化酶启动,受损的DNA碱基由一种或几种具有特异性的DNA糖基化酶识别并将其切除,产生1个无碱基位点(AP site),在短片段碱基切除修复(SP-BER)中,AP核酸内切酶将受损碱基5′端的磷酸二酯键切开,产生3′端羟基残基(3′-OH)和5′端脱氧核糖磷酸(5′-dRP),并以此为底物,通过DNA聚合酶β(Polβ)聚合1个新的脱氧核苷酸到DNA链上,5′-dRP随后被切除,切除后产生的位点通过Lig1(DNA ligase 1)或Lig3(DNA ligase 3)和XRCC1 (X-ray repair cross-complementing protein 1)的复合物进行修复[28-29]。
在长片段碱基切除修复(LP-BER)中,由多功能糖基化酶切除碱基产生断裂单链,由于新加入的核苷酸数目较多,会在其下游顶起一个Flap结构,该结构由核酸酶FEN1(flap endonuclease)特异切除,最后由Lig1完成修复。植物中除不存在Polβ外,具有大多数BER蛋白的同源物,也拥有一些植物特异性BER蛋白[30-31]。
由于BER期间的核苷酸切除,导致DNA单链断裂(SSB)的瞬时形成,因此BER酶也是SSB修复的主要参与者。
3.1.3 MMR途径
DNA复制具有高度忠实性,聚合酶的选择是复制过程中保真度的主要决定因素;随后对DNA链进行校对,如果链延伸过程中产生错配,则启动错配修复(MMR)机制,错配修复(MMR)途径纠正聚合酶校对后遗留的罕见错误,将复制保真度提高了100倍以上;核苷酸的选择性、校对和MMR协同作用,保障基因组的稳定性[31]。
MMR途径能够在DNA复制、遗传重组、DNA损伤修复期间识别和修复碱基的错误插入和缺失[32]。植物MMR系统由MutL、MutS等错配修复同系物组成,原核生物中没有发现MutH,作为MMR系统中最重要的单体,MSH2、MLH1与其他MMR蛋白形成异二聚体,例如MutSα(MSH2-MSH6)、MutSβ(MSH2-MSH3)、MutSγ(MSH2-MSH7)、MutLα(MLH1-PMS1)、MutLγ(MLH1-MLH3),MutSα主要参与短插入/缺失环(IDL)和碱基错配的校正,而MutSβ优先去除大IDLs(2~12个核苷酸),植物特异性MutSγ主要识别单碱基错配[33-34]。
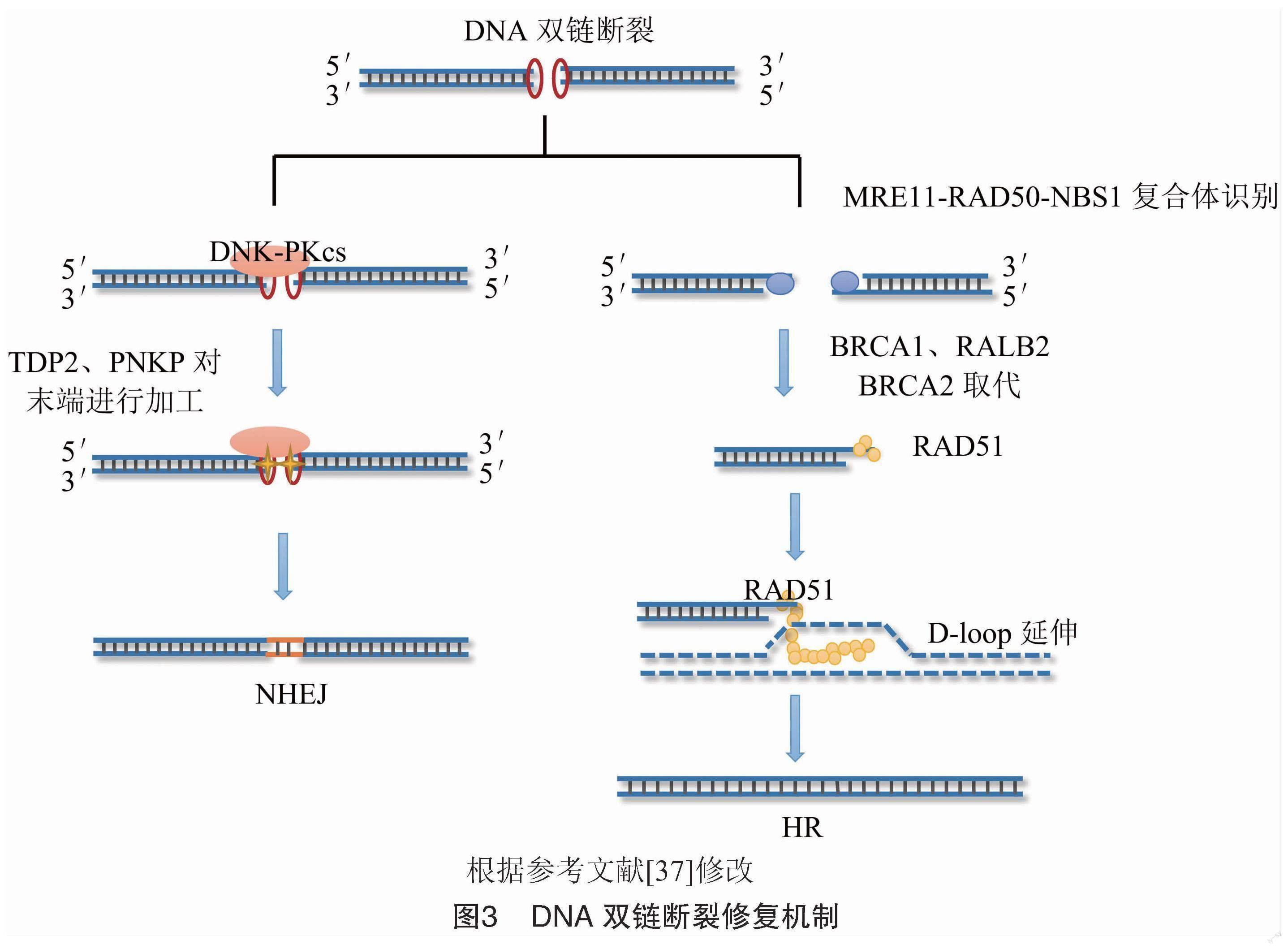
3.2 DNA双链断裂修复 (DSBR) 机制
DNA双链断裂(DNA double-strand breaks,DSBs)是真核细胞中最为严重的DNA损伤类型之一,单个裸露的DSB即可诱发细胞凋亡。细胞主要使用2种途径来修复DSB:非同源末端连接(NHEJ)和同源重组修复(HR)。目前认为细胞周期是选择DNA修复途径的关键调节因素,NHEJ在G1期最为重要。HR在细胞周期的S 期和G2期起作用[35-36]。两者共同发挥作用,以维持基因组的稳定性。
3.2.1 NHEJ途径
NHEJ的修复是快速但并非精确的,修复过程中可能会随机引入和去除几个碱基(图3),该途径涉及以下步骤:首先Ku蛋白(Ku70/Ku80)复合物识别损伤并结合到DSBs末端,Ku-DNA复合物与DNA依赖性蛋白激酶(DNA-PK)催化亚基(DNA-PKcs)相互作用,形成具有稳定性和功能性的DNA-PKcs复合物,DNA-PK活化蛋白在体内经历广泛的自磷酸化,启动NHEJ通路,随后对DNA末端进行处理,Ku蛋白的5′-dRP/AP裂解酶活化切除5′-dRP/AP位点,酪氨酸-DNA磷酸二酯酶(TDP2)解旋5′磷酸酪氨酸与DNA间的磷酸二酯键,多核苷酸激酶/磷酸酶(PNKP)的3′-DNA磷酸酶和5′-DNA激酶活性可连接5′-磷酸和3′-羟基末端等,最后由XRCC4-LIG4-XLF复合物促使DNA末端进行连接[37]。
3.2.2 HR途径
从NHEJ到HR的转变是渐进的。HR是一种高保真修复途径,由多种成分介导,被认为比末端连接更能保护基因组完整性[38]。
在HR途径中,首先以未受损的姐妹染色单体的同源序列作为修复模板(图3),随后MRN复合物识别受损位点,结合到DNA末端,通过核酸酶处理DSB位点产生3′-ssDNA尾部,3′-ssDNA尾部由RPA结合蛋白包裹,使其免受核酸酶的降解并去除二级结构,BRCA2蛋白介导RPA被RAD51取代,RAD51在DNA上形成核蛋白丝,RAD51核蛋白开始寻找同源DNA序列,侵入完整的雙链DNA分子,形成置换环(D-loop);最后D-loop延伸或与另一个末端连接,完成修复过程[37]。
4 DNA损伤修复对水稻生长发育的影响
4.1 影响初生根
RecQ解旋酶是ATP依赖性解旋酶家族的成员,积极参与基因组监测,在DNA复制、重组、修复等多种DNA代谢过程中具有不同的作用,在维持基因组的稳定性方面起重要作用。水稻OsRecQl4的表达仅限于分生组织(RAM),osrecql4突变体对DNA损伤剂(博来霉素)表现出超敏反应,表明
OsRecQ14可能参与DNA单链断裂(SSB)和DSB的修复;osrecql4突变体对DNA聚合酶的抑制剂也表现出敏感性,表明OsRecQl4在S期停滞恢复过程中具有一定的作用。在osrecql4突变体中HR修复功能增强,可修复部分DSB,未修复的DSB诱导根分生组织的细胞死亡[39]。因此,OsRecQl4通过参与RAM中DNA复制及DNA 损伤修复过程,影响根系的生长,维持基因组稳定。
4.2 影响叶片生长
在DNA复制期间和复制后,生物体存在高度保守的调节作用和保护遗传物质的机制[40]。DNA复制通过核糖核苷酸还原酶(RNR)严格控制dNTP的合成,将单个dNTP的浓度维持在不同水平。不平衡的dNTP会影响复制的保真度,此外dNTP浓度在G1、S期增加,与DNA复制开始时期相吻合。水稻ALR基因编码一种在所有组织中表达的典型DCD蛋白,ALR基因功能的丧失,使DCD蛋白缺乏结合能力,降低dNTP水平并扰乱dNTP的平衡。osalr突变体表现为植株矮小、叶片细胞数量减少和细胞长度增加,随着叶片的生长,近乎白化的叶片出现白绿色条纹和坏死斑点。osalr突变体对DNA损伤剂敏感,DNA损伤剂诱导DNA修复和DNA复制检查点的激活,但随着未修复DNA的积累,产生更严重的DNA损伤,细胞死亡增加。osalr 突变体中缺乏DCD蛋白,导致细胞周期进程出现缺陷,具体表现为从G1/S期到G2/M期的过渡受阻,不仅影响核基因组复制,使细胞分裂减少,质体基因组复制和叶绿体分裂也受到影响[41]。因此,ALR基因通過影响DNA复制和增加DSB积累来影响叶片生长。
4.3 影响花发育
减数分裂过程中,同源重组在增加遗传多样性和维持基因组稳定性方面起着重要作用,复制蛋白A(RPA)是由RPA1、RPA2、RPA3组成的异源三聚体,已被证明对DNA复制、DNA 损伤信号传导、DNA 修复和同源重组至关重要。RPA通过多个寡核苷酸/寡糖结合折叠,包被和保护暴露的ssDNA免受核酸酶的侵害。作为一种典型的支架蛋白,RPA可与多种蛋白质相互作用,包括DNA核酸酶、DNA解旋酶和DNA聚合酶等。水稻RPA1a基因突变后,观察到减数分裂期出现缺陷,Ⅱ型CO(cross over)大大增加,出现染色体碎片和染色体桥,四分体中形成微核,最终导致植株雄配子体部分可育,而雌配子体完全不育。进一步试验表明,水稻RPA1a在减数分裂过程中限制交叉形成,并通过与FANCM复合物或BTR复合物相互作用,来调节重组中间体的准确加工[42]。此外,osrpa1a突变体对紫外线辐射以及DNA损伤剂丝裂霉素和甲磺酸甲酯敏感[43]。因此,OsRPA1a基因通过调节减数分裂过程中的同源重组修复以促进DSB修复,来维持基因组稳定性。
4.4 影响种子发育
在植物中,DNA损伤反应(DDR)和修复系统是抵御环境胁迫(紫外线B辐射、干旱、盐、热和其他因素,如金属)最重要的防御系统之一。在应对环境压力过程中产生的活性氧,可以改变碱基并损害糖残基,导致双链断裂和DNA片段化。在种子寿命相关研究中发现,DNA修复机制和DNA损伤反应(DDR)是控制种子发芽和决定种子发芽潜力的关键因素[44]。拟南芥通过转录因子SOG1整合了ATM、ATR信号传导,延迟程序性细胞死亡,最大限度减少了DNA损伤的影响。OsSOG1、OsSGL是拟南芥DDR蛋白AtSOG1的水稻同源基因,且OsSGL为OsSOG1的下游靶标。水稻中OsSOG1的缺乏,导致其对DNA损伤的敏感性显著增加,并抑制响应DNA损伤的基因表达(如Rad51A2、PARP2A、MSH4、MSH5等),延迟DDR反应,积累DNA损伤。sog1-sgl双突变植株倾向于严重的DNA损伤表型[45]。进一步试验表明,OsSOG1在氧化应激反应中也起着重要作用[46]。因此OsSOG1通过调节DNA损伤反应进程和损伤修复,来影响水稻生长发育。
5 水稻基因组稳定性研究的未来方向
基因组的稳定性是长期进化形成的。前期研究主要集中在对新基因及其功能的挖掘,目前已经克隆出很多参与维持基因组稳定的关键性基因(表1)。但是,对于这些基因之间的相互关系以及其信号传递却鲜有报道。随着现代生物技术的不断发展和优化,对水稻生长发育过程中DNA损伤及修复调控网络的认识将会更加全面,同时也有助于水稻育种探索。
水稻基因组稳定与绿色超级稻(GSR)的培育。预计2050年全球人口将达到90亿,人口和环境的压力倍增;在此基础上,我国科学家提出了新目标,即开发绿色超级稻品种,在持续增产和品质提升的前提下,绿色超级稻应具备抗多种病虫害、养分表
达仅限于分生组织(RAM),osrecql4突变体对DNA损伤剂(博来霉素)表现出超敏反应,表明率高、抗旱等特点,有望大幅减少农药、化肥、水的消耗,对粮食安全的保障和可持续农业的发展具有重要意义[47]。GSR可以通过2个阶段来实现,第1阶段的任务是研究水稻重要农艺性状的基因功能及其分子调控网络,目前已经部分实现;第2阶段的任务是在整个基因组稳定遗传的基础上将所需基因进行积累,使水稻品种得到逐步改良,这是具有很大挑战性的。GSR育种计划已经出现使用上述育种策略改良优良品种的成功案例,即表现出对1种或多种非生物/生物胁迫的耐受性。水稻基因组稳定性是体现各种绿色性状(基因)育种价值的基础。
水稻是最古老的驯化谷物之一,水稻的驯化过程体现在对农学重要性状进行人工选择的过程,如种子落粒性、打破种子休眠、株型、每穗粒数、耐胁迫性和籽粒颜色等,以及对维持基因组稳定关键基因的选择[48],例如水稻驯化和现代育种过程中HUO基因的去除。HUO是一个活跃的长末端重复(LTR)逆转录转座子,存在于所有野生物种和42%的地方品种中,在水稻驯化和现代育种过程中,HUO可能已从水稻品种中去除。HUO可以触发强烈的宿主基因组防御或监视系统,有效抑制HUO的转录,而且还在整个基因组中诱导表观遗传的不稳定性。进一步分析表明,HUO通过RNA定向的DNA甲基化途径受到严格的沉默,多个HUO拷贝可以通过改变全基因组DNA甲基化和小RNA生物发生以及改变基因表达来触发基因组的不稳定,导致抗病性和产量下降[49]。因此,水稻驯化和现代育种是维持水稻基因组稳定研究的又一重要方向。
綜上所述,在生长发育过程中有多种因素会造成水稻基因组不稳定,同时触发保护机制来抵抗这种不稳定。对水稻基因组稳定性的研究,聚焦在减少损伤和增强修复的基因挖掘方面,优化和加强这些基因的应用研究,是科学育种的又一方向,也是人工促进水稻的定向进化。
参考文献:
[1]Tong A H Y,Evangelista M,Parsons A B,et al. Systematic genetic analysis with ordered arrays of yeast deletion mutants[J]. Science,2001,294(5550):2364-2368.
[2]Puddu F,Herzog M,Selivanova A,et al. Genome architecture and stability in the Saccharomyces cerevisiae knockout collection[J]. Nature,2019,573(7774):416-420.
[3]Kennedy J A,Syed S,Schmidt K H. Structural motifs critical for in vivo function and stability of the RecQ-mediated genome instability protein Rmi1[J]. PLoS One,2015,10(12):e0145466.
[4]Jackson S P,Bartek J.The DNA-damage response in human biology and disease[J]. Nature,2009,461(7267):1071-1078.
[5]Lambert S,Carr A M.Replication stress and genome rearrangements:lessons from yeast models[J]. Current Opinion in Genetics & Development,2013,23(2):132-139.
[6]Alexandrov L B,Nik-Zainal S,Wedge D C,et al. Deciphering signatures of mutational processes operative in human cancer[J]. Cell Reports,2013,3(1):246-259.
[7]Jiang J M,Mao N,Hu H A,et al. A SWI/SNF subunit regulates chromosomal dissociation of structural maintenance complex 5 during DNA repair in plant cells[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(30):15288-15296.
[8]Motofei I G. Biology of cancer;from cellular and molecular mechanisms to developmental processes and adaptation[J]. Seminars in Cancer Biology,2022,86(Pt3):600-615.
[9]Alexander J L,Orr-Weaver T L.Replication fork instability and the consequences of fork collisions from rereplication[J]. Genes & Development,2016,30(20):2241-2252.
[10]Brown R E,Freudenreich C H.Structure-forming repeats and their impact on genome stability[J]. Current Opinion in Genetics & Development,2021,67:41-51.
[11]Hamperl S,Cimprich K A.The contribution of co-transcriptional RNA:DNA hybrid structures to DNA damage and genome instability[J]. DNA Repair,2014,19:84-94.
[12]Yang Z,Li M M,Sun Q W.RHON1 co-transcriptionally resolves R-loops for Arabidopsis chloroplast genome maintenance[J]. Cell Reports,2020,30(1):243-256.
[13]Srinivas U S,Tan B W Q,Vellayappan B A,et al. ROS and the DNA damage response in cancer[J]. Redox Biology,2019,25:101084.
[14]Chatterjee N,Walker G C.Mechanisms of DNA damage,repair,and mutagenesis[J]. Environmental and Molecular Mutagenesis,2017,58(5):235-263.
[15]Chirinos-Arias M C,Spampinato C P.Role of the mismatch repair protein MSH7 in Arabidopsis adaptation to acute salt stress[J]. Plant Physiology and Biochemistry,2021,169:280-290.
[16]Hartman P E,Hartman Z. Direct interception of mutagens and carcinogens by biomolecules[M]//Antimutagenesis and anticarcinogenesis mechanisms Ⅲ. Boston,MA:Springer US,1993:351-366.
[17]Beranek D T. Distribution of methyl and ethyl adducts following alkylation with monofunctional alkylating agents[J]. Fundamental and Molecular Mechanisms of Mutagenesis,1990,231(1):11-30.
[18]Angon P B,Tahjib-Ul-Arif M,Samin S I,et al. How do plants respond to combined drought and salinity stress?—a systematic review[J]. Plants,2022,11(21):2884.
[19]Hasanuzzaman M,Nahar K,Alam M,et al. Physiological,biochemical,and molecular mechanisms of heat stress tolerance in plants[J]. International Journal of Molecular Sciences,2013,14(5):9643-9684.
[20]Morgan C,Zhang H K,Bomblies K.Are the effects of elevated temperature on meiotic recombination and thermotolerance linked via the axis and synaptonemal complex?[J]. Philos Trans R Soc Lond B Biol Sci,2017,372(1736):20160470.
[21]Ning Y J,Liu Q P,Wang C,et al. Heat stress interferes with formation of double-strand breaks and homolog synapsis[J]. Plant Physiology,2021,185(4):1783-1797.
[22]Zhao K,Sun X X,Zheng C H,et al. Enhancement of xrcc1-mediated base excision repair improves the genetic stability and pluripotency of iPSCs[J]. Science Bulletin,2022,67(11):1126-1130.
[23]Maddukuri L,Dudzińska D,Tudek B.Bacterial DNA repair genes and their eukaryotic homologues:4.The role of nucleotide excision DNA repair (NER) system in mammalian cells[J]. Acta Biochimica Polonica,2007,54(3):469-482.
[24]Fousteri M,Mullenders L H.Transcription-coupled nucleotide excision repair in mammalian cells:molecular mechanisms and biological effects[J]. Cell Research,2008,18(1):73-84.
[25]Jeppesen D K,Bohr V A,Stevnsner T.DNA repair deficiency in neurodegeneration[J]. Progress in Neurobiology,2011,94(2):166-200.
[26]Kunz B A,Anderson H J,Osmond M J,et al. Components of nucleotide excision repair and DNA damage tolerance in Arabidopsis thaliana[J]. Environmental and Molecular Mutagenesis,2005,45(2/3):115-127.
[27]David C. Replication-coupled DNA repair[J]. Molecular Cell,2019,74(5):866-876.
[28]Hays J B. Arabidopsis thaliana,a versatile model system for study of eukaryotic genome-maintenance functions[J]. DNA Repair,2002,1(8):579-600.
[29]Roldán-Arjona T,Ariza R R. Repair and tolerance of oxidative DNA damage in plants[J]. Reviews in Mutation Research,2009,681(2/3):169-179.
[30]Garcia-Diaz M,Bebenek K. Multiple functions of DNA polymerases[J]. Critical Reviews in Plant Sciences,2007,26(2):105-122.
[31]Jiang M,Wu X J,Song Y,et al. Effects of OsMSH6 mutations on microsatellite stability and homeologous recombination in rice[J]. Front Plant Sci,2020,11:220.
[32]Spampinato C P,Gomez R L,Galles C,et al. From bacteria to plants:a compendium of mismatch repair assays[J]. Reviews in Mutation Research,2009,682(2/3):110-128.
[33]Singh S K,Roy S,Choudhury S R,et al. DNA repair and recombination in higher plants:insights from comparative genomics of Arabidopsis and rice[J]. BMC Genomics,2010,11:443.
[34]Gómez R,Spampinato C P.Mismatch recognition function of Arabidopsis thaliana MutSγ[J]. DNA Repair,2013,12(4):257-264.
[35]Ceccaldi R,Rondinelli B,DAndrea A D.Repair pathway choices and consequences at the double-strand break[J]. Trends in Cell Biology,2016,26(1):52-64.
[36]Karanam K,Kafri R,Loewer A,et al. Quantitative live cell imaging reveals a gradual shift between DNA repair mechanisms and a maximal use of HR in mid S phase[J]. Molecular Cell,2012,47(2):320-329.
[37]Spampinato C P. Protecting DNA from errors and damage:an overview of DNA repair mechanisms in plants compared to mammals[J]. Cellular and Molecular Life Sciences,2017,74(9):1693-1709.
[38]House N C,Polleys E J,Quasem I,et al. Distinct roles for S.cerevisiae H2A copies in recombination and repeat stability,with a role for H2A.1 threonine 126[D]. United States:Tufts University,University of Alaska Anchorage,2019,8.
[39]Yong-Ik K,Kiyomi A,Masaki E,et al. DNA replication arrest leads to enhanced homologous recombination and cell death in meristems of rice OsRecQl4 mutants[J]. BMC Plant Biology,2013,13(1):62.
[40]Buckland R J,Watt D L,Chittoor B,et al. Increased and imbalanced dNTP pools symmetrically promote both leading and lagging strand replication infidelity[J]. PLoS Genetics,2014,10(12):e1004846.
[41]Niu M,Wang Y H,Wang C M,et al. ALR encoding dCMP deaminase is critical for DNA damage repair,cell cycle progression and plant development in rice[J]. Journal of Experimental Botany,2017,68(21/22):5773-5786.
[42]Chang Y X,Gong L,Yuan W Y,et al. Replication protein A (RPA1a) is required for meiotic and somatic DNA repair but is dispensable for DNA replication and homologous recombination in rice[J]. Plant Physiology,2009,151(4):2162-2173.
[43]Ishibashi T,Kimura S,Furukawa T,et al. Two types of replication protein A 70 kDa subunit in rice,Oryza sativa:molecular cloning,characterization,and cellular & tissue distribution[J]. Gene,2001,272(1/2):335-343.
[44]Waterworth W M,Latham R,Wang D P,et al. Seed DNA damage responses promote germination and growth in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America,2022,119(30):e2202172119.
[45]Nishizawa-Yokoi A,Motoyama R,Tanaka T,et al. SUPPRESSOR OF GAMMA RESPONSE 1 plays rice-specific roles in DNA damage response and repair[J]. Plant Physiology,2023,191(2):1288-1304.
[46]Mahapatra K,Roy S. SOG1 transcription factor promotes the onset of endoreduplication under salinity stress in Arabidopsis[J]. Scientific Reports,2021,11(1):11659.
[47]Zhang Q F.Strategies for developing green super rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16402-16409.
[48]Izawa T,Konishi S,Shomura A,et al. DNA changes tell us about rice domestication[J]. Current Opinion in Plant Biology,2009,12(2):185-192.
[49]Peng Y,Zhang Y Y,Gui Y J,et al. Elimination of a retrotransposon for quenching genome instability in modern rice[J]. Molecular Plant,2019,12(10):1395-1407.
