AIM2炎性小体在早期非小细胞肺癌组织中的表达及其作用探讨
2023-02-24杨光辉梁明雪吴礼高承泽农龚晓萌胡俊锋
杨光辉,梁明雪,吴礼高,承泽农,龚晓萌,胡俊锋
肺癌是最常见的恶性肿瘤之一,目前在全球范围内其致死率是各类癌症之首。肺癌死亡率在我国男性、女性恶性肿瘤中均为第1位,仅有19%的肺癌病人在确诊后存活5年或更长时间[1]。根据组织学不同,肺癌可分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC高达所确诊肺癌的85%左右[2]。目前临床上针对肺癌的治疗手段主要以手术、化疗及放疗为主,但大部分肺癌病人确诊时已是晚期,失去了手术的最佳时机[3]。因此,探讨与NSCLC发生发展相关的可能机制对肺癌的预防、早期发现、诊断、干预及预后评估具有重要的临床价值。
肿瘤相关性炎症已成为肿瘤的主要生物学特征之一。炎性小体被称为炎症反应的中心环节,是由模式识别受体参与组装的多蛋白复合物,可识别病原体相关分子模式或宿主来源的损伤相关分子模式,在细胞受到外界信号刺激或感染时,特定炎性小体招募激活caspase-1,并促进细胞因子白细胞介素(interleukin,IL)-1β和IL-18的分泌,引起DNA损伤,最终使细胞发生渗透性崩解,诱发细胞焦亡,加剧炎性疾病的发展。慢性炎症可改变肺和支气管的微环境,进而导致肺癌的发生。有报道[4]称,肺癌微环境中发现了高水平的炎性细胞,提示肺癌的危险因素与氧化应激标志物、免疫细胞组成的改变和炎症细胞因子水平有着密切关系。以上研究提示,炎性小体参与肺癌的发生,对其机制的探讨可能有利于肺癌的早期诊断及预后判断。黑素瘤缺乏因子2(absent in melanoma 2,AIM2)最早于1997年在人黑素瘤中被发现,是炎性小体家族成员中较为重要的一员,因能被多种信号激活而被广泛研究。AIM2炎性小体是一种细胞内的DNA感受器,当机体受到DNA病毒或细菌感染时,可以识别释放到细胞质中的双链DNA,进而激活下游相关的多种效应蛋白[5-6]。本研究采用免疫组织化学技术检测AIM2炎性小体及其下游IL-1β、IL-18蛋白在早期NSCLC和癌旁组织中的表达,分析其在早期NSCLC发病中的可能机制,并探讨NSCLC癌组织中各蛋白表达水平间的关系。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月至2020年10月就诊我院行手术治疗并经病理确诊的57例早期NSCLC癌组织及癌旁组织石蜡标本。其中腺癌(adenocarcinoma,ADC)33例,鳞癌(squamous cell carcinoma,SCC)24例;男29例,女28例;>60岁31例,≤60岁26例;肿瘤直径>3~5 cm 27例,≤3 cm 30例;肿瘤高中分化23例,低分化34例;有淋巴结转移31例,无淋巴结转移26例。纳入标准:(1)所有病人经病理学诊断明确为肺腺癌或肺鳞癌且临床资料完整;(2)TNM分期为Ⅰ、Ⅱ期病人;(3)确诊前均未接受过任何形式治疗。排除标准:(1)组织学类型为肺腺癌及鳞癌以外的肺癌病人;(2)自身免疫性疾病病人;(3)感染性疾病病人。
1.2 试剂 AIM2多克隆抗体(货号20590-1-AP)购至美国Proteintech公司;凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)(货号DF6304)、caspase-1(货号AF5418)、IL-1β(货号AF5103)和IL-18多克隆抗体(货号DF6252)均为美国Affinity Biosciences公司产品。
1.3 免疫组织化学法 将组织标本连续切片烘烤干燥,脱蜡后放入不同浓度梯度乙醇中。用PBS冲洗使切片水化,将切片完全浸入修复液中,加热至沸腾,停止加热冷却至室温,使用PBS洗涤3次。将3%过氧化氢加入切片中,避光孵育后使用PBS冲洗。将切片放置于湿化孵育盒中,封闭游离结合位点。倒去封闭液,每张切片加入待检测抗原对应的一抗[稀释比例:AIM2(1∶200)、ASC(1∶50)、caspase-1(1∶100)、IL-18(1∶200)、IL-1β(1∶200),均在4 ℃避光过夜孵育12 h],次日滴加酶标二抗封闭。PBS冲洗,经DAB显色,苏木精复染后蒸馏水冲洗终止染色。将玻片脱水,取出后风干,中性树脂封片胶封片后于光学显微镜下观察。
本研究判定标准参考FENG等[7]采用的计分法,由阳性细胞百分比和染色强度分数共同决定,将两项得分相乘得出染色强度得分,结果判断标准:-(0分),+(1~3分),2+(4~8分),3+(9~12分)。染色强度得分<4分计阴性,≥4分计阳性。用%表示各种蛋白在不同肺癌组织及癌旁组织中的阳性率。
1.4 统计学方法 采用t检验、χ2检验和Spearman秩和相关分析。
2 结果
2.1 AIM2炎性小体组分及下游IL-1β、IL-18蛋白在NSCLC癌组织和癌旁组织的表达 AIM2、ASC、caspase-1、IL-1β、IL-18蛋白主要表达于细胞质中(见图1)。NSCLC癌组织中AIM2、ASC、caspase-1、IL-1β、IL-18的阳性表达率均明显高于癌旁组织(P<0.01)(见表1)。
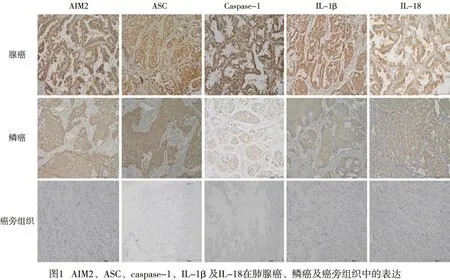

表1 AIM2炎性小体组分及下游IL-1β、IL-18蛋白在NSCLC癌组织和癌旁组织的表达[n;百分率(%)]
2.2 AIM2炎性小体组分、IL-1β及IL-18与NSCLC临床病理参数的关系 AIM2、ASC、caspase-1、IL-1β、IL-18在ADC中的阳性表达率均高于SCC(P<0.05~P<0.01);在低分化、伴有淋巴结转移NSCLC中的阳性表达率均分别高于高中分化、无淋巴结转移的NSCLC(P<0.05~P<0.01);不同性别、年龄、肿瘤直径NSCLC中AIM2、ASC、caspase-1、IL-1β、IL-18的蛋白表达差异均无统计学意义(P>0.05)(见表2)。
2.3 AIM2炎性小体组分、IL-1β、IL-18在NSCLC癌组织中表达水平的相关性 在NSCLC癌组织中,AIM2的表达水平与ASC、caspase-1、IL-1β、IL-18的表达水平均呈正相关关系(P<0.05~P<0.01);ASC的表达水平与caspase-1、IL-1β、IL-18的表达水平均呈正相关关系(P<0.05~P<0.01);caspase-1的表达水平与IL-1β、IL-18的表达水平均呈正相关关系(P<0.01和P<0.05)(见表3)。

表2 AIM2炎性小体组分、IL-1β及IL-18与NSCLC临床病理参数的关系[n;百分率(%)]
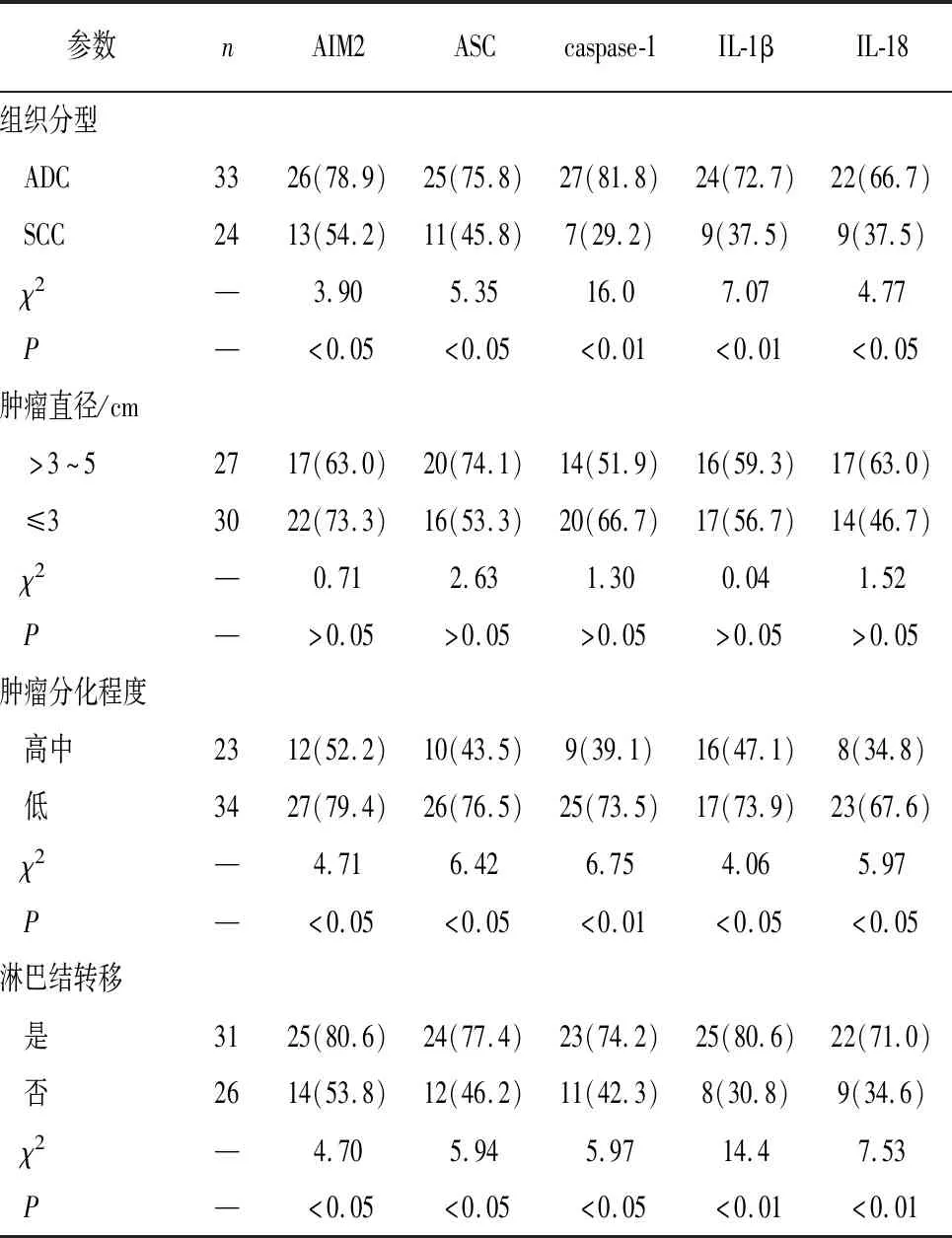
续表2
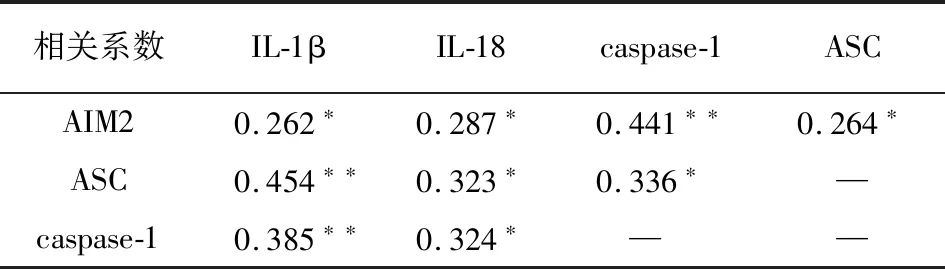
表3 NSCLC癌组织中AIM2炎性小体组分、IL-1β、IL-18的表达相关性(r)
3 讨论
随着诊断方法进步、新化疗药物以及靶向药物出现,肺癌病人生存率有所提高。然而要大幅度提高生存率,仍有赖于癌症的早期诊断和规范治疗,这是取得良好预后非常重要的前提。深入探讨肺癌的发病机制,寻求肺癌发生关键因素,靶向关键指标开展药物研发具有重要的意义。
炎性小体是由模式识别受体参与组装的多蛋白复合物,主要存在于髓样细胞中,可识别宿主来源的损伤相关分子模式或病原体相关分子模式。目前已发现的炎性小体可分为AIM2样受体家族的AIM2、IFI16、pyrin炎性小体和NOD样受体家族的NLRP1、NLRP3、NLRC4、NLRP6、NLRP12炎性小体等。AIM2炎性小体是炎性小体家族中较为重要成员之一,同时也是干扰素诱导的HIN-200蛋白家族中唯一能识别DNA并形成炎性小体从而激活caspase-1的一员,对外来细菌和病毒均有防御杀伤作用,具有免疫功能。当细菌、DNA病毒入侵细胞或细胞受到创伤引起核DNA泄漏到细胞内时,双链DNA可以进入胞质[8];同时AIM2炎性小体通过其羧基端带正电荷的HIN-200结构域以非序列特异性的方式通过静电相互作用,与双链DNA的糖-磷酸骨架作用并识别双链DNA后,AIM2发生构象变化,与ASC结合并诱导ASC二聚体化,ASC的CARD结构域会与pro-caspase-l的CARD结构域结合,形成AIM2炎性小体(AIM2-ASC-pro-caspase-1)。随后促进caspase-1的活化,caspase-1将pro-IL-1β和pro-IL-18切割成成熟,触发细胞焦亡,IL-1β和pro-IL-18分泌到细胞外,促进炎症反应加剧发生。文献[9]报道,IL-1β被认为是NSCLC中的一种致癌细胞因子,与健康对照者相比,NSCLC病人血清中的IL-1β水平明显升高,IL-1β处理后可显著增强H460和H1299细胞增殖和迁移,并猜测IL-1β可通过COX2-HIF 1ɑ途径促进NSCLC细胞的增殖和迁移。并且有研究[10]表明,NSCLC病人血清中IL-18的水平较健康对照者血清中IL-18的水平显著增加。研究[11]表明,AIM2炎性小体参与调控多种肿瘤的发生与发展,在肿瘤的发展中有着双重作用。AIM2炎性小体表达在结直肠癌[12]、乳腺癌[13]、肝癌[14]等癌症中均有不同程度的下降,因此AIM2炎性小体被认为是一种抑癌基因;但AIM2炎性小体在皮肤鳞癌[15]、口腔鳞癌[16]发病机制中发挥致癌作用。AIM2在肺癌中的表达报道较少,其可能作用机制目前尚不清楚。
本研究采用免疫组织化学法检测Ⅰ、Ⅱ期NSCLC癌组织及癌旁组织中AIM2炎性小体组分及其下游细胞因子的表达,结果显示,AIM2炎性小体组分及下游细胞因子在早期NSCLC癌组织中的表达水平明显高于癌旁组织,与ZHANG等[11]研究相一致。通过对临床病理参数的分析发现,ADC组织中AIM2、ASC、caspase-1、IL-1β、IL-18的表达水平高于SCC,提示NSCLC组织中AIM2炎性小体的表达可能与肺癌组织学类型密切相关,这可能是因为不同类型的肺癌细胞起源不一致,并且在不同的肺癌细胞中由于组织受体的分布不相同,导致AIM2炎性小体的表达可能会存在着差异。
同时本研究结果表明,AIM2炎性小体及下游细胞因子IL-1β、IL-18的表达与早期肺癌分化程度及有无淋巴结转移有关。低分化及伴有淋巴结转移时,其表达水平上调。ZHANG等[11]报道,AIM2是以炎症依赖的方式作为致癌基因发挥作用的,并可能提供一种治疗NSCLC的潜在靶点,并且还推测AIM2通过AIM2炎性小体/IL-1β/STAT 3信号通路,建立连接AIM2炎性小体和NSCLC的反馈机制。但QI等[17]研究提示AIM2炎性小体通过调节线粒体动力学促进NSCLC发展,并非通过炎症依赖性途径进行。本研究进一步分析各蛋白之间的相关性,结果显示,AIM2炎性小体组分AIM2、ASC、caspase-1及IL-1β、IL-18蛋白之间的表达趋势呈现出一致性,并存在正相关关系,这表明AIM2炎性小体可能是以AIM2/ASC/caspase-1/IL-1β及IL-18通路参与NSCLC的发生、发展。KONG等[18]研究发现AIM2在两个不同的NSCLC细胞系中的蛋白和mRNA表达水平均高于正常肺支气管上皮细胞系,并且AIM2蛋白在A549细胞系中的表达水平明显高于H460细胞;进一步分析显示包含ASC、caspase-1、IL-1β和IL-18在内的炎症组分的表达水平在NSCLC中较正常肺支气管上皮细胞系中的表达水平明显增强。
综上所述,早期NSCLC癌组织中AIM2炎性小体组分AIM2、ASC、caspase-1及IL-1β、IL-18表达均上调,且腺癌中AIM2炎性小体的表达高于鳞癌,其表达水平与其肿瘤分化程度及有无淋巴结转移有关。AIM2炎性小体可能成为预测早期NSCLC进展和预后判断的一个潜在分子标志物,并且为调控NSCLC相关性炎症的免疫调节治疗提供新的靶点。本研究仅采用免疫组织化学法从组织学角度分析了AIM2炎性小体和NSCLC的可能联系,下一步还需要采用干预手段减少AIM2炎症小体在相关肺癌细胞株或裸鼠模型上的表达,进行相关机制探讨,以明确AIM2炎症小体在NSCLC发生和发展中的作用。
