基于双荧光中心碳量子点的比率型荧光探针快速检测乐果
2023-02-22吕春秋司露露盘钊金梁杨琳廖秀芬陈丛瑾
吕春秋, 司露露, 盘钊金, 梁杨琳, 廖秀芬, 陈丛瑾*
1. 南宁海关技术中心, 广西 南宁 530021 2. 广西大学化学化工学院, 广西石化资源加工及过程强化技术重点实验室, 广西 南宁 530004
引 言
有机磷农药的主要作用是控制病虫危害以及抑制杂草生长, 凭借其容易使用、 药效持久、 容易被水、 酶及微生物降解、 残留毒性小等优点逐步取代了有机氯农药, 已成为我国农业生产中应用最广泛的有机合成类农药。 乐果是一种中等毒性的内吸性有机磷杀虫、 杀螨剂, 被广泛使用于防治多种作物上的刺吸式口器害虫, 如蚜虫、 叶蝉、 粉虱、 潜叶性害虫及某些蚧类害虫[1], 对保证粮食安全生产, 推动农业经济发展做出了巨大贡献。 但是长期大量或不规范使用乐果, 不仅严重破坏生态系统, 还对人类的健康造成了巨大威胁。 非常有必要检测环境中乐果的含量。 由于色谱法自带分离功能在高检测通量方面优势显著, 特别是色谱技术耦合现代化的检测器, 是目前检测乐果的主流技术[2-4]。 然而色谱技术不仅仪器昂贵、 检测费时, 而且对操作人员的专业水平要求较高[5-6], 无法实现即时检测, 而即时检测手段在紧急事件的处理中显得尤为重要。 现有基于生物技术构建的快速检测方法, 则需要进口试剂盒, 存在原材料获取困难等问题, 虽然大多数快速检测方法的经济成本低, 但是研究耗时长, 并且大部分快速检测方法只能实现特异性检测, 短时间内难以得到推广使用。 依然需要开发一种简单、 快捷、 廉价、 灵敏的方法应用于乐果的快速检测。
近年来, 比率型荧光探针因其具有高灵敏度、 操作简单、 对目标物的响应时间短等优势, 在农药残留的检测中备受关注[7]。 该法同时关注两个不同荧光团的信号变化, 对两个信号进行归一化处理或者以它们的比值作为输出信号, 相当于引入了一个内标。 可以在一定程度上消除仪器噪音和环境的干扰, 提高方法的准确度[8]。 由于比率型荧光探针需要同时关注两个以上的荧光信号变化, 常规的做法是同时引入两个不同的荧光团[9-10]。 同时引入两个荧光团构建比率型荧光传感器的策略是可行的, 但是引入不同的荧光团无疑增加了实验的操作, 且引入的不同荧光团可能会相互拮抗, 影响彼此的荧光效果[11]。 针对单一荧光团的比率型荧光探针将更具优势。
以木糖为碳源, NH4HCO3为氮源, 在180 ℃条件下进行水热反应4 h制备掺杂氮的碳量子点(N-doped carbon quantum dots, N-CQDs)。 所制备N-CQDs的激发光谱可知, 其在238和330 nm各具有一个荧光中心, 其荧光发射中心则重叠于402 nm左右。 通过实验发现, N-CQDs在238 nm激发的发射光谱, 能对乐果浓度的变化做出灵敏反应, 而在330 nm激发的发射光谱没有明显的变化。 利用这两个不同荧光中心对乐果的不同荧光响应, 建立新型比率型荧光探针, 应用于乐果的检测。 为提高检测结果的准确性, 对测量条件进行优化, 并详细讨论了方法的线性范围、 检出限、 选择性、 精密度和准确度等检测性能。 该方法无需酶标记, 简单廉价, 且能在1 min内对乐果作出响应, 反应迅速, 为紧急事件处理时农药残留的即时检测提供技术支撑, 并为其他比率型荧光探针的构建提供了新的策略。 基于N-CQDs不同荧光中心对乐果的不同荧光响应建立的比率型荧光探针还未见报道。
1 实验部分
1.1 仪器与试剂
JJ324BC型电子天平(常熟市双杰测试仪器厂); DHG-9070型电热恒温鼓风干燥箱(上海聚宏仪器设备有限公司); RF5301型荧光分光光度计(岛津, 日本); HITACHI型紫外-可见光记录分光光度计(日立, 日本); phs-3c型pH计(上海雷磁); UP-FD-1PF型立式冷冻干燥机(上海优普实业有限公司); TRACE 1300-TSQ 9000型气相色谱串联质谱仪(Thermo Fisher Scientific, 美国); JEM-F200型透射电子显微镜(JOEL, 日本); ESCALAB 250 Xi型X射线光电子能谱仪(Thermo fisher Scientific, 美国); Nicolet iS10型傅里叶红外光谱仪(Thermo Fisher Scientific, 美国)。
农药标准溶液(乐果、 氨唑磷、 特丁硫磷、 甲草胺、 甲基硫环磷、 噻虫胺、 甲奈胺、 乙酰甲胺磷、 甲基对硫磷、 敌百虫、 伏杀磷, 浓度均为100 μg·mL-1)购自中国农业环境保护研究所; NH4HCO3、 HCl、 NaOH(分析纯)购自国药集团化学试剂有限公司; 月桂酸、 十二烷基苯磺酸钠、 聚乙二醇、 聚乙烯醇购自阿拉丁试剂(上海)有限公司; CaSO4、 MgSO4、 KCl、 Na2CO3、 Al(NO3)3购自成都金山化学试剂有限公司。
1.2 N-CQDs的合成
N-CQDs的合成参考Liao等工作并稍作修改[12]。 将0.2 g木糖和1.5 g 碳酸氢铵溶于10 mL去离子水中, 室温下超声搅拌均匀, 然后转移至100 mL的聚四氟乙烯高压反应釜中, 于180 ℃的烘箱中反应4 h。 反应完成后待反应釜冷却至室温, 用0.22 μm的滤膜过滤, 收集滤液后用透析袋(1 000 Da)透析24 h, 将制备好的N-CQDs于4 ℃保存备用。
1.3 基于单一量子点的乐果快速检测比率型荧光传感器构建
在若干只干净的10 mL 比色管中加入30 μL N-CQDs, 150 μL 月桂酸, 1 μg·mL-1的乐果标准品(10, 20, 30, 50, 100, 150, 200, 300, 400, 500, 600, 700, 800和900 μL), 用pH为6的去离子水(HCl调至)定容至 5 mL, 摇匀。 然后用LS55型荧光分光光度计分别测量其在激发波长λex为238和330 nm的荧光发射光谱, 记录荧光强度, 用(I330/I238)-(I330/I238)0来表示乐果对N-CQDs的猝灭效果(狭缝宽度: Ex=3, Em=5)。
1.4 实际样品处理
实际样品的处理根据NY/T 761—2008[13]进行, 并稍作修改。
提取: 称取10 g火龙果匀浆, 分别加入0, 20, 100和500 μL的10 μg·mL-1乐果标准溶液(每个加标浓度进行3次平行实验), 20 mL的乙腈, 充分搅拌2 min后用滤纸进行过滤, 收集约16~20 mL滤液装到50 mL离心管中, 并加入约2.4 g氯化钠, 盖上塞子, 剧烈震荡2 min, 在室温下静置0.5 h, 使水和乙腈分离。
净化: 用移液枪移取10 mL的乙腈溶液至100 mL的烧杯中, 将烧杯放置在80℃的水浴锅中加热, 并往烧杯缓缓通入空气流, 在蒸发掉大部分液体后, 加入2 mL的甲醇, 并将液体转移至10 mL的离心管中, 再用约3 mL的甲醇冲洗三次烧杯, 将洗涤液收集至离心管中, 最后定容至5 mL, 并充分摇匀, 于4 ℃冷藏备用。 如定容后的溶液比较浑浊, 可用0.2 μm的滤膜过滤。
1.5 实际火龙果样品检测
采用1.3节构建的比率型荧光传感器对实际火龙果样品进行检测, 取100 μL的1.4节中的处理液, 并根据1.3节, 计算回收率和相对标准偏差(RSD)。 采用国家标准的GC-MS法对实际火龙果样品进行检测时, 具体操作步骤根据国家标准GB 232000.8—2016[14]进行, 同时进行加标回收实验并计算回收率和RSD。
2 结果与讨论
2.1 N-CQDs的表征
为了探究N-CQDs的光学性能, 分别测定了N-CQDs的吸收光谱, 激发光谱和发射光谱, 结果如图1(d)所示。 N-CQDs在270和310 nm处出现了并肩吸收峰, 分别对应π—π*共轭的sp2碳核和n—π*共轭官能团[15]。 N-CQDs的激发光谱表明, 其在238和330 nm处各具有一个荧光中心。 无论在238 nm还是330 nm光激发下, 发射光谱中均重叠于402 nm左右。 这种双激发-单发射现象可能归因于其两个荧光中心的超共轭。 对于238 nm的激发中心, 其stokes位移为164 nm。 此外, 由图1(d)的插图可以看出, 所制得的N-CQDs在自然光下为淡黄色液体, 而在365 nm紫外光照下发出明亮的蓝色荧光。
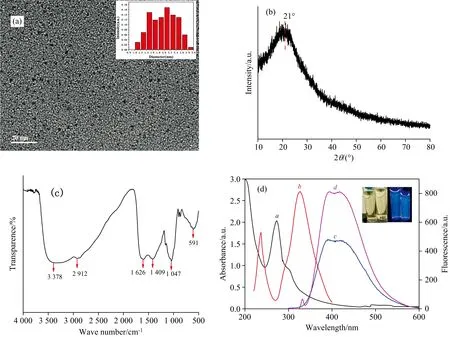
图1 (a) N-CQDs的TEM图(插图: N-CQDs的粒径分布); (b) N-CQDs的XRD图谱; (c) N-CQDs的FTIR; (d) N-CQDs的UV-Vis光谱a、 荧光激发光谱b和荧光发射光谱(c: λEx=238 nm; d: λEm=330 nm; 插图: N-CQDs在自然光和365 nm紫外灯下的图片Fig.1 (a) TEM image of N-CQDs (Inset: Sizes distribution of N-CQDs); (b) XRD pattern of N-CQDs; (c) FTIR spectrum of N-CQDs; (d) UV-Vis spectrum a, fluorescence excitation spectrum b, and fluorescence emission spectra (c: Ex: λEx=238 nm; d: λEm=330 nm; Inset: imagines of N-CQDs under natural light and 365 nm UV light) of N-CQDs
2.2 乐果对N-CQDs的作用及可能的机理
如图2(a)和(b)所示, 随着乐果的不断加入, 238 nm激发的发射峰其荧光被不断猝灭, 而330 nm激发的发射峰变化不大。 探讨了乐果对N-CQDs可能的荧光猝灭机理。 由图2(c)可知, 乐果的紫外吸收光谱与N-CQDs的荧光发射光谱基本无重叠, 因此可以排除荧光共振能量转移和内滤效应。 采用Stern-Volmer方程[16]来判断猝灭类型, 其方程如式(1)所示
F0/F=1+Ksv[Q]=1+Kqτ0[Q]
(1)
式(1)中,F0和F分别为加入猝灭剂前后荧光团的荧光强度;Ksv为荧光猝灭常数; [Q]为猝灭剂的浓度;Kq为猝灭速率常数;τ0为荧光团的荧光寿命, 取τ0=10-8s。 对于静态猝灭, 荧光团与猝灭剂之间发生相互作用, 产生不可逆的非荧光基态络合物从而使得发射光谱的荧光强度降低,Ksv随着温度的升高而降低; 动态猝灭主要由于分子间的碰撞而导致, 猝灭剂与荧光团之间没有复合产物生成, 随着温度升高,Ksv增大。 图2(d)为293, 303和313 K下乐果对N-CQDs在238 nm光激发下发射光谱的荧光猝灭曲线。 在这三个温度下,Ksv分别为5.14×105, 3.94×105和3.65×105L·mol-1, 对应的Kq分别为5.14×1013, 3.94×1013和3.65×1013L·mol-1·s-1。Ksv随温度的升高而降低, 并且Kq值也远大于各类猝灭剂的最大猝灭速率常数(2×1010L·mol-1·s-1), 因此乐果对N-CQDs猝灭机理可归为静态猝灭。
根据参考文献[12, 17], N-CQDs的238 nm处荧光来自于π—π*共轭的sp2型碳核, 而330 nm处的荧光则主要来自于n—π*共轭的表面官能团。 由此可见, 乐果主要作用于sp2型碳核。 根据Zeta电位测试结果, N-CQDs的Zeta电位为-12.03 mV, 表明其表面主要覆盖了大量的—OH和—COOH官能团, 这些官能团在水中水解产生负电荷。 乐果的Zeta电位为-3.37 mV, 决定了它不会与具有相同负电荷的N-CQDs官能团反应。 而乐果和N-CQDs混合物的Zeta电位为-16.07 mV, 说明乐果与N-CQDs带正电荷的基团发生反应。 CQDs的碳核主要由石墨型碳(sp2结构)和无序的sp3碳组成, 氮的掺杂使得部分sp2碳被氮所取代, 这些氮以吡啶氮、 吡咯氮和“石墨型”氮的形式存在, 在水中解离使得它们带上正电荷, 为具有负电荷的乐果提供了结合位点。 反应形成N-CQDs—乐果基态复合物, 导致sp2碳的电子结构破坏, 最终使238 nm激发的荧光猝灭以及混合体系的负电荷上升。 N-CQDs与乐果的反应机理如图2(e)所示。
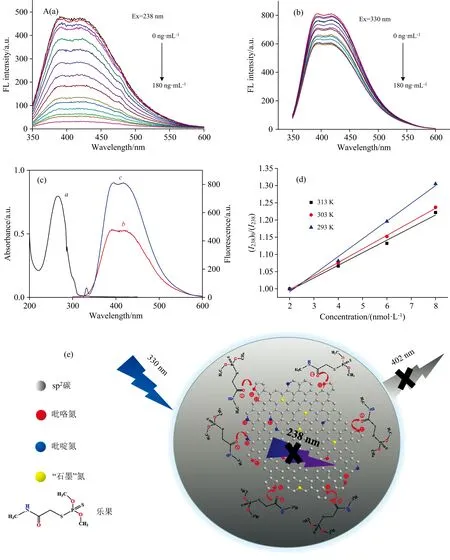
图2 (a) 0~180 ng·mL-1乐果对N-CQDs 238 nm荧光中心的猝灭; (b) 0~180 ng·mL-1乐果对N-CQDs 330 nm荧光中心的猝灭; (c) 乐果的吸收光谱和N-CQDs的荧光发射光谱; (d) 不同温度下乐果猝灭N-CQDs的Stern-Volmer曲线; (e) 乐果猝灭N-CQDs荧光的可能机理Fig.2 (a) Fluorescence quenching of 238 nm fluorescence center of N-CQDs by dimethoate in the concentration range of 0~180 ng·mL-1; (b) Fluorescence quenching of 330 nm fluorescence center of N-CQDs by dimethoate in the concentration range of 0~180 ng·mL-1; (c) Absorption spectrum of dimethoate and the fluorescence emission spectra of N-CQDs; (d) Stern-Volmer curve between dimethoate and N-CQDs under different temperature; (e) Possible fluorescence quenching mechanism of N-CQDs by dimethoate
2.3 实验条件优化
以238 nm激发光测得的发射光谱作为响应信号, 330 nm激发光测得的发射光谱为参比信号, 以加入乐果前后两发射光谱荧光强度的比值的差值[(I330/I238)-(I330/I238)0]为相应信号, 构建比率型荧光探针。 为了提高N-CQDs对乐果检测的灵敏度, 对反应溶剂条件, N-CQDs的用量, 反应时间进行优化。 乐果具有较强的疏水性, 为了提高其在水溶液中的溶解度, 进而提高其与N-CQDs的反应效率, 首先考察了不同类型表面活性剂及其用量的影响。 实验结果表明, 当月桂酸的浓度为3 μg·mL-1时, 获得最大的[(I330/I238)-(I330/I238)0]值。 考察了不同pH的影响, 最佳pH为6。 还考察了不同N-CQDs用量的影响, 结果表明当加入30 μL的N-CQDs时获得最佳的实验效果。 响应时间及其稳定性是评判一个新方法的重要指标。 如图3(a)和(b)所示, N-CQDs与乐果之间的响应在1 min内可完成, 并且在1 h内基本稳定不变。 说明, 所建立的荧光探针具有响应速度快、 稳定性强等特点, 在乐果的快速检测中具有潜在的应用价值。
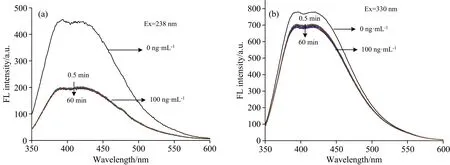
图3 0.5~60 min内40 ng·mL-1乐果对N-CQDs的238 nm荧光中心(a)和330 nm荧光中心(b)的荧光猝灭图Fig.3 Fluorescence quenching of the N-CQDs fluorescence centers at 238 nm (a) and 330 nm (b) by 40 ng·mL-1 of dimethoate in 0.5~60 min
2.4 标准曲线的建立
当乐果浓度为2~180 ng·mL-1时, N-CQDs在238 nm激发的发射峰被有效猝灭, 而在330 nm激发的发射峰则变化较小, 因此以238 nm激发的荧光峰为响应信号, 330 nm激发的荧光峰为参比信号, 建立基于单一碳量子点不同荧光中心的比率型荧光传感器用于乐果的快速检测。 如图4所示, (I330/I338)-(I330/I238)0与乐果浓度在2~100和100~180 ng·mL-1范围内时线性关系良好。 获得的回归方程分别为:y=0.043ρ-0.19和y=0.081ρ-4.11(其中,y为(I330/I238)-(I330/I238)0的值;ρ为乐果的浓度, ng·mL-1), 对应的相关系数r分别为0.996 0和0.998 9, 检测限为0.67 ng·mL-1(3δ/k)。
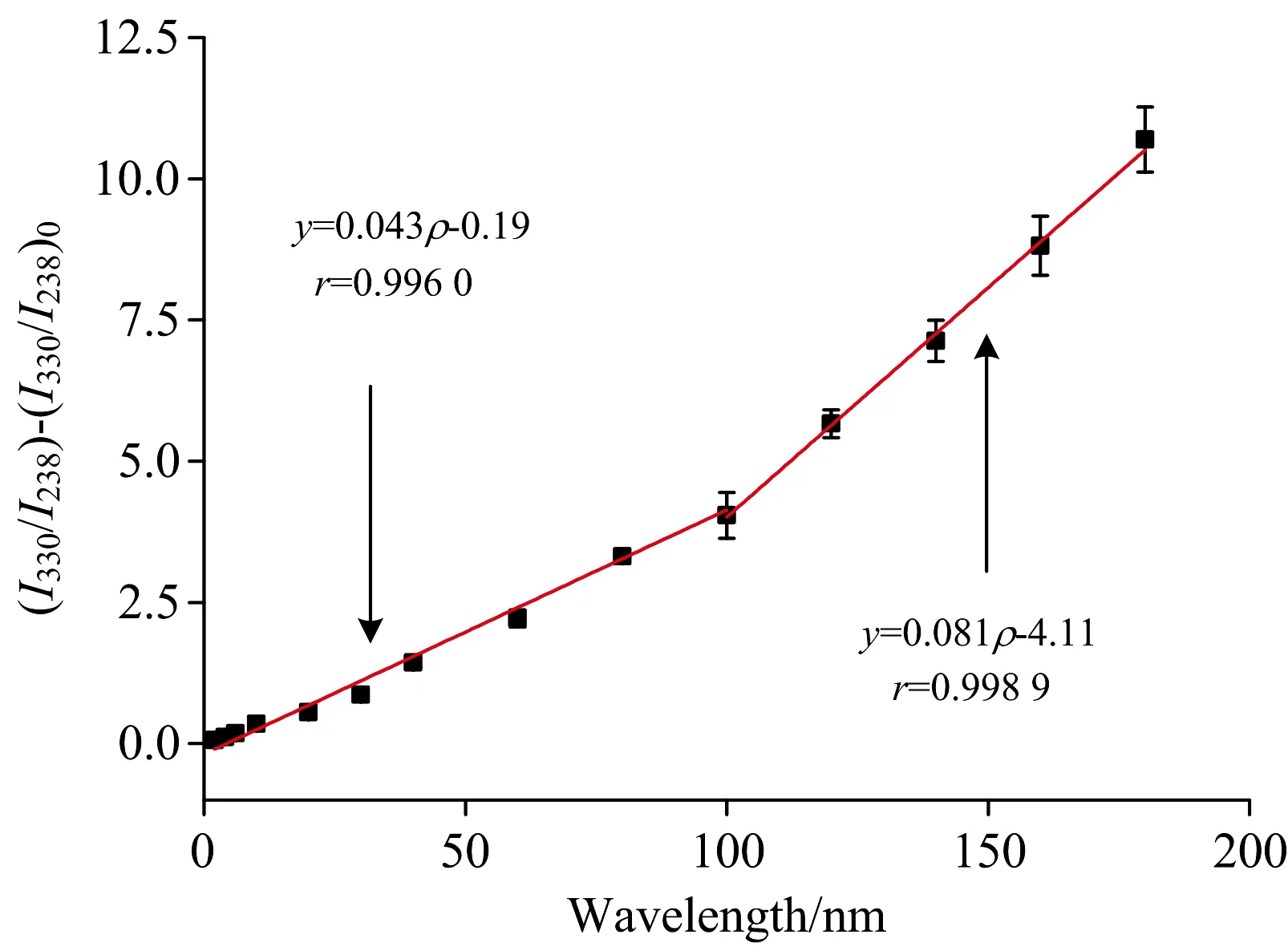
图4 乐果的标准曲线Fig.4 Standard curve of dimethoate
2.5 共存物质对体系的影响
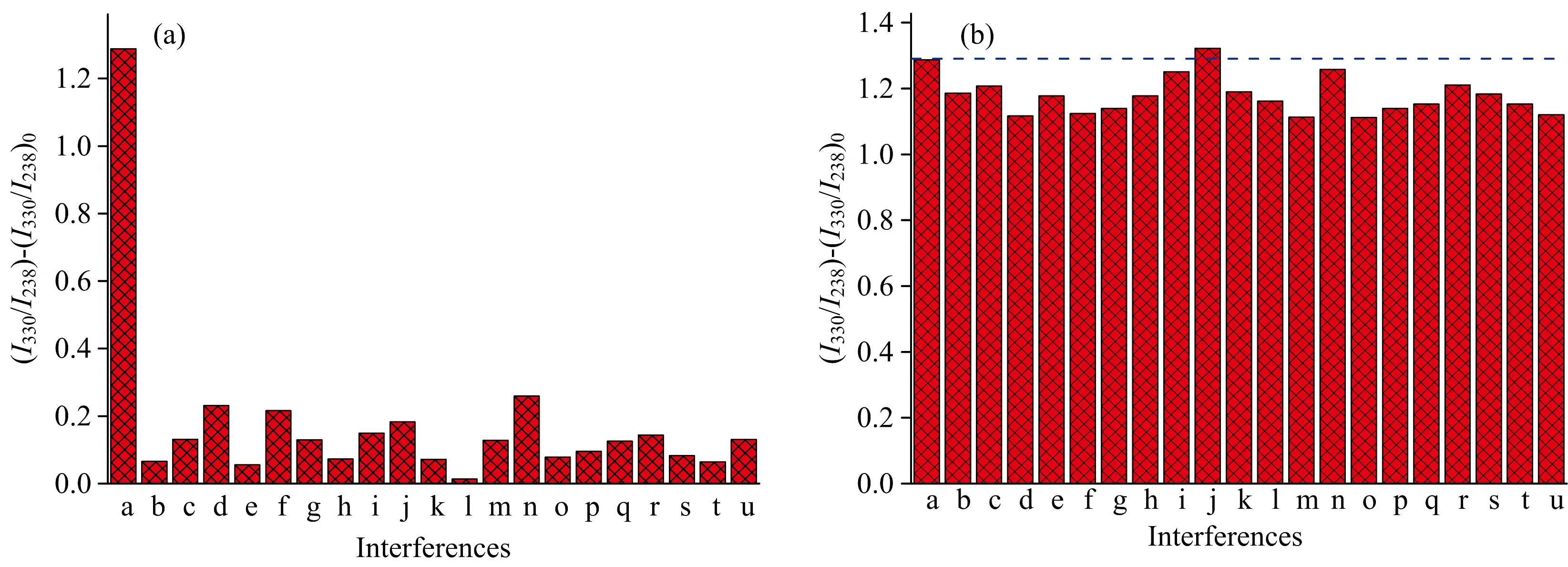
图5 (a) 常见阴阳离子及其他农药对N-CQDs荧光比率变化值(I330/I238)-(I330/I238)0的影响, a~u分别为a: 乐果, 氯唑磷, n: 特丁硫磷, o: 甲草胺, p: 噻虫胺, q: 甲奈胺、 r: 乙酰甲胺磷, s: 甲基对硫磷, t: 敌百虫, u: 伏杀磷; (b) 常见阴阳离子及其他农药存在下N-CQDs对乐果选择性的影响, 其中a为乐果, b—u分别为乐果加上述干扰物Fig.5 (a) The effect of common ions and pesticides to the fluorescence ratio change (I330/I238)-(I330/I238)0 of N-CQDs, a~u represent to a: dimethoate, b: Ca2+, c: d: Mg2+, e: K+, f: Cl-, g: Na+, h: j: Al3+, k: m: clozophos, n: terbufos, o: alachlor; p: clothianidin, q: α-naphthylamine, r: orthene, s: parathion-methyl, t: dipterex, u: phosalone, respectively; (b) The effect of common ions and pesticides to the selectivity of the constructed dual fluorescence center based dimethoate probe, a represents to dimethoate, and b—u represent to the mixture of dimethoate and the interfering substances mentioned above, respectively
2.6 火龙果样品中乐果的检测
为研究该检测方法在实际样品检测中的应用性能, 将其应用于火龙果中的乐果检测, 并进行了加标回收实验, 每个水平的加标回收实验进行3个平行试验。 通过测量回收率来估计准确度, 通过计算3个平行实验结果的RSD来估计精密度。 为了能更好地评价方法的检测性能, 还将所建立的方法与国家标准的GC-MS法进行对比试验。 实验结果如表1所示。 所建立的比率型荧光探针在火龙果检测时的回收率在92.55%~102.24% 之间, RSD在2.28% ~3.62%(n=3)之间。 而GC-MS的回收率在84.22%~100.64%之间, RSD在2.95%~10.95%之间。 与GC-MS法相比, 所建立的实验方法获得更高的准确度(回收率)和精密度(RSD)。 值得一提的是, 当样品中乐果的加标量为4.0 ng·mL-1时, GC-MS法无法识别, 而所建立的荧光比率分析法仍可识别, 回收率为102.24%, RSD为3.62%, 说明所建立的方法比国家标准规定的GC-MS法具有更高的灵敏度。 此外, 本方法在1 h内可完成所有样品的检测, 而GC-MS法则需要10 h左右的检测时间, 说明本研究所建立的方法更加快捷。

表1 火龙果中乐果残留量的检测Table 1 Determination of dimethoate residues in pitaya
3 结 论
利用N-CQDs的不同荧光发射中心构建了比率型荧光传感器用于测定有机磷农药乐果含量。 在优化的实验条件下, 乐果的线性检测范围为2~180 ng·mL-1, 检测限为0.67 ng·mL-1(3δ/k)。 常见的干扰物质和其他类型的有机磷农药对乐果检测影响不大, 方法选择性好。 将所构建的方法用于火龙果中乐果的检测, 回收率在92.55%~102.24%之间, RSD在2.28%~3.62%(n=3)之间。 国标GB 232000.8—2016所规定的GC-MS法回收率在84.22%~100.64%之间, RSD在2.95%~10.95%之间。 与GC-MS法相比, 所建立的检测方法获得了更高的准确度(回收率)和精密度(RSD)。
