基于丝素蛋白的可注射水凝胶在肌肉再生工程的应用
2023-02-21李艾元施心雨刘梦斐宣智宏岳万福
李艾元, 施心雨, 刘梦斐, 李 诚, 宣智宏, 岳万福
(浙江农林大学 动物科技学院·动物医学院,杭州 311300)
蚕丝作为一种多用途的高分子聚合物,在组织工程和再生医学中的应用得到了广泛的探索[1]。丝素蛋白是从蚕丝提取的纤维蛋白[2]。丝素蛋白由一条重(H)链和一条轻(L)链组成,通过二硫键相连,形成HL复合物[3]。这种HL复合物还通过疏水作用以6︰1的比例结合形成一种糖蛋白(P25),三者构成基本胶束单元[4]。除了丝素蛋白外,蚕丝中还存在丝胶蛋白[5],当蚕结茧时,丝胶蛋白起到胶水的作用,丝胶蛋白将丝素蛋白结合在一起,丝胶蛋白占蚕丝的重量近30%[6]。丝素蛋白是一种生物相容性材料,因为它不会引起长期或持久的炎症反应[7]。当植入人体内时,它会引起轻微的初始炎症反应,并随时间消退,表明丝素蛋白具有免疫相容性,与其他常见生物材料相比,丝素蛋白的免疫原性较低[8]。
湖羊肌肉卫星细胞具备分化成湖羊肌肉组织的能力,与本次实验对象湖羊来自同源,不会引起免疫排斥反应。肌肉损伤和老化是人体肌肉主要的疾病形式[9]。肌肉损伤的修复过程首先需要激活肌肉卫星细胞,因为新肌肉纤维或原发性肌纤维的形成始于肌肉卫星细胞的激活[10]。其次是肌肉卫星细胞的增殖和分化阶段,形成肌细胞。最后通过肌细胞融合形成肌纤维,并整合到现有的肌肉中,完成肌肉的自我修复[11]。尽管肌肉具有与生俱来的再生能力,但某些条件下自我修复最终达不到健康的肌肉组织的标准,反而导致萎缩、发病和功能丧失[12]。例如,严重的车祸和大面积烧伤等意外中,肌肉组织的大量损失会阻碍修复过程并妨碍肌肉的功能恢复[13]。此外,某些肌肉萎缩疾病也可以阻止正常的肌肉组织再生过程[14]。肌肉卫星细胞疗法是增强肌肉修复的一种新的手段,采用自体或同种异体干细胞来增强自身肌肉修复的能力[15]。
组织工程技术尚未生产出用于治疗肌肉损伤的可靠产品,市面上人工合成物质在人体内难以降解并会引发免疫排斥反应,因此丝素蛋白水凝胶逐渐进入人们的视野[16],丝素蛋白水凝胶能够为细胞提供附着点和与细胞发生特异性作用,可调节的物理支撑,连接水凝胶内外的孔隙结构,进行氧气、营养物质和生长因子的交换[17],因此非常适合作为肌肉组织再生的细胞支架[18-19]。利用水凝胶进行肌肉组织工程已成为一种有希望的治疗方案。例如,将丝素蛋白水凝胶用作封装肌肉细胞的递送载体,发现丝素蛋白水凝胶能够促进肌肉细胞的增殖和分化,丝素蛋白水凝胶能够促进肌肉细胞整合,同时保护移植细胞免受移植手术加剧的慢性炎症环境的影响[20]。鉴于丝素蛋白水凝胶的多功能性,丝素蛋白水凝胶构成了独特的生物材料,广泛用于组织工程研究及许多肌肉疾病和损伤病理学[21]。
图1为DMPG诱导的丝素蛋白水凝胶制作工艺。首先将丝素蛋白溶解,得到丝素蛋白溶液,再将DMPG溶液加入到丝素蛋白溶液中,混合均匀后将细胞悬液加入到混合溶液中,然后用注射器将处于溶胶状态的丝素蛋白水凝胶注射到动物体内[22]。期望通过这种方式获得一种生物相容性良好的丝素蛋白水凝胶,能够为人类再生医学植入治疗肌肉损伤奠定基础。
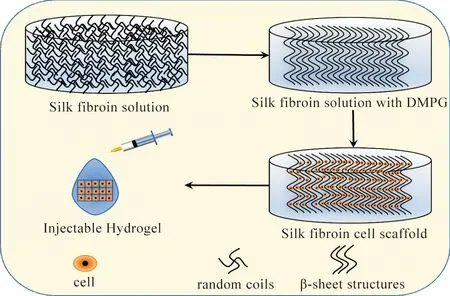
图1 丝素蛋白水凝胶制作工艺示意Fig.1 Schematic diagram of silk fibroin hydrogel making process
1 实 验
1.1 试 剂
PBS缓冲液(杭州浩克生物技术有限公司),碳酸氢钠(上海阿拉丁生化科技股份有限公司),二甲基亚砜(DMSO)、胎牛血清、双抗、胰蛋白酶-EDTA消化液、胶原酶Ⅳ、CCK-8试剂盒、DAPI溶液、4%多聚甲醛、曲拉通Triton X-100(北京索莱宝科技有限公司),溴化锂(国药集团化学试剂有限公司),透析袋(上海索桥生物科技有限公司),F12培养基(杭州昊鑫生物科技有限公司),MYHC一抗、DESMIN一体、FITC标记的二抗(武汉爱博泰克生物科技有限公司),活细胞/死细胞双染试剂盒(翌圣生物科技(上海)股份有限公司),100 μm细胞筛网(康宁(上海)有限公司)。
1.2 仪 器
烘箱(上海跃进医疗器械有限公司),载玻片及盖玻片(江苏汇达医疗器械有限公司),SI-A256涡旋仪(秒生科技有限公司),MC2掌上离心机(上海吉泰生物科技有限公司),ECLIPSE E100显微镜、ECLIPSE C1荧光显微镜(NIKON),KE003068移液枪(Dragon公司),SU8010台式扫描电子显微镜(日本松下公司),冻干机(香港力康发展有限公司),磁力搅拌器、iS50 FTIR傅里叶红外测谱仪、纯水仪(赛默飞世尔科技(中国)有限公司),KS-600D超声波水域锅(宁波海曙超声科技设备有限公司)。
1.3 丝素蛋白的制备
参照文献[23]的脱胶方法,利用丝素蛋白与丝胶蛋白溶解度不同来获得丝素蛋白,首先将蚕丝用剪刀剪为2~4 cm长度,按1︰200的浴比放入0.5%的碳酸氢钠溶液中煮沸30 min,期间每隔15 min用玻璃棒翻一次,煮好后用去离子水洗脱3次,此时丝胶蛋白溶解在0.5%碳酸氢钠溶液中;蚕丝煮好后用去离子水清洗6次,最后将脱胶的蚕丝放入烘箱,温度设置为37 ℃,干燥12 h后放入通风干燥处保存,即可得到丝素蛋白。
1.4 丝素蛋白溶液的制备
参照文献[23]的溶解方法,首先配置摩尔浓度为9.3 mol/L的溴化锂溶液。即1 L的烧杯中称取807.7 g无水溴化锂,加入600 mL超纯水溶解,使用磁力搅拌器使溴化锂完全溶解,冷却后加水到1 000 mL,使用循环水真空泵过滤溶液至澄清,得到澄清的9.3 mol/L的溴化锂溶液。将脱胶干燥后的丝素蛋白撕扯成蓬松的棉花状,事先将溴化锂溶液放入60 ℃的烘箱中预热30 min,之后将丝素蛋白与溴化锂溶液按照1︰4的溶质比溶解,丝素蛋白完全没入溴化锂溶液后再放入60 ℃恒温烘箱中继续溶解2 h,期间每隔15 min拿出来搅拌一次,溶解完毕后得到黄色的丝素蛋白—溴化锂混合溶液。将混合溶液放入透析袋中透析3 d,纱布过滤之后低温高速离心机7 000 r/min离心20 min,上清液用0.22 μm针头滤器过滤后放入4 ℃备用。
1.5 湖羊肌肉卫星细胞的获取
湖羊肌肉卫星细胞的分离采用胶原酶消化法:1) 无菌条件下,剥离湖羊胎儿后肢腿部肌肉组织,用75%乙醇轻微浸泡消毒后立即用PBS冲洗2次,放入盛有PBS的35 mm细胞培养皿中;2) 利用眼科剪将肌肉组织剪碎,加入适量Ⅳ型胶原酶后放入37 ℃、5% CO2培养箱中消化15 min,每隔5 min取出吹打一次,共3次;3) 消化结束后,加入2倍体积A培养基(F12培养基+10%胎牛血清)终止消化,用100目细胞筛过滤并收集细胞悬液至15 mL离心管中,低速离心机室温1 200 r/min离心15 min,弃上清液;4) 加入B培养基(F12培养基+10%胎牛血清+1%双抗)重悬细胞,将细胞悬液接种至100 mm细胞培养皿中,普通光学显微镜下观察细胞形态,放入37 ℃、5% CO2培养箱中进行培养。正常传代培养冻存,生长至对数生长期,后续用于注射湖羊体内。
1.6 湖羊肌肉卫星细胞的传代与冻存
将湖羊肌肉卫星细胞传至P2—P5代,显微镜下观察细胞形态。使用血细胞计数板计数,在细胞密度至少达到1×106mL时,进行传代培养,按照1︰3的比例进行传代培养。湖羊肌肉卫星细胞的冻存液采用“现配现用”的原则,将胎牛血清与二甲基亚砜(DMSO)按照10︰1的比例进行配比,在细胞密度达到1×106mL进行冻存。具体步骤为:在无菌条件下,首先用PBS洗去培养基,加入1 mL的胰酶进行消化,消化结束后,加入2倍体积A培养基(F12培养基+10%胎牛血清)终止消化,低速离心机室温1 200 r/min离心5 min,弃上清液,加入1 mL冻存液重新悬浮细胞,放入2 mL冻存管中,将冻存管放入冻存盒中,-80 ℃保存24 h后放入液氮长期保存。
1.7 湖羊肌肉卫星细胞的鉴定
1) 将生长至对数生长期的湖羊肌肉卫星细胞在24孔细胞培养皿中培养至70%~80%密度;
2) 移除培养基,用预冷的PBS缓冲液洗5次,每孔加入200 μL的4%多聚甲醛,将细胞培养皿放入冰上,固定15 min;
3) 移液枪移除多聚甲醛,用PBS洗5次,每孔加入200 μL 0.25% Triton X-100对细胞进行透化10 min;
4) 移除0.25% Triton X-100,之后用PBS洗5次,每孔加入200 μL封闭液(含0.25% Triton X-100的PBS),放入4 ℃过夜;
5) 移除封闭液,用PBS洗5次,按照1︰100的比例稀释一抗,每孔加入100 μL一抗稀释液,4 ℃孵育24 h;
6) 移除一抗,用PBS洗5次,按1︰50的比例稀释二抗,每孔加100 μL二抗稀释液,室温避光孵育1 h;
7) 移除二抗稀释液,用PBS洗5次,每孔加入100 μL DAPI染液,避光孵育15 min,PBS洗5次,彻底洗去DAPI染液,使用荧光显微镜观察。
1.8 丝素蛋白水凝胶的制备
制备的方法采用物理混合的方法,将丝素蛋白溶液(质量分数为3%),分别与三种摩尔浓度DMPG溶液混和。具体过程为:首先将DMPG与去离子水水和,然后超声波水浴加热30 min,将丝素蛋白溶液烘干称重(一般为6%),两者混合后保持DMPG的终摩尔浓度依次为5、10、15 mmol/L,丝素蛋白终质量分数为3%,制得三种摩尔浓度的胶块,放入4 ℃以便后续测定使用。
1.9 水凝胶结构测试
取适量冻干后的水凝胶样品于研钵中,加入溴化钾研磨均匀,压片并在傅里叶红外光谱仪中进行测试。仪器的分辨率为4 cm-1,扫描32次,检测范围为4 000~400 cm-1。谱图的采集和分析均使用Thermo Fisher公司的OMNIC 8.0软件,并将获得的数据导入到Prism 8.0中进行绘制。
1.10 细胞活力影响测定
选择生长至对数生长期的湖羊肌肉卫星细胞,使用浸提液的方法测定丝素蛋白水凝胶对细胞毒性的影响。具体步骤为:1) 将丝素蛋白水凝胶材料用75%乙醇浸洗5 min,然后用磷酸缓冲溶液PBS浸洗5 min,反复3次后加入纯培养基直至没过材料,静置24 h后作为浸提液备用;2) 在96孔板中接种湖羊肌肉卫星细胞悬液,在潮湿的培养箱中预培养24 h(37 ℃、5% CO2),更换细胞培养液,然后加入10 μL先前制备好的丝素蛋白水凝胶浸提液,不加浸提液作为空白组;3) 将培养板在细胞培养箱中培养12~48 h,取出湖羊肌肉卫星细胞培养板,向板的每个孔中加入110 μL CCK-8培养基混合液,将细胞板在培养箱中孵育30 min后取出,然后使用酶标仪在450 nm波长条件下测定各孔吸光度,取平均值并通过对照组评定材料的细胞毒性。
1.11 Masson切片染色及分析
取对数生长期(P2—P5代)的湖羊肌肉卫星细胞,细胞密度控制在1×105mL,终摩尔浓度DMPG为10 mmol/L,丝素蛋白终质量分数为3%,分装低温运送至羊场,无菌混合后,10 min后注射入湖羊耳朵,无细胞组作为对照,每组加一个不做处理的空白,做好标记归圈饲养。采集不同天数的湖羊组织耳朵组织进行Masson染色,先将石蜡切片脱蜡至水,再将切片放入无水乙醇和二甲苯等量混合溶液中15 min,接着在二甲苯溶液中处理20~40 min;然后在100%无水乙醇中处理10 min,95%无水乙醇中处理5 min,90%无水乙醇中处理5 min,80%无水乙醇中处理5 min,70%无水乙醇中处理5 min;最后使用蒸馏水洗。重铬酸钾媒染剂过夜,切片脱蜡至水后,重铬酸钾标准液常温过夜(约17 h)。Masson染色试剂盒内丽春红酸性品红液染5~10 min,蒸馏水快速漂洗。
磷钼酸处理:Masson染色试剂盒内磷钼酸水溶液处理1~2 min。苯胺蓝染色:不用水洗,直接用Masson染色试剂盒内苯胺蓝液复染5 s。分化:三缸1%冰醋酸依次处理5~10 s。脱水封片:三缸无水乙醇、正丁醇分别快速脱水15~30 s,二甲苯透明,中性树脂胶封片。显微镜镜检,图像采集分析。
染色结果:胶原纤维、黏液、软骨呈蓝色;肌纤维、纤维素和红细胞呈红色。
2 结果与分析
2.1 湖羊肌肉卫星细胞的培养与鉴定
从图2可以看出,湖羊肌肉卫星细胞具备了分化为肌肉细胞的能力。将分离得到的湖羊肌肉卫星细胞进行传代培养,将P2代(图2(a))湖羊肌肉卫星细胞放在显微镜下观察,湖羊肌肉卫星细胞呈梭形,细胞增殖能力强,细胞相互之间聚集但未发生融合,复合肌肉卫星细胞的特征;将P5代(图2(b))湖羊肌肉卫星细胞放在显微镜下观察,发现肌肉细胞相互融合,而且细胞形态向成熟的肌细胞发生改变,细胞增殖能力下降。为了进一步验证湖羊肌肉细胞是否为肌肉细胞,在P2代(图2(c))做免疫荧光染色,P2代湖羊肌肉卫星细胞未检测到Myod1细胞表面标志物(绿色荧光)的表达,只表达了细胞核的蓝色荧光;将培养至P5代(图2(d))做免疫荧光,检测到Myod1细胞表面标志物(绿色荧光)的表达,说明湖羊肌肉卫星细胞表达了肌肉相关的表面标志物。提取的湖羊肌肉卫星细胞具备了分化为肌肉细胞的能力,且细胞活力较好。
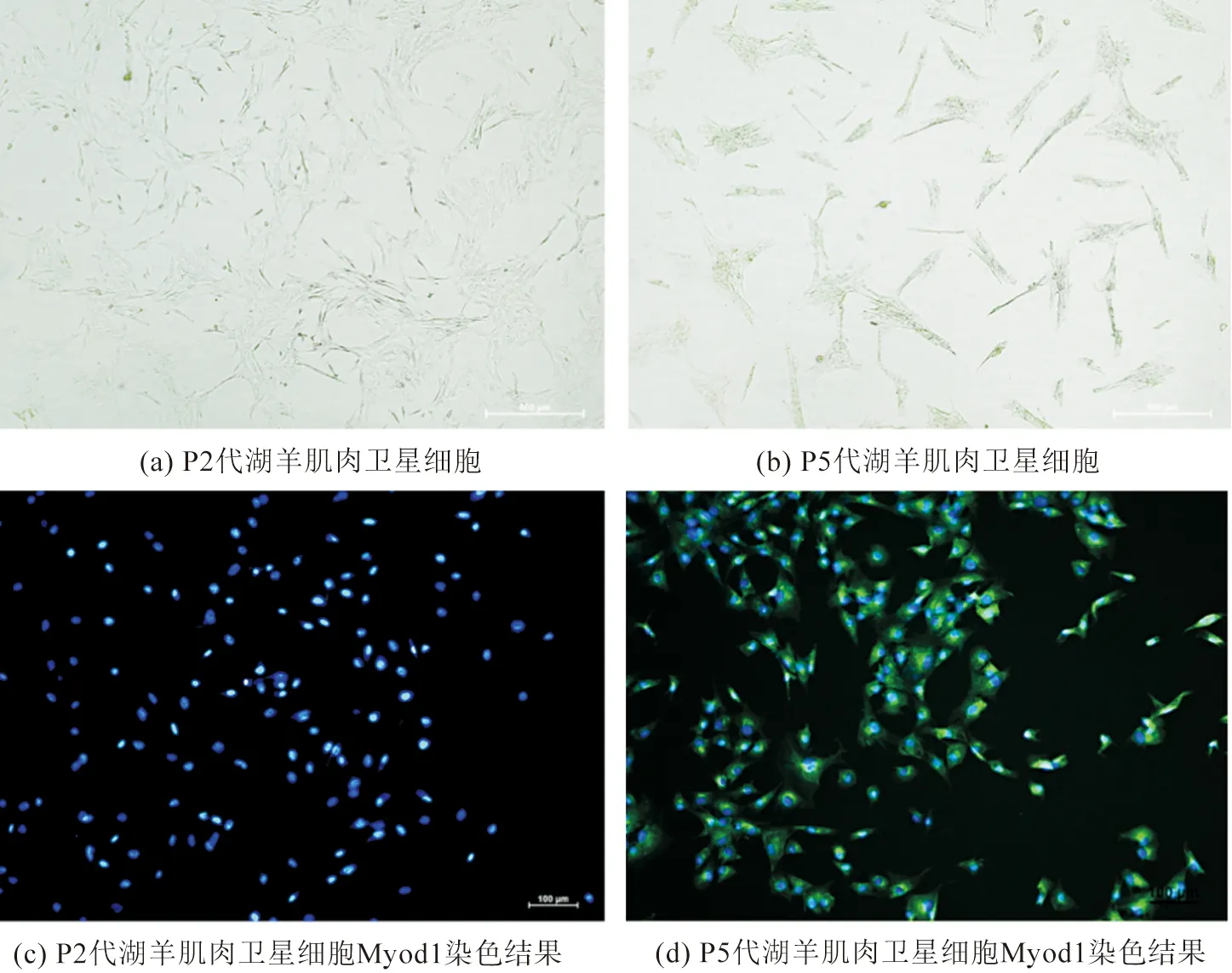
图2 湖羊肌肉卫星细胞鉴定结果Fig.2 Hu sheep muscle satellite cell identification results
2.2 丝素蛋白水凝胶红外光谱图
从图3结果可以看出,丝素蛋白水凝胶支撑结构主要是β折叠。红外结果显示,DMPG并没有改变丝素蛋白水凝胶的结构,加快凝胶的原理是蛋白质和脂质之间的静电和或疏水相互作用,诱导蛋白质构象变化。各个摩尔浓度的红外光谱如图3(b)所示,可以看出10 mmol/L和15 mmol/L的丝素蛋白水凝胶在波长为1 632 cm-1(酰胺Ⅱ谱带)、1 523 cm-1(酰胺Ⅱ谱带)、2 930 cm-1(C—H伸缩振动)3 280 cm-1(—COOH)处出现了蛋白质的特征吸收峰;5 mmol/L的DMPG蛋白特征峰不明显。DMPG诱导的丝素蛋白水凝胶的蛋白质特征峰未发生偏移,保留了主要的酰胺Ⅱ结构中的β折叠结构。
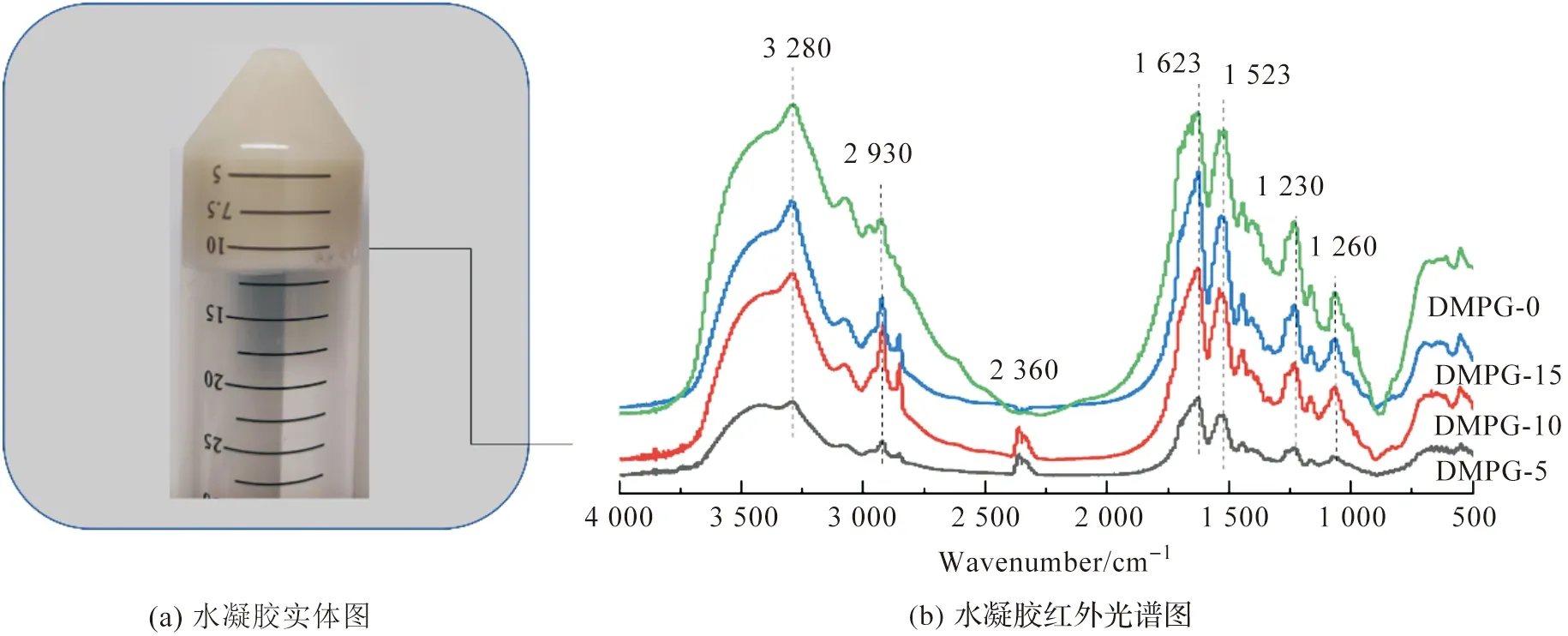
图3 傅里叶红外结果Fig.3 Fourier infrared results
2.3 丝素蛋白水凝胶生物相容的测定
从图4可以看出,DMPG诱导的丝素蛋白水凝胶具有良好的细胞相容性。本文分别选取了不同摩尔浓度DMPG,依次为5、10、15 mmol/L,丝素蛋白浓质量分数为3%。从图4(a)可以看出,加入丝素蛋白浸提液12 h后,三组OD值几乎没有差异,最高的是10 mmol/L丝素蛋白水凝胶处理组;从图4(b)可以看出,10 mmol/L的丝素蛋白水凝胶与细胞培养24 h后,OD值几乎没有任何变化,其余处理组OD值降低,其中空白处理组高于5 mmol/L和15 mmol/L处理组;从图4(c)可以看出,10 mmol/L的丝素蛋白水凝胶与细胞培养36 h后,OD值升高,空白对照组OD值与24 h的OD值没有发生变化;从图4(d)的结果可以看出,细胞与丝素蛋白水凝胶浸提液共培养48 h后,只有10 mmol/L的OD值保持在2.0左右的水平,其余处理组均徘徊在1.0~1.2。结果反映出了不同摩尔浓度之间的丝素蛋白水凝胶对细胞的影响,其中10 mmol/L处理组的随着与细胞培养时间的增加OD值逐渐增加,OD值反映了细胞活力的大小,细胞活力越大,OD值越高,10 mmol/L的丝素蛋白水凝胶是3种摩尔浓度中细胞相容性最好的。

图4 不同摩尔浓度的丝素蛋白水凝胶浸提液对细胞OD值影响的结果Fig.4 Results of the effect of the silk filament hydrogel extract of different mol concentrations on the cell OD value
2.4 肌肉生成与支架降解的分析
从图5可以看出,丝素蛋白水凝胶能够在湖羊体内凝结,并且使水凝胶内的湖羊肌肉卫星细胞增殖分化为新的肌肉组织,最后随着植入天数的增加,丝素蛋白水凝胶逐渐降解。从图5(a)可以看出,丝素蛋白水凝胶在第11天时基本降解完成;从图5(b)可以看出,丝素蛋白水凝胶(含湖羊肌肉卫星细胞)在湖羊体内凝结,蓝色区域为胶原纤维,即丝素蛋白水凝胶;从图5(c)可以看出,丝素蛋白水凝胶(不含湖羊肌肉卫星细胞)在湖羊体内凝结,蓝色区域比含细胞的水凝胶较小;从图5(d)可以看出,正常肌肉组织的状态,与植入水凝胶的肌肉组织形成鲜明的对照。图5(e~g)则直观地显示了丝素蛋白水凝胶在植入湖羊体内1~11 d过程中水凝胶发生降解和肌肉再生,Masson染色将丝素蛋白水凝胶染成蓝色,蓝色部分随着植入湖羊体内的天数逐渐降解;同时,Masson染色将肌纤维染成红色,红色部分随着植入的天数增加逐渐成熟,肌纤维数量更多而且直径变粗。
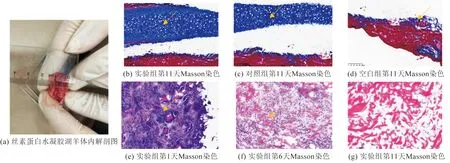
图5 不同天数水凝胶层Masson染色结果Fig.5 Masson staining result of hydrogel layers for different days
3 结 论
通过实验,本文获得了一种高效、简易、无免疫原性、可降解的丝素蛋白水凝胶细胞支架。具体结果如下:
1) DMPG诱导丝素蛋白形成的水凝胶是一种可注射的水凝胶,且结构比较稳定。
2) DMPG诱导的丝素蛋白水凝胶具有良好的细胞相容性,其中摩尔浓度10 mmol/L的细胞相容性最好。
3) DMPG诱导的丝素蛋白水凝胶具有良好的生物相容性,在湖羊体内凝结而且成功实现肌细胞到肌纤维再到肌肉组织的分化过程。

《丝绸》官网下载

中国知网下载
