极端环境下的生物节律
2023-02-21虞子青张二荃
虞子青, 张二荃
(北京生命科学研究所, 北京 102206)
1 生物节律
1.1 生物节律概述
地球以24 h为周期自转,产生了每天的昼夜交替,从而使地面上的光照、温度等环境也产生24 h为周期的规律变化。为了适应这种周期性的环境波动,地球上的生物进化出了昼夜节律[1]。内源性的生物节律最早出现在25亿年前的蓝细菌中[2],并作为一种较为保守的生命活动调节机制广泛存在于各种生物中。一般情况下,与外在环境一致的生物节律会使生物更加适应环境,获得进化上的优势。目前,越来越多的人从事昼夜颠倒的工作,由于活动时间与内源性生物节律和外界环境不符而导致的睡眠紊乱和代谢疾病发病率越来越高[3]。睡眠时间不足是导致心脑血管疾病发病的因素之一,睡眠时相的改变会导致生物节律的改变。长期的内源性生物节律与外界环境和行为节律的不同步,会导致代谢状态不良和心脑血管疾病患病概率上升[4]。
从每个节律基因的表达水平,到体温、心跳和活动等生理指标都呈周期性变化,这些变化可以用正弦曲线近似地描述。因此,可以用相位(phase)、振幅(amplitude)、周期(period)等3个参数来描述生物节律(Fig.1)[5]。

Fig.1 Three parameters to describe circadian clock Since the expression levels of circadian genes and many physiological indicators oscillate in a sine-like pattern, circadian rhythm is always described by 3 parameters: amplitude, phase, and period
20世纪70年代,随着Konopka和Benzer等[6]在果蝇中发现了可以改变生物节律周期的遗传突变株Period(Per),人们逐渐意识到生物节律是由一系列基因控制的。在哺乳动物中,光线从视网膜传入产生生物节律的中枢,视交叉上核(suprachiasmatic nuclei,SCN),从而完成外界光线环境对生物体内源生物节律的“校准”和同步化。视交叉上核又将该信号传递到其他脑区以及外周器官,使得各个器官以统一的节律进行各自的生命活动[7]。
1.2 转录-翻译负反馈环路
大多数情况下,生物节律是在转录层面上的周期性调控,生物钟基因组成了一个转录-翻译负反馈环路(transcriptional-translational feedback loop,TTFL)。核心生物钟基因由bHLH (basic helix-loop-helix) -PAS (PER-ARNT-SIM)家族转录因子、酪蛋白激酶和一些孤儿核受体组成,这些转录因子可以识别生物钟基因启动子上的E-box、D-box或视黄酸受体相关孤儿受体结合元件(retinoic acid receptor-related orphan receptor binding element,RRE)等元件。在哺乳动物中,最核心的环路由转录激活因子(circadian locomotor output cycles kaput,Clock)和Bmal1(brain and muscle Arnt-like 1,又称aryl hydrocarbon receptor nuclear translocator-like protein 1或Arntl1),以及转录抑制因子Per(period)和Cry(cryptochrome)组成。Clock和Bmal1形成异源二聚体,结合在包括Per和Cry等基因启动子的E-box元件上,促进这些基因的表达;随着Per和Cry蛋白质的积累,它们又可以反过来结合Clock-Bmal1二聚体,从而抑制转录激活因子的作用,减少自身的表达,形成负反馈。
除此之外,Rev-erb和Ror的表达也受到Clock-Bmal1复合物的调控,而Rev-Erb和ROR蛋白质又能通过RRE调节Clock和Bmal1的转录。DBP(D-box binding protein)本身受E-box调控,E4BP4(E4 promoter-binding protein 4)受RRE调控,这二者又可以通过D-box调节Per的表达。如此,便形成了3个环环相扣、互相影响的转录-翻译负反馈环路(Fig.2)。

Fig.2 Interlocking loops of mammalian circadian components The core loop is composed of Clock-Bmal1 and Per-Cry. Transcription activators (RORs and DBP) and repressors (Rev-ERBs and E4BP4) synergistically regulate the expression of Clock, Bmal1, and Per. Adapted from Zhang et al[8]
随着分子生物学和细胞生物学的发展,越来越多的生物钟相关基因被发现,上百个基因可以通过各种与核心生物钟环路直接或间接的相互作用参与到生物节律的调控中,这也表明,许多调控其他生命活动的蛋白质受生物节律的调控,也反过来影响着生物节律[8]。
2 环境对生物节律的影响
2.1 光照对节律的给时者效应
环境中的光信号经视网膜神经元的感光换能后,通过视网膜-下丘脑束传递给视交叉上核,使中枢生物钟与外界光照节律同步;视交叉上核再将节律信息传递到身体各组织器官,使机体各部分作为一个有机的整体产生有节律的生理活动与行为[9]。虽然进食、药物、运动、睡眠-觉醒周期都可以影响生物节律的同步化[10],但光照仍然是节律系统最初级的给时者(zeitgeber)[11]。
视网膜本身也是一个有节律的器官。视网膜的节律使我们在24 h内感受到变化超过1* 106倍的光强范围,可以为每一种光照状态调整合适的视觉灵敏度[12]。在视交叉上核病变或视神经截断的动物中,视杆细胞的外截视盘脱落节律和血清素N-乙酰转移酶(aralkylamine N-acetyltransferase,AANAT)mRNA的昼夜节律依然存在,这意味着视网膜的节律可能不受节律中枢视交叉上核控制[13]。视网膜会影响视交叉上核的节律。去除视网膜会扰乱MAPK的磷酸化的节律,感光细胞的脱落会导致视交叉上核cAMP应答元件结合蛋白(cAMP response element-binding protein,CREB)在夜间的磷酸化水平升高[14]。
在光线激活视网膜的感光细胞后,谷氨酸是在这个光诱导过程中发挥主要作用的信号分子。谷氨酸与其受体结合,引起视交叉上核神经元的钙离子内流。第二信使浓度的增加导致了一系列信号通路的激活,包括钙调蛋白依赖性激酶II(calmodulin-dependent protein kinase II,CaMKII)、神经元一氧化氮合酶、cAMP和cGMP依赖的蛋白激酶、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)。这一系列的信号导致了CREB的磷酸化,磷酸化的CREB结合在节律基因Per和Cry启动子的cAMP应答元件上,导致这些基因的转录被激活,从而实现光线对节律基因的调控[12, 15, 16]。
除了正常的昼夜交替会“校准”我们的节律之外,短时间和长时间的光刺激都会对正常的节律产生影响。光刺激在某些时候对于生物节律的相位无任何作用,但在某些时间点的光刺激会导致节律相位的提前或滞后——这也是相位响应曲线(phase response curve,PRC)的定义[17, 18]。不同时间点对于光照刺激不同的响应,其实就起到了将内源性生物节律转换成被光同步化过后的真实节律的作用。实际上,在完全黑暗(constant darkness,DD)实验条件下,在某时间点给予小鼠1个或者2个光脉冲刺激,就能根据受到刺激的时间诱导出新的相位[19]。
持续光照条件(constant light,LL)会破坏小鼠个体的昼夜节律。例如,处在恒定光照环境下的小鼠会表现出运动减少、节律周期变长,直到无节律的表型。虽然恒定的光照会使视交叉上核的细胞去同步化,从而导致节律紊乱,但是这种情况下细胞内部的节律不会被破坏,单个细胞的节律基因表达还是正常的[20]。
将恒定光照下的小鼠放回恒定黑暗的环境,小鼠行为以及基因表达水平的节律都会迅速得到恢复,这意味着真正的内在节律被光照掩盖了[21]。因此,短时间的脉冲光刺激会改变节律基因的表达,从而影响相位,长时间持续光刺激会扰乱细胞之间的同步化耦合,但是目前的机制尚不清楚。
2.2 氧气对节律的影响——缺氧通路与生物钟环路的相互作用
氧气是氧化磷酸化过程中最终的电子受体,可产生活性氧(reactive oxygen species, ROS)。活性氧具有较高的反应活性,可破坏大分子,从而导致细胞功能障碍或细胞死亡。因此,进化使得所有现存的生物都有一个维持氧稳态的系统,其主要分子机制在于缺氧诱导因子(hypoxia inducible factor,HIF)的氧化和降解[22]。在正常氧气水平下,PHD家族脯氨酸羟化酶能利用氧气将HIF-α中的1个特定脯氨酸残基羟基化,VHL(von Hippel-Lindau )蛋白与羟基化的HIF-α结合,招募泛素连接酶,并介导HIF-α的降解。HIF-1α抑制因子(FIH1)也会利用氧羟基化HIF-1α上的天冬酰胺残基,抑制其与共激活蛋白质的相互作用[23, 24]。
与大多数节律转录因子一样,HIF家族的蛋白质(HIF-1/2 α/β)也含有bHLH-PAS结构域,可以介导异源二聚体和DNA的结合[25]。在缺氧条件下,HIF-α蛋白不会被羟基化,因此较为稳定,可以与Arnt(aryl hydrocarbon receptor nuclear translocator,又称HIF-1β)形成异源二聚体,然后与和E-box序列相似的缺氧应答元件(hypoxia-response elements,HREs)结合,招募p300/CBP促进下游基因转录[26]。
在过去的几十年中,大量研究表明,氧气水平或者说缺氧的状态,会影响生物节律;反之,缺氧诱导因子也受到生物节律的调控[27]。在缺氧条件下,斑马鱼中的某些节律基因,例如Clock和Per1表达水平会显著改变,且在长期暴露在缺氧条件下会使斑马鱼生物节律的振幅减弱,在小鼠成纤维细胞中也观察到了类似的结果[28];长时间低氧环境的暴露也会显著增加小鼠大脑内的Clock和Per1蛋白质水平[29]。另外,有对于大鼠和小鼠等模式生物的研究表明,急性暴露于缺氧环境中,会削弱体温节律的振幅。总体来看,缺氧通路的激活会减弱生物节律。在离体细胞中加入模拟缺氧环境的化合物,例如DMOG等,也可以看到荧光素酶报告基因显示出的细胞节律性的降低。激素水平、酸碱平衡、心脑血管相关指标等生理指标的节律性在低氧环境下也会显著性减弱[30]。
由于生物钟和缺氧状态是相互影响的,而且这2种调控机制都是基于转录的,因此,生物钟蛋白质极有可能与缺氧相关蛋白质存在直接的相互作用,并可以协同调节生命活动。最初,人们利用凝胶迁移实验(electrophoretic mobility shift assay,EMSA)来观察Clock和HIF-1α在抗利尿激素基因转录激活中的协同作用[31],并通过荧光原位杂交技术(fluorescence in situ hybridization,FISH)来证明Bmal1和Bmal2(又称Arntl2)会与缺氧因子形成异源二聚体[32, 33];荧光素酶报告基因实验也证明,Epas1(也称作HIF-2α)和Bmal1共同激活了Pai1基因的转录[34]。这些实验都未直接看到二者的直接的协同作用,但也提示我们,除了2个通路之间的相互影响外,节律蛋白质可能与缺氧因子确实存在蛋白质-蛋白质相互作用。然而,仍需要更多的研究来证实这一假设。
直到2017年,生物节律与缺氧信号通路在分子水平直接的相互作用才受到广泛关注。染色质免疫共沉淀(ChIP-seq)表明,超过三分之一的HIF-1α结合的基因是与Bmal1重合的,免疫共沉淀等一系列的生化实验也证实,HIF-1α与Bmal1之间存在直接的相互作用[30]。另外,同年另一项研究表明,小鼠血液和组织中的氧气含量也有节律;在培养的细胞中可以用节律性的氧气浓度变化来重置细胞的节律,部分节律基因会响应氧气浓度的变化而改变表达模式,而这种改变也依赖于HIF-1α[28]。
结构决定功能,相似的蛋白质结构或许意味着在功能上也会有所交叉。Clock、Bmal1等生物钟蛋白质和缺氧诱导因子都属于bHLH-PAS家族的转录因子,都有着可以和DNA结合的碱性螺旋-环-螺旋(bHLH),2个串联的PAS结构域 (PAS-A和PAS-B),以及一段结构多变的转录激活或转录抑制结构域(TAD或TRD)。这2个PAS结构域,都是由5个反向平行的β折叠以及数个α螺旋构成的[35, 36],是形成异源二聚体时负责与另外的转录因子相互作用的接触面[37, 38]。
根据异源二聚体的聚合形式,bHLH-PAS家族蛋白质可以被分成2类。其中1类包括3种缺氧诱导因子(HIF-1α, HIF-2α, HIF-3α),芳烃受体(AHR),芳烃受体抑制蛋白(AHRR),4种神经元PAS蛋白(Npas1, Npas2, Npas3, Npas4),2种Sim蛋白(Sim1, Sim2),和生物钟蛋白Clock。另1类包括Arnt,Arnt2,Arntl1,Arntl2[39]。这两类蛋白质之间可以形成异源二聚体。例如目前已经解出晶体结构的生物钟核心环路里的转录激活因子Clock-Bmal1二聚体,以及在缺氧调控通路中的HIF-1α/2α-Arnt二聚体。目前,虽然并未解出缺氧诱导因子和Bmal的异源二聚体结构,但相似的结构域排布以及一些生化实验提供二者存在直接相互作用的线索,还是为接下来纯化并解出HIF-Bmal复合物晶体结构提供了希望。
2.3 环境温度对节律的影响
理论上,反应温度会决定化学反应的速率。然而,对于从简单到复杂的各种生物节律系统来说,温度的变化并不会改变周期,这被称为“温度补偿效应”[40]。温度的改变不影响周期的长短,并不意味着温度对于生物节律毫无影响。除恒温脊椎动物外,环境温度循环是生物体内昼夜节律系统非常普遍的诱导线索。在植物、昆虫和鸟类中,温度也有可能成为除光线之外的给时者[41]。
在链孢菌中,温度的高低会影响生物钟蛋白Frq的表达量。因此,温度的变化可以表现为节律蛋白质的绝对数量,从而确定当前的时间[42]。拟南芥的离体组织中,蛋白质-蛋白质之间的相互作用节律是独立的,但地上部分的组织和地下部分的组织都可以单独响应环境温度信号的周期性变化,以维持其温度补偿效应[43]。在果蝇中,温度会影响生物钟蛋白Per的磷酸化和稳定性以及Per基因mRNA的剪切;转录组分析也表明,果蝇的一部分基因转录会受到温度的调控。人们认为,果蝇中节律基因的表达实际上是光线和温度共同控制的[44]。
恒温的哺乳动物中,环境温度只能算是一种非常弱的给时者,与光照相比未见那么重要。但是哺乳动物的生物节律系统其实也保留了一部分对环境温度的敏感度,这种敏感度使得环境因素的变化在核心体温节律中发挥一种“中介”的作用,让机体潜在的节律和生活环境同步[41]。
将大鼠放在30 ℃环境中4周,就可以观察到大鼠体温节律的振幅下降[45];狐猴放置在较低的环境温度中,则会增加一天之内体温节律的振幅[46]。然而,对于哺乳动物个体来讲,一般很难判断由环境温度改变而引起的节律变化究竟是由于温度直接对节律的影响,还是温度对体温调节系统有所影响,从而影响了核心体温的节律或者其他生命活动节律的振幅。
但是,对于离体的哺乳动物组织来说,变化的环境温度确实可以诱导出不同相位的生物节律。因为,由视交叉上核驱动的一天之内的体温的变化节律,对于外周器官来讲就是一个非常好的同步化信号。这样由体温节律驱动的系统需要满足2个条件:1是视交叉上核本身不能对这种微小的体温波动过于敏感,2是外周组织的节律能在正常生理状态下的体温波动范围内对温度的变化产生响应。有一项研究将视交叉上核、垂体和肺在36 ℃下离体培养,并分别规律地给予时长为1 h和6 h, 38.5 ℃热刺激,以Per2启动子驱动的萤火虫荧光素酶报告基因(Per2-luciferase)发出的荧光信号作为节律性的输出。结果显示,视交叉上核的节律并未受到热刺激的影响,而垂体和肺都在2种热刺激之间表现出了不同的相位。加入河豚毒素阻断钠离子通道,视交叉上核节律对于温度变化的抵抗就会消失;加入热休克蛋白(heat shock protein)抑制剂KNK437阻断热休克反应通路,则会让视交叉上核失去温度补偿效应[47]。这些结果表明,进化上古老的温度重置节律的反应在恒温动物上同样适用,可以增强内部昼夜节律同步。
3 极昼极夜下的生物节律
3.1 研究概述
生物节律最基础的给时者是光线的昼夜交替,而在北极圈和南极圈内,极昼极夜存在的时间随纬度升高而延长。在南极和北极极点,1年中有一半的时间是极昼,一半时间是极夜;而在北极圈或南极圈(北纬或南纬66.5°),只有夏至日和冬至日会出现完全的极昼和极夜。因此,在极圈内栖息的生物,1年中会有一段时间缺乏光线对节律的诱导。然而,即使在极昼极夜期间,温度或其他气候条件也会随时间有规律地变化,人们可能会观察到由于温度、食物、或非极昼极夜期间微弱的光线对内源性节律的掩蔽效应。北极的候鸟在极昼期间活动是有节律的,南极原住民阿德利企鹅(Pygoscelisadeliae)在冬天也会保持进食的节律[48],北极地松鼠(Urocitellusparryii)在夏天能保持每天处于地面之上活动节律[49, 50]。
虽然对于动物活动的观察显示,在极昼极夜的情况下部分生物还是保持了节律性,但不能因此推断极昼极夜不影响内源的节律。在极圈内的不同纬度栖息的种群,在1年中不同的时期,也有可能具有不同的节律表型。例如,在79°N的纬度,全年检测北极驯鹿(Rangifertarandus)的活动性以及心跳、瘤胃温度等生理指标,会发现在极昼极夜期间,活动性节律丧失,生理指标的内源性节律也大幅减弱,这意味着北极驯鹿会在极昼极夜期间会失去节律[51];而在70°N,会由于这个纬度即使在“极夜”期间,也会有微弱的光线,导致其实并不存在真正的“极夜”,因此,在极夜期间也能保持昼夜节律[52]。
3.2 北极驯鹿的节律基因突变
一项研究对比了78°N和70°N的北极驯鹿(78°N的为Rangifertarandusplatyrhynchus,简称SR;70°N的为R.tarandustarandus,简称NR)的生物节律相关表型。这2种北极驯鹿都可以在1年中观察到相对活跃与相对不活跃的次昼夜节律。然而,NR的节律是由光照周期控制的,SR几乎不被光照控制。SR对光照的反应、昼夜节律和同步化的社会活动都很弱[53]。
2019年的一项研究揭示了这种区别的分子机制。正如前文所说,光信号诱导生物节律需要谷氨酸与受体结合,改变细胞内钙离子浓度,从而导致下游信号通路的激活,引起CREB的磷酸化,再激活包括核心节律基因Per、Cry的部分节律基因的转录。通过KEGG(Kyoto Encyclopedia of Genes and Genomes)对驯鹿的基因组进行分析,发现8个与该通路相关的基因(Per2,Noct,Gria1,Grin2b,Grin2c,Itpr3,Adcy5,Nos1ap)在功能结构域存在突变,4个基因(Adcy2,Adcy8,Calml4,Camk2)还显示出了快速的进化。Per2基因P1172 T的突变,使得Per2蛋白无法与Cry1蛋白有效结合,从而丧失了生物钟核心环中的负反馈抑制作用,这是导致北极驯鹿丧失内源性节律的主要原因。Gria1和Gria2基因编码的是谷氨酸受体,是将光信号从视网膜传递到视交叉上核产生节律的关键。Itpr3编码了钙离子通道,Adcy、Camk2、Calmk4、Nos1ap则编码了负责CREB磷酸化的蛋白质。总体看来,在生物节律被光线同步化的信号通路中,每个环节都有基因在无节律的北极驯鹿中出现了突变与进化(见Fig.3)[54]。

Fig.3 Mutations of the circadian rhythm genes and pathways in the reindeer Light regulates the molecular clockwork in reindeer SCN neurons. G, G protein; P, phosphorus; nNOS, neuronal nitric oxide synthase; ER, endoplasmic reticulum. Red, specific variant genes; blue, rapidly evolving genes. Adapted from Lin et al[54]
对于食草动物来说,北极是1个十分极端的环境。1年当中初级产量很低,只有在地面无雪、温度相对较高的夏季,食草动物才会获得食物来源。北极的食草动物依靠夏季积累身体的脂肪,为漫长的寒冬提供能量储备。因此,在极昼期间放弃昼夜节律、保持高度活跃、最大限度摄取能量的个体,会在自然选择中占据优势,这也是大量生物钟基因在北极驯鹿中发生正向选择的动力。
3.3 极昼极夜对人类节律的影响
对于在南极和北极进行科考工作的人来说,极昼和极夜也是影响昼夜节律,影响睡眠、代谢、情绪健康和工作效率的一大障碍。研究两极地区人类的昼夜节律出现的问题并想法改善,是十分有应用价值的。
人们将冬季光线不足引起的心理障碍称为季节性情绪失调(seasonal affective disorder,SAD),而给予更长时间的灯光来模拟夏季长时间的光照则可以缓解这一症状。在两极地区工作的人,在漫长的极夜期间也会出现类似的情况。另外,对于极地工作人员尿液中褪黑素代谢物(6-sulfatoxymelatonin,aMT6s)的测量,以及对于睡眠-觉醒节律的监测表明,在极夜的情况下,生物节律相位会推迟约1.5 h,且睡眠质量会变差[55, 56]。2006年的一项研究表明,若将光照在4~5个周的周期内用标准白光和富蓝光的灯泡交替进行,就可以显著缓解由于极夜带来的情绪和睡眠问题[21, 57]。
长时间的黑暗环境下,生物体表现出的是其内源性节律,在长时间无光照进行同步化的情况下,内源性节律的周期并不是严格的24 h,因此相位可能逐渐发生偏移;而持续的光照会使哺乳动物的生物钟神经元去同步化,从而导致行为上节律的丧失[20]。在极昼的环境下,若不对光照条件加人工干预,则会产生比极夜更加严重的影响。一项在加拿大军事基地(位于北纬82.5°)开展的研究表明,由于士兵需要在极昼期间的夜晚时间在户外值班,长时间的光照信号抑制了松果体产生褪黑素,导致睡眠总时长与同年冬季相比有明显的下降,并出现入睡困难和认知功能下降等症状;在值班结束光照条件允许休息情况下,士兵们入睡困难的现象仍然存在,无法得到充分的休息。该研究在2012年和2014年进行了2次实验,由于2012年夏季的平均光照强度高于2014年夏季,士兵们在2012年夏季的睡眠质量明显差于2014年。在2012年夏季,给予士兵褪黑素治疗,主观报告的入睡难易程度得到明显的改善,但实际测量的睡眠质量并无明显区别[58]。
虽然随着可穿戴式测量设备的普及,可以更加便捷地获得人类受试者的睡眠、体温、心率、活动和血压等长期记录节律的数据,但对于内源性节律(例如生物钟基因的表达和激素的分泌等)的测量仍无便捷的方法;另外,在两极的极端环境下,开展生理和生化实验,尤其是针对人类受试者进行实验,是非常困难的。尽管可以在低纬度地区模拟极昼极夜的环境进行一系列实验,目前的研究也仍然受到测量手段的限制,无法深入研究内源性节律的变化;另外,模拟环境光源与自然光源在波长和光强上都有一定的差距,能否在低纬度地区较为准确地模拟极昼极夜环境,从而得出科学合理的结论,仍有待商榷。通过高通量测序和一系列分子生物学手段逐步了解两极的极端环境对动物的自然选择规律,对如何开展人类的相关实验,以及人类应当如何调整以适应极地环境会提供一些启示。
4 高海拔地区的生物节律
4.1 高海拔地区的生物节律研究概述
不同于极昼极夜带来的光照条件变化对生物节律直接的影响,高原地区低氧、气候多变、昼夜温差大等特殊的自然环境,以及其特殊的生态结构,使得高原地区的部分生物进化出了独特的昼夜节律。青藏高原、安第斯高原、埃塞俄比亚高原是最大的3个具有长期居住人群的高海拔地区[59],不少从进化角度探索人类对于高海拔环境适应的研究都会对比这3个地区的高原原住民具有的跟缺氧通路相关的基因多态性;这些高原上常见的哺乳动物的行为和生理指标也经常是研究人员关注的焦点。
对于缺氧环境的适应性以及生物节律的改变,3个地区的高原原住民的表型似乎不尽相同。安第斯高原居民的血红蛋白浓度和血红蛋白氧饱和度的百分比高于相同海拔的青藏高原居民。并有证据表明,埃塞俄比亚高原居民在这2方面与平原居民无区别。低氧介导的昼夜节律变化被认为是高海拔低地居民睡眠片段化和睡眠质量差的关键驱动因素,而埃塞俄比亚高原居民的睡眠质量显著优于青藏高原居民和安第斯高原居民[59, 60]。
虽然目前的研究锁定了HIF、VEGF、EPO等缺氧响应基因以及血氧饱和度、血红蛋白浓度等生理指标在高原原住民当中的进化和自然选择,然而,现有研究的问题是,基因多态性、生理上对低氧环境的适应、生物节律(包括体温、睡眠等指标)的改变,几乎都是分离的。若一直以人类或某些在高原地区栖息但难以捕捉、饲养和操作的野生动物为对象展开研究,便会只能从现象上解释现象,而很难把分子水平的进化与生理水平的改变联系起来,得出一个从基因到表型的完整结论。
4.2 高海拔地区生物潜在影响生物钟的缺氧相关基因突变
由于众多研究表明,生物钟环路和缺氧信号通路存在功能上的和蛋白质相互作用层面上的交叉,缺氧信号通路相关的基因突变很可能也会影响到生物节律。为了适应高海拔地区的缺氧环境,多种生物在进化过程中具有了与缺氧相关的独特的表型,然而,不同高海拔地区的生物对于缺氧环境的适应而做出的进化也有所不同,例如青藏高原居民与安第斯山脉居民,在包括氧气输送过程的许多生理特征中有很大的数量差异。近10年来,随着全基因组测序技术的发展,在不同高原地区的各种哺乳动物为了适应缺氧环境而自然选择出的基因多样性逐渐被揭示。
对于安第斯高原居民的基因组分析显示,至少有40个与缺氧通路以及缺氧相关的基因与高海拔环境的自然选择相关[60]。而对于埃塞俄比亚高原居民来说,有更多发生在非典型的缺氧相关的基因上的自然选择,而其中部分基因,就是既能调控缺氧相关基因的表达,又参与到生物钟环路里的bHLH家族转录因子。DEC2(bHLHe41)就是其中之一[61]。HIF1a-ARNT蛋白二聚体是缺氧诱导的血管内皮生长因子(vascular endothelial growth factor,VEGF)转录过程中的关键激动因子,而DEC2可以通过与HIF1a-ARNT相互作用,来抑制VEGF的转录。而DEC2又参与到许多生物钟基因,或与睡眠、觉醒相关的神经肽(例如食欲肽(orexin))的转录调控中[62, 63],在DEC2基因上的自然选择或许就会带来生物节律方面的改变。另一个在埃塞俄比亚高原居民中发现可能与缺氧适应性和生物节律都相关的基因是ARNT2,正如前文所说,该基因也属于bHLH家族转录因子,存在和核心节律蛋白质相互作用的可能。
对于青藏高原的人类及马、狗等其他哺乳动物来说,Epas1基因表现出最强的正向选择的特征[64, 65]。在藏马中,Epas1的2个错义突变有可能会与促进血液循环的生理参数,以及缺氧条件下氧气运输和消耗的血液密切相关。通过蛋白质诱变的功能验证表明,这些突变增加了Epas1的稳定性和对Arnt的异源二聚体亲和性[66]。另一项研究中,人们首先测量了来自西藏和中国低海拔地区的乡村狗的血红蛋白水平,并发现两组之间的血红蛋白水平非常相似,这表明藏狗可能与藏人有相似的适应策略。通过全基因组测序方法,确定了Epas1和Hbb是青藏高原缺氧适应的候选基因。种群遗传分析表明,西藏的人与狗之间存在显著的趋同现象[67, 68]。Epas1蛋白与核心节律蛋白Bmal1存在相互作用,Epas1-Bmal1复合物在胚胎发育、软骨生成中也发挥关键作用[69]。影响Epas1基因表达量和蛋白质稳定性的突变极有可能通过其与Bmal1的相互作用,对生物节律产生一定的影响。
4.3 高原鼠兔的节律
除了南极北极之外,青藏高原被称为地球上的“第三极”。高原鼠兔在青藏高原从海平面上隆起之前就已经栖息于此地,因此,高原鼠兔的进化过程会在一定程度上代表哺乳动物逐渐适应高原环境的过程。由于青藏高原是世界上海拔最高的高原,氧气含量低;又因为高原鼠兔是青藏高原上数量最多的哺乳动物,说明它们是最适应该地区生态特征的哺乳动物[70],它们常年生活在低温、低氧的极端环境中,是研究低氧适应的理想动物模型。研究高原鼠兔的生物节律或许有助于理解高原哺乳动物在低氧环境下的节律状况,以及通过缺氧信号通路与生物钟环路的相互作用,来解释高原上的哺乳动物为了适应缺氧环境而在进化上做出的改变。
有生态学研究对高原鼠兔进行录像,然后分析其活动,认为高原鼠兔属于夜伏昼出的昼行性动物,并且其活动节律随季节变化而不同[71];又有研究表明,高原鼠兔的体温和活动是无昼夜节律的[70]。因此在很长一段时间内,人们对于高原鼠兔的节律性未达成统一的认知。虽然活动节律可以在很大程度上反映生物体的节律,但是在野生的环境下,活动节律会受到光线、天气、捕食者活动等多方面因素的干扰,无法准确反映出生物个体内在的节律。因此,在冬季、春季和夏季分别在青藏高原捕捉了野生的高原鼠兔,并在位于青海省的实验室中(此处氧气含量约为平原地区的60%)使用遥感发射机系统(telemetric transmitter system)同时实时监测高原鼠兔在12 h灯光-12 h黑暗,以及全黑暗情况下的体温节律和活动节律,以全面探究高原鼠兔抛开外界环境影响后的内在节律。结果表明,大于80%的高原鼠兔是无内源性的生物节律的(或节律极弱),而在相同环境下饲养超过20代的大鼠仍然保留了很强的生物节律。我们进一步提取了无节律和少数有节律的高原鼠兔的成纤维细胞,并采用Per2-luciferase记录细胞的节律,发现体温活动无节律的高原鼠兔细胞在离体状态下仍然是无节律的,有节律的高原鼠兔细胞是有节律的,活动和体温的记录与离体细胞的节律吻合,表明高原鼠兔或许从基因层面发生了某些改变,导致从分子水平失去了内源性的生物节律,而不是由于细胞或器官之间对于外界光线的感知和同步化出现问题而导致的无节律[72]。
虽然,一般认为生物钟能够帮助生物体预测每天的温度和食物来源随时间的变化,以最大程度地节省能量来适应昼夜交替的环境,但是在青藏高原的极端环境中,气候变化无常,几分钟之内的温度变化就可以达到20 ℃;又由于高原鼠兔是青藏高原几乎其他所有哺乳动物的食物,天敌众多,用内源性生物钟过于规律地“预测”昼夜的环境变化对于高原鼠兔来说反而成了可能致命的缺点。因此,在自然选择中,不同于平原上的大多数生物,反而是无节律的高原鼠兔占据了优势。
4.4 Epas1剪接异构体对高原鼠兔生物节律的影响
前文提到在我们的研究中,大多数高原鼠兔的内源性节律是紊乱的。因此,我们克隆了高原鼠兔的核心节律基因,但发现其功能完全正常;对高原鼠兔进行全基因组测序,也未发现核心节律基因特异性的突变。
考虑到在青藏高原的哺乳动物大多数都是通过缺氧诱导因子及其下游调控的基因的进化实现对高原缺氧环境的适应,而缺氧诱导因子又可能与节律蛋白质相互作用,从而影响生物节律,我们对这些可能存在物种特异性突变的基因进行了深入的序列比对。在大多数高原鼠兔中,Epas1蛋白存在一段特异性的长度为24个氨基酸的插入,这是由于在Epas1基因第14、15个外显子之间存在1个G>A突变,导致mRNA剪切位点发生改变。有趣的是,在有节律的高原鼠兔中,同时存在2种Epas1基因,一种是带有特异性突变和插入的“长”的Epas1(L-Epas1),一种是和其他哺乳动物一致的“短”的Epas1(S-Epas1)(见Fig.4)。L-Epas1在蛋白质稳定性实验(global protein stability,GPS)中表现出显著高于其他物种Epas1(包括高原鼠兔S-Epas1)的稳定性。在小鼠的视交叉上核注射病毒过表达L-Epas1可以扰乱小鼠核心体温的生物节律,而在无节律的鼠兔成纤维细胞中用shRNA敲降该L-Epas1可以显著恢复细胞节律。
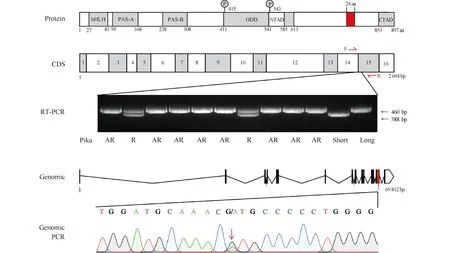
Fig.4 Multiple Epas1 splice variants differentially regulate pika rhythmicity A sequence alignment identified a unique insertion (in red) between Exon14 and Exon15 in the Plateau Pika Epas1 protein. The Plateau Pika-specific Epas1 insert identified is indicated with red. RT-PCR results showing that rhythmic pikas had both short and long isoform Epas1 sequences, and genomic PCR showing they are heterozygous at the G/A site. Adapted from Liu et al [72]
EMSA实验表明,Epas1和Bmal1可以形成异源二聚体,结合在节律基因启动子的E-Box元件上;而荧光素酶报告基因实验的结果表明,Epas1-Bmal1对于E-Box的激活能力远远低于Clock-Bmal1。免疫共沉淀的结果表明,L-Epas1和S-Epas1与Bmal1的结合能力并无差别,但S-Epas1由于不稳定,或许无法在体内生理条件下与Bmal1形成稳定的二聚体。稳定的L-Epas1蛋白与Bmal1形成二聚体后占据了本应是Clock-Bmal1的位置,又无法有效激活下游基因转录,导致高原鼠兔的节律紊乱(见Fig.5)。
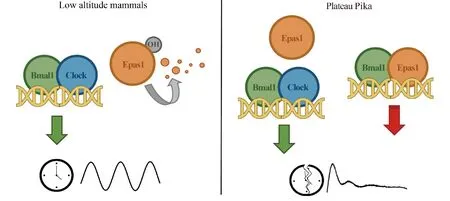
Fig.5 Work model for Plateau Pika L-Epas1 to disrupt circadian clock In low altitude mammals, the Epas1 protein is soon degraded after its translation because of its instability. However, in plateau pika, the stabilized L-Epas1 can accumulate and dimerize with Bmal1 to form a heterodimer, whose trans-activation ability is lower than Clock-Bmal1, resulting in a decreased regulation of Clock-Bmal1 at E-box loci, and thus disrupt the circadian rhythm
该特异性的点突变不仅使得大多数高原鼠兔丧失了节律,通过将高原鼠兔L-Epas1基因敲入小鼠基因组,我们发现,这还提升了小鼠对于低氧环境的耐受能力,在低氧条件下体重的损失、心血管受到的损伤均显著低于野生型小鼠[72]。
因此,这种稳定的Epas1突变体有可能是高原鼠兔在青藏高原漫长的进化过程中,被自然选择留下,既能适应高原变幻无常的天气和随处可见的天敌,又能适应高原低氧环境的突变,这种看似反常的无节律反而成了高原鼠兔适应极端生存环境的关键。
5 沙漠中的昼夜节律
在干旱的沙漠中,动物通常面临着极其恶劣的生存环境。与天气变化无常、几分钟之内气温变化可高达20 ℃的高原不同,沙漠中白天炎热晚上寒冷。沙漠中白天的平均气温为38 ℃,夜晚的平均气温则可以低至-3.9 ℃,一天之内的温差可以高达30 ℃。除了要适应白天黑夜的光线变化外,沙漠中的动物还需要及时调整自己的状态,来应对巨大的昼夜温差,因此,沙漠动物必须具有很好的生物节律,环境温度成了许多在沙漠中生存的动物形成昼夜节律的主要线索。
沙漠甲虫(TrigonoscelisgigasReitt)是一种在生态学和空间生物学中研究昼夜节律用的模式生物。野外观察其节律,可以发现沙漠甲虫具有早晚2个活动高峰。由于白天气温极高,沙漠甲虫会钻入很深的沙土中,等到傍晚降临、气温下降时,沙漠甲虫又会回到地面活动[73]。然而,在沙土中,是没有光线这个给时者的,而且温度也是恒定的(所以才会用来“避暑”),因此,沙漠甲虫回到地面的行为是由内源性节律决定的。沙漠甲虫早晨和傍晚的活动有可能是由2个单独的节律发生器所控制(类似于果蝇中的“晨细胞”和“昏细胞”分别控制果蝇天亮前和天黑前的活动高峰),这2种节律发生器虽然可以在黑暗条件下保持较长时间(30~40 d)的自主节律,仍是需要定期地被外界环境同步化,否则2个活动高峰最终会在70~80 d后逐渐由于相位移动而冲突,导致沙漠甲虫个体的活动失去节律[74]。
沙漠中常见的沙漠鬣蜥(Dipsosaurusdorsalis)[75]、格氏惧蝎(Pandinusgregoryi)、斑马扁石蝎(Hadogenesbicolor)[76]等,都被发现具有较好的节律性。
有研究测试了沙漠中的山羊的生物节律。在持续黑暗和温度恒定的环境下,山羊的内源性体温和活动节律分别以25.3 h和25 h为周期。若以24 h为周期的温度变化在全黑暗条件下诱导,山羊的体温和活动也会呈现和温度变化一致的、以24 h为周期的节律。若将诱导的温度变化规律进行颠倒,山羊的活动和体温变化相位也会随之颠倒。褪黑素分泌的节律也会以相同的规律被温度变化周期所诱导,在温度降低时,褪黑素就会开始分泌[77]。在单峰骆驼中,人们也做过类似的研究,得出了相同的结论。然而,若在12 h光照-12 h黑暗的条件下进行该研究,则大多数骆驼的节律还是以光照为准[78]。这也进一步说明,在哺乳动物中,虽然环境温度的调节也很重要,但光线仍是占据了生物节律的诱导的主要地位。
6 “星辰大海”——向未知区域的生物节律进发
6.1 深海中的生物节律
海洋可分为上层(海平面下0~200 m)、中层(海平面下200~1 000 m)、深层(海平面下1 000~4 000 m)、深渊(海平面下4 000~6 000 m)和超深渊(海平面6 000 m以下)几个区域,而地球表面超过70%区域都是深度超过200 m米的海洋。由于海水的折射和吸收作用,在深层及以下区域都检测不到光线的存在,而在上层和中层,也只有波长为480 nm的蓝光可以毫无变化地存在于海水中[79]。因此,在陆地上最常见的昼夜节律诱导因素,在海洋中几乎是缺失的。然而,在海洋中,也存在着如内潮和惯性流等以天或半天为周期变化的潮汐节律(因此分为全日潮和半日潮)。这些潮汐会使水中的浮游生物和硫化物、甲烷等化学物质随着水流被搬运到其他区域,从而产生规律的浓度的变化,这对于海洋生物来讲是最直接的“给时者”[80]。
随着近几年深海观测站的发展,人们更加直接地观测到海洋中生物运动的节律,也能结合高通量测序技术来分析海洋中生物节律基因的进化与表达情况。2011年,2个深海观测站在大西洋和东北太平洋建立并运行,重点关注热液喷口生态。2个生态模块共同记录了23天(2011年10月7日至30日)的图像和环境变量,以及长达9个月(2011年10月至2012年6月)的环境变量。基于图像分析评价了群落动态,揭示了动物群和环境的时间变化节律。太平洋和大西洋热液喷口之间的潮汐节律发生有6 h的滞后,这与2个喷口之间的地理距离和时间延迟相对应[80]。2020年,人们对大西洋中脊1 688米深处的热液喷口进行了观测,记录到以约12 h为周期变化的压强和海水温度,同时对该区域的贻贝(Bathymodiolusazoricus)进行了转录组分析,检测到了具有周期为10.4~14.4 h,以及20~24.8 h的节律基因。同时,在贻贝中,也存在传统节律基因Clock,Per,Cry1等的同源基因,但这些基因在野生和实验室条件下,都并未真正地表现出与传统哺乳动物或昆虫生物钟基因类似的节律性[81]。
除浮游生物和最常见的硫化物之外,珊瑚礁上的环境二氧化碳分压也会发生昼夜节律性波动。在一项对于常见的岩礁鱼类(Acanthochromispolyacanthus和Amphiprionpercula)的研究中,在CO2分压恒定与呈节律性波动的情况下,岩礁鱼节律基因表达及整个转录组的基因表达模式有明显的区别;不同CO2分压下的节律基因表达也会有所不同。节律性波动CO2水平也是诱导海洋生物节律的因素之一[82]。近年来,CO2排放逐渐增加,已经达到了可以使海洋酸化的程度,海洋生物的生理状况也会因此受到影响。海洋酸化和变暖显著影响了贻贝的代谢(清除率、耗氧率、氨排泄率、O:N比、ATP含量、丙酮酸激酶活性和代谢相关基因表达),导致能量供应不足(ATP在体内含量)。此外,暴露于酸化和变暖的环境中,贻贝的节律(心率的节律以及Per2,Cry1和Bmal1的表达节律)和神经递质的分泌(乙酰胆碱酯酶活性和体内乙酰胆碱、γ-氨基丁酸和多巴胺含量)显著被破坏[83]。测量在不同CO2暴露水平下橄榄沙鲈幼鱼(Paralichthysolivaceus)血浆中Cry1和Per2的水平变化,以及褪黑素分泌的变化,可以发现,CO2暴露会使生物节律产生相位后移和相位逆转的现象[84]。由此可见,海水酸化对于海洋生物的节律会产生负面影响,这会严重影响海洋生物的生存,对海洋生态平衡产生威胁。
6.2 太空中的生物节律
近年来,随着我国航空航天技术的发展和空间站的建造,太空上的生活逐渐受到越来越多人的关注,而研究太空中的生物节律,对宇航员提高睡眠质量、维持健康的身体状态具有重要意义。早在1976年,一项在空间实验室中进行的研究就表明,飞行中会出现快速动眼睡眠提高的现象[85];1993年,人们在一艘轨道飞行器上进行了一项评估睡眠和昼夜节律调节的研究。在轨道上,24 h的给时者影响减弱,这可能导致昼夜节律相位延迟,并有可能过渡到只由内源性生物钟控制的自由运行的昼夜节律。这一点和太空任务的特定压力源可能会导致超睡眠调节的改变,以及睡眠时长和质量的降低。在执行任务期间,记录了睡眠和体温,并通过情绪问卷对白天的警觉性进行主观评定。为了进行比较,在空间任务之前测量了相同的参数。与之相比,在太空中体温和警觉性的昼夜节律延迟,睡眠时间更短,更容易受干扰;睡眠结构明显改变,在太空中快速眼动潜伏期较短[85, 86]。2012年,人们将研究生物钟常用的模式生物脉胞菌带上了太空。虽然部分菌株的昼夜节律可以保持和在地球上一致,但许多样品出现了节律减弱,甚至节律丧失的情况[87]。除光照外,太空中的微重力环境对昼夜节律也可能产生影响。在飞行任务中,恒河猴的体温节律振幅降低和相位改变,在实验室的微重力环境模拟研究中,大鼠的体温和活动节律也随着重力的变化而变化,但这种变化并不是呈线性相关的。处于模拟失重环境中的小鼠和细胞的节律基因Bmal1的表达相位和振幅同样会发生改变[88]。目前,光线是太空中最容易诱导航天员节律的因素,因此,有研究通过不同光强[89]和周期[90]的光线下人类的睡眠节律以及褪黑素分泌的节律性,发现这些指标都会被不同的光照条件所诱导和同步化。然而,直到近几年,虽然测量手段和准确度在不断优化,也根据先前的经验对宇航员进行了光照治疗和褪黑素干预等措施来试图改善宇航员的睡眠和昼夜节律,但并未见明显的效果;在太空中进行的研究也仍停留在检测睡眠、心率、警觉度等行为和生理指标。理解人体在太空中发生的变化仍然还有较长的路要走。在未来的研究中,应当建立更可靠的动物模型,进行更加深入和全面的研究;在调整空间站环境时,从光照、重力、作息时间等多个方面全面模拟地球环境,考虑环境对生物节律直接和间接的影响,而不是单纯改变直接影响昼夜节律的光照和作息等因素,可能会对于改善航天员的昼夜节律有所帮助。
7 问题与展望
本文总结了光线、氧气含量、外界温度这3种环境因素对生物节律的影响,并以两极地区、高原、沙漠、深海和太空这几种极端环境为例,综述了环境对生物活动节律和内源性节律的影响,以及极端环境长期对节律相关表型和基因的自然选择。昼夜变换的光线是生物节律产生的基础,也是可以最广泛地调节并同步化从个体到各个器官组织节律的因素。对于大多数生物而言,丧失节律性的光照条件会导致睡眠、代谢、激素分泌等生理功能发生紊乱,不利于生存。在极夜期间给予一点“骨架性”的短暂光刺激便可以改善昼夜节律。而这种环境也通过基因突变逐渐选择出了本身就无节律的个体,这样的个体可以更加适应无光照节律的生存环境。氧气是地球上绝大多数生物生存所必需的,高原上的低氧环境选择出了缺氧通路具有突变的个体,从而降低了心肺功能在低氧条件下受到的损伤。缺氧诱导因子本身就与生物节律通路相互作用密切,受到生物节律的调控同时也影响着生物节律。因此,相关的突变必然会间接影响到节律功能。另外,由于高原上天气变化无常,过于规律的昼夜节律也不利于生存,这导致了无节律的高原鼠兔在青藏高原的极端环境下,得以大规模繁殖和正常存活。温度作为不可忽视的外界环境条件,对昼夜节律也有一定的诱导作用。与前2种昼夜节律带来的生存压力的极端情况相比,在沙漠中,规律的昼夜节律可以帮助生物预测巨大的昼夜温差,从而及时调整自己的状态来迎接炎热或寒冷。
在各种极端环境下,生物节律是否有利于生存是不确定的。随着高通量测序技术的发展以及分子生物学实验手段的普及,可以更好地对极端环境下生存的生物进行基因和分子层面的研究,找到它们适应极端环境的机制。自然选择虽然有时并未直接作用于典型的生物节律基因,但可能通过某些信号传导机制间接作用于生物节律环路。从生物节律的角度思考生物对极端环境的适应,可以为处在极端环境中的工作人员如何调节身体状况,以更好地适应环境提供新的思路。另外,目前常用的模式生物都是平原地区常见的物种,缺乏在极端环境下的模式生物,这导致很多研究只能停留在生态学或野生动物行为学的观察方面,准确性和可重复性不高。更重要的是,无法进行更加精细的研究来检测基因和分子水平上的变化。若能找到既适应了当地环境,又便于操作的极端环境下的模式生物,或许可以更加方便地进行深入研究,可以为人类在极端环境下的某些疾病的发生机制与预防治疗提供重要参考。
