雷替曲塞同步放疗治疗晚期食管癌的效果观察
2023-02-21徐保辰
徐保辰
山东省新泰市人民医院肿瘤三科,山东新泰 271200
食管癌是一种消化道恶性肿瘤,来源于食管上皮细胞,该病早期无明显临床表现,随着病情发展,患者多出现吞咽困难、常吐黏液样痰等症状,极大降低患者的生存质量。晚期食管癌患者已错过最佳手术时机,临床上多采用放疗、化疗等方式对肿瘤细胞生长扩散进行控制,延长患者生存周期。放疗可通过辐射照射的方式破坏肿瘤细胞染色体,以此阻止其生长分裂,发挥治疗作用,但不同患者间存在较大的个体差异,部分患者对放疗治疗的敏感度不足,单一放疗难以有效缩小病灶[1-2]。雷替曲塞属于胸苷酸合成酶抑制剂的一种,具有特异性,该药具有较长的效应时间,能够抑制胸苷酸合成酶的活性,发挥长效抗肿瘤作用[3]。本研究对74例晚期食管癌患者进行分析,旨在探讨雷替曲塞同步放疗治疗的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年8月至2021年9月新泰市人民医院收治的74例晚期食管癌患者作为研究对象,采用随机数表法将其分为观察组(n=37)与对照组(n=37),观察组男19例,女18例,年龄43~76岁,平均(62.15±5.89)岁;病理类型:腺癌5例,鳞状细胞癌32例;病灶部位:颈段3例,胸上段10例,胸中段18例,胸下段6例。对照组男18例,女19例,年龄45~77岁,平均(62.22±5.81)岁;病理类型:腺癌6例,鳞状细胞癌31例;病灶部位:颈段4例,胸上段8例,胸中段20例,胸下段5例。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性。本研究经新泰市人民医院医学伦理委员会审核批准通过,患者知情同意。纳入标准:①符合《中国食管癌放射治疗指南(2019年版)》[4]中关于食管癌的诊断标准;②符合放疗、化疗适应证;③预计生存周期>3个月,至少有1个可观察测量的临床病灶;④均意识清醒、依从性良好,可配合相关治疗及检查。排除标准:①合并脏器功能异常者;②发生肿瘤细胞远处转移者;③合并食管穿孔、食管瘘、严重恶液质、肢体活动障碍、严重慢性疾病者;④研究开展1个月前曾接受过相关放疗、化疗治疗者;⑤对本研究所用治疗药物过敏者。
1.2 方法
对照组采用放疗治疗,使用CT定位肿瘤靶区和受累器官,肿瘤靶区分为肿瘤原发病灶与阳性淋巴结,临床靶区范围为肿瘤靶区前后左右各外扩0.5~1.0 cm,上下各外扩1.0~1.5 cm,结合患者实际情况进行调整,使用6MV-X射线调强,或采用三维适形放疗,放疗剂量控制在50.4~66.0 Gy,1.80~2.15 Gy/次,1次/d,5次/周。
观察组在放疗(同对照组)基础上加用雷替曲塞治疗,第1天静脉滴注雷替曲塞(南京正大天晴制药有限公司,国药准字H20090325,规格:2 mg)2.5 mg/m2,滴注时间控制在15 min,放疗第1、4周各进行1次。
两组均治疗3个月。
1.3 观察指标及评价标准
统计两组近期疗效、不良反应,比较治疗前及治疗3个月后的肿瘤标志物水平。①近期疗效:根据实体瘤治疗疗效评价标准1.1(response evaluation criteria in solid tumors 1.1,RECIST 1.1)[5]中的相关标准评估临床疗效,完全缓解(complete remission,CR):患者病灶全部消失,且持续时间≥28 d;部分缓解(partial response,PR):患者病灶缩小>30%,且持续时间≥28 d;疾病稳定(stable disease,SD):患者病灶缩小≤30%或者增大<20%;疾病进展(progressive disease,PD):患者病灶增大>20%或者有新的病灶出现。客观缓解率(overall response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%;②肿瘤标志物:分别抽取患者治疗前、治疗3个月后的空腹静脉血5 ml,在3000 r/min的速度下离心10 min,分离血清,使用免疫沉淀吸附法检测癌胚抗原(carcinoembryonic antigen,CEA)、鳞状上皮细胞癌相关抗原(squamous cell carcinoma antigen,SCC)水平;③不良反应:比较两组患者不良反应(胃肠道反应、骨髓抑制、放射性食管炎)的发生情况。
1.4 统计学方法
采用SPSS 25.0统计学软件进行数据分析,计量资料(肿瘤标志物)用均数±标准差()描述,组间比较行t检验,计数资料(临床疗效)用[n(%)]描述,组间比较行χ2检验,等级资料(不良反应)采用秩和检验,P< 0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效比较
观察组患者的ORR(56.76%vs.32.43%)、DCR(75.68%vs.51.35%)均高于对照组,差异有统计学意义(P< 0.05)。见表1。

表1 两组患者近期疗效比较[n(%)]
2.2 两组患者肿瘤标志物比较
两组患者治疗前CEA、SCC水平比较,差异无统计学意义(P> 0.05);两组患者治疗后CEA、SCC水平低于本组治疗前,观察组患者治疗后CEA、SCC水平低于对照组,差异有统计学意义(P< 0.05)。见表2。
表2 两组患者肿瘤标志物比较(±s)
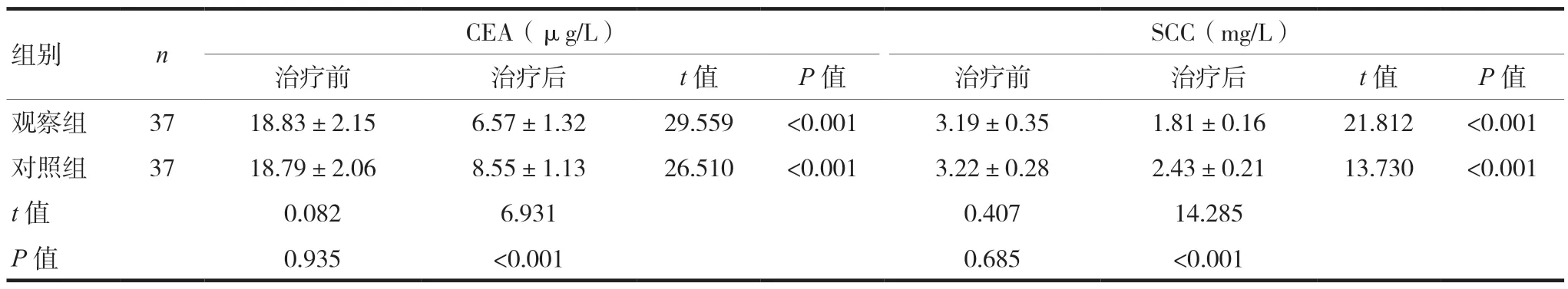
表2 两组患者肿瘤标志物比较(±s)
注 CEA:癌胚抗原;SCC:鳞状上皮细胞癌相关抗原
组别 n CEA(μg/L) SCC(mg/L)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值观察组 37 18.83±2.15 6.57±1.32 29.559 <0.001 3.19±0.35 1.81±0.16 21.812 <0.001对照组 37 18.79±2.06 8.55±1.13 26.510 <0.001 3.22±0.28 2.43±0.21 13.730 <0.001 t值 0.082 6.931 0.407 14.285 P值 0.935 <0.001 0.685 <0.001
2.3 两组患者不良反应比较
两组患者的骨髓抑制、放射性食管炎、胃肠道反应发生率比较,差异无统计学意义(P> 0.05)。见表3。

表3 两组患者不良反应比较[n(%)]
3 讨论
食管癌具有发病率高、预后差、病死率高等特点,且其病因复杂,外部因素和内部刺激均可导致食管组织细胞反复损伤、修复,继而发生鳞状上皮增生或柱状上皮化生,形成食管癌[6-7]。该病起病隐匿,部分患者在发现时已经步入晚期,难以通过手术方式进行治疗,对于此类患者,临床上多采取放疗或化疗措施[8]。
放疗治疗主要利用放射线杀灭肿瘤细胞,通过破坏细胞内染色体来抑制其生长增殖,该治疗方式适用范围广、精准度高,但单独使用时疗效不理想,患者生存率仍然较低[9]。近年来,随着医疗技术的不断发展,同步放化疗逐渐受到人们重视,其作为一种综合治疗模式,能够对肿瘤细胞进行有效杀灭,促进患者生存周期的延长[10]。雷替曲塞具有广谱抗肿瘤活性,能够被细胞主动摄取,促进聚谷氨酸生成(在叶酸基聚合谷氨酸合成酶代谢下),对胸苷酸合成酶进行抑制,对肿瘤细胞DNA的合成起到阻碍作用,从而延缓其增殖、扩散速度[11-12]。雷替曲塞的半衰期长、毒副作用小,能够长时间潴留在肿瘤细胞内,发挥良好的抗肿瘤效果,静脉注射给药时间仅需15 min,用药方式相对简便,能够有效提高患者的治疗配合度[13]。将雷替曲塞与放疗同步使用,可改变肿瘤细胞的缺氧状况和血液供应,从而提高肿瘤细胞放射敏感度,获取更理想的近期疗效[14]。
本研究结果显示,观察组患者ORR(56.76%vs.32.43%)、DCR(75.68%vs.51.35%)均高于对照组,差异有统计学意义(P< 0.05)。究其原因,雷替曲塞同步放疗能够发挥较好的协同作用,在抑制肿瘤细胞增殖生长的同时改变其血液供应情况,提高放射敏感度,进一步增强疗效。CEA是酸性糖蛋白的一种,广泛存在于肿瘤细胞表面(内胚层细胞分化而成),可作为广谱肿瘤标志物,晚期食管癌患者受到疾病因素影响,体内的CEA水平呈异常偏高状态;SCC是特异性鳞癌肿瘤标志物的一种,广泛存在于鳞状细胞癌细胞的胞质内,且其浓度会随着病情加重而升高,由于食管癌多为鳞状细胞癌,患者体内的SCC水平会出现异常升高[15-16]。本研究结果显示,观察组患者治疗后CEA、SCC水平低于对照组,差异有统计学意义(P< 0.05)。究其原因,雷替曲塞同步放疗能够长效抑制胸苷酸合成酶活性,对肿瘤细胞合成DNA产生阻碍,对其增殖扩散进行抑制,从而调节相关肿瘤标志物水平[17-18]。此外,两组患者的骨髓抑制、放射性食管炎、胃肠道反应发生率比较,差异无统计学意义(P> 0.05),提示雷替曲塞同步放疗安全性较高。
综上所述,雷替曲塞同步放疗治疗晚期食管癌患者,可提高近期疗效,对患者肿瘤标志物水平有明显调节作用,具有较高安全性,值得推广。
