柴胡皂苷A治疗高脂血症作用分子机制的生物信息学分析
2023-02-20程玉鹏李忠蒙刘广杰高宁
程玉鹏,李忠蒙,刘广杰,高宁,2
(1.黑龙江中医药大学药学院,黑龙江哈尔滨 150040;2.黑龙江中医药大学中西医结合博士后科研流动站,黑龙江哈尔滨 150040)
柴胡为我国传统中药,具有疏散退热、疏肝解郁、升阳举气的功效[1]。现代药理学研究表明,柴胡具有解热、抗感染、保肝护肝、抗抑郁、降血脂等功能[2-3]。由于柴胡对高脂血症具有较好疗效,因此以柴胡为主要组成的中药降脂方剂越来越受到关注,如大柴胡汤、柴胡加龙骨牡蛎汤、柴胡疏肝散等均在临床上得到了广泛应用[4-5]。然而,目前关于柴胡降脂的研究主要集中于药效的确证,而其主要有效成分并不清晰、作用靶点尚不明确、作用机制研究较少,也使得相关药物的质量标准难以确定,影响了柴胡及其类方的进一步开发与应用[5]。课题组对现有研究结果[5-7]分析推定,柴胡中的皂苷类成分柴胡皂苷A 极有可能是柴胡治疗高脂血症的关键药效分子。柴胡皂苷A(saikosaponin A)是五环三萜类齐墩果烷型衍生物,是柴胡药材质量的指标成分之一。现有研究表明,柴胡皂苷A 对于肿瘤、炎症性疾病、癫痫、肝损伤等均表现出较好的治疗效果[8],亦有部分研究显示,柴胡皂苷A 能够影响细胞对脂类分子的吸收与转运[7],可能是柴胡降血脂的活性成分之一。为深入探讨柴胡皂苷A 的降血脂作用及其可能的分子机制,本研究采用生物信息学手段,建立“药效分子-靶点-信号通路-疾病”的关联性并利用qPCR 对分析结果进行验证,以期为开发柴胡皂苷A 新的治疗应用奠定理论基础,也为揭示柴胡及其类方治疗高脂血症的分子机制提供参考。
1 材料与方法
1.1 试剂及细胞株
人体肝癌细胞(HepG2)由中科院细胞库提供,由本实验室继代保存。
SV Total RNA Isolation System,GoScriptTMReverse Tanscription System,GoTaq®qPCR Master Mix 均购自普洛麦格(北京)生物技术有限公司;DMEM培养基购自赛默飞世尔生物化学制品(北京)有限公司;胎牛血清购自赛澳美细胞技术(北京)有限公司;总胆固醇(TC/TCH)测定试剂盒,甘油三脂(TG)测定试剂盒均购自南京建成生物工程研究所有限公司;柴胡皂苷A 购自上海源叶生物科技有限公司。
1.2 靶点预测
在PubChem 中搜索柴胡皂苷A(saikosaponin A)的结构信息,下载得到其简化分子线性输入规范(Simplified molecular input line entry specification,SMILES)文件,将SMILES 信息导入小分子靶点在线预测分析系统SwissTargetPrediction(http://www.swisstargetprediction.ch/index.php),SwissTargetPre‐diction 可基于“相似性原理(similarity principle)”对柴胡皂苷A 与其数据库中超过370 000 个活性靶点进行匹配,进而分析预测其可能的靶蛋白。
1.3 靶点蛋白生物学功能及信号通路富集分析
将分析得到的靶点导入基因本体论数据库(gene oncology,GO)得到靶点蛋白参与的生物过程(biological process),同时将靶点信息导入京都基因与基因组百科全书数据库(kyoto encyclopedia of genes and genomes,KEGG),得到各靶点所参与的信号通路及代谢通路,全面了解靶点蛋白的生物学功能。随后,利用STRING 11(http://string-db.org)富集分析功能对靶蛋白的生物学过程及信号通路进行富集分析,筛选得到柴胡皂苷A 显著调节的生物功能,探讨其对高脂血症的影响。
1.4 靶点蛋白相互作用网络分析
将分析得到的靶点列表导入STRING 11,得到蛋白质间相互作用关系,构建蛋白质相互作用网络(protein-protein interaction networks,PPI networks),随后导入Cytoscape 软件,利用复合分子检测法(MCODE)分析PPI 网络,筛选相互作用关系模块(Module),明确各模块生物学功能,探讨柴胡皂苷A治疗高脂血症的分子机制。
1.5 HepG2细胞中TC、TG含量的测定
取处于对数生长期的HepG2 细胞,胰酶消化后用PBS 调整细胞浓度为1×106个/mL,接种于六孔板,每孔2 mL,5% CO2、37 ℃培养24 h,弃上清。将细胞随机分为药物处理组与对照组,药物处理组每孔加入2 mL 含有10 μg/mL 柴胡皂苷A 的无血清培养基,对照组加入2 mL 无血清培养基,37 ℃孵育24 h,每组设6 个复孔。随后弃上清,PBS 清洗2 次,加入含30%胎牛血清的DMEM 培养基孵育24 h。孵育结束后,按照试剂盒说明书操作,检测各组HepG2细胞中总胆固醇(TC)及甘油三酯(TG)含量。
1.6 实时定量PCR验证关键靶点基因表达变化
1.6.1 样品处理
取处于对数生长期的HepG2 细胞,胰酶消化后用PBS 调整细胞浓度为1×106个/mL,接种于六孔板,每孔2 mL,5%CO2、37 ℃培养24 h,弃上清。将细胞随机分为药物处理组与对照组,药物处理组每孔加入2 mL 含有10 μg/mL 柴胡皂苷A 的无血清培养基,对照组加入2 mL 无血清培养基,37 ℃孵育24 h。每组设6 个复孔。孵育结束后,用PBS 清洗细 胞2 次,按照SV Total RNA Isolation System 总RNA 提取试剂盒说明书操作,提取细胞总RNA,经电泳及NanoDrop 8000 检测合格后(电泳条带清晰,A260/A280 在1.9~2.2 之间),通过逆转录试剂盒GoScriptTMReverse Tanscription System 合成cDNA。-80 ℃保存备用。
1.6.2 qPCR验证基因表达
取cDNA 样本,利用GoTaq®qPCR Master Mix试剂盒,按如下参数进行qPCR。预变性阶段:95 ℃,2 min;循环阶段:95 ℃变性15 s,60 ℃退火及延伸1min,40个循环;熔解曲线阶段:65 ℃→95 ℃,台阶时间15 s,台阶温度1 ℃。
以GAPDH为内参,利用2-△△Ct比较靶点基因在给药组与对照组间表达差异(n=6)。所用引物经Primer Premier 6.0设计并由生工生物工程(上海)股份有限公司合成,见表1。

表1 目的基因引物序列Table 1 Primers of target genes
2 结果
2.1 柴胡皂苷A靶点信息
将柴胡皂苷A 的结构信息输入SwissTargetPre‐diction 后,共筛选得到100 个靶点蛋白结果,对其中打分前50 位的靶点蛋白进行统计分析表明,G 蛋白偶联受体家族A(20%)、激酶(16%)、磷酸酶(10%)以及蛋白酶(10%)是所占比例最多的类别,见图1。而在预测打分中排名最前的10 个靶点蛋白依次为细胞信号转导与转录激活因子3(STAT3)、白细胞介素-2(IL-2)、蛋白酪氨酸磷酸酶1b(PTPN1)、血小板活化因子受体(PTAFR)、肾素(REN)、己糖激酶4型(GCK)、白三烯B4受体1(LTB4R)、T细胞蛋白酪氨酸磷酸酶(PTPN2)、受体型酪氨酸蛋白磷酸酶α(PTPRA)、酰胺A1 受体(ADORA1)。预测打分中,可能性排名前20的靶点蛋白见表2。

表2 柴胡皂苷A作用可能性排名前20的靶点蛋白Table 2 The top 20 proteins for the possibility of targeting by saikosaponin A

图1 靶点蛋白各类别比例Figure 1 Piechart of target proteins categories
2.2 靶点蛋白生物学功能与信号通路富集分析结果
利用GO对得分前50名的靶点蛋白进行生物学功能注释并对其进行富集分析,结果表明,柴胡皂苷A 靶点蛋白主要涉及信号转导(GO:0023056,GO:1902533)、磷酸化(GO:0042325)、细胞增殖调控(GO:0042127)、对刺激的应答(GO:0009605)等多种生物学过程,其中富集显著性排名前10位的生物学过程如图2所示。对柴胡皂苷A 靶点蛋白参与的通路进行富集分析结果表明,靶点蛋白主要参与的信号通路包括PI3K-Akt 信号通路(hsa04151)、EGFR酪氨酸激酶抑制剂耐药性(hsa01521)、神经活性配体-受体相互作用(hsa04080)、Jak-STAT 信号通路(hsa04630)、鞘磷脂信号通路(hsa04071)等,其中富集显著性排名前10位的代谢及信号通路见表3。

表3 柴胡皂苷A靶点蛋白富集显著性前10位的代谢及信号通路Table 3 Top 10 KEGG pathways of target proteins effected by saikosaponin A

图2 柴胡皂苷A靶点蛋白富集显著性前10位的生物学过程Figure 2 Top 10 biological processes of target proteins effected by saikosaponin A
2.3 靶点蛋白相互作用的PPI网络分析结果
STRING 11 收集整理了超过5 000 个物种的近百万对蛋白质相互作用关系,通过STRING 11 构建柴胡皂苷A 靶点蛋白互作网络PPI,见图3。将PPI网络关系导入Cytoscape 3.7,利用network analysis分析表明,连通度排在前5 位的蛋白分别为VEGFA、EGFR、GRB2、STAT3、PIK3CA,由MCODE分析得到3 个蛋白相互作用模块,见图4,基于GO、KEGG、REACTOME等对各模块生物学功能进行总结,结果见表4。

表4 模块相关生物学功能Table 4 Biological functions of the modules

图3 柴胡皂苷A靶点蛋白相互作用网络Figure 3 PPI network of target proteins effected by saikosaponin A

图4 柴胡皂苷A靶点相互作用模块Figure 4 Modules in the PPI network
2.4 柴胡皂苷A 处理后HepG2 细胞内TC 与TG 含量变化结果
以HepG2 细胞作为模型,检验柴胡皂苷A 对细胞内脂质含量的影响。结果表明,柴胡皂苷处理后,HepG2 细胞中总胆固醇及甘油三酯的含量均有所下降(P<0.05),见图5,提示柴胡皂苷A 能够抑制HepG2细胞的脂质代谢及吸收。

图5 HepG2细胞中TC与TG的含量Figure 5 The contents of TC and TG in HepG2 cells(n=6)
2.5 靶点基因表达差异分析结果
选取了JAK-STAT 信号通路中的关键基因STAT3、GRB2、EGFR、SOCS1以及PI3K-Akt 信号通路中的PIK3CA、GRB2、EGFR基因对生物信息分析结果进行验证。qPCR 结果显示,柴胡皂苷A 能够促进HepG2细胞中STAT3、GRB2、PIK3CA、EGFR的表达,并抑制SOCS1基因表达,见图6。
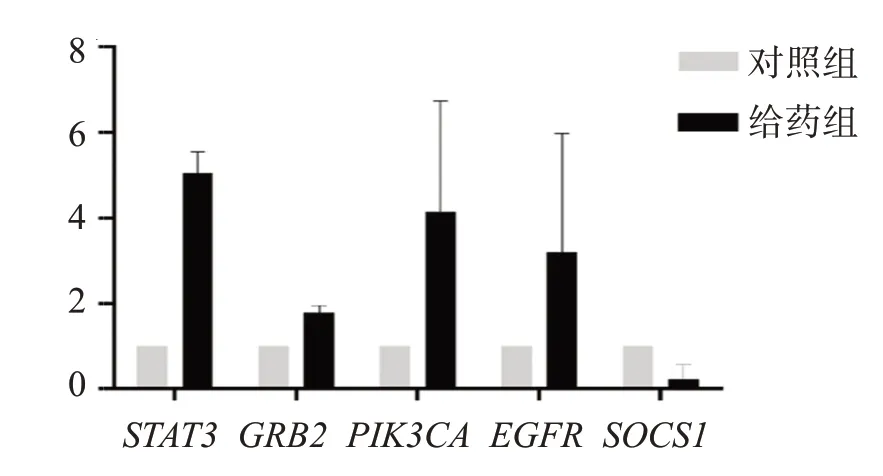
图6 目的基因qPCR 的相对表达值Figure 6 Relative expressionvalues of target gene qPCR(n=6)
3 讨论与结论
高脂血症是以血清胆固醇及甘油三酯水平升高为主要特征的病变状态,是动脉粥样硬化等多种心血管类疾病的重要诱因,其发病率高、危害大,严重威胁着人们的身体健康[9]。近年来,生活水平的不断提高,以及不健康的饮食及生活习惯等,使得我国高脂血症患者数量逐年攀升,有效防治高脂血症也成为现代医药研究的重要方向之一。现阶段对于高脂血症的治疗仍以药物干预为主,主要包括他汀类、贝特类、胆固醇吸收抑制剂等多种类型,但各化学合成类降脂药物均存在较多的不良反应[10],因此,在实践中疗效确切的中药及方剂,成为筛选新的高效低毒的降血脂药物首选来源[9]。作为我国常用的传统中药,柴胡及大柴胡汤、小柴胡汤、柴胡疏肝散等方剂均能够显著调节高脂血症患者的脂代谢紊乱,恢复血脂水平,展现出良好的临床应用效果[6]。其中柴胡所含的柴胡皂苷A在体外实验中展现出对胆固醇代谢的调节作用[7],可能是柴胡及其类方降血脂的重要有效成分之一,有望开发成为新的降血脂药物以及相关方药质量标准的重要参考指标。
本研究基于生物信息学技术对柴胡皂苷A 潜在靶点及其涉及的生物学过程、信号与代谢通路、蛋白相互作用网络进行了分析,并基于脂代谢异常与肝癌的密切关系[11],选择人肝癌细胞HepG2 作为体外检测模型,对分析结果进行验证。结果发现柴胡皂苷A 能够影响高脂血症多个相关的基因及信号通路。
信号转导与转录激活因子(signal transducer and activators of transcription,STAT)是最为保守且高效的蛋白转录因子家族之一,目前共发现7 个成员(STAT1、2、3、4、5a、5b 和6)。由其介导的JAKSTAT 信号通路是少数几种多效性级联转导通路之一,也是哺乳动物中多种细胞因子与生长因子的主要信号传递机制。细胞因子/生长因子与细胞表面受体结合后,引起受体构象改变并激活受体相关的Janus 激酶(receptor-associated Janus kinase,JAK),随后JAK 互磷酸化并催化受体胞内部分酪氨酸残基磷酸化,磷酸化的受体通过SH2 结构域与STAT结合,JAK 则通过磷酸化作用激活STAT,活化后的STAT 形成二聚体并转移至细胞核,进入细胞核的STAT能够与特异性DNA原件相结合进而调控上千种基因的转录。整个信号转导受多水平调控,其中细胞因子信号抑制蛋白(SCOCS)与蛋白酪氨酸磷酸酶(PTPs)是2类比较重要的STAT负调控因素[12]。研究证明,在汉族人群中,STAT3的常见变异与高甘油三酯血症及肥胖的患病风险有密切关系[13]。JAK2/STAT3 信号通路能够被瘦素受体激活,在脂代谢过程中发挥重要作用,JAK2/STAT3 信号通路异常能够导致高脂血症、动脉粥样硬化、脂肪肝等多种疾病[12]。许多中药及方剂也通过调节STAT3实现降脂功能[14-15]。对柴胡皂苷A 潜在靶点进行生物信息学分析发现,得分最高的靶点蛋白为STAT3,表明柴胡皂苷A 对其作用最为明显,通路分析则发现JAK-STAT 信号通路得到显著性富集,蛋白相互作用网络分析也表明STAT3 在柴胡皂苷A 药理作用网络中处于重要的节点位置,网络作用模块1 的关键功能即为JAK-STAT 信号通路。此外,qPCR 也证实通路中STAT3、GRB2、EGFR基因在柴胡皂苷A 的作用下,表达量呈上升状态;而其抑制基因SOCS1的表达则呈下降状态。综上可知,以STAT3 为核心作用靶点,进而调节JAK-STAT 信号通路、改善机体脂质代谢可能是柴胡皂苷A 治疗高脂血症的主要分子机制,见图7。

图7 柴胡皂苷A调节JAK-STAT信号通路的靶点Figure 7 Targets of saikosaponin A in JAK-STAT signaling pathway
另一条富集显著性较高的通路是磷脂酰肌醇3-激酶-蛋白激酶B 信号通路(PI3K-Akt signaling pathway),在蛋白相互作用网络连通度前5 位的靶点蛋白中的PIK3CA、EGFR、GRB2 均属于此通路。PI3K-Akt 信号途径对多种细胞刺激及毒性刺激均能产生应答,调控转录、翻译、增殖等生理功能。生长因子与受体型磷酸激酶或G 蛋白偶联受体相结合,分别激活Ia 型与Ib 型PI3K,活化后的PI3K 催化PIP2 生成磷脂酰肌醇-3,4,5-三磷酸(PIP3),后者作为胞内第二信使协助PDK 与mTORC2 催化激活AKT,随后AKT通过磷酸化作用进一步激活下游蛋白进而调节细胞细胞凋亡、蛋白合成、细胞周期、细胞增殖等生物学过程[16]。qPCR 结果也表明PIK3CA、GRB2、EGFR基因在柴胡皂苷A 的作用表达量呈现上调状态,客观反映出柴胡皂苷A 能够激活PI3K-Akt信号通路。研究显示,PI3K-Akt信号通路能够参与高脂血症[17]、非酒精性脂肪肝[17]、代谢综合征[18]等疾病的发生发展过程,青钱柳[19]、吴茱萸[20]等中药的降脂作用也与PI3K-Akt 信号通路密切相关。由此可知,PI3K-Akt 信号通路在柴胡皂苷A 降血脂过程中也发挥了重要作用,见图8。

图8 柴胡皂苷A调节PI3K-Akt信号通路的靶点Figure 8 Targets of saikosaponin A in PI3K-Akt signaling pathway
此外,生物信息分析结果表明,靶点蛋白相互作用网络的关键节点蛋白血管内皮生长因子(VEGFA)与高脂血症引起的血管内皮损伤密切相关[21];而Ca2+信号、鞘磷脂信号以及溶血磷脂酸(lysophosphatidic acid,LPA)异常也被证明与高脂血症及其并发症存在关联[22-24]。
其他显著性富集通路及其关键蛋白如神经活性配体-受体相互作用(hsa04080)、癌症相关通路(hsa05200)、破骨细胞分化(hsa04380)、白细胞介素-2(IL-2)等则涉及柴胡皂苷A 的抗癫痫、抗肿瘤、抗感染、抑制破骨细胞分化等作用,并已有较多相关研究报道[1,25]。其结果也间接证明了基于生物信息学分析柴胡皂苷A药效作用分子机理的可行性。
综上可知,柴胡皂苷A 能够以STAT3、PIK3CA、VEGFA等为其主要调节位点,通过影响JAK-STAT信号通路、PI3K-Akt 信号通路,辅以钙离子信号通路、溶血磷脂与LPA 受体、鞘磷脂信号通路等,最终发挥改善机体脂质代谢、治疗高脂血症的作用。
中药及其方剂具有多成分、多靶点的特征,各味药君臣佐使亦有其各自功能。因此,以方药所含全部成分进行网络药理学研究,往往会得到各成分及其靶点极为复杂的相互作用关系。对于前期研究较充分的方药,能够对照已有结果很快发现新的突破点;而对于前期研究基础薄弱的方药,在众多调节途径中抽丝剥茧寻找核心机制则显得力不从心。因此,为聚焦核心机制,本研究以降脂方剂中君药柴胡的关键药效分子柴胡皂苷A 为研究对象,分析其治疗高脂血症的分子机理,为柴胡皂苷A 的新药开发奠定基础,也为进一步分析柴胡及其类方配伍机制提供理论依据,同时为将柴胡皂苷A 纳入柴胡降脂类方药质量标准提供参考。
