藤茶提取物及活性成分对创伤弧菌的体外抑菌活性及作用机制
2023-02-20祁子麟陈咏琪蔡延渠李苑新鲁湘鄂张萱萱
祁子麟,陈咏琪,蔡延渠,3,4,李苑新,3,4,5,鲁湘鄂,3,4,张萱萱,3,4
(1.湖北科技学院医学部,湖北咸宁 437100;2.广东药科大学新药研发中心,广东广州 510006;3.国家中医药管理局中药制剂实验室(三级),广东广州 510006;4.广东省教育厅现代中药重点实验室,广东广州 510006;5.广东省药物新剂型重点实验室,广东广州 510006)
创伤弧菌(Vibrio vulnificus)属于革兰阴性菌,是重要的海洋食源性病原菌之一,可引起原发性败血症、炎症介导的感染性休克和坏死性伤口感染如坏死性筋膜炎,病情发展快、死亡率高[1],目前美国、中国、澳大利亚、德国、韩国和日本等国均有创伤弧菌感染病例的报道。究其原因,与食用被创伤弧菌污染的生海鲜或暴露在含有创伤弧菌的温暖海水中的开放性伤口有关,即能够通过伤口、肠道等途径引起水产动物和人体感染[2-3]。近年来,水产品中的创伤弧菌污染状况及耐药情况愈发严重[4-5],其致病性与耐药性可严重威胁到人类的生命健康。因此,迫切需要开发出新的抗菌剂或通过相关技术方法提升现有药物的抗菌活性。
藤茶,又名显齿蛇葡萄(Ampelopsis grossedentata),是葡萄科蛇葡萄属显齿蛇葡萄[Ampelopsis megalo‐phylla(Hand.-Mazz)W.T.Wang]的嫩茎叶,为民间药食两用品种之一,具有清热利湿、平肝降压、活血通络的功效。其不同部位提取物中均含有丰富的黄酮类成分(如二氢杨梅素、杨梅素、蛇葡萄素等)以及酚类化合物(如没食子酸等),其中叶中总黄酮含量最高(41.2%~45.3%)[6],具有抗菌[7]、抗炎[8]、抗氧化[9]、护肝[10]、免疫调节[11]等多种功能作用,但是目前尚无藤茶提取物及其有效成分对创伤弧菌的抗菌活性及作用机制研究报道。因此,本文拟采用KB 纸片法、微量肉汤二倍稀释法测定藤茶提取物及二氢杨梅素、没食子酸对创伤弧菌的体外抑杀活性,同时以酶标仪法结合试剂盒法分析抗菌作用机制,为其作为抗菌剂的应用开发提供实验依据。
1 材料与方法
1.1 试验材料
(1)药材:藤茶叶,采自湖北恩施来凤,经广东药科大学新药研发中心李苑新副研究员鉴定为葡萄科蛇葡萄属显齿蛇葡萄[Ampelopsis megalophylla(Hand.-Mazz)W.T.Wang]的嫩茎叶。药品:二氢杨梅素(批号:SXXZ20220403),陕西夏州生物科技有限公司;没食子酸(批号:C17D10C105977),上海源叶生物科技有限公司。
(2)实验菌株:创伤弧菌,ATCC27562,来源于广东省微生物研究所。
1.2 试剂与仪器
(1)主要试剂:2216E 液体培养基、2216E 琼脂培养基,海博生物技术有限公司;0.5%无菌TTC 溶液,广东环凯微生物科技有限公司;碱性磷酸酶(AKP)测试盒、BCA 试剂盒,南京建成生物工程有限公司;其他试剂均为分析纯。
(2)主要仪器:SW-CJ-1FD 型洁净工作台(苏州安泰空气技术有限公司);HPP110恒温培养箱(德国美墨尔特有限公司);YX-280D 手提式压力蒸汽灭菌器(合肥华泰医疗设备有限公司);Synergy HTX酶标仪[赛默飞世尔科技(中国)有限公司];UV-1700紫外分光光度计(日本岛津有限公司)。
1.3 藤茶提取物制备及溶液配制
参考文献[12]操作。准确称取100 g 藤茶叶于圆底烧瓶中,按料液比1∶30(体积比)加入水(或70%乙醇),浸泡0.5 h,100 ℃(或80 ℃)加热回流提取2 次,1.5 h/次,合并2 次提取液,75 ℃减压浓缩至一定浓度,真空干燥。采用紫外分光光度法,测得藤茶水提物中二氢杨梅素的含量为610.39 mg/g、没食子酸含量为200.64 mg/g,藤茶70%醇提物(以下简称“藤茶醇提物”)中二氢杨梅素的含量为728.96 mg/g、没食子酸含量为163.77 mg/g。
分别称取适量的藤茶水提物、藤茶醇提物、二氢杨梅素、没食子酸,以含2.0%吐温-80、6.0% DMSO的水溶液为助溶剂配制质量浓度为20 mg/mL的溶液。
1.4 菌悬液制备
将保存的创伤弧菌菌种取出复苏20 h,挑取单菌落于2216E 液体培养基中,30 ℃振荡培养8 h,比对计数,稀释成浓度为2.0×106CFU/mL的菌悬液[13]。
1.5 藤茶提取物的体外抗菌活性测定
1.5.1 抑菌环直径测定 采用K-B纸片法[13],分别吸取10 μL 浓度为20 mg/mL 的藤茶水提物溶液、藤茶醇提物溶液、二氢杨梅素溶液、没食子酸溶液至无菌空白药敏片上,60 ℃烘干,制备成药敏片。吸取100 μL 浓度为2.0×106CFU/mL 的菌悬液至2216E 琼脂板上,涂布均匀,贴放药敏片,30 ℃培养20 h,用游标卡尺测量抑菌环直径。评价标准:直径>20 mm表示极敏感,15~20 mm 表示高度敏感,10~15 mm表示中度敏感,6~10 mm 表示低度敏感,≤6 mm 表示不敏感。
1.5.2 MIC及MBC测定 采用微量二倍稀释法[13],取96 孔细胞培养板,在每排的第1~9 孔中加入100 μL菌悬液,再分别吸取浓度为20 mg/mL的藤茶水提物溶液、藤茶醇提物溶液、二氢杨梅素溶液、没食子酸溶液100 μL 于细胞培养板横排第1 孔中,混匀后吸取100 μL 于第2 孔中,依次进行倍比稀释至第8 孔,使得孔中混合液药物终质量浓度依次为10.00、5.00、2.50、1.25、0.63、0.31、0.16、0.078 mg/mL;第9孔加入100 μL 无菌助溶剂(含2.0%吐温-80、6.0%DMSO的水溶液)作为空白对照。加样后,于30 ℃孵育20 h,取出后每孔加入0.5%无菌TTC 溶液进行显色,以颜色不变红者为MIC 值。同时选择药物浓度为MIC、2 MIC、4 MIC 的对应孔,分别吸取50µL 培养液于2216E 琼脂板上涂匀,30 ℃培养20 h,取出观察计数,以无菌生长者为MBC。
1.6 藤茶提取物的抗菌作用机制[13]
1.6.1 对创伤弧菌生长特性的影响(1)藤茶醇提物不同浓度组:分别加入500 µL 的20 mg/mL 藤茶醇提物溶液和2.0×106CFU/mL 的菌悬液于12 孔板中,使混合液终浓度为1/2 MIC、MIC、2 MIC;(2)创伤弧菌空白对照组:只加入同量的无菌助溶剂溶液和菌悬液。于30 ℃振荡培养12 h,每隔2 h 取出培养液,采用酶标仪测定波长600 nm 处的吸光度(A)值,以t为横坐标、A600为纵坐标绘制生长抑制曲线,考察不同浓度藤茶醇提物在不同作用时间下对创伤弧菌生长的影响。
1.6.2 对创伤弧菌细胞壁通透性的影响(1)藤茶醇提物不同浓度组:分别加入500 µL 的20 mg/mL藤茶醇提物溶液和2.0×106CFU/mL 的菌悬液于12孔板中,使混合液终浓度为1/2 MIC、MIC、2 MIC;(2)创伤弧菌空白对照组:只加入同量的无菌助溶剂溶液和菌悬液。于30 ℃振荡培养6 h,将培养液取出,4 000 r/min 低温离心15 min,取上清液,按照AKP 试剂盒说明书进行操作,于酶标仪中波长520 nm 下测定吸光度(A)值,代入公式计算AKP 活力,分析不同浓度藤茶醇提物在一定作用时间内对创伤弧菌细胞壁通透性的影响。

其中,C标准:酚标准液浓度,0.1 mg/mL;N:样本测试前稀释倍数。
1.6.3 对创伤弧菌细胞膜的影响(1)藤茶醇提物不同浓度组:分别加入1 000µL的20 mg/mL藤茶醇提物溶液和2.0×106CFU/mL的菌悬液于12孔板中,使混合液终浓度为1/2 MIC、MIC、2 MIC;(2)空白对照组:只加入同量的无菌助溶剂溶液和菌悬液。于30 ℃振荡培养6 h,将培养液取出,4 000 r/min 低温离心15 min,取上清液,①于酶标仪中波长260 nm处测定吸光度值,分析不同浓度藤茶醇提物在一定作用时间内对创伤弧菌细胞内核酸含量的影响。②按照BCA试剂盒说明书进行操作,于酶标仪中波长562 nm 下测定吸光度值,计算可溶性蛋白质浓度,分析不同浓度藤茶醇提物在一定作用时间内对创伤弧菌细胞内可溶性蛋白质含量的影响。
1.7 统计学分析
实验数据以表示,组间差异采用SPSS19.0软件进行方差分析及t检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 藤茶提取物的抑菌活性评价
表1 结果显示,藤茶水提物对创伤弧菌的抑菌环直径为(18.28±0.71)mm,表现出高度敏感性,MIC、MBC 均为5.00 mg/mL。藤茶醇提物的抑菌环直径为(21.45±0.63)mm,表现出极敏感性,MIC、MBC 均为0.63 mg/mL。二氢杨梅素的抑菌环直径为(20.16±0.49)mm,表现出极敏感性,MIC、MBC为1.25、2.50 mg/mL。没食子酸的抑菌环直径为(19.59±0.67)mm,表现出高度敏感性,MIC、MBC为2.50、5.00 mg/mL。几者相比,藤茶70%醇提物对创伤弧菌的体外抑菌活性最强。

表1 藤茶提取物对创伤弧菌的体外抑菌活性Table 1 In vitro antibacterial activity of Ampelopsis grossed‐entata extracts against Vibrio vulnificus(n=3)
2.2 藤茶醇提物的抗菌作用机制
2.2.1 对创伤弧菌的生长抑制影响 分析图1 不同作用时间下的A600值可知,创伤弧菌在正常培养0~12 h 内的A600值不断提高,而不同浓度藤茶醇提物组的变化如下:①1/2 MIC 组与创伤弧菌组的生长趋势类似,但菌体生长数量稍有减少;②MIC 组的A600值在6~12 h 基本一致,表示菌体生长受到显著性的抑制影响;③2 MIC 组则在12 h 内A600值基本不变,完全抑制菌体生长。结果表明,藤茶醇提物在1/2 MIC 浓度时,略微影响创伤弧菌的正常生长,而在MIC、2 MIC 时能够显著地抑制菌体生长(P<0.01),表明其抑菌能力随药物浓度的提高而增强。
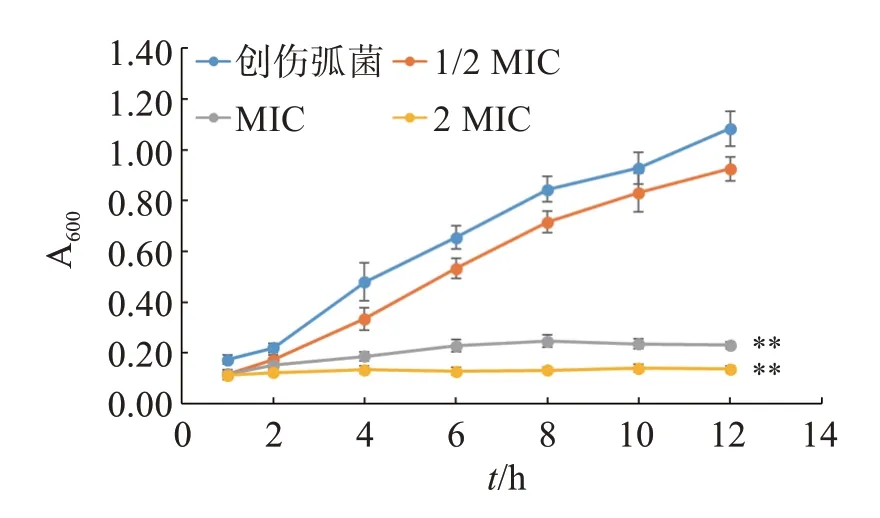
图1 不同浓度藤茶醇提物对创伤弧菌生长繁殖的影响Figure 1 Effect of different concentrations of Ampelopsis grossedentata extracts on the growth and reproduction of Vibrio vulnificus(n=3)
2.2.2 对创伤弧菌细胞壁通透性的影响 分析图2可知,创伤弧菌在正常生长6 h后,由于受到细胞壁的保护,其胞外的AKP含量依然保持在低水平;当藤茶醇提物浓度为1/2 MIC时,胞外的AKP含量稍有增加,但差异无统计学意义(P>0.05);而当药物浓度提高至MIC、2 MIC 时,菌体细胞壁受到明显破坏,引起胞内AKP外泄,因此导致胞外AKP含量显著性提高(P<0.01)。结果表明,藤茶醇提物能够有效破坏创伤弧菌细胞壁的完整性,且浓度越高,破坏能力越强。
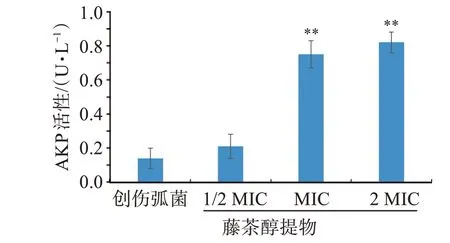
图2 不同浓度藤茶醇提物对创伤弧菌胞外AKP含量的影响Figure 2 Effect of different concentrations of Ampelopsis grossedentata extracts on extracellular AKP content of Vibrio vulnificus(n=3)
2.2.3 对创伤弧菌细胞膜的影响 分析图3-4 可知,创伤弧菌在正常生长6 h 后,由于受到细胞膜的保护,胞内核酸(RNA/DNA)、可溶性蛋白质等内容物的外排量很少。当藤茶醇提物浓度为1/2 MIC时,可能对个别菌体的细胞膜具有一定作用,因此内容物略有外泄,但与空白组比较差异无统计学意义(P>0.05);而随着药物浓度增加至MIC、2 MIC时,菌体细胞膜受破坏明显,胞内物质大量外泄,使得胞外核酸、可溶性蛋白质的含量显著地提高(P<0.01)。结果表明,藤茶醇提物具有破坏创伤弧菌细胞膜完整性的作用,并且作用强弱随着药物浓度的增加而增强。
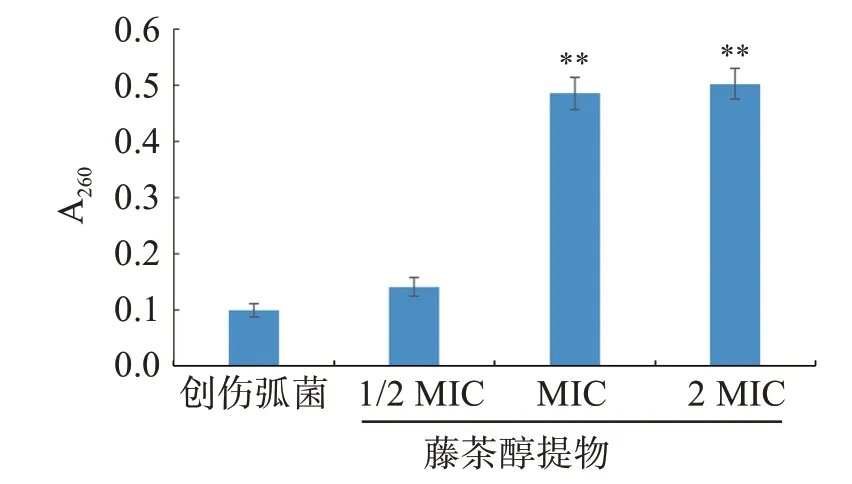
图3 不同浓度藤茶醇提物对创伤弧菌胞外核酸含量的影响Figure 3 Effect of different concentrations of Ampelopsis grossedentata extracts on extracellular nucleic acid content of Vibrio vulnificus(n=3)

图4 不同浓度藤茶醇提物对创伤弧菌胞外可溶性蛋白质含量的影响Figure 4 Effect of different concentrations of Ampelopsis grossedentata extracts on extracellular soluble protein content of Vibrio vulnificus(n=3)
3 讨论
研究表明,藤茶中的黄酮类化合物(如二氢杨梅素、藤茶素、藤茶苷、槲皮素、山柰酚)、酚类化合物(如没食子酸、儿茶素、表儿茶素等)是主要抗菌活性成分[14],且以二氢杨梅素为代表,可对金黄色葡萄球菌、MRSA、肺炎克雷伯菌、铜绿假单胞菌、肺炎链球菌、大肠杆菌、痢疾杆菌、粪肠球菌、阴沟肠杆菌、白色念珠菌、鸡沙门氏杆菌、猪链球菌、根霉、黑曲霉等多种人、畜、植物致病菌具有广谱高效的抑菌作用(MIC:0.31~10.00 mg/mL)[15]。与中草药(芒果叶等)[16]、化学抗菌药(头孢吡肟、头孢唑林、亚胺培南、司他丁钠、苯唑西林、头孢西丁)[17]联用,可通过破坏细菌细胞壁及细胞膜的完整性[18],或干扰微生物糖代谢中的呼吸代谢途径[19],或影响蛋白质及遗传物质[20](DNA、RNA)等方面起到相加或协同增效作用。
本研究发现,藤茶不同溶剂(水、70%乙醇)提取物及有效成分均能够抑制食源性创伤弧菌的生长,体外抗菌性能强弱依次为:藤茶醇提物>二氢杨梅素>没食子酸>藤茶水提物(MIC 依次为:0.63、1.25、2.50、5.00 mg/mL,MBC 依次为:0.63、2.50、5.00、5.00 mg/mL);通过比较发现,藤茶醇提物较水提物的抗菌活性更强,主要是二氢杨梅素、没食子酸、槲皮素、儿茶素等活性成分在醇-水体系中更容易溶出,因此含量更高、抗菌活性更强;比活性成分二氢杨梅素、没食子酸的抗菌活性更强,虽然70%乙醇提取物中只含有72.9%二氢杨梅素、16.4%没食子酸,但却也含有其他黄酮类、多酚类的抗菌活性成分,因此不同成分间可能以某种方式起到相互协同或相加作用,从而使其表现出更优的整体抗菌性能。在抗菌作用机制研究中发现,藤茶醇提物达到MIC、2 MIC 时,能够显著地抑制菌体正常生长;且在作用6 h 后,能够显著破坏创伤弧菌的细胞壁与细胞膜结构和功能的完整性,促使细胞内AKP、核酸、蛋白质等内容物的释放和干扰菌体细胞内酶系统及遗传物质的正常代谢,引起膜功能障碍,并诱导细胞死亡,从而有效抑制细菌生长。在下一步的工作中,将对藤茶提取物中不同成分的配伍比例与抗菌活性间的内在关系进行深入探讨。
藤茶在广西、贵州、湖北、湖南、重庆、江西、福建、广东等多个省市均有种植或野生资源分布,年产量可达万吨以上[21],同时目前文献中尚无藤茶及其活性成分对致病菌产生耐药性的报道,有望深入开发为天然抗菌剂或抗菌增效剂。
