桑枝不同部位超高效液相特征图谱建立及化学模式识别研究
2023-02-20邓李红陈仕妍王寿富林伟雄张雪兰邱彩月黄贵发张正
邓李红,陈仕妍,王寿富,林伟雄,张雪兰,邱彩月,黄贵发,张正
(1.广东一方制药有限公司,广东佛山 528244;2.广东省中药配方颗粒企业重点实验室,广东佛山 528244)
桑枝始载于《本草图经》[1],为桑科桑属植物桑Morus albaL.的干燥嫩枝,味微苦,性平,入肝经,具有祛风湿、利关节功效,可治疗风湿痹病、肩臂、关节酸痛麻木等症,临床上常用于治疗肩臂关节肿痛、四肢痉挛和肌体风痒等疾病[2-3]。桑枝的资源非常丰富,在全国各地均有分布,但主产于浙江、安徽、江苏、湖南等地[4],一般春末夏初采收,呈长圆柱形,少有分枝,长短不一,从结构上可分为木质部和韧皮部两部位,各约占全杆桑枝的72%、27%,另髓芯部约占1%[5]。现代研究表明,桑枝主要含有黄酮类、生物碱类、木质素类、果胶类、多糖类等化学成分[6-8],不同部位化学成分差异较大,如木质素和多糖类在木质部中的含量占比略高,而韧皮部中则含有较多的果胶类成分[9]。为进一步探究桑枝不同部位的化学成分差异,弥补《中国药典》2020 年版桑枝项下仅有性状和显微鉴别,而无相关化学成分定性定量分析的空白。本研究通过建立超高效液相色谱法,获得桑枝及其不同部位全面系统的超高效液相特征图谱,运用方差分析、热图和聚类分析、主成分分析、正交偏最小二乘法判别分析等化学模式识别方法对超高效液相特征图谱中的多指标变量进行统计分析,深入研究桑枝不同部位主要特征性成分的差异,对完善桑枝质量标准修订及今后桑枝资源综合开发利用具有重要意义。
1 材料
1.1 仪器
Waters H-Class 型超高效液相色谱仪(美国Waters 公司);ME204E 型、XP26 型分析天平(瑞士METTLER TOLEDO 公司);KQ-500DE 型数控超声清洗器(昆山市超声仪器有限公司);111B 型二两装高速中药粉碎机(浙江瑞安市永历制药机械有限公司);MiliQ Direct 8 型超纯水机(德国Merck 有限公司)。
1.2 药品与试剂
桑皮苷A 对照品(纯度≥98%,批号18052901,购自成都普菲德生物技术有限公司);绿原酸对照品(纯度:96.30%,批号110753-202119,购自中国食品药品检定研究院);隐绿原酸对照品(纯度:99.30%,批号DST220104-035,购自成都德斯特生物技术有限公司);乙腈为色谱级(默克公司),其余试剂为分析纯,水为超纯水。10 批桑枝药材(编号S1-S10)经广东一方制药有限公司孙冬梅教授鉴定为桑科植物桑Morus albaL.的干燥嫩枝,来源信息详见表1。将10 批桑枝药材不同部位分开,分别得木质部芯杆(编号G1-G10)、韧皮部皮(编号P1-P10)。
表1 10批桑枝来源信息Table 1 Source information of 10 batches of Ramulus Mori
2 方法与结果
2.2 特征图谱的建立
2.2.1 色谱条件 Waters HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);流动相A:乙腈,流动相B:0.1%磷酸,梯度洗脱(0~2 min,9%~13%A;2~6 min,13%~14%A;6~7 min,14%~23%A;7~18 min,23%~40%A;18~19 min,40%~68%A;19~20 min,68%~9%A);检测波长:320 nm;流速:0.3 mL·min-1;柱温:30 ℃;进样量:1 μL。
2.2.2 对照品溶液的制备 分别精密称定桑皮苷A、绿原酸、隐绿原酸对照品,加50%甲醇制成每1 mL分别含86.05 μg桑皮苷A、98.90 μg绿原酸、88.48 μg隐绿原酸的溶液,作为对照品参照物溶液。
2.2.3 供试品溶液的制备 取桑枝样品粉末(过三号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定重量,超声(功率:500 W,频率:40 kHz)处理15 min,放冷,再称定质量,用50%甲醇补足减失质量,摇匀,采用0.22 μm滤膜滤过,取续滤液,即得。
2.2.4 精密度考察 取桑枝药材粉末适量,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件检测样品,重复进样6 次,以2 号峰桑皮苷A为参照峰(S),计算得到各特征峰相对保留时间(RRT)和相对峰面积(RPA)的RSD均小于3%,提示仪器精密度良好。
2.2.5 重复性考察 取桑枝药材粉末适量,平行6份,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样检测样品,以2 号峰桑皮苷A 为参照峰(S),计算得到各特征峰RRT 和RPA 的RSD均小于3%,提示该方法重复性良好。
2.2.6 稳定性考察 取桑枝药材粉末适量,按“2.2.3”项下方法制备供试品溶液,室温放置,分别在样品制备后0、2、4、8、12、24 h 按照“2.2.1”项下色谱条件检测样品,以2 号峰桑皮苷A 为参照峰(S),计算得到各特征峰RRT 和RPA 的RSD 均小于5%,提示供试品溶液在24 h内稳定性良好。
2.2.7 桑枝特征图谱的建立 按“2.2.3”项下方法制备10批桑枝药材供试品溶液,按“2.2.1”项下色谱条件检测,采集色谱图,将其导入国家药典委员会颁布的《中药色谱指纹图谱相似度评价系统(2012版)》软件中进行色谱图匹配,建立桑枝药材的特征图谱。以S1图谱作为参照图谱,时间窗宽度设置为0.1 min,经多点校正、全谱峰匹配、中位数法生成10批桑枝药材的共有特征图谱及对照特征图谱,10 批桑枝药材共有特征图谱中共标定了共有峰11个,通过对照品比对,指认了2 号峰为桑皮苷A、4 号峰为绿原酸、5 号峰为隐绿原酸,详见图1、2。计算10 批桑枝药材特征图谱与生成的共有对照特征图谱的相似度为0.936、0.971、0.859、0.989、0.994、0.865、0.982、0.940、0.924、0.898,表明不同批次桑枝样品间质量一致性整体较好。

图1 10批桑枝药材共有特征图谱Figure 1 Common characteristic chromatograms in 10 batches of Ramulus Mori
2.2.8 桑枝不同部位特征图谱评价 按“2.2.3”项下方法制备10批桑枝芯杆及皮两部位的供试品溶液,按“2.2.1”项下色谱条件检测,采集色谱图。采用《中药色谱指纹图谱相似度评价系统(2012版)》软件中进行色谱图匹配,分别以G1、P1 图谱作为参照图谱,经多点校正、全谱峰匹配生成10批桑枝芯杆及皮两部位的共有特征图谱,同时采用中位数法分别生成对照特征图谱,10 批桑枝芯杆及皮共有特征图谱中均标定了11 个共有峰。共有特征图谱详见图3,对照特征图谱详见图4。

图2 桑枝药材对照图谱和对照品图谱Figure 2 Reference characteristic chromatogram of Ramulus Mori and chromatograms of mixed reference substances

图3 桑枝芯杆(A)和皮(B)共有特征图谱Figure 3 Common characteristic chromatograms of Ramulus Mori core rod(A)and bark(B)

图4 桑枝芯杆和皮的对照特征图谱Figure 4 Reference characteristic chromatograms of Ramulus Mori core rod and bark
2.3 化学模式识别分析
2.3.1 方差分析 采用SPSS 20.0 软件对10 批桑枝药材、芯杆和皮共有特征峰的单位峰面积(μAu*s/g)进行单因素方差分析。结果显示,芯杆的峰3、5、10,皮的峰1、2、4、5、9-11 与药材间的单位峰面积差异具有统计学意义(P>0.05),表明药材各特征峰的含量与芯杆接近,而与皮差异较大,或与芯杆在药材占比较大有关;芯杆的峰1-4、11 与皮间的单位峰面积差异具有统计学意义,即桑枝皮中峰1-4的单位峰面积显著大于桑枝芯杆,而桑枝皮中峰11的单位峰面积则显著小于桑枝芯杆,此外峰5、6、9、10 的单位峰面积在芯杆中含量略高,峰7、8 的单位峰面积在皮中含量略高,表明桑枝不同部位含有的化学成分存在一定差异。10 批桑枝不同部位特征图谱共有峰单位峰面积的方差分析结果见表2。
表2 桑枝不同部位样品特征图谱共有峰峰面积方差分析结果Table 2 Variance analysis of common peak area of different parts of Ramulus Mori(,n=10)
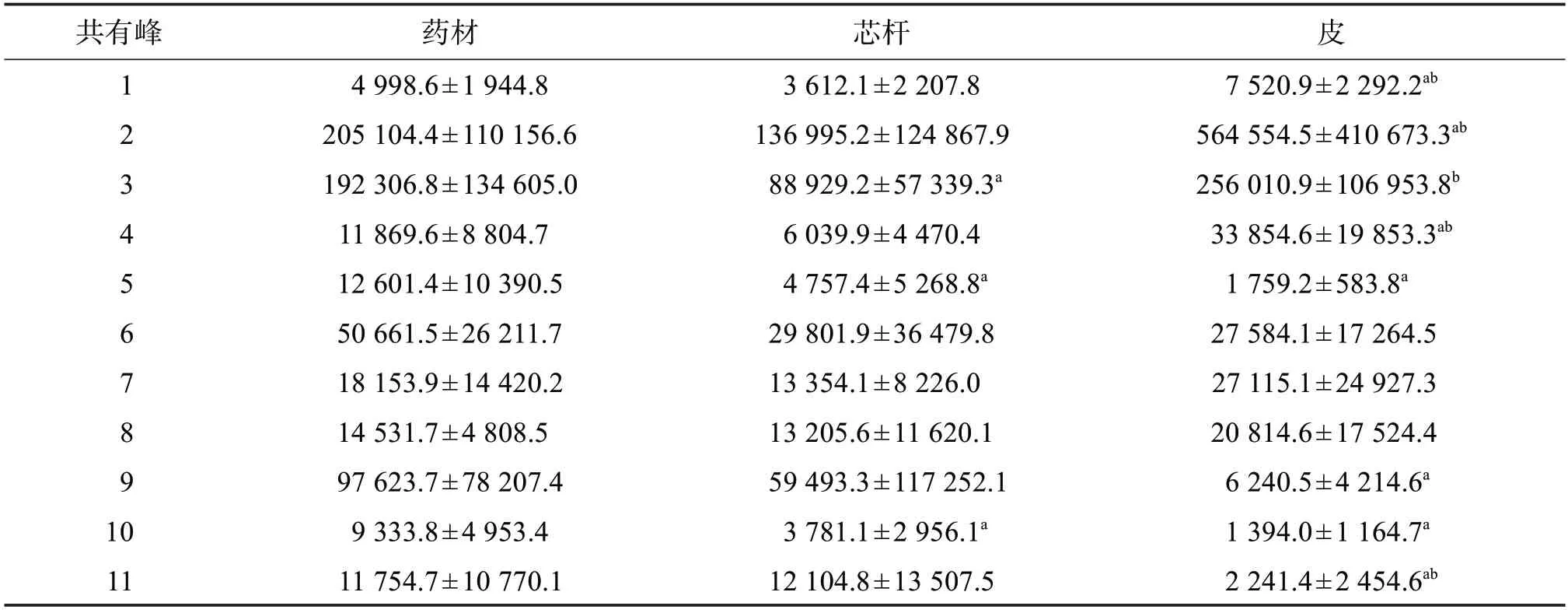
表2 桑枝不同部位样品特征图谱共有峰峰面积方差分析结果Table 2 Variance analysis of common peak area of different parts of Ramulus Mori(,n=10)
与药材比较:aP<0.05;与芯杆比较:bP<0.05
2.3.2 热图和聚类分析 以11 个共有特征峰单位峰面积为变量,采用对数归一化方式,以Euclidean 平方距离为度量标准,使用HemI 1.0软件对10批桑枝药材、芯杆和皮特征图谱数据进行热图和聚类分析。热图分析结果显示桑枝药材、芯杆和皮间化学成分含量差异较大,其中桑枝皮1-4共有特征峰颜色偏暖,表明其所含各成分含量较药材、芯杆高;桑枝皮9-11 共有特征峰稍偏冷,表明其所含各成分含量均较药材、芯杆低;5~8 特征峰在桑枝药材、芯杆和皮间颜色相近,表明其所含化学成分含量差异较小;除桑枝药材的S8样品与桑枝皮样品聚在一起外,样品聚类分析结果显示桑枝药材和芯杆可大致聚为Ⅰ类,桑枝皮大致聚为Ⅱ类,表明桑枝芯杆与药材的一致性较高,且与皮区分明显,如图5所示。
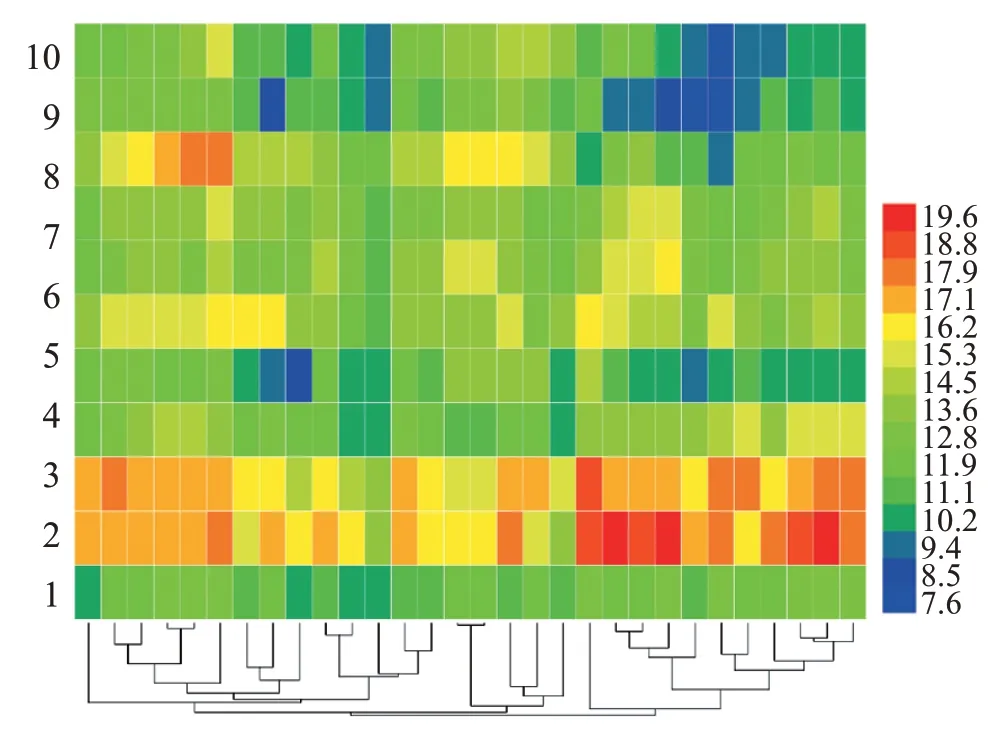
图5 桑枝不同部位的热图聚类分析图Figure 5 Heat map and dendrogram of hierarchical cluster analysis of different parts of Ramulus Mori
2.3.3 PCA 分析 在聚类分析的基础上,进一步采用主成分分析(PCA)对桑枝药材、芯杆和皮样品进行比较,通过数学降维的原理,从10批桑枝药材、芯杆和皮样品原数据中提取几个具代表的综合性指标来代替多个原始变量。PCA 分析结果中提取到4个特征值大于1 的主成分(PC),可用于反映桑枝药材、芯杆和皮样品特征图谱86.08%以上信息,其中PC1 贡献率为31.82%,贡献率最大,PC2 贡献率为27.28%,PC3 贡献率为17.59%,PC4贡献率为9.40%。由前3 个主成分建立坐标系,得到10 批桑枝药材、芯杆和皮样品的PCA得分图(详见图6),由图可见,桑枝药材与芯杆聚为一类,桑枝皮单独聚为一类,PCA 的整体区分与热图聚类分析结果一致。根据桑枝不同部位共有峰成分矩阵,主成分1的信息来自峰1、2、4、8,其中2号峰为桑皮苷A、4号峰为绿原酸;主成分2 的信息来自峰6、9、10、11;主成分3 的信息来自峰3、7;主成分4 的信息来自峰5隐绿原酸。详见表3。

表3 桑枝不同部位成分矩阵Table 3 Composition matrix of different parts of Ramulus Mori

图6 桑枝不同部位样品的主成分分析得分图Figure 6 Principal component analysis score plot of different parts of Ramulus Mori samples
以Y1,Y2,Y3、Y4 代表4 个主成分来作为10 批不同部位桑枝成分所表达的信息,建立桑枝不同部位品质评价模型,得出如下成分的线性关系表达式分别为Y1=F1*0.906+F2*0.890+F3*0.613+F4*0.649-F5*0.043+F6*0.359+F7*0.568+F8*0.747+F9*0.049-F10*0.231-F11*0.152;Y2=F1*0.041-F2*0.040-F3*0.031-F4*0.346+F5*0.570+F6*0.541+F7*0.178+F8*0.341+F9*0.818+F10*0.828+F11*0.870;Y3=F1*0.280-F2*0.324+F3*0.710+F4*0.553+F5*0.368+F6*0.202-F7*0.672-F8*0.530+F9*0.034+F10*0.181-F11*0.008;Y4=-F1*0.222+F2*0.155+F3*0.248-F4*0.279+F5*0.691+F6*0.055+F7*0.290-F8*0.085-F9*0.488-F10*0.049-F11*0.091。结合1、2、3、4 主成分方差贡献率,桑枝药材、芯杆和皮的综合评价表达式Y综合得分=(Y1*31.82+Y2*27.28+Y3*17.59+Y4*9.40)/86.08,根据以上公式得到桑枝药材、芯杆和皮的综合评价得分及排名,排名前10的样品中桑枝皮占了7 批,排名前20 的样品中桑枝药材占了7 批、桑枝皮占了9 批,表明桑枝皮的化学成分综合质量水平优于桑枝药材及芯杆,桑枝药材综合质量水平则介于桑枝皮和芯杆之间。详见表4。

表4 桑枝不同部位主成分得分及综合得分排名Table 4 Ranking of principal component scores and comprehensive scores of different parts of Ramulus Mori
2.3.4 OPLS-DA 分析 为了进一步明确桑枝药材、芯杆和皮样品之间产生差异的主要标志物,基于主成分分析(PCA)结果,采用监督模式识别法进行桑枝药材、芯杆和皮样品间正交偏最小二乘法-判别分析(OPLS-DA),计算出对差异贡献较大的因素。以模型变量投影(VIP)值为指标对引起桑枝药材、芯杆和皮样品间差异的成分进行分析,筛选贡献较大的6 个变量(以VIP 值>1 为标准),分别为1 号峰(VIP=1.247)、10 号峰(VIP=1.171)、4 号绿原酸峰(VIP=1.134)、2 号桑皮苷A 峰(VIP=1.133)、3 号峰(VIP=1.072)和11 号峰(VIP=1.046),提示上述6 个成分是引起桑枝药材、芯杆和皮样品间成分差异的主要标志性成分,其余峰VIP 值小于1,对样品的区分影响较小。详见图7。

图7 桑枝不同部位样品11个共有峰的VIP值Figure 7 VIP values of 11 common peaks of different parts of Ramulus Mori
3 讨论
本研究通过建立桑枝不同部位超高效液相特征图谱,结合方差分析、热图和聚类分析、主成分分析、正交偏最小二乘法判别分析进行化学模式识别分析,能将桑枝芯杆与皮进行有效地区分。方差分析结果表明桑枝不同部位所含的化学成分存在较大差异,偏水溶性成分(峰1-4)含量主要富集在桑枝皮中,偏脂溶性成分(峰9-11)含量主要富集在桑枝芯杆中,这与热图分析结果桑枝皮1-4共有特征峰颜色偏暖,9-11 共有特征峰颜色偏冷相符。PCA 分析结果显示桑枝药材与芯杆聚为一类,桑枝皮单独聚为一类,与热图聚类分析结果一致,进一步建立桑枝不同部位品质评价模型,表明桑枝皮的化学成分的综合质量水平优于桑枝药材及芯杆,或为桑枝不同结构组织上的差异导致主要化学成分的合成和积累不同,同时又因芯杆占药材的绝大部分导致药材质量与芯杆相似,故在药材采收时应综合考虑不同生长年限、不同直径大小等因素下皮和芯杆主要化学成分的合成积累,另在药材加工时也应注意对皮部的保留以确保药材品质。OPLS-DA分析进一步明确了桑枝药材、芯杆和皮样品之间产生差异的6 个主要标志物,其中标志物之一桑皮苷A为二羟基芪类化合物,又称为氧化白藜芦醇苷,主要存在于桑属植物中[10-11],在桑枝药材中质量分数相对较高,具有镇咳平喘、抗炎镇痛、抑制络氨酸酶、抗氧化活性以及逆转耐药活性等多种作用[12-14],作为评价桑枝不同部位差异及药材质量控制的指标具有重要意义。
本研究建立的超高效液相特征图谱和化学模式识别分析方法能较好地反映桑枝不同部位化学成分的分布规律及差异性。《中国药典》2020 年版收载的桑枝来源为桑的嫩枝,规定其直径应为0.5~1.5 cm,但未对嫩枝的生长年限做明确的规定[2],刘善新等[15]通过比较不同生长年限桑枝中的黄酮成分,发现生长时间在半年内的桑枝,黄酮的总含量和种类均明显少于生长时间1 年以上的桑枝,因此桑枝药材质量控制应关注不同生长时期不同部位主要成分桑皮苷A 及其他化学成分的含量变化规律,同时结合药效学及安全性评价开展进一步的系统研究。
