水稻根系内生固氮菌的分离鉴定及其促生作用研究
2023-02-20施龙清解振兴吴春珠张居念张数标姜照伟
董 萌,施龙清,解振兴,连 玲,吴春珠,张居念,张数标,姜照伟
(福建省农业科学院 水稻研究所,福建 福州 350018)
氮素是水稻生长发育的重要营养元素,影响水稻的分蘖与穗质量,进而影响水稻产量,对水稻高产稳产有重要意义。我国水稻生产中,为保证产量而投入过多氮肥,导致氮肥利用率降低。国内外研究发现,水稻根系有大量微生物,其对提高水稻的氮肥利用效率具有重要作用[1-2]。在自然界中,生物固氮主要有自生固氮、共生固氮和联合固氮3种方式,禾本科作物以联合固氮菌为主。联合固氮菌不仅能为宿主提供氮素,同时具有溶磷、增强宿主抗性、促进宿主生长发育的作用。
20世纪60年代,内生固氮菌首次在甘蔗中被发现,之后在不同禾本科作物中均有发现[3]。研究者利用PCR扩增方法,从日本水稻品种Nihonn的根系中检测到23个含固氮酶铁蛋白基因(nifH)序列的内生菌,其中Δ-变形菌(脱硫弧菌属)和γ-变形菌(类克雷伯氏菌属)是主要内生固氮菌[3]。Zhang等[2]对68份籼稻和27份粳稻根系微生物的测序分析发现,籼稻能特异富集与氮代谢相关的微生物,说明根系微生物群落可能会导致籼稻和粳稻氮素利用效率不同。硝酸盐转运蛋白基因(NRT1.1B)是籼稻氮利用效率高于粳稻的原因之一[4]。研究发现,不同发育时期、不同地点的水稻根系微生群属不同[5-7]。水稻根系中的内生固氮菌可以产生吲哚乙酸(IAA),IAA可促进根系生长,进而促进水稻根系对营养物质的吸收[8-9]。国内外研究人员从水稻根系中分离到许多内生固氮菌,但对不同生育期水稻根系内生固氮菌的多样性及其对水稻根系生长和氮素吸收利用影响的研究较少。探究不同生育期水稻根系内生固氮菌的多样性,可以揭示内生固氮菌在水稻体内的变化规律,为固氮菌在水稻生产上的应用提供理论依据。本试验以水稻品种佳辐占为材料,在拔节期和抽穗期对其根系内生固氮菌进行分离鉴定,并对分离菌的溶磷能力、固氮酶活性和促生能力进行检测,旨在为水稻微生物肥料的开发提供理论依据和技术支持。
1 材料与方法
1.1 材 料
水稻品种佳辐占、日本晴、台粳8号,由本课题组提供。Ashby液体培养基和Ashby无氮固体培养基,购自青岛海博生物。PCR反应所需试剂,均购自大连宝生物公司(TaKaRa);胶回收试剂盒,购自美国OMEGA公司。无机磷固体培养基:葡萄糖10 g/L,硫酸铵0.5 g/L,氯化钠0.3 g/L,硫酸镁0.3 g/L,硫酸锰0.03 g/L,硫酸钾0.3 g/L,硫酸亚铁0.03 g/L,磷酸钙5.0 g/L,琼脂15 g/L。有机磷固体培养基:葡萄糖10 g/L,硫酸铵0.5 g/L,酵母浸粉0.5 g/L,氯化钠0.3 g/L,氯化钾0.3 g/L,硫酸镁0.3 g/L,硫酸亚铁0.03 g/L,硫酸锰0.03 g/L,卵磷脂0.2 g/L,碳酸钙1.0 g/L,琼脂15 g/L。解钾培养基:葡萄糖10.0 g/L,磷酸钠0.2 g/L,七水硫酸镁0.2 g/L,氯化钠0.2 g/L,二水硫酸钙0.2 g/L,碳酸钙5.0 g/L,琼脂15.0 g/L,钾长石粉(直径<74 μm) 2.5 g/L。
1.2 根系内生固氮菌株的分离
用于分离内生固氮菌的水稻品种为佳辐占,种植地点为福州市福建省农业科学院水稻研究所农场(119°21′57″E,26°00′53″N)。2019年3月15日育秧,4月19日采用人工插秧方式移栽。供试土壤类型为砂质壤土,试验前土壤有机质、全氮含量分别为20.1和1.8 g/kg,速效氮、速效磷和速效钾含量分别为144.91,31.72和188.17 mg/kg。氮肥(N)施用量为180 kg/hm2,施用比例为m(基肥)∶m(分蘖肥)∶m(促花肥)∶m(保花肥)=3∶4∶2∶1。在佳辐占拔节期(6月上旬)和抽穗期(6月下旬)各选5株水稻,取其根系(地下10 cm)用流水冲洗表面泥土,在超净工作台内用体积分数75%酒精浸泡10 min,然后用无菌水洗涤5次,放入20 g/L的次氯酸钠溶液中消毒10 min,无菌水冲洗4~6次。将消毒后的水稻根置于含Luria-Bertani(LB)固体培养基的平板内,28 ℃培养2 d,若平板中无菌生长说明根表面消毒彻底,否则需要重新消毒。将表面消毒完全的根置于加有8 mL Ashby液体培养基的灭菌研钵内磨碎,静置5 min后,取5 mL上清液加入到20 mL Ashby液体培养基中,28 ℃、180 r/min摇床培养2 d,随后转接到新的Ashby液体培养基中,转接3次,然后在Ashby无氮固体培养基上反复划线分离,直至出现单克隆菌落,挑取单克隆于2 mL无菌离心管中,加入1 mL Ashby液体培养基,28 ℃、180 r/min条件下摇床培养2 d,最后在LB固体培养基上划线分离,挑取不同形态菌落纯化培养并保存菌种。
1.3 根系内生固氮菌的鉴定与系统进化分析
在细菌编码rRNA操纵子的5S rRNA、16S rRNA、23S rRNA中,16S rRNA是最稳定保守的,常用于细菌的分类鉴定。合成16S rRNA基因引物:F27:5′-AGAGTTTGATCATGGCTCAG-3′,R1514:5′-AAGGAGGTGATCCAGCCGCA-3′。采用PCR方法对分离的细菌进行鉴定,PCR 反应体系(50 μL)为:5×Primer STAR GXL Buffer 10 μL,dNTP Mixture (2.5 mmol/L) 4 μL,F27引物1 μL,R1514引物 1 μL,Template(菌液) 1 μL,PrimerSTAR GXL DNA Polymerase 2 μL,灭菌水31 μL。PCR扩增条件:98 ℃ 1 min;98 ℃ 10 s,55 ℃ 15 s,68 ℃ 50 s,30个循环。PCR产物用1.5%琼脂糖凝胶电泳检测后,用胶回收试剂盒回收目标片段,送上海生工生物股份有限公司测序。用NCBI blast对测序结果进行序列比对,采用Neighbor-Joining法构建系统发育树,设定Bootstrap为1 000。
1.4 根系内生固氮菌溶磷解钾能力测定
将分离的内生固氮菌菌株活化,吸取10 μL菌液置于无机磷固体培养基、有机磷固体培养基和解钾培养基的平板中间,30 ℃培养48~72 h,观察有无透明圈生成,重复3次。
1.5 根系内生固氮菌固氮酶活性检测
利用乙炔还原法检测内生固氮菌株的固氮酶活性。取5 mL活化后的菌液接种于Ashby液体培养基中,30 ℃培养2~4 d至对数生长期,在超净工作台内取5 mL新鲜菌液至顶空瓶中(已灭菌)并压盖封口。在实验台远离火源处抽取1 mL气体然后再注入1 mL标准乙炔气体,30 ℃培养48 h后,80~100 ℃水浴5~10 min,用气相色谱仪检测生成乙烯体积分数。固氮酶活性以每单位样品每小时生成乙烯的物质的量表示,计算公式如下:
固氮酶活性(nmol/(mL·h))=(生成乙烯浓度(μL/mL)×气体体积(mL)×稀释倍数×1 000)/(样品体积(mL)×反应时间(h)×24.5) 。
1.6 根系内生固氮菌促生能力检测
1.6.1 盆栽接种试验 供试侵染水稻品种为日本晴,接种菌株为J3、J10、J23、H27、H30、H33、H37、H40-2,按照文献[2]中的方法进行接种。具体操作如下:将水稻土装入培养盆中,用密封袋封装后置于60Co-γ辐照装置中灭菌,辐照剂量为40 kGy(2 kGy/h,持续20 h)。去掉水稻种子谷壳,用体积分数75%乙醇表面灭菌1 min,然后再用10 g/L次氯酸钠灭菌8 min,无菌水洗涤3~5次,在MS培养基上培养5 d。将菌株J3、J10、J23、H27、H30、H33、H37、H40-2分别用LB培养液培养至菌液OD600约为0.8,收集菌液并调整其OD600为0.5,备用。取2.0 mL混合菌液添加到250 mL无菌水中,并与培养盆中土壤(约200 g)混合,对照用无菌水替代。将5日龄的水稻苗转移至培养盆中,在28 ℃、16 h光照和相对湿度40%条件下培养,2周后测量株高、地上部分鲜质量和根长、根鲜质量,评估菌株对水稻的促生作用。
1.6.2 田间接种试验 供试侵染水稻品种为佳辐占和台粳8号,种植地点在福建省农业科学院水稻研究所农场,2021年3月中旬育秧,30 d后插秧。将6株内生固氮菌株(J3、J23、H27、H33、H37、H40-2)分别培养至菌液OD600为0.5~0.6,收集菌液并用PBS (0.1 mmol/L,pH=7.2)缓冲液洗涤2次,调整细菌含量至108CFU/mL,等体积混合,备用。将混合菌液侵染水稻佳辐占、台粳8号幼苗根部,15 min后移栽,对照组用缓冲液PBS浸泡根部,每个处理3个重复,水肥管理(除基肥外)按照2019年施肥方式减半。在水稻齐穗期,每小区选取10株水稻测定顶上3片叶(倒1叶、倒2叶和倒3叶)的SPAD值。
2 结果与分析
2.1 水稻根系内生固氮菌的分离纯化
在水稻拔节期共分离得到10株固氮菌,分属于5个科,其中肠杆菌科4株,假单胞菌科和莫拉菌科各2株,丛毛单胞菌科和柄杆菌科各1株(表1)。在水稻抽穗期分离到内生固氮菌20株,除1株科未定外,其余19株分属于8个科,其中假单胞菌科7株,气单胞菌科5株,肠杆菌科2株,丛毛单胞菌科、鞘脂单胞菌科、李斯特氏菌科、莫拉菌科和黄色假单胞菌科各1株(表2)。水稻2个生育期分离到的固氮菌多数属于γ-变形菌纲。
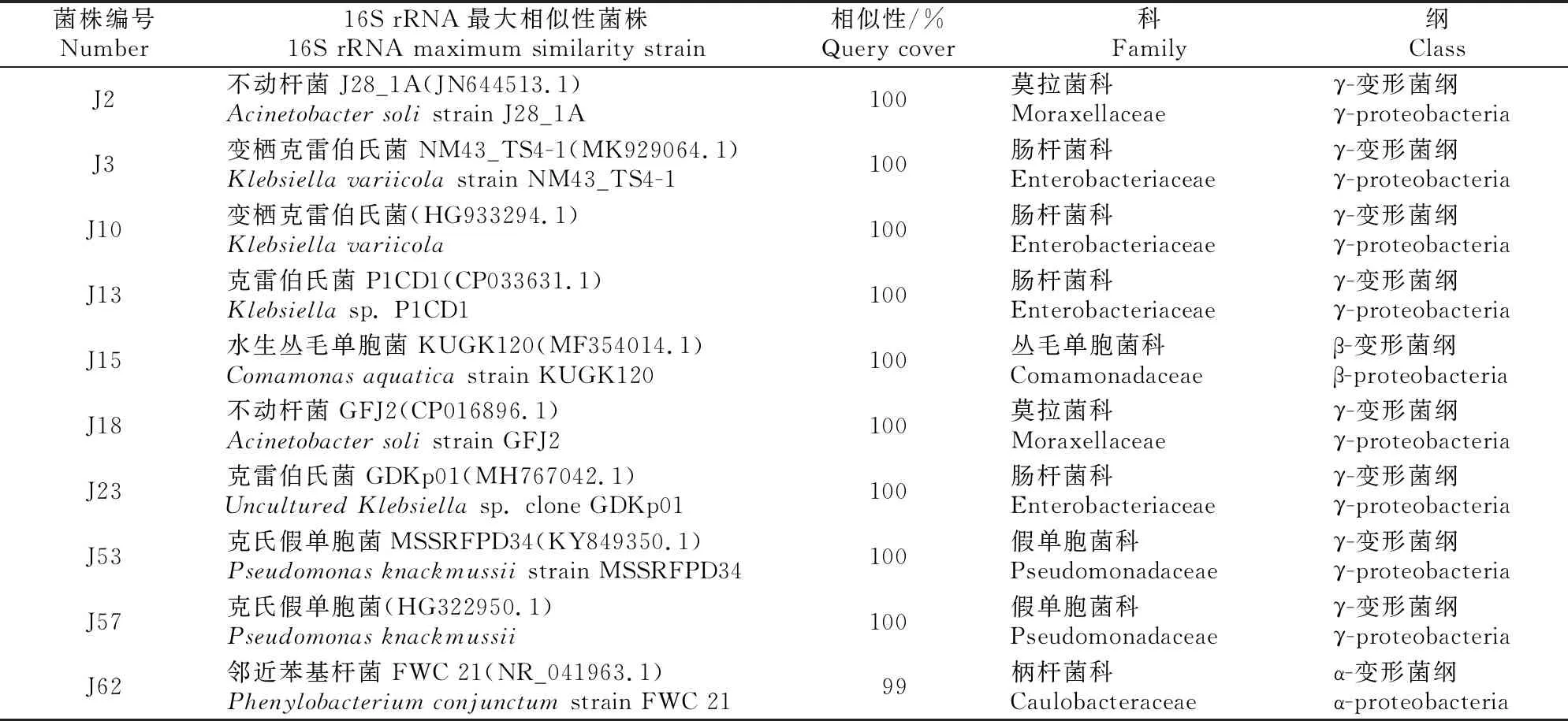
表1 拔节期水稻根系内生固氮菌的分离鉴定结果

表2 抽穗期水稻根系内生固氮菌的分离鉴定结果
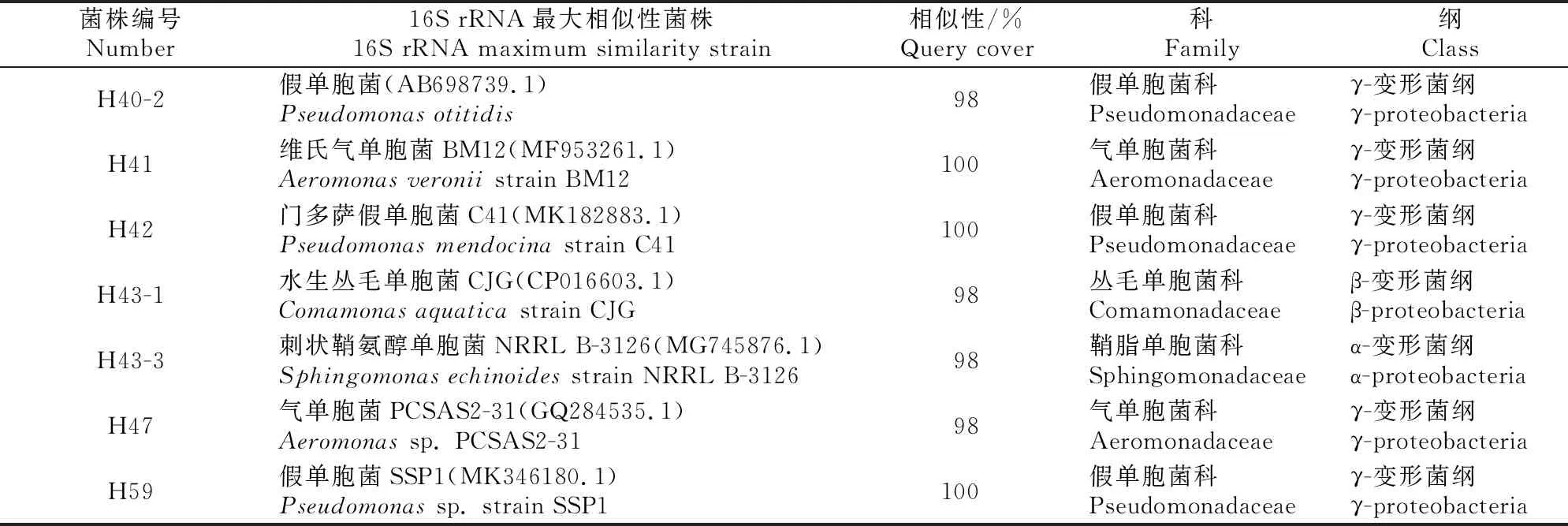
表2(续) Continued table 2
2.2 内生固氮菌16S rRNA基因测序与进化树
由图1可以看出,在水稻拔节期,根系内生固氮菌优势菌属为克雷伯氏菌属,分离到的4株克雷伯氏菌株聚类到同一分支,与不动杆菌属聚类关系最近,而与α-变形菌纲和β-变形菌纲的菌株聚类关系较远。从图2可以看到,水稻抽穗期分离得到的固氮菌分成2个大的分支,6个假单胞菌属菌株(H28、H37、H40-2、H31-1、H33和H15)聚类在一起,然后与肠杆菌属、泛菌属和气单胞菌属的菌株聚类为一大分支;芽孢杆菌纲的H18,假单胞菌H42、H59,气单胞菌H41、H47和H1-2聚为另一大分支。

图1 拔节期水稻根系内生固氮菌的进化分析

图2 抽穗期水稻根系内生固氮菌的进化分析
2.3 内生固氮菌株的溶磷解钾能力及固氮能力
溶磷解钾能力验证结果发现,分离到的30株内生固氮菌中有7株菌具有溶解无机磷能力,分别是J3、J10、J23、H27、H30、H33和H37(图3);未发现具有解钾能力的菌株。利用乙炔还原法鉴定除J57、J62、H15、H29-3、H30、H31-1、H43-3和H59外的22个内生固氮菌的固氮酶活性,结果表明分离的多数菌株固氮酶活性较低,为1.05~1.73 nmol/(mL·h),其中H33和H40-2菌株固氮酶活性相对较高,分别为12.7和15.1 nmol/(mL·h)。

图3 水稻根系内生固氮菌的溶磷能力
2.4 内生固氮菌株对水稻促生能力的影响
由图4可以看出,接种内生固氮菌株组水稻幼苗的株高、地上部分鲜质量和根鲜质量均高于对照组,其中接种H40-2和J3菌株处理的差异达到显著或者极显著水平;内生固氮菌对根长影响不显著。试验结果表明,分离到的内生固氮菌对水稻幼苗有促生作用,尤其是H40-2和J3菌株。

*和**分别表示与对照相比,差异达显著和极显著水平。下同
由图5可以看出,水稻幼苗经混合内生固氮菌侵染根部后,齐穗期台粳8号倒1叶片、倒2叶片和倒3叶片SPAD值较对照显著或极显著增加,佳辐占各叶片SPAD值与对照无显著差异,说明混合重组菌液处理后台粳8号在齐穂期氮吸收利用率较对照更高。

L1.倒1叶;L2.倒2叶;L3.倒3叶
3 讨 论
不同植物间、同种植物不同基因型和不同发育阶段根系中微生物菌群均具有明显的差异[10-14]。研究人员从水稻中鉴定了多种内生固氮菌,袁梅等[15]从水稻栽培品种中分离到19株内生固氮菌,隶属于芽孢杆菌属(Bacillus)、短杆菌属(Brevibacterium)、Fictibacillus属、类芽孢杆菌属(Paenibacillus);谭志远等[16]从普通野生稻中分离到37株内生固氮菌,其中γ-变形菌纲肠杆菌科的克雷伯菌属(Klebsiella)、泛菌属(Pantoea)、肠杆菌属(Enterobacter)是优势菌属。目前分离的内生固氮菌多数属于δ-变形菌纲、γ-变形菌纲和α-变形菌纲[3,17-18],其多样性与水稻发育时期密切相关,δ-变形菌纲相对丰度随着水稻生长发育的推进逐渐增加,而厚壁菌门、β-变形菌纲和γ-变形菌纲逐渐减少[7]。本研究从拔节期和抽穗期佳辐占中分离到30株内生固氮菌,均属于变形菌门,隶属于3纲9科12属,其中假单胞菌科菌株最多,其次是肠杆菌科和气单胞菌科,优势菌属与前人研究结果[16]一致。本研究发现,在水稻拔节期根系内生固氮菌以肠杆菌科为主,而抽穗期以假单胞菌科和气单胞菌科为主,说明水稻内生固氮菌群多样性会随水稻的生长发育而发生变化[6]。
植物根际微生物及根内生微生物可以通过分泌植物激素、抑制病原菌或提高营养元素吸收效率来促进植物生长发育[8-9,19-21],被称为植物的“第二基因组”。拟南芥中,香豆素参与调控假单胞菌在根系的定殖,改善根系微生物群落组成,通过活化土壤铁营养而促进植物对难溶性铁的吸收利用[22-23]。水稻中分离的内生固氮菌同时具有一定的溶磷能力,从而可促进水稻幼苗的生长发育[8-9,24]。前人从水稻根际、稻田土壤中分离的固氮菌亦多为假单胞菌属、芽孢杆菌属等,并证明其对水稻等作物具有较好的促生长作用,接种内生固氮菌菌株的水稻幼苗地上部分干质量与根干质量显著提高[24-25]。本研究对佳辐占根系内生固氮菌进行分离鉴定,发现7株菌具有溶解无机磷的能力,并对水稻幼苗有促生作用,其中H40-2和J3菌株的促生作用最为明显,这2个菌分别属于假单胞菌属和克雷伯氏菌属,其促生机理有待进一步深入研究。
生物固氮可为植物提供氮源,是替代氮肥的一种潜力氮源[26-27]。固氮菌是理想的植物促生菌,近年来在甘蔗、玉米、水稻等作物中发现大量的内生固氮菌[18,28-32],可为植物生长发育提供大量氮素从而减少氮肥的施用量。玉米的气生根周围也存在大量的固氮微生物,其通过固定空气中的氮为玉米提供氮素,使玉米可以在低氮或不施氮肥的土壤中生长[32]。将根瘤固氮菌工程菌株PseudomonasprotegensPf-5 X940分别接种玉米和小麦,并用15N同位素示踪,发现玉米和小麦从固氮菌中获得了大量的氮素[33]。水稻超高产也与水稻根系微生物多样性有关[34]。水稻氮素的积累与齐穂期顶上3片叶的叶绿素含量(SPAD值)呈显著正相关,通过测定生育后期功能叶中的叶绿素含量可判断氮素的利用率[35]。本研究结果表明,分离的内生固氮菌能使齐穂期台粳8号倒1、倒2、倒3叶的SPAD值显著提高,但对佳辐占叶片SPAD值无显著影响,表明根内微生物群落可能会影响籼粳稻对氮素的利用效率,这与前人研究结果[2,4]一致。
4 结 论
从拔节期和抽穗期水稻根系中共获得30株内生固氮菌,分属于α、β、γ变形菌纲的多个科,内生固氮菌具有多样性,且拔节期与抽穗期的多样性不同。从佳辐占根内分离的内生固氮菌可以促进水稻幼苗生长,尤其是H40-2和J3菌株对幼苗促生作用明显。混合内生固氮菌可显著提高齐穂期粳稻叶片SPAD值,表明混合菌液可以显著提高水稻的氮吸收效率。
