体外受精囊胚培养液中mtDNA拷贝数与囊胚发育潜能的相关性研究
2023-02-19蔡桂丰徐楗荧阮永铭曾伟荣赵琴许伟标吴松
蔡桂丰,徐楗荧,阮永铭,曾伟荣,赵琴,许伟标,吴松
(1.珠海市妇幼保健院,珠海 519000;2.亿康基因科技有限公司,苏州 215000)
线粒体是人体细胞内细胞器之一,在线粒体DNA(mtDNA)和核DNA驱动下它们负责细胞能量物质ATP生产,因此也被称为细胞的能量工厂,同时也参与介导细胞的增殖、凋亡和分化。线粒体自身拥有一套独立的基因组DNA,其拷贝数量取决于细胞内线粒体的数量。在成熟的人类精子中,大约有22~75个这样的细胞器被包裹在中段周围,而大量的线粒体分布在卵母细胞的细胞质中[1]。受精后,主要遗传自母系卵母细胞的线粒体会发生不对称分离,有研究表明线粒体在发育中胚胎形成的卵裂球中分布不均衡,直到囊胚阶段才自主复制[1-4]。在人类生殖过程中,生殖细胞的形成和受精、着床前胚胎的发育及胚胎着床都需要大量的细胞能量供给[5-6],线粒体对于成功受精和正确的胚胎植入和发育至关重要,ATP含量不足与受精失败和胚胎发育异常有关[4,7]。因此,卵母细胞中线粒体的质量决定了卵母细胞的质量,进而决定了发育中胚胎的质量[8]。
在辅助生殖技术(ART)应用中,胚胎质量是影响辅助生殖治疗的一个关键因素[9]。尽管ART取得了实质性进展,但评估胚胎生存能力的临床工具几乎没有发展,胚胎学家在选择最佳移植胚胎时仍然依赖于不精确和高度主观的形态学和形态计量分级系统。重要的是,即使在植入前遗传学检测(PGT)筛选到染色体正常胚胎的情况下,仍然有部分移植胚胎无法植入或活产[10];同时,PGT作为一种有创性的胚胎选择技术对于胚胎的影响也存在争议。2014年Stigliani等[11]发现,99%以上的废弃胚胎培养液样本可以检测到mtDNA,证明培养液中含有mtDNA是一种常见现象,且与核DNA相比含量更高。近年来相关学者通过这种无创的方式探究了培养液中mtDNA与胚胎发育潜能的关系[11-14],但研究数量有限,胚胎培养液中mtDNA与胚胎质量的关系有待进一步确认。本研究选择了第5或6天发育囊胚(D5或D6囊胚)培养液,应用高通量测序(NGS)技术检测培养液中mtDNA拷贝数,试图了解mtDNA拷贝数与常规胚胎形态、非整倍体性和囊胚发育时间的关系,为新的囊胚质量评价指标提供数据支持。
资料和方法
一、研究对象
选取2021年7—12月于珠海市妇幼保健院生殖中心就诊的10名行PGT的患者为研究对象。10名患者获得正常受精并培养发育至4期的36枚囊胚,采集囊胚活检细胞和培养液。
10对夫妇均签署了卵胞浆内单精子注射(ICSI)和PGT知情同意书。医院生殖伦理委员会对此研究项目通过伦理审查。
二、研究方法
1.胚胎培养:将成熟卵母细胞进行ICSI后转移至G-1 PLUS培养液(Vitrolife,瑞典),16~18 h后观察双原核(2PN)形成情况。第3天(D3)根据胚胎质量评分,用合适的剥卵针进一步去除D3胚胎的颗粒细胞,每个胚胎清洗3次后转入G-2 PLUS培养液(Vitrolife,瑞典)中培养到D4,再转入单微滴进行培养,每个培养滴25 μl,培养至D5进行观察并评分。
2.囊胚形态学评价:采用Garnder囊胚评分法[15]对培养的囊胚进行形态学评估,参考Klimczak囊胚分类标准[16]对囊胚分组:(1)高质量囊胚,包括3~6AA和4~6AB囊胚;(2)一般质量囊胚,包括BB、1~3AB及1~2AA囊胚;(3)低质量囊胚,包括AC、CA、BC、CB或CC囊胚。
3.胚胎活检及培养液的收集:当囊胚发育到4期(一般为D5/D6),评估胚胎等级,选择4CB/4BC以上囊胚进行活检。用记号笔在样本采集管上标号,用移液器在需采样的培养液中反复吹吸3次后收集胚胎培养液样本(避免吸到油滴),收集1个培养滴更换1次枪头,避免交叉污染。将样本采集管置于迷你离心机(珠海黑马)上,瞬时离心(4 000 r/min,5~10 s),确保采集的样本置于采集管底,-80℃保存。
4.单细胞全基因组扩增(WGA)和NGS分析:对收集的囊胚活检细胞和培养液进行WGA,然后通过ChromInst(EK100100724 NICSInstTM文库制备试剂盒;苏州亿康基因)进行文库制备。使用QubitdsDNA HS Assay Kit(货号Q32851;Invitrogen,美国)对扩增建库产物进行纯化和定量,然后使用Illumina NextSeq 550平台(Illumina,美国)进行双端reads 75测序,每个样品产生大约150万个测序读数。下机数据进行引物接头和低质量序列的过滤,过滤后的高质量reads序列比对到hg19人类参考基因组,并进行重复reads序列去除和碱基GC含量校正,剩余唯一比对reads使用CBS分割算法进行拷贝数变异(CNV)分析。
mtDNA含量以mtDNA拷贝数/核基因组的形式进行量化,即平均每核基因组下mtDNA的拷贝数。把比对到线粒体基因组的测序读取序列进行计数,并通过比对到常染色体的读取序列计数进行均一化;根据以下公式计算和显示每个核基因组的mtDNA拷贝数:mtDNA拷贝数=(比对常染色体区域数×2×比对线粒体读取序列数量)/(比对常染色体读取序列数×比对线粒体区域数)。
三、统计学分析

结 果
一、样本分组
本次研究共收集到36枚囊胚,其中D5囊胚33枚、D6囊胚3枚。根据形态学评估结果,高质量囊胚21枚、一般质量囊胚12枚、低质量囊胚3枚。根据胚胎植入前非整倍体遗传学检测(PGT-A)结果,整倍体囊胚19枚,非整倍体囊胚17枚(表1)。
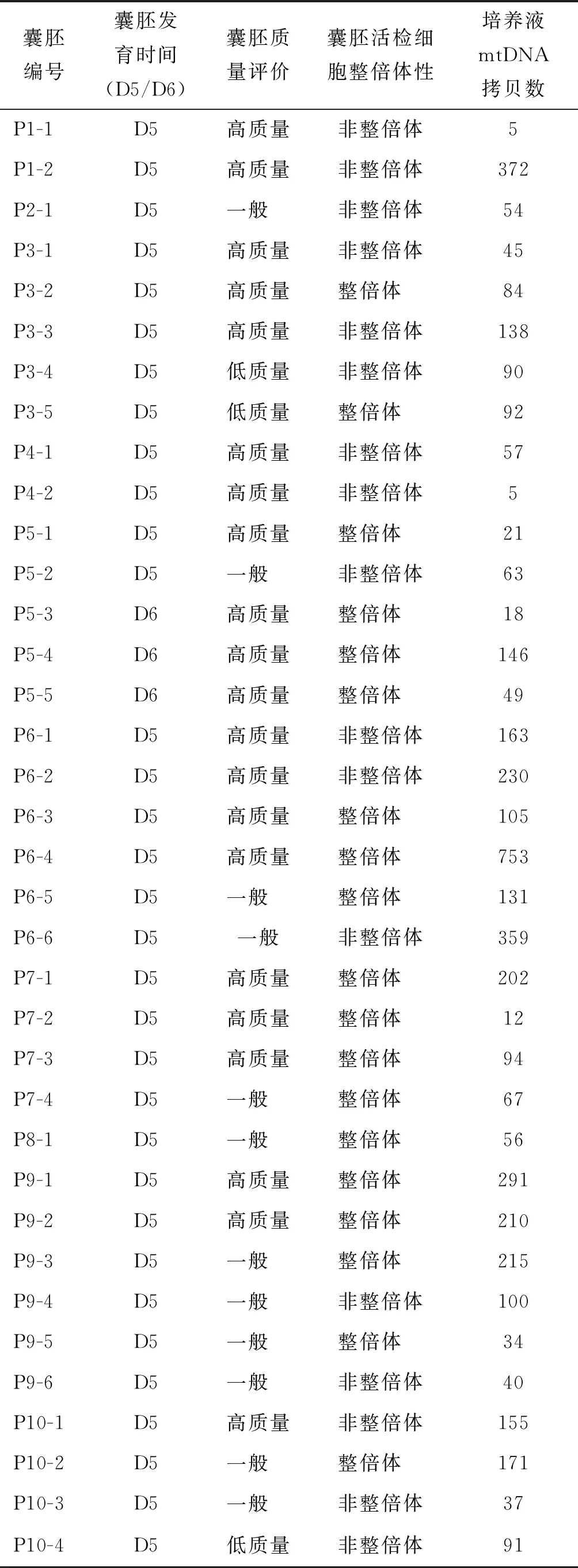
表1 囊胚评价指标情况表
二、不同形态学质量评价囊胚培养液中mtDNA拷贝数比较
根据发育囊胚形态学质量评价分组,检测结果显示质量评价为高质量、一般质量和低质量胚胎组的mtDNA拷贝数分别为[(150.24±166.24),n=21]、[(110.58±92.83),n=12]和[(91.00±0.82),n=3],组间差异无统计学意义(P>0.05)(图1)。
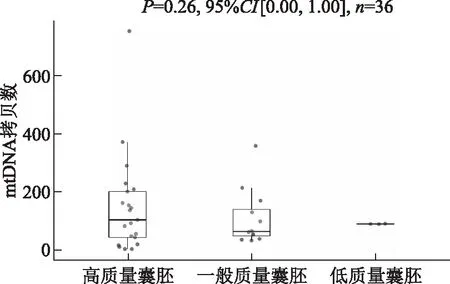
图1 不同形态学质量评价囊胚组培养液中mtDNA拷贝数比较
三、D5和D6囊胚培养液中mtDNA拷贝数比较
根据囊胚发育时间分组,检测结果显示D5和D6囊胚培养液中mtDNA拷贝数分别为[(137.64±143.57),n=33]和[(71.00±54.52),n=3],组间差异无统计学意义(P>0.05)(图2)。
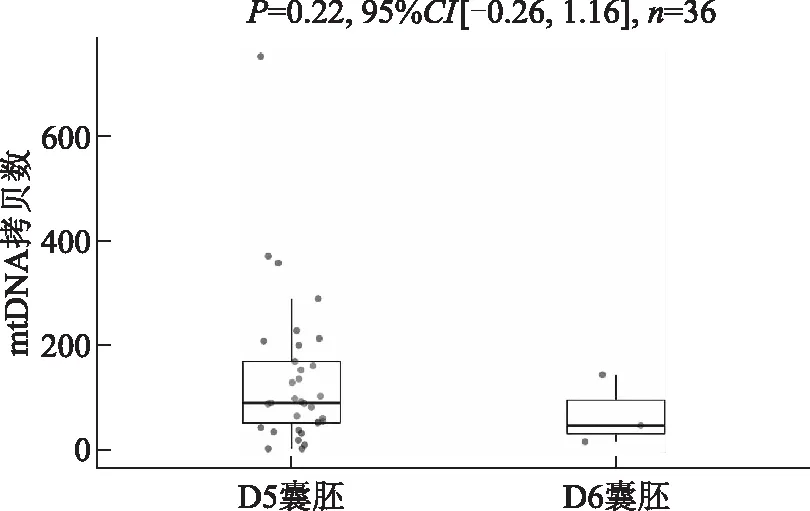
图2 D5和D6囊胚培养液中mtDNA拷贝数比较
四、整倍体和非整倍体囊胚培养液中mtDNA拷贝数比较
根据囊胚活检细胞整倍体性分组,检测结果显示36份囊胚活检细胞中整倍体囊胚和非整倍体囊胚分别为19枚和17枚,其中整倍体组和非整倍体组培养液中mtDNA拷贝数分别为[(144.79±162.17)]和[(117.88±107.14)],组间差异无统计学意义(P>0.05)(图3)。
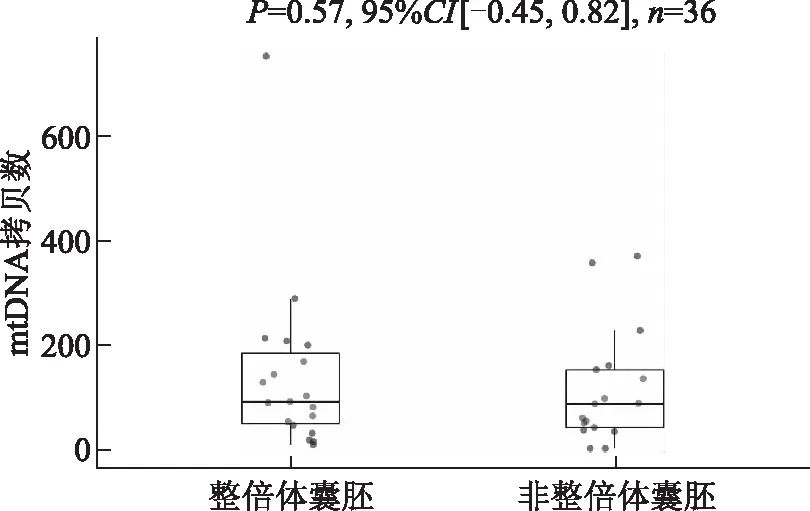
图3 整倍体和非整倍体囊胚培养液中mtDNA拷贝数比较
讨 论
优质胚胎的选择是生殖医学技术发展所关注的一个重点问题。虽然现阶段基于胚胎形态学和遗传学的评估已经在辅助生殖临床治疗应用上取得了良好效果,但这些方法仍然存在着一定的局限性,如形态学评估的主观判断差异、胚胎活检细胞遗传学检测的有创性。近年来,胚胎培养液或腔液中遗传物质的发现引起了学者的关注,已有数据表明包括培养液中细胞核DNA和mtDNA可以被成功分离、检测和分析[17-21],这为胚胎遗传学的无创评估提供了基础。目前,针对核DNA的无创评估已经取得了一定的进展,但是对于囊胚培养液中mtDNA的无创评估研究较少。本研究通过NGS无创检测囊胚培养液中mtDNA拷贝数,探究mtDNA拷贝数与胚胎质量的关系。
一般而言,在当前胚胎评价中形态学质量评分高和整倍体的囊胚具有更好的胚胎质量或发育潜能。本研究尝试探索不同形态学质量评级、不同整倍体性和不同发育时间(D5/D6)的囊胚培养液中mtDNA拷贝数的差异,研究结果与先前的一些研究有所不同。在Stigliani等[11-12]的两项研究中,其中一项研究比较了A等级与B、C等级D2/D3胚胎培养液中mtDNA/核DNA比值,结果显示两者无明显差异[12];另一项研究结果显示,可以形成囊胚的D3卵裂胚培养液中mtDNA/核DNA比值显著高于不能成囊的胚胎,且可在D5发育至3或4期囊胚的D3卵裂胚培养液中mtDNA/核DNA比值显著高于发育较慢的胚胎,表明高mtDNA/核DNA比值是高发育潜能胚胎的一个参考指标[11]。李亨利等[13]对卵裂期胚胎培养液中mtDNA拷贝数在不同胚胎形态学质量分组中进行了比较,研究结果提示,形态学优质组(以卵裂球数目判定)显著高于非优质组,发育正常速度组显著高于异常速度组,而高评分组与低评分组无显著差异。本研究中,在高质量、一般质量、低质量囊胚以及D5、D6囊胚分组中并未发现培养液中mtDNA拷贝数的显著差异。分析其原因可能因为,不同时期胚胎样本、胚胎形态学评价的标准、mtDNA检测方法和量化方法造成了研究间结果的不一致。
Zhang等[14]进一步对囊胚培养液中mtDNA进行了研究,多重因素线性回归分析显示,培养液中mtDNA拷贝数与囊胚活检细胞mtDNA拷贝数(P=0.001)、女性年龄(P=0.012)、囊胚评分(P=0.014)呈显著正相关,但与囊胚染色体整倍体性无明显相关性(P=0.138),说明囊胚活检细胞mtDNA拷贝数、女性年龄、囊胚评分可能是影响培养液中mtDNA拷贝数的因素。本研究未进行线性相关性分析,但从不同分组间平均mtDNA拷贝数的数据可以看到,从低质量到高质量囊胚呈现上升趋势,但尚无统计学差异,这可能因为本研究中胚胎形态学评价的标准和mtDNA拷贝检测方法不同于上述研究。同时也有研究提出,目前囊胚培养液中DNA来源不明、DNA产量和完整性较低、潜在外源性污染、培养液或囊腔液样本采集标准不统一、数据处理和分析不一致等问题对培养液中遗传信息的无创研究带来了挑战[21-22],这也可能是影响目前研究结果差异的重要原因。
但本研究仍存在一些不足之处:首先,研究纳入的胚胎样本数量较少,导致最后分组间差异较大;其次,未纳入胚胎移植及妊娠结局的相关数据,导致研究结论有一定的局限性。后续应完善实验设计,开展更大样本量的队列研究加以分析。
综上所述,不同形态学评级、囊胚发育时间和染色体整倍体性囊胚培养液中mtDNA拷贝数无显著差异,胚胎质量与培养液中mtDNA拷贝数的关系有待进一步确认。在当前囊胚培养液mtDNA拷贝研究数据较少的情况下,本研究为进一步探究囊胚培养液中mtDNA拷贝数与胚胎质量关系提供了参考数据。
