相同产地3种龙胆属植物根及根茎中化学成分的差异分析 Δ
2023-02-18李睿张莹莹刘卫红宋艳秋李龙星李海峰大理大学药学院云南大理67100云南省滇西抗病原植物资源筛选研究重点实验室云南大理67100大理大学图书馆云南大理67100大理大学公共卫生学院云南大理67100大理大学分析测试中心云南大理67100
李睿 ,张莹莹 ,刘卫红 ,宋艳秋 ,李龙星 ,李海峰 (1.大理大学药学院,云南 大理 67100;.云南省滇西抗病原植物资源筛选研究重点实验室,云南 大理 67100;.大理大学图书馆,云南 大理 67100;.大理大学公共卫生学院,云南 大理 67100;.大理大学分析测试中心,云南 大理 67100)
龙胆属植物在全世界约有360种,我国有248种,在全国各地均有分布,且主要集中分布于西南山区[1]。在云南分布的龙胆属植物有119种及6个变种,其中坚龙胆Gentiana rigescens Franch.被历版《中国药典》所收载,是龙胆药材的基原植物。坚龙胆于1987年就被列入国家重点保护野生药材物种,并且由于近年来生态环境被破坏(紫茎泽兰等外来物种入侵)和过度采挖(药厂需求激增),坚龙胆野生资源急剧减少,濒临灭绝[2]。因此,寻找坚龙胆可替代资源具有重要意义。笔者前期通过调研及探访民间草药医生发现,白族民间将坚龙胆G.rigescens Franch.、头花龙胆 G. cephalantha Franch.和微籽龙胆G. delavayi Franch.这3种主要分布在云南大理的龙胆属植物统称为龙胆草,俗称蓝花根、炮仗花、苦草及青鱼胆等,以其根及根茎或全草入药。
据报道,环烯醚萜类、黄酮类化合物是龙胆药材的主要活性成分[3―5],其中的环烯醚萜类成分具有保肝利胆(龙胆苦苷)[6]、健脾胃(獐牙菜苦苷)[7]、抗炎杀菌(獐牙菜苷)[8]、调节脂质代谢(苦龙胆酯苷)[9]等功效。本课题组前期采用高效液相色谱(HPLC)法对不同产地头花龙胆根及根茎中4种环烯醚萜类有效成分(龙胆苦苷、獐牙菜苦苷、獐牙菜苷和苦龙胆酯苷)的含量进行了测定,发现不同产地头花龙胆中4种环烯醚萜类成分的含量存在差异[10―11]。但考虑到药用植物的化学成分组成不仅受遗传因子的影响,还受气候、土壤等生态环境因子的影响,因此,本课题组以坚龙胆为对照,采用HPLC法对同一产地3种龙胆属植物(坚龙胆、头花龙胆、微籽龙胆)根及根茎中上述4种环烯醚萜类成分进行定量分析,同时借助超高效液相色谱-电喷雾-四极杆飞行时间高分辨质谱联用(UPLC-ESI-Q-TOF-MS)技术对上述植物根及根茎中的化学成分进行定性分析,并对质荷比(m/z)在50~2 000之间的化学成分进行主成分分析(principal component analysis,PCA),为从龙胆属植物中挖掘坚龙胆可替代资源提供依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Agilent 1200型HPLC仪(美国Agilent公司),Dionex UltiMate 3000型UPLC仪(美国Dionex公司),Compact型质谱系统(德国Bruker Daltonics公司),AE240型电子天平(瑞士Mettler Toledo公司),SK5200H型超声波清洗仪(上海科导超声仪器有限公司)。
1.2 主要药品与试剂
坚龙胆、头花龙胆、微籽龙胆样品均由本课题组于2020年10月采自云南大理,采集地经度为N25°67. 55′、纬度为E99°3. 183′,每个品种随机采集生长年限大致相同且无病虫害的开花期植株30株,采集植株之间的株距不小于10 m。采集的植株样品经大理大学药学院李海峰教授鉴定为龙胆属植物坚龙胆G. rigescens Franch.、头花龙胆G.cephalantha Franch.、微籽龙胆G.delavayi Franch.。将采集的植株样品根及根茎在40 ℃恒温箱中干燥至恒质量。龙胆苦苷对照品(批号ZJ0701BA13,纯度≥98%)、獐芽菜苦苷对照品(批号M29J4S1,纯度≥98%)、獐芽菜苷对照品(批号PN1125SA13,纯度≥98%)、苦龙胆酯苷对照品(批号Z06J6S2,纯度≥98%)均购自上海源叶生物科技有限公司;甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 供试品溶液 随机选取每个品种的根及根茎质量相近的植株10株,混合、粉碎后作为样品。分别精密称取粉末0.2 g于10 mL容量瓶中,加入4 mL甲醇,超声(53 kHz、40 ℃)处理20 min,滤纸过滤,滤渣用4 mL甲醇按上述步骤重复处理1次;合并2次提取滤液至10 mL容量瓶中,冷却至室温,加甲醇定容,混匀。使用前用0.22 μm有机相微孔滤膜过滤,收集滤液,即得。
2.1.2 混合对照品溶液 分别精密称取适量龙胆苦苷、獐牙菜苦苷、獐牙菜苷、苦龙胆酯苷对照品,加甲醇溶解,制备成上述4种成分质量浓度分别为0.200 0、0.050 0、0.005 0、0.005 0 mg/mL的混合溶液,经0.22 μm有机相微孔滤膜过滤,收集滤液,即得。
2.2 3种龙胆属植物根及根茎中4种环烯醚萜类成分含量的测定
2.2.1 HPLC检测条件 色谱柱为Eclipse XDB-C18(250 mm×4.6 mm,5 μm),以甲醇(A)-水(B)为流动相进行梯度洗脱(0~15 min,15%A→35%A;15~40 min,35%A→80%A;40~60 min,80%A→100%A);流速为1.0 mL/min;柱温为25 ℃;检测波长为274 nm(龙胆苦苷)、243 nm(獐牙菜苦苷、獐牙菜苷及苦龙胆酯苷);进样量为5 μL。
2.2.2 方法学考察 按照相关方法进行方法学考察。专属性考察结果显示,混合对照品及供试品溶液在相同保留时间处均有相似的色谱峰,并且特征峰与杂质分离良好、无干扰,表明该方法专属性较好(图略)。以峰面积(A)对各成分进样量(x)进行线性回归,得到龙胆苦苷、獐牙菜苦苷、獐牙菜苷、苦龙胆酯苷的回归方程分别为 A=800.04x+40.197(R2=1.000 0)、A=1 704.3x-57.269(R2=0.999 7)、A=3 014.0x+6.815 4(R2=0.999 8)、A=1 763.9x+7.483(R2=0.999 8),线性范围分别为1.536~15.36、0.050 50~1.010 00、0.001 63~0.081 60、0.001 57~0.078 40 μg。精密度考察结果显示,4个成分对照品溶液峰面积的RSD分别为0.44%、1.31%、1.20%、1.25%(n=6),表明仪器精密度良好。重复性考察结果显示,供试品溶液中上述4个成分含量的RSD分别为2.32%、2.02%、1.91%、2.78%(n=6),表明重复性较好。稳定性考察结果显示,供试品溶液中上述4个成分峰面积的RSD分别为0.42%、0.49%、1.90%、2.94%(n=6),表明供试品溶液在室温放置12 h内稳定。精密量取适量已知含量的样品,共9份,分别按已知含量的80%、100%、120%加入龙胆苦苷、獐牙菜苦苷、獐牙菜苷、苦龙胆酯苷对照品(每个浓度3份),并依法测定加样回收率,结果80%、100%、120%加样量样品的平均加样回收率分别为 100.9%、98.03%、105.3%、97.70%(RSD 分别为2.51%、1.49%、2.33%、1.28%,n=9),表明该方法准确度良好。
2.2.3 含量测定 取“2.1.1”项下供试品溶液,按“2.2.1”项下HPLC检测条件测定3种龙胆属植物中龙胆苦苷、獐牙菜苦苷、獐牙菜苷和苦龙胆酯苷的含量,每个样品均做3组平行实验。结果显示,在头花龙胆和坚龙胆的根及根茎中均检测到了上述4种成分,但在微籽龙胆根及根茎中未检测到龙胆苦苷。其中,头花龙胆根及根茎中龙胆苦苷含量与坚龙胆根及根茎中含量相近,是2020版《中国药典》(一部)“坚龙胆”项下限量标准(1.50%)的4.42倍;而在微籽龙胆根及根茎中未检测到龙胆苦苷,但微籽龙胆根及根茎中獐牙菜苦苷、苦龙胆酯苷的含量分别是坚龙胆根及根茎的34.12、8.81倍,是头花龙胆根及根茎的9.84、7.45倍。结果见表1。
表1 3种龙胆属植物根及根茎中4种环烯醚萜类成分的含量比较(±s,n=3,%%)
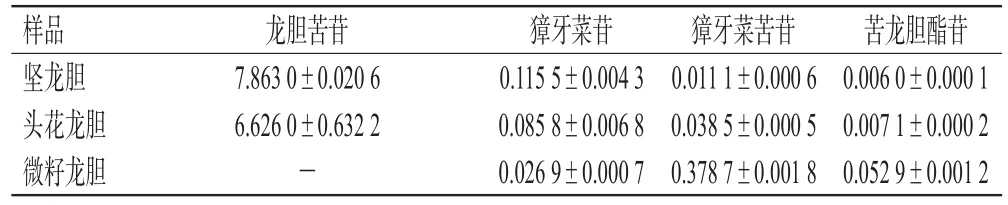
表1 3种龙胆属植物根及根茎中4种环烯醚萜类成分的含量比较(±s,n=3,%%)
-:未检出
样品坚龙胆头花龙胆微籽龙胆苦龙胆酯苷0.006 0±0.000 1 0.007 1±0.000 2 0.052 9±0.001 2龙胆苦苷7.863 0±0.020 6 6.626 0±0.632 2-獐牙菜苷0.115 5±0.004 3 0.085 8±0.006 8 0.026 9±0.000 7獐牙菜苦苷0.011 1±0.000 6 0.038 5±0.000 5 0.378 7±0.001 8
2.3 3种龙胆属植物根及根茎的化学成分差异分析
运用UPLC-ESI-Q-TOF-MS法分析3种龙胆属植物根及根茎的化学成分差异。
2.3.1 色谱及质谱检测条件 采用Dionex-C18(150 mm×2.1 mm,3 μm)色谱柱,以甲醇(A)-水(B)为流动相进行梯度洗脱(0~10 min,15%A→27%A;10~20 min,27%A→35%A;20~40 min,35%A→80%A;40~45 min,80%A→100%A);检测波长为 243 nm;柱温为25 ℃;流速为0.2 mL/min。采用电喷雾离子源(ESI),在正离子模式扫描;毛细管电压为4 500 V,雾化器压力为1.8 bar;干燥气体为氮气,干燥气流速为8 L/min;干燥温度为220 ℃;离子源温度为220 ℃;扫描范围为m/z 50~2 000;碰撞气体为氩气,扫描时碰撞能量为8 eV;六极杆射频电压为70 Vpp,四极杆离子能量为8 eV。准确质量数用甲酸钠校正液校正。
2.3.2 样品检测及数据处理 取“2.1.1”项下供试品溶液和“2.1.2”项下混合对照品溶液,分别按“2.3.1”项下检测条件进样测定,分别测得坚龙胆、头花龙胆、微籽龙胆3种龙胆属植物的质谱数据,并将测得的数据用Bruker Compass Data Analysis 4.3软件进行处理。经课题组前期研究及查阅文献发现,环烯醚萜类和酮类成分在正离子模式下响应较好[12―14],因此本研究选择正离子扫摸模式,选中质谱图中对应的分子离子峰,即可输出对应的分子式。结合对照品相关信息、相同类型化合物的裂解规律[15―17]、文献报道的质谱数据[15―22]进行结构鉴定,并定性分析样品中的主要活性成分。
2.3.3 结果分析 经分析,从坚龙胆、头花龙胆、微籽龙胆根及根茎中共鉴定出33个化合物,包括环烯醚萜类化合物8个(化合物5、6、7、8、16、18、23、27)酮类化合物8个(化合物3、4、10、11、24、28、29、33),黄酮类化合物8个(化合物2、9、12、20、26、30、31、32),生物碱类化合物4个(化合物14、15、17、21),酚酸类化合物3个(化合物1、13、19),三萜类化合物1个(化合物22),苯甲酸酯类化合物1个(化合物25)。3种龙胆属植物根及根茎中有8个共有成分(化合物1~8),主要为环烯醚萜类化合物;坚龙胆与头花龙胆根及根茎中有17个共有化合物(化合物1~17),主要为环烯醚萜类和酮类化合物;坚龙胆与微籽龙胆根及根茎中有9个共有化合物(化合物1~8、化合物20),主要为环烯醚萜类化合物。有4个化合物(化合物26~29)仅在坚龙胆根及根茎中鉴定出,为环烯醚萜类和酮类化合物;有5个化合物(化合物21~25)仅在头花龙胆根及根茎中鉴定出,其中化合物22(三萜类化合物)和化合物25(苯甲酸酯类化合物)为头花龙胆根及根茎中特有成分;有4个化合物(化合物30~33)仅在微籽龙胆根及根茎中鉴定出,均为黄酮类化合物。3种龙胆属植物的UPLC-ESI-Q-TOF-MS基峰色谱图(base peak chromatogram,BPC)见图1,化学成分鉴定结果如表2。
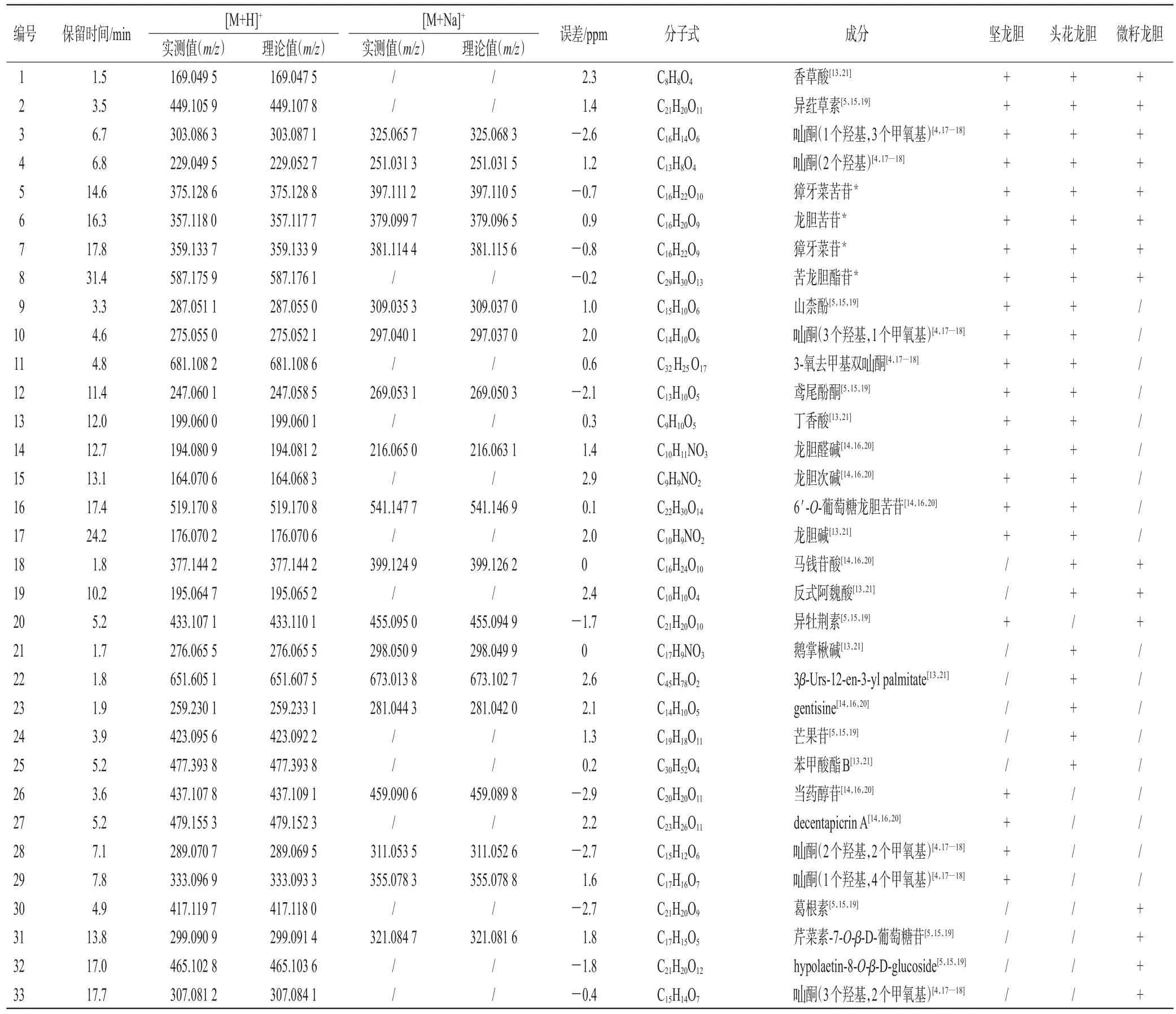
表2 3种龙胆属植物的化学成分鉴定结果
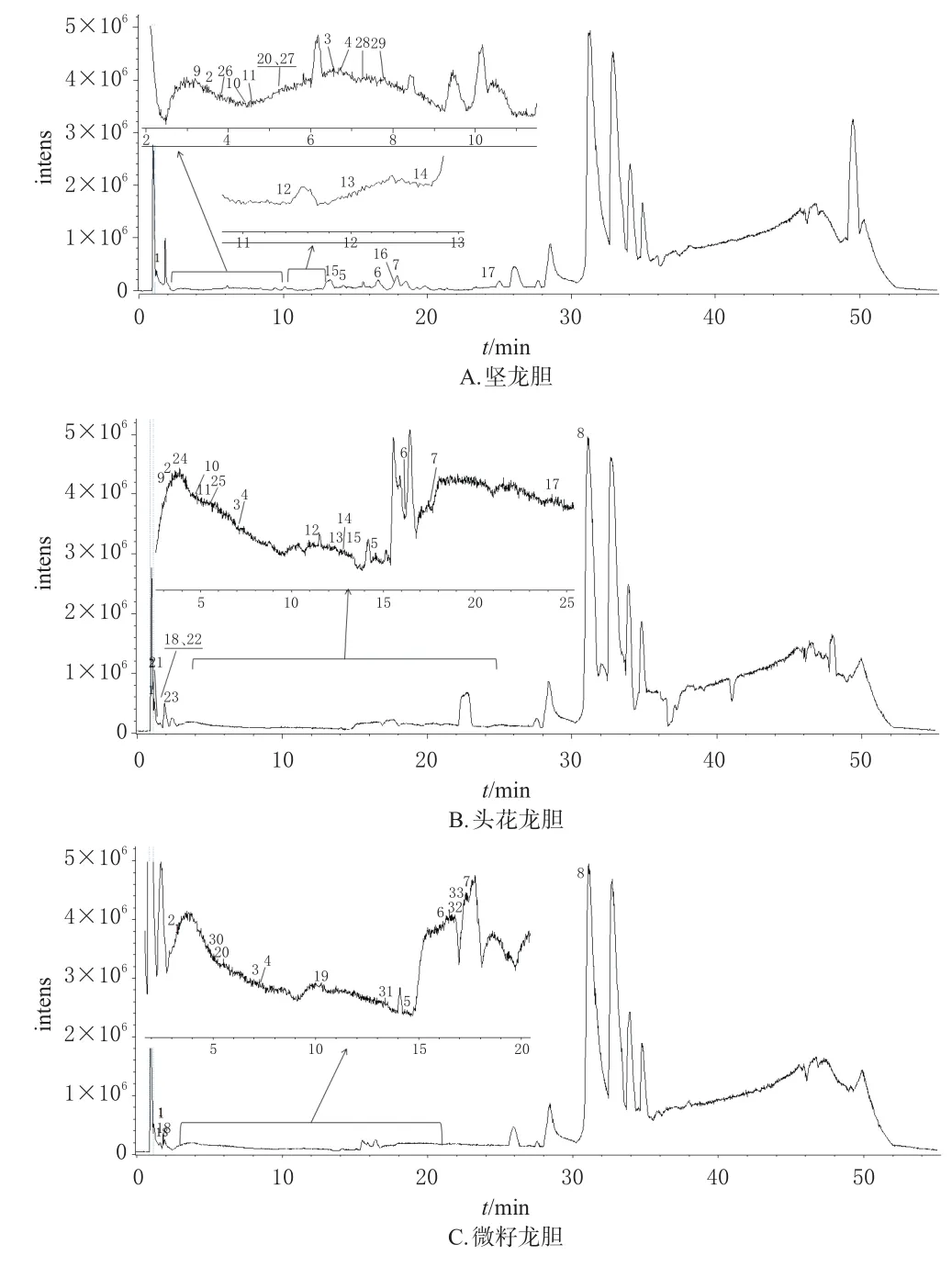
图1 3种龙胆属植物的BPC
2.4 3种龙胆属植物根及根茎的PCA
将“2.3.1”下测得的3种龙胆属植物根及根茎的液质数据导入Bruker Compass ProfilAnalysis 2.2软件进行PCA,结果见图2。结果显示,坚龙胆及头花龙胆的主成分在空间分布较聚集,差异较小;微籽龙胆与其他2种植物的主成分空间分布较远,存在较大差异。进一步对3种龙胆属植物根及根茎的主要差异峰进行分析,结果见图3。结果显示,在PCA模式下3种龙胆属植物中m/z 50~2 000的主成分分布较聚集,但在以下几个峰存在差异:色谱峰46.52 min、m/z 701.500 0对应点离中心距离最远,37.52 min、m/z 717.500 0次之,这2个点对差异的贡献率最大。进一步检索SDBS及ChemSpider等数据库对这2个差异峰进行分析发现,这2个差异化合物均为三萜类化合物,且该化合物仅存在于坚龙胆的根及根茎中。其次,32.52 min、m/z 701.500 0,1.52 min、 m/z 543.500 0,46.52 min、m/z 814.500 0,35.52 min、m/z 814.500 0,45.52 min、m/z 814.500 0,34.52 min、m/z 814.500 0,34.52 min、m/z 701.500 0,1.52 min、m/z 229.500 0等10个点和中心也有一定距离,差异也较大。进一步检索上述数据库,发现这些差异化合物主要为脂肪族化合物和氨基酸。

图2 3种龙胆属植物根及根茎的PCA结果

图3 3种龙胆属植物根及根茎主要差异峰分析
3 讨论
3.1 4种定量分析指标的选择
有许多含有龙胆药材的传统中药方剂都有很好的治疗肝胆脾胃的作用,如出自宋代《太平惠民和剂局方》的中药制剂龙胆泻肝汤等。龙胆属植物主要药效成分为环烯醚萜类化合物,其中以龙胆苦苷为代表,其是龙胆药材的质量控制指标性成分。此外,獐牙菜苦苷作为日本当药的主要活性成分,具有很好的健胃功效[7];Wang等[8]研究发现,在治疗类风湿性关节炎的藏药翼首草中起抗炎作用的主要活性成分可能是獐牙菜苷;Potunuru等[9]研究发现,口服苦龙胆酯苷可以减弱糖尿病介导的新生内膜增厚以及脂质在主动脉内膜的沉积,从而降低动脉粥样硬化的发生风险。因此,本研究采用HPLC法测定了上述4种环烯醚萜类成分含量。
3.2 头花龙胆和坚龙胆中化学成分的差异分析
经HPLC分析,在坚龙胆、头花龙胆中均可检测到上述4种成分,且龙胆苦苷含量均达到2020年版《中国药典》(一部)“坚龙胆”项下标准含量限度的4倍以上,这提示头花龙胆具有替代坚龙胆的可能性。通过UPLC-ESIQ-TOF-MS技术从坚龙胆和头花龙胆根及根茎中共鉴定出17个共有化合物,主要为酮类和环烯醚萜类成分。另外,苯甲酸酯类化合物苯甲酸酯B和三萜类化合物3β-Urs-12-en-3-yl palmitate为头花龙胆所特有。近年来,相关研究发现,苯甲酸酯类化合物对阿尔茨海默病有治疗作用[23]。经PCA发现,头花龙胆和坚龙胆的主成分空间分布聚集在一起,表明头花龙胆和坚龙胆的根及根茎主成分差异较小,这进一步验证了头花龙胆的可替代性。
3.3 微籽龙胆与坚龙胆根及根茎中化学成分的差异分析
经HPLC分析,微籽龙胆中未检测到龙胆苦苷,但可以检测到獐牙菜苦苷、獐牙菜苷和苦龙胆酯苷3种成分,其中獐牙菜苷、苦龙胆酯苷的含量高于坚龙胆。通过UPLC-ESI-Q-TOF-MS技术定性分析,在微籽龙胆根及根茎中鉴定出15个化合物,其中有9个化合物也同时在坚龙胆中被鉴定出,这9个共有化合物主要为环烯醚萜类成分,并且龙胆药材的主要活性成分龙胆苦苷也在微籽龙胆中被检测出。此外,有4种化合物仅在微籽龙胆根中被鉴定出,主要为黄酮类成分,分别是葛根素、芹菜素-7-O-β-D-葡萄糖苷、hypolaetin-8-O-β-D-glucoside和酮(3个羟基,2个甲氧基)。黄酮类成分具有较好的抗炎、抗氧化活性[16],由此推测微籽龙胆可能比坚龙胆具有更好的健胃抗炎等药理作用。经PCA发现,微籽龙胆根及根茎的主成分空间分布与坚龙胆分布在不同区域,距离较远,表明微籽龙胆与坚龙胆主成分差异较大。这与含量分析结果相符,进一步证明了微籽龙胆与坚龙胆的根及根茎存在差异。
综上所述,同一产地坚龙胆与头花龙胆根及根茎中4种主要活性成分含量差异较小,但微籽龙胆与坚龙胆根及根茎的4种主要活性成分含量差异较大。三者化学成分组成也存在差异,坚龙胆和头花龙胆根及根茎中主要为环烯醚萜类和酮类成分,而微籽龙胆根及根茎中主要含有环烯醚萜类和黄酮类成分。因此,微籽龙胆不能代替坚龙胆入药。而头花龙胆与坚龙胆的根及根茎中化学成分差异较小,替代后者入药的可能性较大,但仍需通过药理实验加以验证。
