基于网络药理学和生物信息学探究西黄丸治疗肝癌作用机制
2023-02-17冯文敏吴铠悦黄月萍刘亚茹赵洪波刁勇朱亚玲
冯文敏,吴铠悦,黄月萍,刘亚茹,赵洪波,刁勇,朱亚玲
1.华侨大学医学院,福建 泉州 362021;2.昆明医科大学生物医学工程研究中心,云南 昆明 650500
肝癌是全球范围内最常见的恶性肿瘤之一,其发病率和死亡率呈逐年递增趋势,严重威胁人类生命健康。肝癌发病隐匿,早期诊断率低,多数患者确诊时已为中晚期,错过了最佳治疗时机,导致患者预后较差[1]。因此,迫切需要可有效延长肝癌患者生存期的治疗手段和药物。
西黄丸是中医抗癌名方,由牛黄、麝香、乳香和没药4味中药组成,有清热解毒、消肿散结功效,用于热毒壅结所致痈疽疔毒、瘰疬、癌肿等疾病[2]。药理研究发现,西黄丸对肝癌、肺癌、乳腺癌等多种癌症有一定疗效,具有诱导癌细胞凋亡、抑制细胞侵袭和转移、抑制血管生成、改善肿瘤免疫抑制微环境等作用[3-5],但其治疗肝癌的分子机制尚不完全明确。
网络药理学是基于系统生物学理论,从整体角度探索药物-生物系统-疾病之间复杂作用关系,形成药物分子设计新模式,是发展创新药物的重要途径[6]。近年来,虽然已经利用基因芯片及高通量测序技术发现了一些与肝癌相关的重要基因,但其在肝癌发生发展及治疗中的作用仍需深入研究。本研究通过网络药理学、生物信息学及分子对接方法,对西黄丸治疗肝癌的潜在活性成分及预后相关靶点进行分析,为阐明西黄丸治疗肝癌的作用机制及开发治疗肝癌的新型药物提供依据。
1 资料与方法
1.1 西黄丸活性成分筛选
利用TCMSP(https://tcmsp-e.com/)[7]、化学专业数据库(www.organchem.csdb.cn)[8]检索西黄丸中牛黄、麝香、乳香、没药4味中药的化学成分,通过PubChem(https://pubchem.ncbi.nlm.nih.gov)[9]数据库获取化合物的SMILES分子结构,将分子结构导入SwissADME(http://www.swissadme.ch)[10]数据库预测化合物的吸收度和类药性,筛选胃肠(GI)吸收为“High”、5 个类药性参数(Lipinski、Ghose、Veber、Egan、Muegge)预测结果中有3个及以上为“Yes”的化合物,作为活性成分。
1.2 活性成分靶点预测
将活性成分导入SwissTargetPrediction(http://www.swisstargetprediction.ch)[11]数据库,选择物种为“Homo sapiens”,依据反向药效团匹配方法预测活性成分的作用靶点,收集靶点蛋白信息。随后利用UniProt数据库(https://www.uniprot.org/)[12]对靶点蛋白名称进行统一校正,并获取靶点蛋白对应的靶点基因。
1.3 差异表达靶点基因筛选
利用GEPIA(http://gepia.cancer-pku.cn/)[13]数据库分析靶点基因在肝癌组织和正常组织的表达水平,Matched Normal data 设 为“Match TCGA normal data”,其余为默认。将在肝癌组织和正常组织表达有显著差异,即|log2FC|>1,P<0.01的靶点基因作为差异表达靶点基因。
1.4 GO功能和KEGG通路富集分析
将差异表达靶点基因导入DAVID(https://david.ncifcrf.gov)[14]数据库,以FDR<0.05为显著富集标准,进行GO功能富集和KEGG通路富集分析。
1.5 蛋白相互作用网络构建
将“1.3”项下差异表达靶点基因对应的蛋白导入STRING(https://cn.string-db.org/)[15]数据库,限定物种为“Homo sapiens”,置信度为0.4,构建靶点蛋白相互作用(PPI)网络,将PPI 网络用Cytoscape3.9.0 软件[16]进行可视化,节点颜色代表靶点差异表达水平。借助NetworkAnalyzer插件进行拓扑分析,筛选接近中心性(CC)、中介中心性(BC)和度值(degree)均大于平均值的靶点作为关键靶点。将关键靶点基因与KEGG显著富集通路中对应的靶点基因取交集,得到核心靶点基因。
1.6 核心靶点基因生存分析
Kaplan-Meier Plotter 数据库(http://kmplot.com/analysis/)[17]可评估基因表达对多种肿瘤预后的影响,用于发现和验证与肿瘤预后相关的生物标志物。根据核心靶点基因表达中位数,将数据库中364例肝癌患者分为高表达组和低表达组,计算危险比(hazard radio,HR)及95%置信区间(CI),差异比较用logrankP检验,logrankP<0.05表示差异有统计学意义,分析核心靶点基因与肝癌患者预后的相关性,得到预后相关核心靶点。
1.7 中药-活性成分-预后相关核心靶点-信号通路网络构建
在Excel2013中构建“中药-活性成分”“活性成分-预后相关核心靶点”“预后相关核心靶点-信号通路”的对应关系,并将其导入Cytoscape3.9.0软件,构建并分析西黄丸治疗肝癌的中药-活性成分-预后相关核心靶点-信号通路网络,网络中不同颜色节点表示中药、活性成分、预后相关核心靶点和通路,节点间连线表示关联关系。
1.8 分子对接
从PubChem数据库获取西黄丸活性成分3D结构作为对接配体。从RCSB PDB(http://www.rcsb.org)[18]数据库下载预后相关核心靶点3D结构,作为对接受体。将对接配体和对接受体文件上传至CB-Dock(http://clab.labshare.cn/cb-dock/php/)[19]分子对接工具,受体设为刚性分子,配体设为柔性分子,通过MGLTools工具对受体进行移除小分子、水分子和加氢等操作,对配体进行加氢、加电子等操作使其能量最小化,将其转换为pdbqt 格式文件,应用AutoDock Vina1.1.2进行分子对接,以结合能大小判断受体与配体结合力强弱。
2 结果
2.1 西黄丸活性成分及作用靶点获取
通过TCMSP和化学专业数据库共检索到西黄丸中化学成分385个,根据吸收度和类药性等参数筛选出活性成分194个,其中牛黄18个、麝香36个、乳香72个、没药79个。经SwissTargetPrediction预测活性成分作用靶点,去除重复后,共得到873个作用靶点。靶点数量排名前10位的活性成分见表1。
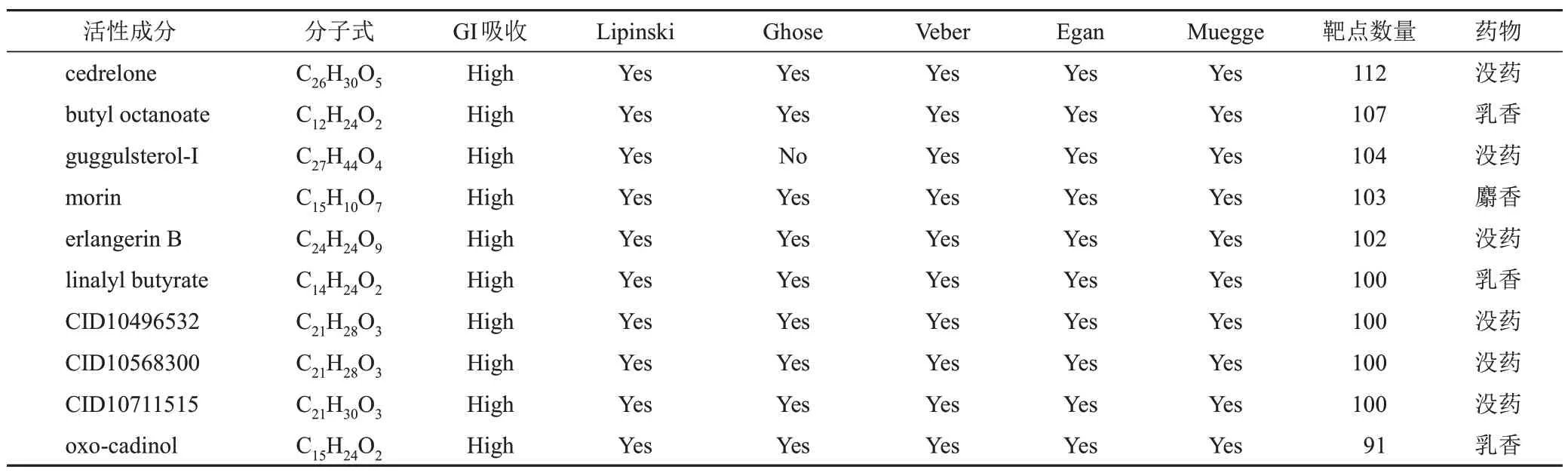
表1 西黄丸活性成分信息(靶点数量前10位)
2.2 差异表达靶点基因获取
利用GEPIA数据库分析873个靶点基因在肝癌组织和正常组织的表达水平,共得到有显著差异的靶点基因147个,其中89个上调靶点基因、58个下调靶点基因。
2.3 GO功能及KEGG通路富集分析结果
GO功能富集分析得到生物过程(BP)19个、细胞组分(CC)13个、分子功能(MF)16个,上调靶点和下调靶点的富集结果中排名前5位条目见图1。上调靶点主要富集于蛋白质磷酸化、细胞分裂、G2/M有丝分裂细胞周期转变、凋亡过程的负调控等生物过程,分布于胞液、核质、细胞膜等细胞组分,涉及蛋白激酶活性、ATP结合、蛋白丝氨酸/苏氨酸激酶活性等分子功能;下调靶点主要富集于药物代谢过程、环氧化酶P450通路、类固醇代谢过程、氧化还原过程等生物过程,分布于细胞器膜、内质网膜、外泌体等细胞组分,涉及氧结合、氧化还原酶活性、类固醇羟化酶活性等分子功能。
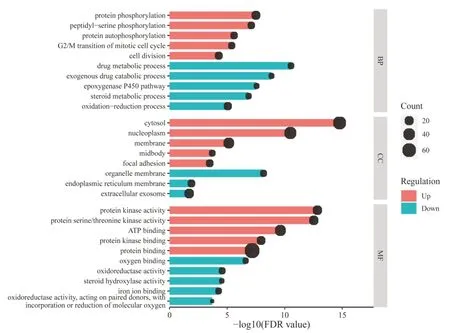
图1 西黄丸治疗肝癌靶点GO功能富集分析
KEGG通路富集分析得到9条信号通路,其中上调靶点参与调控细胞周期、孕酮介导的卵母细胞成熟、卵母细胞减数分裂3条信号通路;下调靶点主要参与细胞色素P450对外源性药物代谢、化学致癌作用、视黄醇代谢、代谢途径等6条信号通路。见图2。
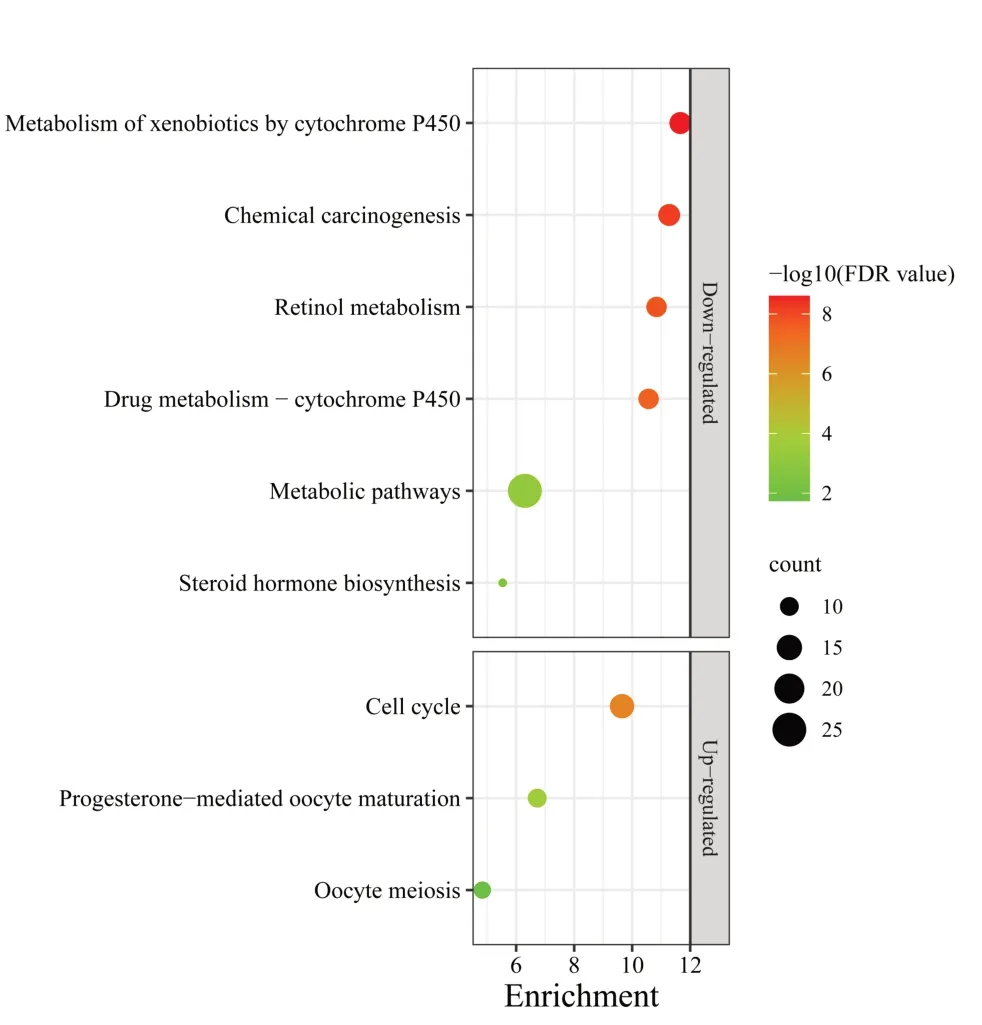
图2 西黄丸治疗肝癌靶点KEGG通路富集分析
2.4 靶点蛋白相互作用网络构建及核心靶点获取
通过STRING数据库及Cytoscape3.9.0软件构建靶点PPI网络(见图3),网络中包含144个节点和833条边,degree值越大,节点越大。拓扑分析得到BC、CC和degree均大于平均值即0.407、0.011和12的节点26个,将其作为关键靶点。关键靶点信息见表2。

表2 西黄丸治疗肝癌关键靶点信息
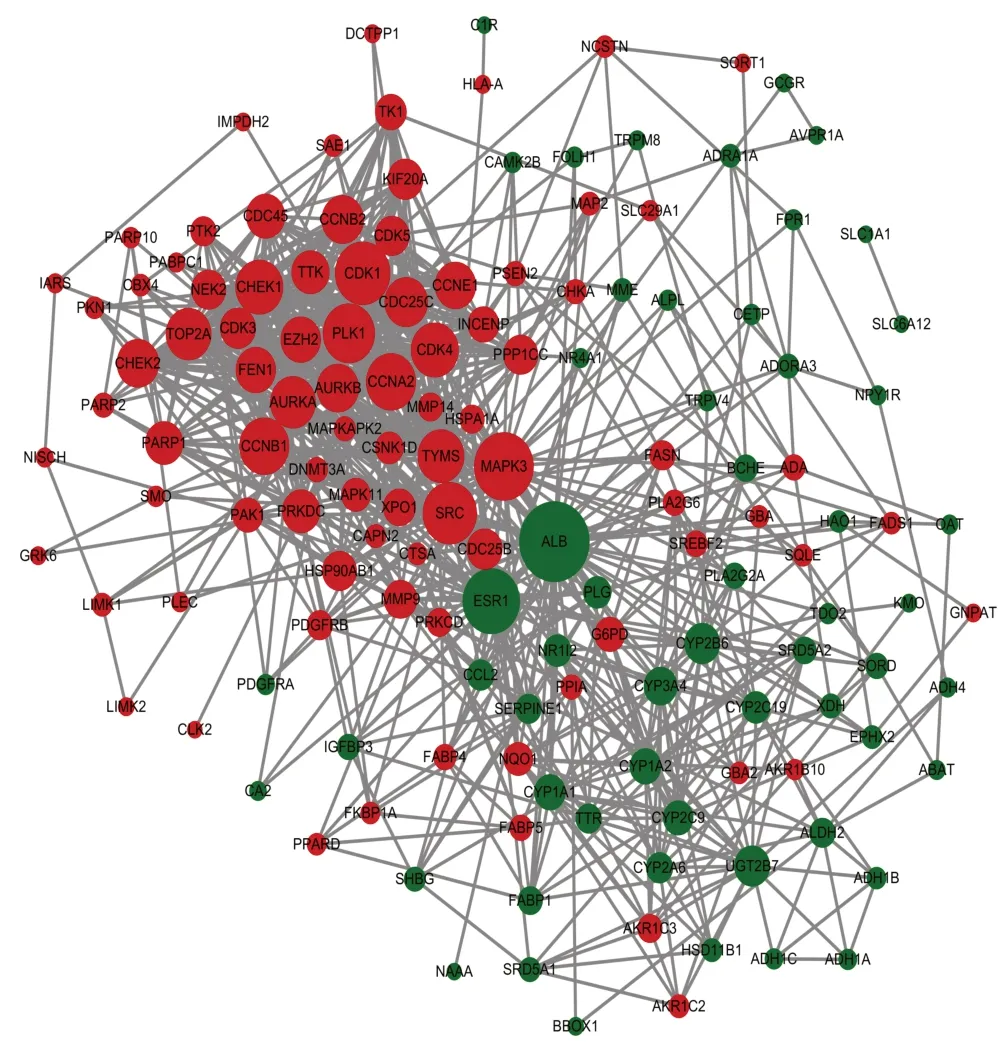
图3 西黄丸治疗肝癌靶点PPI网络
将筛选出的26个关键靶点基因与9条KEGG显著性富集通路中对应的靶点基因取交集,得到14个核心靶点基因,包括MAPK3、CDK1、PLK1、CCNA2等10 个表达上调靶点基因及UGT2B7、CYP2B6、CYP1A1、CYP2C19共4个表达下调靶点基因。
2.5 预后相关核心靶点获取
利用Kaplan-Meier Plotter数据库评估14个核心靶点基因在肝癌患者中的预后价值,总生存期分析结果显示,MAPK3、CDK1、PLK1、CCNA2、CCNB1、CDK4、PRKDC 7个基因高表达与肝癌患者较差的总生存期相关(logrankP<0.05);CYP2C19基因高表达与肝癌患者较长的总生存期相关(logrankP<0.05),表明上述8个基因与肝癌患者预后密切相关。见图4。
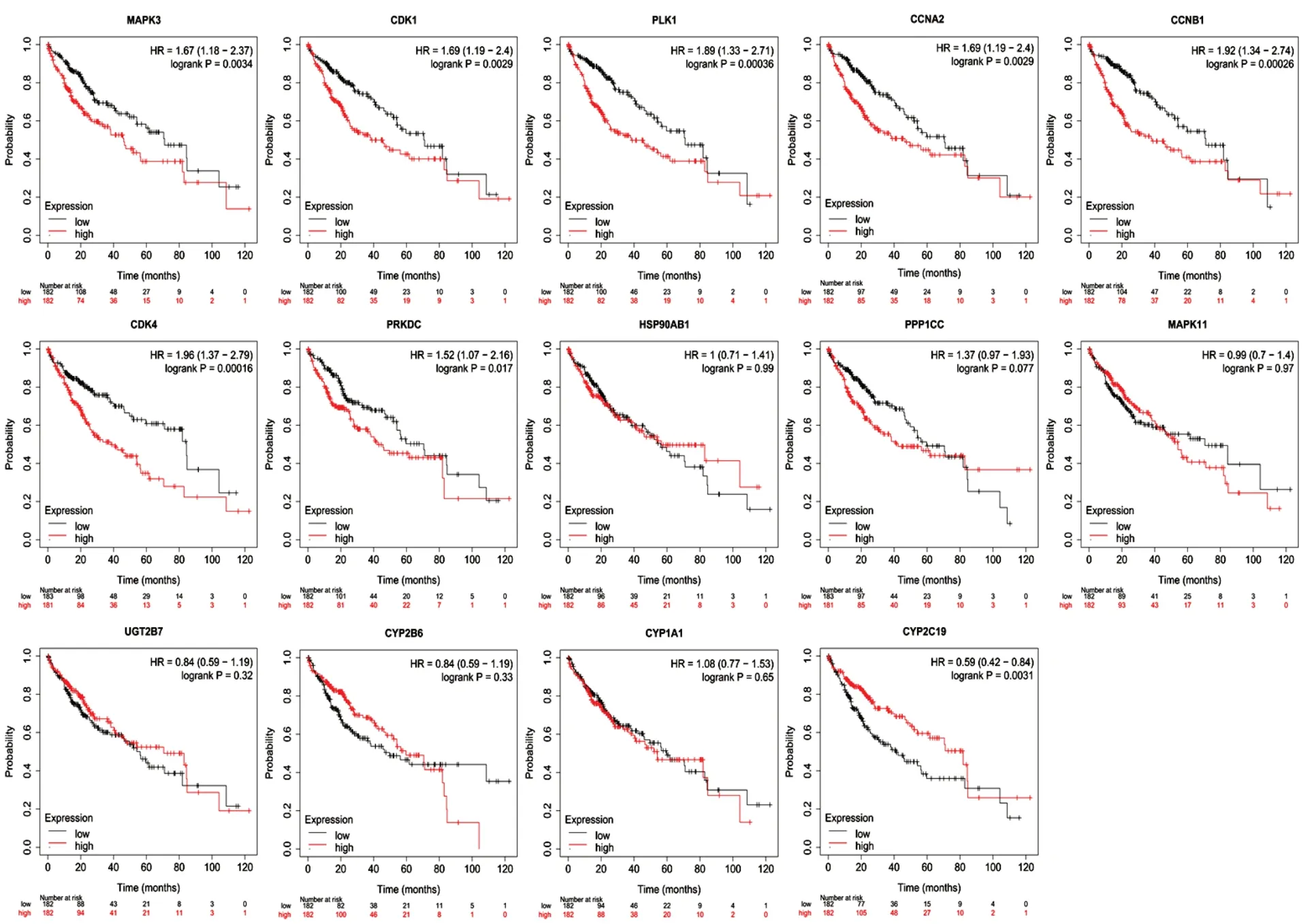
图4 西黄丸治疗肝癌核心靶点基因生存分析
2.6 中药-活性成分-预后相关核心靶点-信号通路网络
采用Cytoscape3.9.0软件构建中药-活性成分-预后相关核心靶点-信号通路网络,见图5。该网络包含86个节点(4个中药、68个活性成分、8个预后相关核心靶点、6条信号通路)和201条边,68个活性成分中27个来自乳香、34个来自没药、4个来自麝香、4个来自牛黄,其中erlangerin B、[(5R,5Ar,8aS)-6-氧代-5-(3,4,5-三甲氧基苯基)-5,8,8a,9-四氢-[2]苯并呋喃[6,5-f][1,3]苯并二氧醇-5a-基]醋酸盐(CID11004967)、洋椿苦素(cedrelone)、桑色素(morin)、辛酸丁酯(butyl octanoate)分别作用于7、5、4、3、3个预后相关核心靶点。MAPK3、CYP2C19、CDK1等靶点对应活性成分数量较多,分别为36、27、23个。
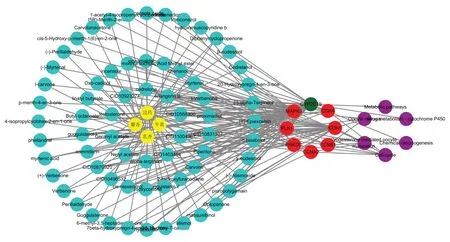
图5 西黄丸治疗肝癌中药-活性成分-预后相关核心靶点-信号通路网络
2.7 分子对接结果
结合能<0 kJ/mol表明配体与受体可自发结合,一般认为,配体与受体结合的构象稳定时能量越低,发生作用的可能性越大,结合力越强[20-21]。将中药-活性成分-预后相关核心靶点-信号通路网络中靶点数排名前5位的活性成分与8个预后相关核心靶点进行分子对接,以结合能≤-5.0 kJ/mol为筛选标准,结果显示,对接结合能>-5.0 kJ/mol的有1个,<-5.0 kJ/mol有39个,表明活性成分与预后相关核心靶点间均具有较强的结合力,见图6。其中cedrelone 与CYP2C19 的结合能最低,cedrelone可结合到CYP2C19蛋白的活性位点,并与氨基酸残基A297 形成氢键作用,与残基L366、F476、F114等形成疏水作用,见图7。
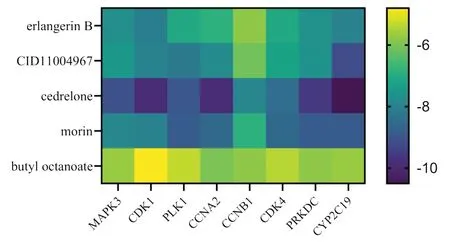
图6 主要活性成分与预后相关核心靶点分子对接热图
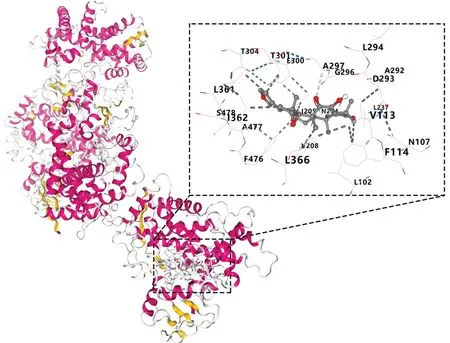
图7 cedrelone与CYP2C19分子对接模式
3 讨论
西黄丸中牛黄清心退热、化痰通窍、散结消肿,为君药;臣以麝香通经络、散结滞、辟恶毒、除秽浊;佐以乳香、没药活血祛瘀。诸药配伍有清热解毒、活血祛瘀、消坚肿、散痰结等功效[22],在肝癌治疗中应用广泛。
本研究利用网络药理学和生物信息学方法筛选得到194个西黄丸活性成分及873个作用靶点,其中147个靶点基因在肝癌组织与正常组织表达有显著差异。经靶点PPI网络构建和生存分析得到MAPK3、CDK1、PLK1、CCNA2、CCNB1、CDK4、PRKDC、CYP2C19共8个与肝癌患者预后密切相关的核心靶点。丝裂原活化蛋白激酶(MAPK)是MAPK/ERK信号通路中的关键蛋白,该通路及下游转录因子参与细胞增殖、凋亡、周期调控、肿瘤侵袭和转移等生物过程[23]。MAPK3磷酸化后可调控细胞增殖和凋亡相关核转录因子c-fos、c-Jun等,促进肝癌发生、发展和转移,且MAPK3磷酸化水平高的肝癌患者复发率明显增加,预后较差[24]。周期蛋白依赖性激酶(CDK)1是一种丝氨酸/苏氨酸激酶,在细胞周期调控中发挥重要作用。研究发现,miR-1271-5p可通过靶向抑制CDK1表达,从而阻滞细胞周期,抑制肝癌细胞增殖,增强肝癌细胞对放疗的敏感性,发挥治疗肝癌的辅助作用[25]。Polo 样激酶(PLK)1是细胞有丝分裂的重要调节因子,其过表达可使多聚二磷酸腺苷酸核糖聚合酶(PARP)10磷酸化,破坏PARP10对NEMO信号泛素化的抑制,从而增强核因子-κB对多个靶基因的转录活性,促进肝癌进展[26]。CCNA2 和CCNB1 是细胞周期蛋白家族成员,可通过激活CDK激酶调控细胞周期,从而调控细胞增殖、生长和凋亡。有研究表明,CCNA2和CCNB1高表达与肝癌患者总生存期和无病生存期降低相关[27]。CDK4/cyclin D 复合物可调控细胞周期G1/S 的转换,SOCS1可通过降低肝癌细胞核CDK4/cyclin D复合物的稳定性,从而抑制细胞周期进展到S期[28]。PRKDC基因编码的DNA依赖蛋白激酶催化亚基(DNA-PKcs)是DNA双链断裂修复和重组的关键组成部分,在维持基因组稳定方面发挥作用[29]。CYP2C19是重要的药物代谢酶,在许多药物、内源性生物分子和环境毒物的激活或消除中发挥关键作用,CYP2C19异常表达与临床药物疗效差或治疗失败有关[30]。
GO功能及KEGG通路富集分析发现,西黄丸治疗肝癌的上调靶点主要通过参与蛋白质磷酸化、细胞分裂、G2/M有丝分裂细胞周期转变等生物过程,调控细胞周期及细胞凋亡等信号通路,发挥治疗肝癌的作用。研究表明,细胞周期失调可介导细胞转化和细胞生长失控,从而导致肿瘤细胞无限增殖[31]。因此,靶向作用于细胞周期调控因子可作为治疗肝癌的潜在策略。下调靶点涉及药物代谢过程、环氧化酶P450通路、类固醇代谢过程等生物过程,与细胞色素P450对外源性药物代谢、化学致癌作用、视黄醇代谢等信号通路相关。肝脏是参与蛋白质合成、脂肪代谢、糖代谢、药物和毒物代谢,发挥吞噬和免疫功能的重要器官,肝脏代谢异常是肝癌发病的基础。肝癌细胞可通过改变脂质代谢、增强糖酵解和脂肪酸β-氧化等途径增加能量供应,从而促进肝癌细胞增殖或减少肝癌细胞凋亡[32]。因此,探索西黄丸调节肝脏异常代谢的机制具有重要的临床意义。
中药-活性成分-预后相关核心靶点-信号通路网络及分子对接分析发现,erlangerin B、CID11004967、洋椿苦素、桑色素等活性成分与肝癌预后相关核心靶点具有较强的结合力,说明活性成分在西黄丸治疗肝癌过程中可能发挥重要作用。研究发现,erlangerin B对巨噬细胞具有一定的细胞毒性,且能抑制多种肿瘤细胞增殖[33]。洋椿苦素可通过上调肝癌患者体内吩嗪合成类结构域蛋白水平,介导Ras/Rap1信号通路,表现出显著的抗肝癌作用[34]。桑色素是一种黄酮类化合物,具有抗氧化、抗糖尿病、抗炎、抗肿瘤、抗高血压、抗菌、降尿酸和神经保护作用[35]。有研究报道,桑色素对肝癌、宫颈癌、黑色素瘤、乳腺癌、前列腺癌和结肠癌等多种癌症具有药理作用[36]。
综上所述,本研究通过网络药理学、生物信息学及分子对接方法,探讨西黄丸治疗肝癌的药理作用机制, 发现西黄丸中活性成分erlangerin B、CID11004967、洋椿苦素、桑色素等通过作用于MAPK3、CDK1、PLK1等肝癌预后相关靶点调节多条信号通路,从而发挥治疗肝癌及延长肝癌患者生存期的作用,可为后续研究提供新的思路。
