普鲁兰多糖产生菌出芽短梗霉的紫外诱变及其培养基优化
2023-02-17赵廷彬殷海松张琳乔长晟
赵廷彬,殷海松,2*,张琳,乔长晟,3,4*
(1.天津慧智百川生物工程有限公司,天津 300457;2.天津现代职业技术学院生物工程学院,天津 300350;3.天津科技大学生物工程学院,天津 300457;4.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457)
普鲁兰多糖是微生物产生的一种胞外水溶性中性多糖,是以α-(1,4)糖苷键连接D-葡萄糖单体缩合成的麦芽三糖单元通过α-(1,6)糖苷键连接而成的线性多糖[1-3],又可称为聚麦芽三糖。普鲁兰多糖独特的结构使其具有高水溶性、成膜性、可塑性、可降解性、阻氧性和稳定性等诸多特性[4-7],被广泛应用于各领域,是一种极具开发价值和应用前景的新型功能性生物大分子,分子范围为5 ku~9 000 ku[8-10]。
目前,能够生产普鲁兰多糖的菌株有寄生真菌(Cytaria spp.)、出芽暗色孢霉(Dematium pullulans)、出芽短梗霉(Aureobasidium pullulans)、栗疫病菌(Cryphonectria parasitica)、红酵母(Rhodotorula bacarum)、黄金银耳(Tremella mesenterica)和产气杆菌(Aerobacter aerogenes)等[1,11-13]。出芽短梗霉因其产糖量高,逐渐成为微生物发酵产普鲁兰多糖的主要菌种[7,13-15]。
出芽短梗霉由于其变种很多,性能差异大而不能直接满足工业化生产的需求,并且在普鲁兰多糖合成的过程中往往伴有黑色素等多种副产物的生成[4,13,16],对后期普鲁兰多糖的分离提取带来极大的困难,加上该菌株形态多异,不好控制等原因,导致普鲁兰多糖的工业化生产成为难题。为了实现普鲁兰多糖高产量、高品质、低成本的工业化生产,产糖量高、色素合成低的菌种是关键前提。李慧颖等[17]利用紫外诱变筛选出了1株高产普鲁兰多糖的突变株UV-1,其普鲁兰多糖产量为46.96 g/L,较原始菌株提高了1.43倍。王贤卓[18]通过硫酸二乙酯、亚硝基胍、紫外线等复合诱变,筛选出一株普鲁兰多糖高产菌P1012,普鲁兰产量为25.60 g/L,较出发菌株P23提高了22.4%。
本文实验室前期分离得到的出芽短梗霉CGMCC NO.3337具有较高的普鲁兰多糖合成能力,多糖产量在60 g/L左右。为了进一步提高普鲁兰多糖的产量,以该菌株为出发菌株,利用紫外诱变技术进行普鲁兰高产菌的选育。后续以单因素试验结合响应面分析法对突变株UV-10的发酵培养基成分配比进行优化,寻找最佳产糖培养基配比,为后续工业化放大提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种与培养基
出芽短梗霉(Aureobasidium pullulans):保藏于中国普通微生物菌种保藏管理中心。保藏号:CGMCC NO.3337。
斜面培养基(g/L)[马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)]:土豆 200,琼脂粉 20,葡萄糖20,加入蒸馏水至1 L,121℃高压灭菌20 min。
种子培养基(g/L):蔗糖 100,酵母浸粉 3.0,NaCl 2.5,MgSO4·7H2O 0.4,(NH4)2SO41,FeSO4·7H2O 0.05,K2HPO42,初始pH值6.0,121℃下灭菌20 min。
基础发酵培养基(g/L):蔗糖 150,蛋白胨 5,MgSO4·7H2O 0.4,K2HPO47,NaCl 3,FeSO4·7H2O 0.05,初始pH值6.0,121℃下灭菌20 min。
1.1.2 主要试剂
蔗糖:广西田东县制糖有限公司;酵母浸粉:维科特化工产品贸易有限公司;硫酸铵、硫酸亚铁、磷酸氢二钾:天津博迪化工股份有限公司;蛋白胨、牛肉粉:北京奥博星生物技术有限公司;硫酸镁:淄博川北化工有限公司;氯化钠:维科特化工产品贸易有限公司;所有试剂均为国产分析纯。
1.2 仪器与设备
UVmini-1240紫外/可见分光光度计:日本岛津公司;SKY-2102摇床:上海苏坤实业有限公司;YJ-875S医用超净台:苏州净化设备厂;SPK-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;LD5-10高速离心机:北京医用离心机厂;Agilent 1100高效液相色谱分析仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 培养方法
1.3.1.1 斜面培养
将-80℃甘油管中保存的菌体溶化后划线转接到新鲜的PDA斜面中,放入28℃恒温培养箱中培养3 d~4 d。
1.3.1.2 种子培养
取出培养好的斜面,在无菌操作条件下挑取一环孢子接到装有50 mL种子培养基并灭好菌的500 mL挡板瓶中,并放入到28℃摇床中,180 r/min下恒温振荡培养20 h。
1.3.1.3 摇瓶发酵培养
将培养好的种子液在无菌条件下混匀,然后按照10%(体积比)的接种量,接种到装有45 mL基础发酵培养基的500 mL挡板瓶中。采用两阶段控温发酵,前24 h为32℃,后64 h温度调为28℃,转速为180 r/min培养周期为88 h。
1.3.2 分析方法
1.3.2.1 菌体量测定
参考文献[19]中的试验方法进行菌体量测定。
1.3.2.2 残糖的测定
参考文献[20]中的试验方法进行残糖的测定。
1.3.2.3 普鲁兰多糖的测定
参考文献[21]中的试验方法进行普鲁兰多糖的测定。
1.3.3 紫外诱变试验
1.3.3.1 制备菌悬液
取培养至对数生长期的菌液5 mL于离心管中,5 000 r/min下离心5min,收集菌体,将菌体用无菌生理盐水洗涤离心2次,并重悬于45 mL无菌生理盐水中,然后倒入放有玻璃珠的三角瓶中,振荡20 min,使孢子充分分散。用无菌脱脂棉过滤,血球计数板计数,调整孢子浓度到约108CFU/mL,制成孢子悬液。
1.3.3.2 紫外诱变处理
取5 mL制备好的孢子悬液放入内置有灭菌磁力转子的无菌培养皿中,在30 W紫外灯下,20 cm处进行照射,照射时间分别为 0、30、60、90、120、150 s。在暗室中将1 mL不同照射时间处理液稀释到适合的浓度,然后取100 μL稀释液涂布于PDA平板上,于28℃避光培养3 d~4 d。计算各个照射时间的致死率,并绘制致死率曲线。

1.3.3.3 初筛
将诱变的孢子悬浮液涂布于PDA平板上,28℃下培养3 d~4 d。以菌落颜色深浅,形态大小及表面质地为筛选指标,挑取出芽短梗霉菌落直径大、表面湿润、颜色浅或白色的变异株。并将平板初筛获得的变异菌株进行摇瓶初筛。
1.3.3.4 复筛
选取平板初筛变异株刮取一环接种到种子培养基中,28℃下培养30 h。然后将种子培养基按2%的比例接种于基础发酵培养基中,并按1.3.1.3所描述的方法进行发酵试验,发酵结束后测定普鲁兰多糖产量,并选出产量最高的突变株1株~2株。
1.3.3.5 遗传稳定性试验
将复筛选出的变异菌株在斜面上连续传代10代,选第2代、第4代、第6代、第8代和第10代进行发酵试验,测定突变株的普鲁兰产量,检验菌株遗传稳定性。
1.3.4 发酵培养基优化
1.3.4.1 单因素优化
分别以发酵培养基中碳源种类(蔗糖、葡萄糖、果糖、麦芽糖、F42果葡糖浆)、目标碳源质量浓度(100、125、150、175、200 g/L)、氮源种类(酵母浸粉、蛋白胨、玉米浆、牛肉粉、硝酸铵、氯化铵、硝酸钠、硫酸铵)、目标氮源质量浓度(2、4、6、8、10、12、14、16 g/L)、金属离子种类(Na+、K+、Mg2+、Fe2+)及不同初始 pH 值(5.0、5.5、6.0、6.5、7.0)为自变量,以普鲁兰多糖产量为评价指标,确定提高普鲁兰多糖产量的主要因素及其添加量。
1.3.4.2 Plackett-Burman(PB)试验设计
在单因素试验的基础上,对培养基的成分及pH值进行筛选:蔗糖、牛肉粉、MgSO4·7H2O、K2HPO4、FeS O4·7H2O、初始pH值。每个因素设计高和低两个水平值,忽略个因素之间的交互作用,建立模型,确定因素的效应值。PB试验设计表如表1所示。

表1 PB设计因素水平Table 1 Factors and levels of Plackett-Burman design
1.3.4.3 最陡爬坡试验
最陡爬坡试验以PB试验的试验值变化方向为爬坡方向,根据PB试验结果设计步长,尽快逼近最大响应区域。
1.3.4.4 中心组合试验设计(CCD)
以最陡爬坡试验最优点的数据作为中心点,设计三因素三水平中心组合试验,使用Design Expert 8.0软件对试验结果进行响应面分析。中心组合试验设计表如表2所示。

表2 中心组合试验设计因素水平Table 2 Factors and levels of central composite design
2 结果与分析
2.1 紫外诱变
2.1.1 诱变时间的确定
对原始菌株进行紫外诱变处理,并绘制致死率曲线,如图1所示。

图1 诱变时间对出芽短梗霉致死率的影响Fig.1 Effect of UV mutation time on the mortality of A.Pullulans
由图1可知,随紫外照射时间的延长,致死率逐渐增加。致死率一般控制在80%~90%为宜,当照射时间为100 s时,致死率为79.5%,120 s时达到97.9%。因此,选择最佳诱变时间为110 s。
2.1.2 突变菌株筛选
通过平板初筛和摇瓶复筛得到5株普鲁兰多糖产量高且不产黑色素的突变株,结果如表3所示。

表3 突变菌株复筛结果Table 3 The results of secondary screening of mutant strains
选择产量提高在20%以上的2株突变菌,分别命名为UV-4和UV-10,进行后续试验。
2.1.3 遗传稳定性试验
UV-4和UV-10遗传稳定性试验结果如下表4所示。

表4 UV-4和UV-10遗传稳定性试验Table 4 Genetic stability experiment of UV-4 and UV-10
由表4可知,随着传代次数的增多,UV-4突变株在传至第4代之后普鲁兰的产量明显降低。说明该突变株不稳定,容易发生了回复突变。而UV-10突变株经过10代的传代培养,普鲁兰多糖产量较稳定。因此,选用UV-10突变株进行后续的试验。
2.2 发酵培养基的优化
2.2.1 单因素试验
2.2.1.1 初始pH值对普鲁兰发酵的影响
不同初始pH值对普鲁兰发酵的影响结果如图2所示。

图2 不同初始pH值对普鲁兰发酵的影响Fig.2 The effect of different initial pH on pullulan fermentation
由图2可知,pH值对于普鲁兰多糖产量和菌体量影响较大。当初始pH值为6.5时,菌体量达到最大,但普鲁兰多糖在初始pH6.0时达到最大。出芽短梗霉UV-10菌体最适生产pH值和产物最佳合成pH值并不相同。pH值不仅影响菌体的生长,而且也会影响发酵后期pH的动态变化以及菌体合成普鲁兰多糖的能力,同时对出芽短梗霉的菌体形态产生影响[19]。
2.2.1.2 碳源种类及浓度对普鲁兰发酵的影响
不同碳源对普鲁兰发酵影响非常大[22]。碳源对普鲁兰多糖发酵的影响结果如图3所示。

图3 碳源对普鲁兰多糖发酵的影响Fig.3 The effect of carbon sources on pullulan fermentation
由图3A可知,以蔗糖为唯一碳源发酵生产普鲁兰多糖时产量最高,达到80.46 g/L,而麦芽糖最适合菌体生产。因此,选择蔗糖作为出芽短梗霉生产普鲁兰多糖的碳源。如图3B所示,随着蔗糖浓度的增加,普鲁兰多糖产量和菌体量也在增加。当蔗糖浓度为150 g/L时,蔗糖转化率和单位菌体产糖量最高。底物浓度再增加时,转化率和单位菌体产糖量均处于下降趋势,为节约生产成本,蔗糖的最适浓度应选择为150 g/L。
2.2.1.3 氮源种类及浓度对普鲁兰发酵的影响
不同氮源对普鲁兰多糖产量的影响结果如图4所示。

图4 不同氮源对普鲁兰多糖产量的影响Fig.4 Effect of nitrogen sources on pullulan fermentation
如图4A所示,当有机氮源作为唯一氮源时,发酵普遍优于无机氮源。在有机氮源中,牛肉粉作为氮源时发酵结果最为理想,普鲁兰多糖产量高达91.93 g/L。无机氮源作为唯一氮源时发酵结果均不理想,可能是由于无机氮源除可提供单一氮元素外,无其他微量元素,导致既不利于菌体生长,也不利于普鲁兰多糖的产生[23]。由图4B可以看出,菌体量随着牛肉粉添加量的增加而持续增大,而普鲁兰多糖的产量先增大后减小,在4 g/L时,多糖产量达到最大,为92.6 g/L,大于4 g/L后普鲁兰的产量呈下降趋势。故牛肉粉的最适添加量为4 g/L。
2.2.1.4 无机盐对普鲁兰发酵的影响
无机盐对普鲁兰多糖产量的影响结果如图5所示。

图5 无机盐对普鲁兰多糖发酵的影响Fig.5 Effects of inorganic salt on pullulan fermentation
在大量无机元素中,钠离子与维持细胞渗透压有关,虽不参与细胞的组成,但仍是微生物发酵培养基的必要成分,故在培养基中常加入少量的钠盐。图5A可以看出,发酵培养基中添加NaCl对普鲁兰多糖的产量影响甚微,菌体量随着NaCl浓度的增加而略微有下降趋势。为了考虑经济成本,决定将基础发酵培养基中的NaCl去掉。
由图5B可知,当培养基中不添加MgSO4·7H2O时,发酵液中菌体量只有少量积累,过少的菌体量不利于多糖产量的合成。随着发酵液中MgSO4·7H2O,浓度的提高,菌体量大量积累,普鲁兰多糖也快速合成。当MgSO4·7H2O的浓度为0.6 g/L,普鲁兰多糖产量和菌体量达到最大,分别为90.8 g/L和16 g/L。究其原因是MgSO4·7H2O激活了普鲁兰多糖合成途径中关键酶的活性[21]。
由图5C可以看出,发酵培养基中K2HPO4是否存在对普鲁兰发酵的影响很大。当不添加K2HPO4时,普鲁兰多糖产量仅为34.15 g/L。随着K2HPO4的添加量的增大,普鲁兰多糖产量随之增大。当K2HPO4的浓度达到7 g/L时,普鲁兰多糖产量达到最大,为80.22 g/L。之后随着K2HPO4浓度的增加普鲁兰多糖产量基本不再发生变化。而菌体量随着K2HPO4浓度的增大呈现出先增大后减小的趋势,在3 g/L时达到最大,为15.9 g/L。说明低浓度的K2HPO4有利于菌体量的积累。
由图5D可以看出,FeSO4·7H2O对普鲁兰多糖的发酵影响较小。与未加FeSO4·7H2O时的产量(81.53g/L)相比,添加0.03 g/L的FeSO4·7H2O时,产量提高了3.07 g/L。而当FeSO4·7H2O的浓度超过0.03 g/L,普鲁兰多糖的产量呈下降趋势。
2.2.2 PB试验
根据PB试验设计,按照N=12进行试验。PB试验设计及响应值见表5,各因素效应值及显著性分析见表6。

表5 PB试验设计和试验结果Table 5 Design and results for the Plackett-Burman experiment
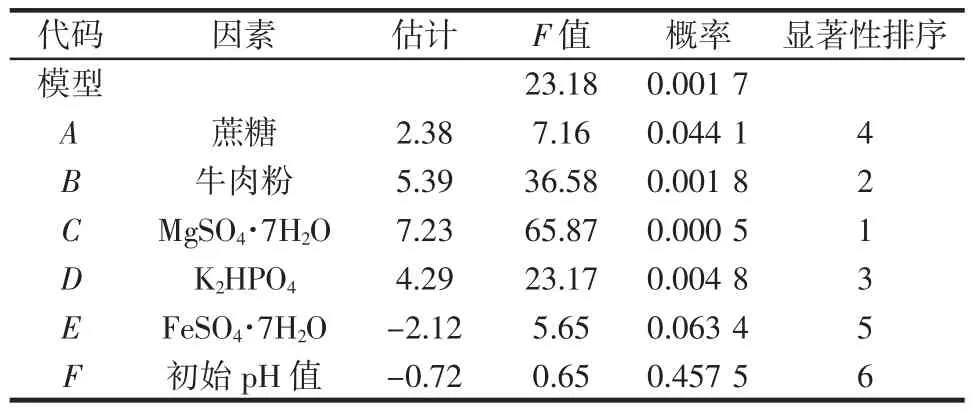
表6 PB试验分析结果Table 6 Result of regression analysis of Plackett-Burman design
利用Design Expert 8.0.6软件对PB设计的结果进行方差分析,该模型中R2=0.97,P<0.05,说明模型可信度较高。其中正影响因子有A、B、C和D。负影响因子为E和F。对普鲁兰产量影响由大到小排列:C>B>D>A>E>F。选择影响最显著的3个因素即MgSO4·7H2O、牛肉粉、K2HPO4进行后续试验。
2.2.3 最陡爬坡试验
在PB试验结果的基础上进行最陡爬坡试验,结果如表7所示。
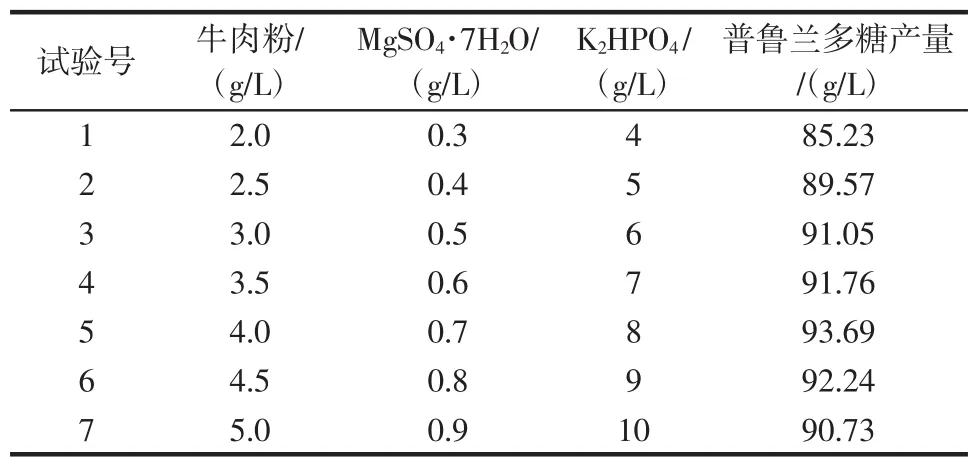
表7 最陡爬坡试验设计及结果Table 7 Experimental design and results of steepest ascent method
由表7可知,当牛肉粉、MgSO4·7H2O和KH2PO4的浓度分别增加到4.0、0.7、8 g/L时,发酵培养基中普鲁兰多糖的产量达到最大,因此我们选择该浓度作为响应面试验的中心点。
2.2.4 响应面试验结果
中心组合设计试验结果见表8。
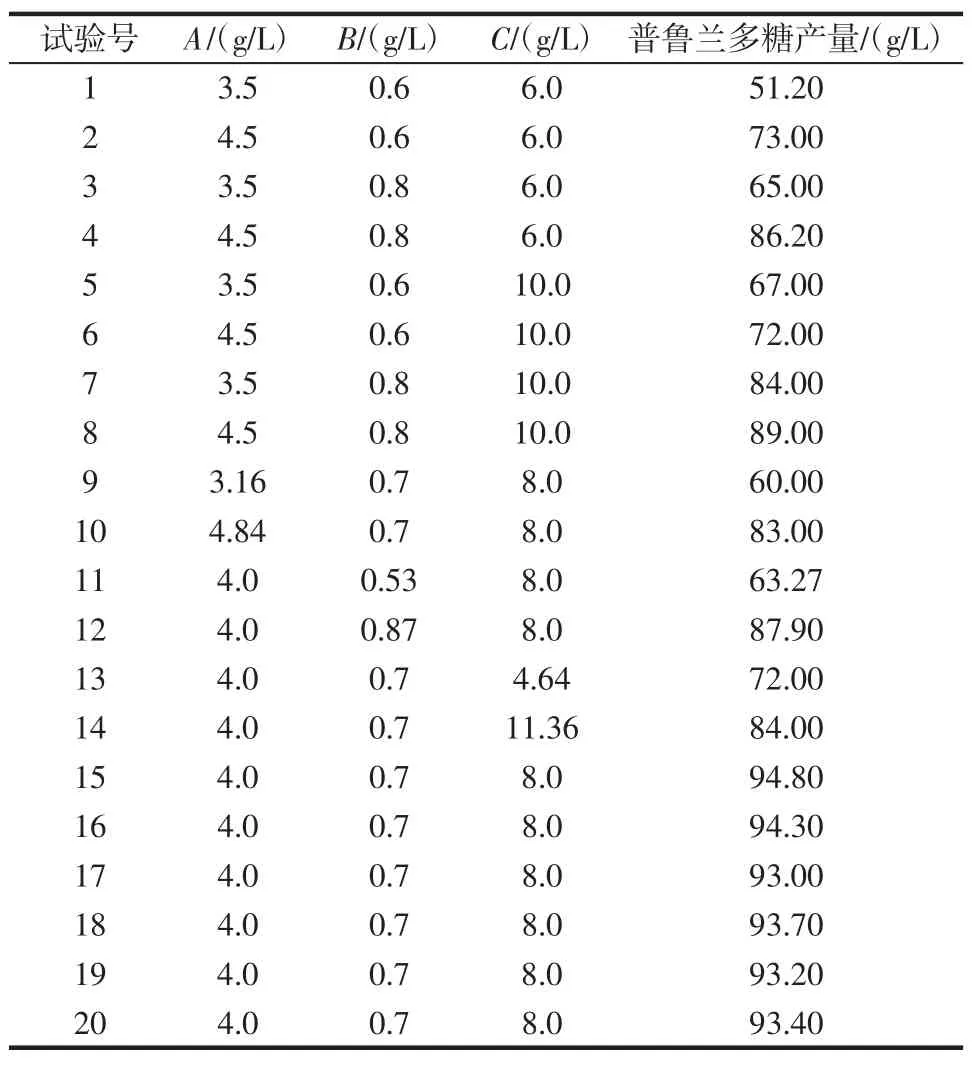
表8 中心组合设计试验结果Table 8 The experiment design and results of the CCD
利用Design expert 8.0.6软件对表8结果进行二次多项回归拟合,得到二阶回归方程:普鲁兰多糖/(g/L)=93.75+6.71A+7.50B+4.16C-0.075AB-4.12AC+0.88BC-7.96A2-6.52B2-5.66C2。
中心组合设计的方差分析结果如表9所示。

表9 中心组合试验设计的方差分析Table 9 Analysis of variance(ANOVA)for the quadratic model
该模型的F值为548.24,P值<0.000 1,说明该模型具有高度显著性。其中 A、B、C、AC、A2、B2、C2项的 P值均小于0.000 1,说明这些项均为显著项。由可信度分析得该模型决定系数R2=99.8%,说明该模型能够解释99.8%的普鲁兰多糖产量的变化,回归拟合程度好,可用此模型来预测发酵液中普鲁兰多糖产量的变化。
利用Design expert 8.0.6软件对该回归模型进行响应面分析,得到各响应面三维图,如图6、图7、图8所示。

图6 牛肉粉和MgSO4·7H2O添加量的相互关系图Fig.6 The response surface plots showing interaction between beef powder and MgSO4·7H2O addition amount

图7 牛肉粉和K2HPO4添加量的相互关系图Fig.7 The response surface plots showing interaction between beef powder and K2HPO4addition amount

图8 K2HPO4和MgSO4·7H2O添加量的相互关系图Fig.8 The response surface plots showing interaction between K2HPO4and MgSO4·7H2O addition amount
由图 6~8可知,牛肉粉、MgSO4·7H2O 和 K2HPO4与普鲁兰多糖的产量存在显著相关性,其中牛肉粉和K2HPO4对普鲁兰多糖产量的影响较为显著。在一定范围内,随着牛肉粉和K2HPO4添加量的增加,普鲁兰多糖的产量明显增加。但随着牛肉粉和K2HPO4添加量的进一步增加,普鲁兰多糖产量会有不同程度的下降。由相应的等高线图可以看出,牛肉粉和K2HPO4、MgSO4·7H2O和K2HPO4的等高线图呈椭圆形,交互作用显著。牛肉粉和MgSO4·7H2O的等高线图近乎圆形,交互作用不显著。通过软件进行分析预测,当A、B、C的编码值分别为(4.17、0.76、8.58),即牛肉粉、MgSO4·7H2O和K2HPO4的浓度分别为 4.17 g/L、0.76 g/L和8.58 g/L时,响应值Y(普鲁兰多糖产量)达最大值。此时,普鲁兰多糖的产量预测值为97.72 g/L。
为了验证优化后的发酵培养基是否达到预期效果,以响应面分析得到的最佳浓度组合及其他单因素最佳值进行了3次验证试验。优化后多糖平均产量为97.60 g/L,与预测模型有较高的一致性,与优化前相比多糖产量提高了26.8%。菌体量从之前的12.5 g/L提高到了18.6 g/L,较优化前提高了48.8%。结果表明,优化后的培养基更有利于普鲁兰多糖的合成和菌体量的积累。
3 结论
本研究以普鲁兰多糖产生菌株Aureobasidium pullulans CGMCC NO.3337为出发菌株,经过紫外诱变后,得到1株高产普鲁兰多糖且稳定性良好的突变株UV-10。利用中心组合设计和响应面法分析,得到最优发酵培养基组成(g/L):蔗糖150,牛肉粉4.17,MgSO4·7H2O 0.76,K2HPO48.58,FeSO40.03,初始pH6.0。与较优化前相比,普鲁兰多糖产量提高了48.8%。因此,菌株的诱变选育与发酵培养基的优化可有效提高普鲁兰多糖产量,这对于普鲁兰多糖的工业化发酵生产提供了有一定的数据基础。
