微小RNA-27a-5p对抑郁症大鼠桡骨骨折愈合的影响
2023-02-16王振龙叶章勇
王振龙, 刘 勇, 祝 茂, 叶章勇
(1. 西南医科大学附属中医医院 骨伤科, 四川 泸州, 646000;2. 四川省泸州市叙永县中医医院 骨伤科, 四川 泸州, 646400)
抑郁症可损害患者骨代谢机能, 导致骨组织骨量流失,并影响骨折愈合[1-2]。慢性束缚应激可通过诱导炎症造成抑郁,促炎因子白细胞介素(IL)-2在其中起关键作用[3-4]。微小RNA(miRNA)-27a在抑郁症患者中表达降低[5], 其家族成员miR-27a-5p也具有显著抑制炎症功能[6], 且与股骨骨密度呈正相关[7], 由此推测miR-27a-5p可能通过其抗炎作用促进骨折愈合。骨折修复是由成骨细胞和免疫细胞参与调控的复杂过程。IL-2是免疫细胞分泌的促炎因子,其可通过介导炎症参与骨折愈合过程。查询Starbase数据库可知, miR-27a-5p与IL-2之间有结合位点,预测miR-27a-5p可能通过靶向调节IL-2促进抑郁症大鼠桡骨骨折愈合。本研究上调及下调抑郁症桡骨骨折大鼠及大鼠骨髓间充质干细胞(BMSC)中miR-27a-5p的表达,并对此假设进行探讨。
1 材料与方法
1.1 材料
1.1.1 动物: SD大鼠,约6周龄,雄性,体质量200~220 g, SPF级,购自斯贝福(北京)生物技术有限公司,生产许可证号: SCXK(京)2019-0010。大鼠饲养在约25 ℃、12 h明暗循环照明的动物房中,相对湿度约为55%, 大鼠自由取食饮水。
1.1.2 试剂与材料: miR-27a-5p mimics、miR-27a-5p mimics阴性对照、miR-27a-5p inhibitor、miR-27a-5p inhibitor阴性对照、miR-27a-5p agomir阴性对照、miR-27a-5p agomir、miR-27a-5p antagomir阴性对照、miR-27a-5p antagomir、野生型IL-2 3′-UTR报告质粒、突变型IL-2 3′-UTR报告质粒、miR-27a-5p及IL-2、U6、β-actin引物、大鼠骨保护素(OPG)酶联免疫吸附测定(ELISA)试剂盒(货号D731022-0096)、大鼠核因子κ B受体活化因子配体(RANKL)ELISA试剂盒(货号D731112-0096)均购自上海生工生物工程股份有限公司; 大鼠骨髓间充质干细胞(BMSC, 货号CP-R131)、大鼠BMSC完全培养基(CM-R131)、大鼠BMSC成骨诱导分化培养基(PD-008)均购自武汉普诺赛生命科技有限公司; 脂质体2000(货号L7800)、大鼠IL-2 ELISA试剂盒(货号SEKR-0003)、总RNA提取试剂盒(货号R1200)、大鼠IL-6 ELISA试剂盒(货号SEKR-0005)、一步法实时荧光定量聚合酶链反应(qRT-PCR)试剂盒(货号T2210)、偶氮偶联法碱性磷酸酶染色液(货号G1480)、双荧光素酶报告基因检测试剂盒(货号D0010)均购自北京索莱宝科技有限公司等。
1.1.3 仪器: 强迫游泳系统(型号LE803/4)购自上海然哲仪器设备有限公司; microCTμ100扫描仪购自瑞士Scanco公司; 全自动酶标仪(型号UMR-9600T)购自杭州优米仪器有限公司; 生物光学显微镜(型号LW200ET-A)购自上海尖端光电科技有限公司; 荧光定量PCR仪(型号CFX96 Touch Deep Well)购自美国Bio-Rad公司等。
1.2 方法
1.2.1 制备大鼠模型及分组给药: 首先制备大鼠抑郁模型[8]。通过慢性温和不可预知应激刺激诱导大鼠抑郁,该应激因素包括禁食禁水、倾斜鼠笼、昼夜颠倒、悬尾、足底电刺激(40 V, 50次)、惊吓刺激(150 dB, 25 Hz, 10 s/次),每天从以上应激中任选2种刺激大鼠,共持续刺激28 d即可完成造模,随机分为骨折+抑郁组、miR-27a-5p agomir阴性对照组、miR-27a-5p agomir组、miR-27a-5p antagomir阴性对照组、miR-27a-5p antagomir组,每组12只大鼠,另选12只SD大鼠和上述抑郁模型大鼠均通过腹腔注射45 mg/kg的戊巴比妥钠溶液麻醉后,将右前肢脱毛、备皮、消毒、切开,分离肌肉组织暴露双侧桡骨,以骨钳折断其中段,固定骨折处后缝合,手术尽量保证无菌环境,最终完成骨折模型制备,只进行骨折手术操作不诱导抑郁的12只SD大鼠作为骨折对照组。造模完成后马上开始给药,记为第1天,参照各自说明书指导将miR-27a-5p agomir、miR-27a-5p agomir阴性对照、miR-27a-5p antagomir及miR-27a-5p antagomir阴性对照溶于生理盐水,均以100 nmol/kg的剂量分组尾静脉注射,模型组和骨折对照组大鼠尾静脉注射等剂量的生理盐水,每周注射1次,共注射4次。
1.2.2 大鼠抑郁症状检测: 给药后第29天,进行强迫游泳实验和蔗糖偏好实验检测各组大鼠抑郁症状。强迫游泳实验: 向玻璃缸中注入19 cm深、35 ℃的干净水,将大鼠小心放入水中,记录5 min内大鼠静止不动的时间,休息20 min后再次测量,取3次检测平均值。蔗糖偏好实验: 对大鼠禁食禁水, 24 h后向鼠笼中放入含有10 g/L蔗糖水溶液的饮水瓶,使大鼠自由饮用, 24 h后测定蔗糖水消耗量=(蔗糖水总量-剩余蔗糖水量)/蔗糖水总量×100%, 取3次检测平均值。
1.2.3 大鼠骨折段骨痂量和骨微结构检测及采集标本: 抑郁症状检测后24 h, 以气体乙醚麻醉各组大鼠,取尾静脉血后(1 000转/min、4 ℃, 离心半径为12 cm)离心15 min, 将上清吸入干净的EP管中,标记组别后置于-80 ℃备用; 断头处理各组大鼠,剥离右前臂双侧桡骨,清除干净软组织后测量桡骨直径、骨痂直径和长度,计算出其体积=2πR1(R2-R1)L,R1为桡骨半径,R2为骨痂半径,L为骨痂长度; 然后通过micro CT检测胫骨骨折段骨微结构,将上述右前臂桡骨水平放在样品架中,对骨折线上下各5 mm区域进行扫描(电压80 kV, 电流500 μA), 分析得出骨折段骨体积分数、骨小梁厚度和骨小梁数量,可以作为正向的成骨指标; 截取骨折处上下各1 cm的骨痂组织,以20%EDTA脱钙后,置于液氮备用。
1.2.4 大鼠血清炎性因子IL-2、IL-6及核因子κ B受体活化因子配体(RANKL)、骨保护素(OPG)水平检测: 取出1.2.3中各组大鼠血清进行解冻,参照ELISA试剂盒说明步骤测量IL-2、IL-6及RANKL、OPG水平。
1.2.5 大鼠骨痂组织miR-27a-5p、IL-2mRNA表达检测: 取出1.2.3中各组大鼠骨痂组织,加入提取试剂研碎,并参照总RNA提取试剂盒说明步骤提取纯化总RNA, 采用一步法qRT-PCR试剂盒并参照其说明配制PCR反应体系,混匀后置于荧光定量PCR仪中进行PCR扩增, miR-27a-5p的内参基因选用U6,IL-2的内参基因选用β-actin, 运用2-ΔΔCt算法计算各基因相对表达量,引物序列见表1。

表1 引物序列
1.2.6 细胞培养及分组处理: 大鼠BMSC细胞置于39 ℃水浴快速冻融,复苏后(1 000转/min、37 ℃)离心,以大鼠BMSC细胞完全培养基重悬细胞沉淀,混匀接种于25 cm2培养瓶,置于37 ℃、5%CO2恒温细胞培养箱中无菌培养,细胞长满瓶底时进行传代,接种于24孔板,置于37 ℃、5%CO2恒温细胞培养箱中无菌培养, 24 h后随机分为对照组、miR-27a-5p mimics组、miR-27a-5p mimics阴性对照组、miR-27a-5p inhibitor组、miR-27a-5p inhibitor阴性对照组,使用脂质体2000并参照试剂说明进行细胞转染, miR-27a-5p mimics组细胞转染miR-27a-5p mimics, miR-27a-5p mimics阴性对照组细胞转染miR-27a-5p mimics阴性对照, miR-27a-5p inhibitor组细胞转染miR-27a-5p inhibitor, miR-27a-5p inhibitor阴性对照组细胞转染miR-27a-5p inhibitor阴性对照, 24 h后收集各组细胞。
1.2.7 细胞miR-27a-5p、IL-2mRNA表达及成骨分化检测: 采用试剂盒提取1.2.6中收集的细胞总RNA后,进行qRT-PCR实验,步骤及引物序列与1.2.5中相同。将大鼠BMSC细胞传代后接种于24孔板,置于37 ℃、5%CO2恒温细胞培养箱中无菌培养24 h, 按照1.2.6中步骤分组并转染24 h后,将大鼠BMSC细胞完全培养基更换为大鼠BMSC成骨诱导分化培养基,诱导成骨分化7 d后,弃去分化培养基,磷酸盐缓冲液(PBS)漂洗, 4%多聚甲醛固定细胞后,加入碱性磷酸酶染色液孵育后漂洗,采用显微镜观察各组细胞染色情况并摄取图片,计数碱性磷酸酶(ALP)阳性细胞,计算ALP阳性细胞相对比例=实验组/对照组×100%。
1.2.8 大鼠BMSC中miR-27a-5p对IL-2的靶向调控检测: 将大鼠BMSC细胞传代后接种于24孔板,置于37 ℃、5%CO2恒温细胞培养箱中无菌培养24 h, 随机分为野生IL-2+miR-27a-5p mimics阴性对照组、野生IL-2+miR-27a-5p mimics组、突变IL-2+miR-27a-5p mimics阴性对照组、突变IL-2+miR-27a-5p mimics组,按照1.2.6中步骤以脂质体2000对细胞分组进行转染,以野生型IL-2 3′-UTR报告质粒和miR-27a-5p mimics阴性对照质粒转染野生IL-2+miR-27a-5p mimics阴性对照组细胞,以野生型IL-2 3′-UTR报告质粒和miR-27a-5p mimics质粒转染野生IL-2+miR-27a-5p mimics组细胞,以突变型IL-2 3′-UTR报告质粒和miR-27a-5p mimics阴性对照质粒转染突变IL-2+miR-27a-5p mimics阴性对照组细胞,以突变型IL-2 3′-UTR报告质粒和miR-27a-5p mimics质粒转染突变IL-2+miR-27a-5p mimics组细胞,转染24 h后采用双荧光素酶报告基因检测试剂盒检测各组细胞双荧光素酶相对活性。
1.3 统计学分析
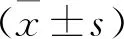
2 结 果
2.1 miR-27a-5p对各组大鼠抑郁症状的影响
与骨折对照组相比,骨折+抑郁组大鼠强迫游泳不动时间延长,蔗糖水消耗量降低,差异有统计学意义(P<0.05)。与骨折+抑郁组相比, miR-27a-5p agomir组大鼠强迫游泳不动时间缩短,蔗糖水消耗量增加,差异有统计学意义(P<0.05), miR-27a-5p antagomir组大鼠强迫游泳不动时间延长,蔗糖水消耗量降低,差异有统计学意义(P<0.05); miR-27a-5p agomir阴性对照组、miR-27a-5p antagomir阴性对照组大鼠强迫游泳不动时间、蔗糖水消耗量比较,差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠强迫游泳实验与蔗糖水消耗实验结果
2.2 miR-27a-5p对各组大鼠骨折段骨痂量和骨微结构的影响
与骨折对照组相比,骨折+抑郁组大鼠骨痂量、骨体积分数、骨小梁厚度、骨小梁数量减少,差异有统计学意义(P<0.05)。与骨折+抑郁组相比, miR-27a-5p agomir组大鼠骨痂量、骨体积分数、骨小梁厚度、骨小梁数量增多,差异有统计学意义(P<0.05); miR-27a-5p antagomir组大鼠骨痂量、骨体积分数、骨小梁厚度、骨小梁数量减少,差异有统计学意义(P<0.05), miR-27a-5p agomir阴性对照组和miR-27a-5p antagomir阴性对照组大鼠骨痂量、骨体积分数、骨小梁厚度、骨小梁数量比较,差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠骨痂量、骨体积分数、骨小梁厚度、骨小梁数量比较
2.3 miR-27a-5p对各组大鼠IL-2、IL-6及RANKL、OPG水平的影响
与骨折对照组相比,骨折+抑郁组大鼠血清OPG水平降低,炎性因子IL-2、IL-6及RANKL水平升高,差异有统计学意义(P<0.05)。与骨折+抑郁组相比, miR-27a-5p agomir组大鼠血清OPG水平升高,炎性因子IL-2、IL-6及RANKL水平降低,差异有统计学意义(P<0.05), miR-27a-5p antagomir组大鼠血清OPG水平降低,炎性因子IL-2、IL-6及RANKL水平升高,差异有统计学意义(P<0.05); miR-27a-5p agomir阴性对照组和miR-27a-5p antagomir阴性对照组大鼠血清炎性因子IL-2、IL-6及RANKL、OPG水平比较,差异无统计学意义(P>0.05)。见表4。

表4 各组大鼠血清炎性因子IL-2、IL-6及RANKL、OPG水平比较
2.4 各组大鼠骨痂组织miR-27a-5p、IL-2 mRNA表达的检测结果
与骨折对照组相比,骨折+抑郁组大鼠骨痂组织miR-27a-5p表达降低,IL-2mRNA表达升高,差异有统计学意义(P<0.05)。与骨折+抑郁组相比, miR-27a-5p agomir组大鼠骨痂组织miR-27a-5p表达升高,IL-2mRNA表达降低,差异有统计学意义(P<0.05), miR-27a-5p antagomir组大鼠骨痂组织miR-27a-5p表达降低,IL-2mRNA表达升高,差异有统计学意义(P<0.05); miR-27a-5p agomir阴性对照组和miR-27a-5p antagomir阴性对照组大鼠骨痂组织miR-27a-5p、IL-2mRNA表达比较,差异无统计学意义(P>0.05)。见表5。

表5 各组大鼠骨痂组织miR-27a-5p、IL-2 mRNA表达水平比较
2.5 各组细胞成骨分化及miR-27a-5p、IL-2 mRNA表达的检测结果
与对照组相比, miR-27a-5p mimics组细胞ALP阳性细胞相对比例、miR-27a-5p表达升高,IL-2mRNA表达降低,差异有统计学意义(P<0.05), miR-27a-5p inhibitor组细胞ALP阳性细胞相对比例、miR-27a-5p表达降低,IL-2mRNA表达升高,差异有统计学意义(P<0.05); miR-27a-5p mimics阴性对照组、miR-27a-5p inhibitor阴性对照组与对照组比较,差异无统计学意义(P>0.05)。见图1、表6。

A: 对照组ALP染色; B: miR-27a-5p mimics阴性对照组ALP染色; C: miR-27a-5p mimics组ALP染色; D: miR-27a-5p inhibitor阴性对照组ALP染色; E: miR-27a-5p inhibitor组ALP染色。图1 各组细胞ALP染色结果(放大400倍)

表6 各组细胞ALP阳性细胞相对比例
2.6 大鼠BMSC中miR-27a-5p对IL-2的靶向调节
查询Starbase数据库可知miR-27a-5p与IL-2之间有结合位点,与野生IL-2+miR-27a-5p阴性对照组比较,野生IL-2+miR-27a-5p mimics组相对荧光素酶活性降低,差异有统计学意义(P<0.05); 突变IL-2+miR-27a-5p阴性对照组与突变IL-2+miR-27a-5p mimics组相对荧光素酶活性比较,差异无统计学意义(P>0.05)。见图2、表7。

图2 miR-27a-5p与IL-2之间结合位点

表7 检测miR-27a-5p对IL-2的靶向调节时各组相对荧光素酶活性值
3 讨 论
精神压力和抑郁障碍会对骨生物学产生负面影响,增加骨折风险,改善骨折患者抑郁症状可有利于其骨折愈合,因此探寻其中的作用机制对改善抑郁及骨折患者预后具有积极意义[9-10]。本研究通过慢性温和不可预知应激刺激SD大鼠建立抑郁模型,然后切断前右肢桡骨中段制备骨折模型,结果显示,相比只做了桡骨骨折处理的大鼠,抑郁后桡骨骨折的大鼠强迫游泳不动时间延长及血清IL-2、IL-6及RANKL水平、骨痂组织IL-2mRNA表达升高,蔗糖水消耗量、骨痂量、骨体积分数、骨小梁厚度、骨小梁数量减少及血清OPG表达水平降低,表明慢性温和不可预知应激刺激可诱发促炎因子IL-2、IL-6过量表达,引发炎症,下调OPG表达,促进RANKL表达,减少骨折大鼠骨形成,破坏骨微结构,抑制其骨折愈合,提示抑郁对骨折愈合起到负面影响,抑郁后骨折大鼠模型构建成功。
IL-2、IL-6、IL-8、肿瘤坏死因子-α(TNF-α)等促炎因子引发的炎症是抑郁症的重要致病因素[11], 炎症可介导成骨分化及骨形成,抑制炎症可缓解抑郁症状,促进骨折愈合[4, 12], OPG、RANKL可作为骨炎症的预测标志物,抑制炎症,增加OPG/RANK比率,可逆转重度抑郁障碍患者的骨密度降低[13]。miR-27a-5p作为一种微小RNA, 可介导炎性级联反应,过表达miR-27a-5p可减轻急性胰腺炎引发的细胞炎症损伤[14], 还可刺激成骨细胞的成骨分化,增加去卵巢骨量,促使骨形成,减轻患者骨质疏松症状[15]。本研究以miR-27a-5p agomir上调抑郁后骨折模型大鼠的miR-27a-5p表达,可增加其蔗糖水消耗量、骨痂量、骨体积分数、骨小梁厚度、骨小梁数量和增高血清OPG水平,缩短大鼠强迫游泳不动时间,降低血清IL-2、IL-6及RANKL水平; 而以miR-27a-5p antagomir下调抑郁后骨折模型大鼠的miR-27a-5p表达,则起到相反作用,表明miR-27a-5p可调控抑郁大鼠体内炎症,进而参与介导其骨折愈合过程,过表达miR-27a-5p可减轻炎症,促进OPG表达同时下调RANKL表达,并促进骨折大鼠骨形成,增强骨痂生长,积极促使骨折愈合,减轻抑郁负面作用。另外以miR-27a-5p mimics上调大鼠BMSC细胞的miR-27a-5p表达,可增高其ALP阳性细胞相对比例,而miR-27a-5p inhibitor作用相反,表明miR-27a-5p可促进成骨分化,总之,上调miR-27a-5p表达可抑制炎症,增强成骨分化,促使抑郁大鼠骨折愈合。
骨折患者会发展为创伤后骨关节炎, IL-2在此过程中具有关键调控作用, IL-2在关节内骨折膝盖滑膜中表达升高,可引发软骨降解[16-17], 并可通过调控炎症和成骨细胞分化参与介导骨折愈合过程。本研究通过Starbase数据库查询到miR-27a-5p与IL-2之间有结合位点,并以双荧光素酶报告基因实验证实miR-27a-5p可靶向下调大鼠BMSC细胞IL-2表达,以miR-27a-5p agomir上调抑郁后骨折模型大鼠的miR-27a-5p表达,可显著下调IL-2表达,而miR-27a-5p antagomir起到相反作用; 另外以miR-27a-5p mimics上调大鼠BMSC细胞的miR-27a-5p表达,可降低其IL-2mRNA表达, miR-27a-5p inhibitor作用相反,表明靶向下调IL-2表达可能是miR-27a-5p促使抑郁大鼠骨折愈合的作用机制。
综上所述, miR-27a-5p调控BMSC的成骨分化及炎症反应,参与介导抑郁大鼠骨折愈合过程,过表达miR-27a-5p可促进大鼠BMSC成骨分化,并减轻大鼠抑郁症状,抑制其炎症发生进展,促进骨折段骨痂生长,改善骨微结构,减少抑郁骨折愈合的负面作用。靶向下调IL-2表达可能是积极促使骨折愈合的作用机制之一,证实了miR-27a-5p可通过靶向下调IL-2, 进而促进抑郁症大鼠桡骨骨折愈合。本研究有利于深入理解抑郁影响骨折愈合的分子机制,并为改进促使抑郁患者骨折愈合的方法提供了新思路。
