2型糖尿病合并非酒精性脂肪肝患者血清维生素D与肝脂肪含量的关系
2023-02-14马小慧吉鹏飞张新乐杨红燕
马小慧,吉鹏飞,张新乐,杨红燕
(包头市中心医院,1.内分泌科;2.消化科,内蒙古 包头 014000;3.鄂尔多斯市达拉特旗人民医院超声科,内蒙古 鄂尔多斯 014300)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)为一种代谢性疾病,可对患者肝功能造成损伤,并且随着我国经济发展及国民饮食结构改变,其发病率逐渐升高且呈年轻化趋势,严重威胁我国国民身体健康[1-3]。有研究[4]表明,NAFLD在糖尿病患者中发病率较普通患者高。2型糖尿病(type 2 diabetes mellitus,T2DM)患者长期处于高血糖状态下,易造成患者发生血管内皮损伤等并发症,严重者可导致致残及致死[5]。并且有研究[6]发现维生素D[25-(OH)D3]缺乏与胰岛素抵抗、NAFLD及高尿酸血症等密切相关,同时25-(OH)D3对胰岛 β 细胞具有一定的调节作用,对改善患者胰岛素抵抗水平及降低脂肪在肝脏堆积有一定帮助。故本研究探讨T2DM合并NAFLD患者血清25-(OH)D3与肝脂肪含量及血尿酸(SUA)的关系。
1 资料与方法
1.1 一般资料
选取2020年11月至2021年11月于包头市中心医院收治的137例T2DM合并NAFLD患者作为研究对象,根据患者入院时25-(OH)D3水平分为4组,分别为A组(>75 nmol/L,n=40)、B组(>50且≤75 nmol/L,n=36)、C组(>25且≤50 nmol/L,n=31)及D组(≤25 nmol/L,n=30)。诊断标准:(1)25-(OH)D3>(30 ng/mL)即为充足,25-(OH)D3>50且≤75 nmol/L即为不足,25-(OH)D3>25且≤50 nmol/L即为缺乏,25-(OH)D3≤25 nmol/L即为严重缺乏[7];(2)患者在任意时间测量血糖含量≥11.1 mmol/L,患者空腹血糖≥7.0 mmol/L,经葡萄糖耐量试验,患者2 h血糖≥11.1 mmol/L,排除其余类型糖尿病[8];(3)经超声检测,患者肝内管道结构未能显示清楚,患者肝脏近场回声呈弥漫性增强,并且回声较肾脏强,患者肝脏远场回声呈逐渐衰减状,满足以上两点即可确诊[9]。纳入标准:(1)患者及其家属知情同意;(2)经诊断,确诊为T2DM合并NAFLD;(3)患者治疗依从性较好;(4)患者临床资料完整;(5)患者年龄≥18岁。排除标准:(1)患有精神类疾病或无法正常沟通者;(2)胃大部分切除术后者;(3)既往或正在服用活性25-(OH)D3或口服对25-(OH)D3、钙磷代谢有影响的药物者;(4)男性饮酒含乙醇量每周≥140 g(女性≥70 g);(5)近3个月服用过影响肝功能、血脂或脂肪肝的药物者。A组男性22例,女性18例,年龄(52.25±9.75)岁;B组男性21例,女性15例,年龄(51.42±9.58)岁;C组男性18例,女性13例,年龄(53.19±9.68)岁;D组男性16例,女性14例,年龄(52.50±9.66)岁。比较各组患者性别及年龄等一般资料,差异无统计学意义(P>0.05)。本研究经医院伦理委员会审批。
1.2 检测方法
所有患者均于入院第2天清晨在空腹状态下抽取外周静脉血5 mL,静置后离心10 min,3 000 r/min,取上清液,并采用25-(OH)D3测定试剂盒(威海纽普生物技术有限公司,型号25T)测定各组患者25-(OH)D3水平,随后根据不同25-(OH)D3水平进行分组。随后采用贝克曼DXI-800全自动化学发光仪及西门子2400全自动仪检测各组患者糖化血红蛋白(HbA1c)、血脂[甘油三酯(TG)、血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)]、SUA及肝功能指标[白蛋白(ALB)、丙氨酸氨基转移酶(ALT)及白蛋白/球蛋白(A/G)]。
1.3 观察指标
采用稳态模型评估法判断各组患者胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹胰岛素×空腹血糖/22.5;并采用特定蛋白分析仪PA-990(上海寰熙医疗器械有限公司,型号:PA-990)测定各组患者超敏C反应蛋白(hs-CRP)水平。
在检查前嘱咐各组患者戒酒1周,并在检查当日空腹状态下,以平卧位,采用Fibroscan502仪器检测各组患者受控衰减参数(CAP)及肝脏硬度值(liver stiffness measurement,LSM)水平;检测时选取1个检测点,并以仪器在患者肝脏区域激发10次有效弹性波,随后经仪器自动生成CAP及LSM值。
检测完成后,采用口服维生素D滴剂(山东达因海洋生物制药股份有限公司)进行治疗,2次/d,1粒/次,早饭及晚饭后服用,治疗6个月后进行随访,观察各组患者HbA1c、血脂、SUA、肝功能、HOMA-IR及hs-CRP水平变化情况。
1.4 统计学分析
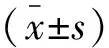
2 结果
2.1 治疗前后各组患者HbA1c、血脂及SUA情况比较
治疗前,各组患者HbA1c、TG、TC、LDL-C及SUA水平相比,从低到高分别为A组、B组、C组及D组,差异有统计学意义(P<0.05);HDL-C水平从低到高分别为D组、C组、B组及A组;治疗6个月后,B组、C组及D组HDL-C水平均较治疗前升高,其余指标较治疗前降低,差异有统计学意义(P<0.05)。见表1。
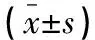
表1 治疗前后各组患者HbA1c、血脂及SUA情况比较
2.2 治疗前后各组患者肝功能情况比较
治疗前、后,各组患者A/G水平相比,差异均无统计学意义(P>0.05);治疗前,ALB及ALT水平相比,从低到高依次为A组、B组、C组及D组,差异有统计学意义(P<0.05);治疗6个月后,B组、C组及D组ALB及ALT水平与治疗前相比均有所降低(P<0.05),但各组组间比较,差异无统计学意义(P>0.05)。见表2。
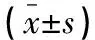
表2 治疗前后各组患者肝功能情况比较
2.3 治疗前后各组患者HOMA-IR及hs-CRP水平比较
治疗前,各组患者HOMA-IR及hs-CRP水平相比,从低到高依次为A组、B组、C组及D组,差异有统计学意义(P<0.05);治疗6个月后,B组、C组及D组HOMA-IR及hs-CRP水平均较治疗前降低(P<0.05),但各组组间比较,差异无统计学意义(P>0.05)。见表3。
2.4 各组患者CAP及SLM水平比较
各组患者CAP及SLM水平相比,从低到高依次为A组、B组、C组及D组,差异有统计学意义(P<0.05)。见表4。
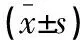
表3 治疗前后各组患者HOMA-IR及hs-CRP水平比较
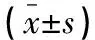
表4 各组患者CAP及SLM水平比较
2.5 25-(OH)D3水平与各项临床指标相关性分析
根据患者25-(OH)D3水平进行赋值:A组为4,B组为3,C组为2,D组为1,采用Spearman法进行相关性分析。结果显示,患者25-(OH)D3水平与HbA1c、TG、TC、LDL-C、SUA、ALB、ALT、HOMA-IR、hs-CRP、CAP及SLM水平呈负相关(P<0.05),与HDL-C水平呈正相关(P<0.05),与A/G水平无相关性(P>0.05)。见表5。
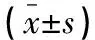
表5 25-(OH)D3水平与各项临床指标相关性分析
3 讨论
NAFLD在T2DM群体中检出率较高,并且将随着患者病情进展,对患者肝脏造成损伤,严重者可引发非酒精性脂肪性肝炎及相关肝硬化、肝癌等病症,危害患者生命安全[10-11]。NAFLD及T2DM关系密切,当患者发生T2DM时,其机体血糖长期处于高水平状态,从而将造成多余葡萄糖即可转化为脂肪在肝脏内堆积,进而导致肝细胞脂肪变性、坏死凋亡;而当患者发生NAFLD时,其机体胰岛素抵抗和脂质代谢紊乱亦可加剧糖代谢紊乱,从而导致患者空腹糖耐量受损,造成患者发生或加重T2DM病症,进而二者之间形成恶性循环,促使患者病症恶化[12-14]。有研究[15-16]表明,肝脏不仅在控制糖代谢方面起到重要作用,亦是生成25-(OH)D3的场所,而T2DM患者机体内25-(OH)D3水平较低,提示25-(OH)D3缺乏可能与T2DM及NAFLD等病症密切相关。
结果显示,治疗前,各组患者HbA1c、TG、TC、HDL-C、LDL-C及SUA水平相比,从低到高分别为A组、B组、C组及D组;治疗6个月后,B组、C组及D组各指标均较治疗前降低,该结果与李颖等[17-18]研究结果相似。分析原因可能为25-(OH)D3可与靶细胞上特异性受体结合,从而提高靶细胞内第二信使Ca2+浓度,并加快细胞内信号通路传导,达到提高胰岛素分泌量及敏感性作用,但当患者机体缺乏25-(OH)D3,则造成患者血糖控制不佳,并促进患者胰岛素抵抗,进而加重患者病情。其次,治疗前,各组患者ALB及ALT水平相比,从低到高依次为A组、B组、C组及D组;治疗6个月后,B组、C组及D组ALB及ALT水平与治疗前相比均有所降低,与Dong等[19]研究结果相似。分析原因可能为ALB及ALT水平可随患者肝功能恢复而降低,而25-(OH)D3缺乏,将造成患者胰岛素抵抗程度加重,从而促使血糖水平处于高水平状态,将造成脂肪在肝脏堆积,进而对患者肝脏细胞造成损害,影响患者肝功能。另一方面,治疗前,各组患者HOMA-IR及hs-CRP水平相比,从低到高依次为A组、B组、C组及D组。治疗6个月后,B组、C组及D组HOMA-IR及hs-CRP水平均较治疗前低。其中HOMA-IR水平可将随着患者胰岛素抵抗程度加深而升高,hs-CRP水平可随着患者炎症反应加重而升高。说明25-(OH)D3缺乏越严重,患者胰岛素抵抗程度越高,机体炎症反应程度越严重。分析原因可能为氧化应激和炎性反应在胰岛素抵抗的发生过程中也起到重要作用,且25-(OH)D3可通过激活Wnt/β-连环蛋白信号传导通路来降低胰岛细胞内氧化应激反应,同时可调节细胞内炎性因子水平。因此患者机体25-(OH)D3充足,则有利于降低胰岛素抵抗及炎症反应程度[20]。另外,各组患者CAP及SLM水平相比,从低到高依次为A组、B组、C组及D组。其中CAP及SLM是基于瞬时弹性成像技术检测脂肪肝的一种新方法,利用振动控制瞬时弹性成像技术,评价肝脏脂肪变程度,可对患者脂肪含量及纤维化程度进行评价。且其水平均会随着患者病症加深而升高,说明25-(OH)D3缺乏越严重,患者肝脏脂肪含量越高,纤维化程度越深。分析原因可能为25-(OH)D3缺乏将增加患者胰岛素抵抗水平,从而造成机体血糖处于较高水平;并造成更多的葡萄糖转化为脂肪在肝脏堆积,引发脂代谢紊乱,进而加重患者肝脏纤维化进程。此外,经研究发现25-(OH)D3与患者血糖、血脂及多项临床指标密切相关。当患者25-(OH)D3缺乏,其HbA1c、TG、TC、LDL-C、SUA、ALB、ALT、HOMA-IR、hs-CRP、CAP及SLM水平均会升高,而HDL-C水平将降低。
综上,T2DM合并NAFLD患者血清25-(OH)D3水平与肝脏脂肪含量密切相关。当患者缺乏25-(OH)D3时,可能造成患者血糖及血脂等控制不良,将促进患者肝脏脂肪堆积,并促进肝纤维化进展,同时将提高患者发生高尿酸血症风险,而给予25-(OH)D3治疗,利于改善患者各项临床指标。
