小鼠发育过程中胸腺上皮细胞的动力学变化
2023-02-12杨书平刘相邑豆晓婕刘国红柴玉荣
杨书平,郑 仲,刘相邑,豆晓婕,刘国红,柴玉荣
郑州大学基础医学院组织学与胚胎学系 郑州 450001
胸腺是人体重要的中枢免疫器官,负责培育和选择成熟的初始T淋巴细胞[1]。以胸腺皮质上皮细胞(cortical thymus epithelial cell,cTEC)和髓质上皮细胞(medullary thymus epithelial cell,mTEC)为主的三维网状结构为T细胞的发育和成熟提供了必需的微环境。随着年龄的增长,胸腺出现生理性退化,其重量和体积明显缩小,免疫功能减退,这种现象也称胸腺增龄性萎缩[2]。胸腺上皮细胞(thymus epithelial cell,TEC)在胸腺生理性退化、免疫功能稳态维持等方面发挥重要作用[3-4]。角质蛋白5(keratin 5,K5)和角质蛋白8(keratin 8,K8)用于标记和定位TEC[5];上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是胸腺上皮祖细胞的重要标志之一[6];性别决定区Y框蛋白2(sex determining region Y-box2,Sox2)作为干细胞转录因子,可以标记胸腺中的成体胸腺上皮干细胞[7];自身免疫调节因子(autoimmune regulator,Aire)主要表达于成熟的mTEC中[8];叉头框蛋白N1(forkhead box protein N1,FoxN1)在TEC的成熟过程中发挥重要作用[9]。本研究通过分析不同发育阶段小鼠TEC分子标记及重要转录因子的表达和变化,探索小鼠发育过程中TEC的动力学变化,为进一步理解胸腺衰老以及提高机体免疫力提供理论依据。
1 材料与方法
1.1 实验动物和主要试剂2月龄、6月龄、12月龄雌性昆明小鼠各5只,购自郑州大学实验动物中心,清洁级环境饲养。该实验通过郑州大学动物实验伦理委员会的批准。兔抗K5和K8抗体购自Abcam公司,羊抗Aire抗体购自Santa Cruz公司,兔抗Sox2抗体购自武汉赛维尔生物科技有限公司,兔抗FoxN1和EpCAM抗体购自博奥赛斯生物科技有限公司。羊抗兔和兔抗羊二抗显色试剂购自中杉金桥生物科技有限公司。
1.2 胸腺组织学分析采用颈椎脱臼法处死小鼠,取胸腺组织,PBS冲洗,置于含有40 g/L多聚甲醛4 ℃冰箱中过夜固定,梯度乙醇脱水,二甲苯透明,浸蜡处理后石蜡包埋,5 μm厚切片,HE染色后于光学显微镜下观察。
免疫组化染色:胸腺组织切片脱蜡和微波抗原修复,加一抗K5和K8(按1∶200稀释)、Aire(按1∶300稀释)、EpCAM(按1∶200稀释)和Sox2(按1∶600稀释)抗体4 ℃孵育过夜,滴加相应羊抗兔和兔抗羊二抗(均按1∶100稀释),37 ℃孵育30 min,DAB显色。光学显微镜下拍照、观察,每张切片选取5个视野(×200),利用Image J分析软件统计阳性细胞的面积。
1.3 小鼠胸腺组织中FoxN1、EpCAM蛋白表达的免疫印迹检测胸腺组织中加入RIPA裂解液、PMSF蛋白酶抑制剂后进行研磨,提取蛋白,4 ℃离心,取上清液,BCA蛋白浓度测定试剂盒测定蛋白含量。SDS-PAGE电泳,转移到PVDF膜上,50 g/L脱脂奶粉液封闭,分别加一抗FoxN1(按1∶1 000)、EpCAM(按1∶5 000稀释)和β-actin(按1∶2 000稀释)抗体4 ℃孵育过夜,TBST洗膜。加辣根过氧化物酶标记的二抗(按1∶5 000稀释),室温孵育2 h,加ECL显色剂曝光成像。利用Image J分析软件检测条带灰度值,以目的蛋白与β-actin条带灰度值的比值作为目的蛋白相对表达水平。
1.4 小鼠胸腺组织中FoxN1、Aire mRNA的qRT-PCR检测使用TRIzol(美国Invitrogen公司)试剂提取小鼠胸腺组织的总RNA。用NanoDrop 2000光谱仪(美国Thermo公司)在260/280 nm波长处测定总RNA浓度。每个样品各取500 ng RNA,使用cDNA合成试剂盒(宝生物工程有限公司)合成cDNA。用ABI 7500 Fast real-time PCR仪(美国Applied Biosystems公司),根据说明书推荐参数,应用SYBR Green Ⅰ荧光染料进行PCR,GAPDH为参照基因。FoxN1、Aire和GAPDH的引物序列见表1。采用2-ΔΔCt计算目的基因的表达量。

表1 FoxN1、Aire引物序列
1.5 统计学处理采用GraphPad Prism 8进行数据分析。应用单因素方差分析和LSD-t检验比较各组小鼠胸腺组织中K5、K8、Aire、EpCAM、Sox2阳性细胞面积的差异,FoxN1蛋白和mRNA表达的差异,EpCAM蛋白和Aire mRNA表达的差异。检验水准α=0.05。
2 结果
2.1 不同发育时期小鼠胸腺组织结构的变化见图1。由图1可知:2月龄小鼠胸腺的皮质和髓质结构较为完整,边界清晰;6月龄小鼠胸腺的皮质和髓质结构逐渐融合;12月龄小鼠胸腺的皮质和髓质结构较紊乱,皮髓质交界处不清楚,皮质变薄;表明胸腺的组织结构完整性随着月龄增长逐渐丧失。
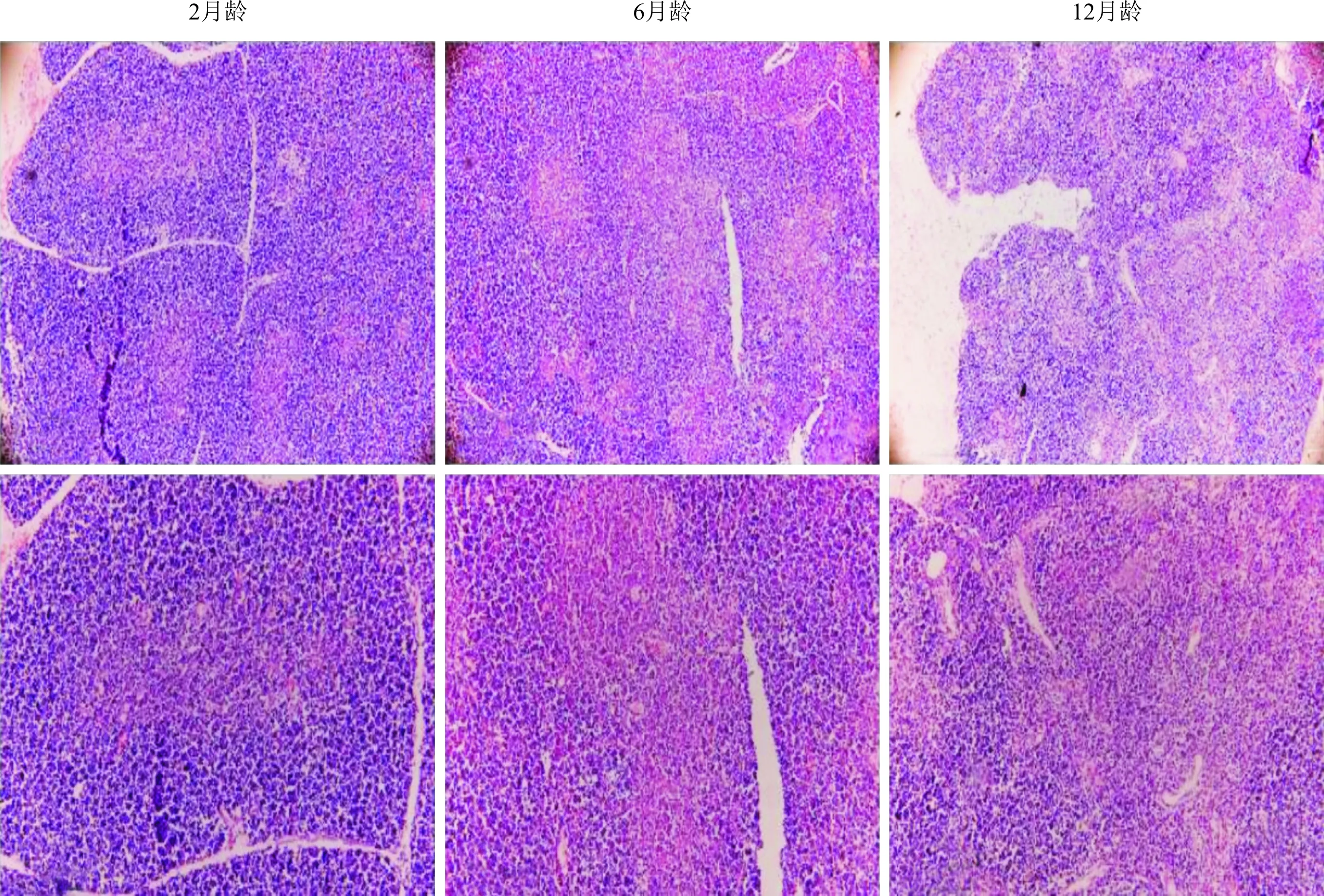
上排:低倍镜(×100);下排:高倍镜(×200)
2.2 不同发育时期小鼠TEC的变化见图2、表2。由图2可知,K5、K8以及Aire阳性的细胞内有棕色颗粒。K5主要表达于mTEC中,且随着小鼠月龄的增长,K5阳性的髓质区域逐渐减少。K8主要表达于cTEC中,mTEC中也有少量表达。随着月龄的增长,K5和K8表达逐渐减少,表明TEC逐步丧失。Aire主要在成熟的mTEC中表达;2月龄小鼠Aire阳性细胞面积最大,6月龄和12月龄小鼠Aire阳性细胞面积减少。
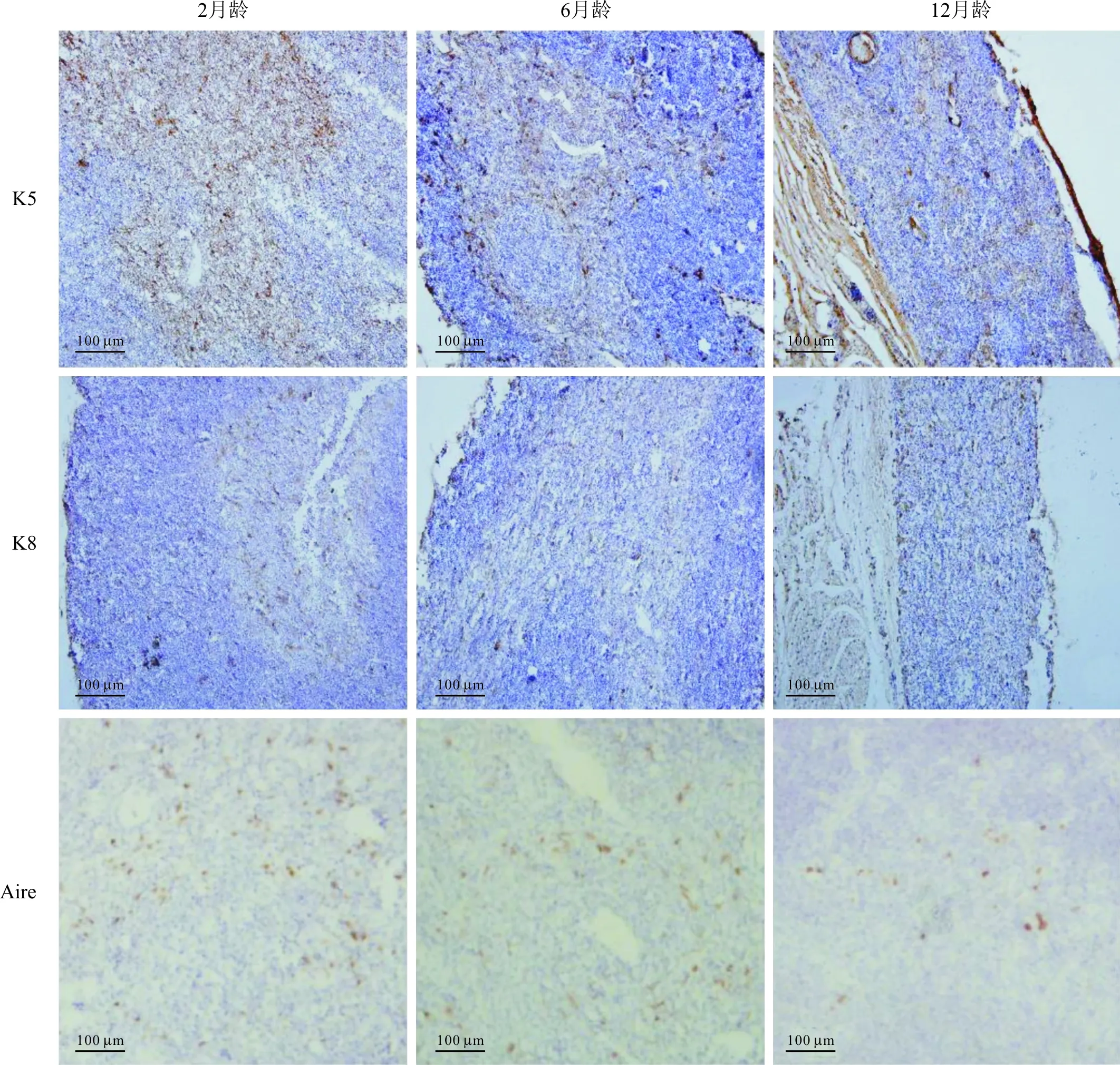
图2 各组小鼠胸腺组织中K5、K8和Aire的表达
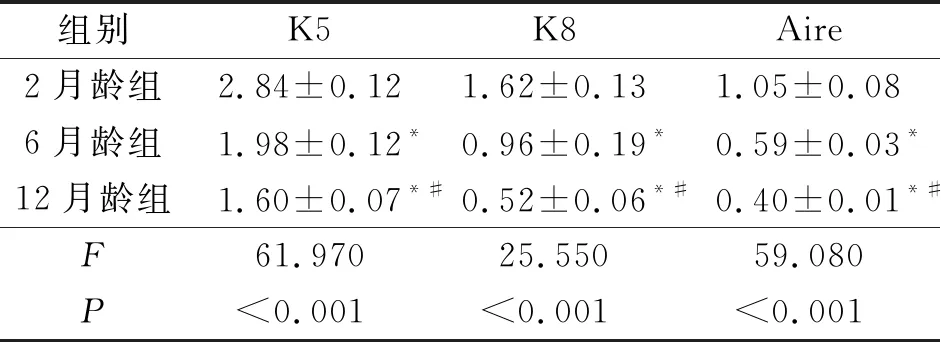
表2 各组小鼠胸腺组织中 K5、K8、Aire阳性细胞面积的比较(n=5)
2.3 不同发育时期小鼠胸腺上皮干细胞/祖细胞的变化见图3和表3。2月龄小鼠胸腺中EpCAM阳性细胞最多,出现在皮质和髓质交界处。6月龄和12月龄小鼠胸腺中EpCAM阳性细胞减少。2月龄小鼠胸腺中Sox2阳性的细胞最多;随着月龄的增长,阳性细胞逐渐减少;12月龄小鼠胸腺的被膜下、皮质和髓质交界处仅见少量Sox2阳性细胞。
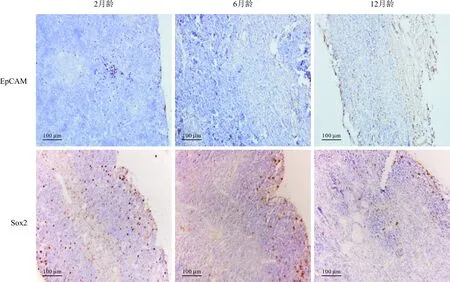
图3 各组小鼠胸腺组织中EpCAM和Sox2的表达变化

表3 各组小鼠胸腺组织中 EpCAM、Sox2阳性细胞面积的比较(n=5)
2.4 不同发育时期小鼠胸腺组织中FoxN1蛋白和mRNA表达的差异、EpCAM蛋白和Aire mRNA表达的变化见表4。由表4可知,2月龄小鼠胸腺中FoxN1蛋白、mRNA和EpCAM蛋白、Aire mRNA的表达量最多;且随着月龄的增加,小鼠胸腺中上述指标逐渐降低。

表4 各组小鼠胸腺组织中FoxN1蛋白和mRNA、EpCAM蛋白和Aire mRNA表达的比较(n=5)
3 讨论
胸腺是产生T淋巴细胞及中枢免疫耐受的部位,对机体的免疫防御功能至关重要。然而,胸腺对外界刺激非常敏感,压力、感染或化疗会造成该器官急性伤害;随着年龄增长,胸腺组织结构和功能也会逐渐发生衰退[10],而且胸腺是机体最先衰老的器官。作为胸腺微环境主要成分的TEC,其数量减少、功能紊乱是引起胸腺退化的重要原因之一[11]。研究[12-14]表明,通过性激素剥夺、补充抗氧化剂等策略可以恢复胸腺的组织结构,调整胸腺细胞的亚群比例。单细胞RNA测序技术表明,TEC存在异质性;并推测成体胸腺中存在胸腺上皮祖细胞,其在组织的稳态维持以及炎症压力等导致的胸腺萎缩恢复过程中起到重要作用[15-17]。2月、6月和12月龄小鼠大致对应人类青春期、30岁和60岁[18],代表胸腺的发育成熟、开始退化、萎缩衰老的动态过程。本研究探索TEC在不同发育阶段小鼠中的动力学变化,期望为深入理解胸腺衰老机制和免疫功能恢复提供理论依据。
K5和K8分别是胸腺中mTEC和cTEC的分子标记,本研究结果显示,随着小鼠月龄的增长,二者的表达衰减,表明mTEC和cTEC数量减少,导致与其相互作用的胸腺细胞不能正常发育,由此,胸腺的整体正常组织结构逐渐被破坏。自身免疫调节因子Aire主要在胸腺mTEC中表达,在TEC的发育、胸腺细胞黏附、免疫耐受和肿瘤免疫中起重要作用,其表达发生改变往往导致多种自身免疫病的发生。Aire可影响mTEC的转录组表达,进而影响胸腺细胞的黏附[19]。Aire阳性细胞表示mTEC的成熟阶段,本研究结果显示,随着小鼠月龄的增长,胸腺组织中Aire阳性细胞逐渐减少,说明成熟的mTEC呈现下降趋势,与年龄相关的免疫能力衰退相一致。
EpCAM作为上皮细胞黏附分子,参与调控肿瘤细胞的黏附、增殖、迁移、干性以及上皮-间充质转化等[20],并且是胸腺上皮祖细胞的重要标志之一。干细胞转录因子Sox2可在干细胞和祖细胞中表达,参与成体器官的稳态维持[21]和肿瘤干细胞的干性维持[22]。本研究结果显示,小鼠胸腺中EpCAM和Sox2阳性细胞主要分布在皮质、皮髓质交界区域,说明该位置可能是胸腺成体干细胞储备区。随着小鼠月龄的增长,EpCAM和Sox2的表达逐渐减少,表明胸腺中成体干细胞的储备逐渐下降。这些祖细胞/成体干细胞标记物表达的下降,也伴随着Aire阳性细胞的减少,推测可能是由于祖细胞的数目减少,导致了Aire阳性mTEC的减少。
FoxN1是TEC发育过程中的关键转录因子,在胸腺发育以及T细胞的分化、成熟等方面发挥重要作用,是维持胸腺功能和稳态的基础[23]。本实验结果表明,随着小鼠月龄的增加,FoxN1在细胞中的表达逐渐降低,提示TEC逐渐衰老,与小鼠胸腺逐渐萎缩的表型相一致。FoxN1的表达降低与EpCAM和Aire的表达减少相同步,推测胸腺上皮干细胞/祖细胞的减少,导致成熟mTEC减少,使T细胞发育、成熟受阻,最终引发胸腺组织萎缩和器官衰老。这些转录因子共同作用以维持胸腺的正常发育与成熟,其表达下降,提示胸腺组织发生了动力学改变。
综上所述,随着小鼠月龄的增长,小鼠胸腺组织中FoxN1、Aire mRNA的表达逐渐减少,EpCAM和Sox2阳性细胞减少,TEC动力学发生显著变化,这与年龄相关的免疫力低下和疾病的易感性相一致。增加成体胸腺上皮干细胞/祖细胞储备的策略或将为胸腺组织再生、自身免疫性疾病的治疗及一些肿瘤免疫提供新的视角。