糖皮质激素对免疫检查点抑制剂治疗非小细胞肺癌临床效果的影响
2023-02-12郭怀娟茅静贤王佳欣严雪冰
郭怀娟, 茅静贤, 王佳欣, 严雪冰, 王 颖
(扬州大学附属医院 肿瘤科, 江苏 扬州, 225000)
非小细胞肺癌(NSCLC)是最常见的病理类型[1-3], 传统手术、放化疗及靶向治疗等手段的治疗效果不佳。最新研究[4-5]表明,免疫检查点抑制剂(ICIs)能够有效改善晚期NSCLC患者的预后。尽管ICI在临床试验及真实世界研究中取得令人满意的成果,但仍有相当一部分患者未能从ICI治疗中获益。ICI疗效受肿瘤表观遗传等内在因素和临床伴随药物等外在因素的影响[6-7]。本研究团队发现,抗生素[8]、质子泵抑制剂等[9]可能在晚期实体肿瘤中降低ICI治疗效果。研究[10]表明,糖皮质激素(GC)作为肿瘤治疗中常用伴随药物,可能在NSCLC患者中降低ICI疗效,特别是GC用于癌症相关症状的患者有更高的疾病进展和死亡风险。但也有研究[11]表明,GC用于脑转移时对总体生存率无影响。因此, GC对于ICI治疗晚期NSCLC临床效果的影响尚存争议。本研究对131例接受ICI治疗的晚期NSCLC患者进行回顾性分析,进一步明确GC对ICI疗效的影响,为临床GC的精准使用提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年1月—2021年12月在扬州大学附属医院接受ICI治疗的131例晚期NSCLC患者为研究对象。通过电子病历及随访记录收集相关临床信息,主要包括年龄、性别、吸烟、病理类型、美国东部肿瘤协作组(ECOG)体力状况评分、治疗策略、治疗线数、ICI治疗前后3个月内使用GC(≥10 mg/d泼尼松或等效GC)的情况、GC用途等。纳入标准: ① 年龄>18岁者; ② 经病理组织学证实的NSCLC者; ③ TNM分期为Ⅳ期者; ④ 接受抗程序性死亡受体1(PD-1)或 程序性死亡受体配体1(PD-L1)免疫治疗者; ⑤ 具有完整的临床资料者; ⑥ 患者或授权家属知情同意。排除标准: ① 伴有其他原发恶性肿瘤者; ② 接受ICI治疗少于2个周期者; ③同时接受其他已知影响ICI治疗效果药物(如抗生素)者。纳入的131例患者中, ≤65岁50例, >65岁81例; 女25例,男106例; 不吸烟者48例,曾经或现在吸烟者83例; 非鳞癌者70例,鳞癌者61例; ECOG评分0~1分者94例,2~3分者37例; 单药治疗者18例,联合治疗者113例; 一线治疗者47例,二线治疗及以上者84例。该研究通过扬州大学附属医院伦理委员会审批(2022-YKL4-28-001)。根据患者在ICI治疗前后3个月内是否使用GC类药物(≥10 mg/d泼尼松或等效GC)分为Non-GC组(ICI治疗期间未使用GC,n=52)与GC组(ICI治疗期间使用GC,n=79)。
1.2 评价指标
通过电话或门诊的形式随访所有患者,时间截至2022年5月31日,患者首次免疫治疗开始时间为研究起点,每3周为1个疗程, 6~8周对患者进行1次随访,最后1次随访时间、死亡日期或疾病进展日期为研究终点。肿瘤预后评估指标包括总生存期(OS)及无进展生存期(PFS), 其中OS定义为从初次使用ICI的日期到患者因任何原因死亡或随访截止日期; PFS定义为初次ICI给药日期至临床疾病进展、死亡或者随访截止日期。
1.3 统计学方法
采用SPSS 25.0和GraphPad Prism 8统计软件分析数据。计数资料以[n(%)]表示,采用χ2检验或Fisher精确概率法分析GC用药情况与患者临床病理特征的关系。采用Kaplan-Meier法绘制生存曲线,采用Log-rank 进行生存检验。通过单因素及多因素Cox风险比例回归模型分析影响患者OS及PFS的因素,P<0.05为差异有统计学意义。
2 结 果
2.1 GC使用与患者临床特征的相关性
在131例接受ICI治疗的晚期NSCLC患者中, GC使用与年龄、性别、吸烟、病理类型、ECOG评分、治疗线数无相关性(P>0.05), 与治疗策略相关(P=0.046), 见表1。
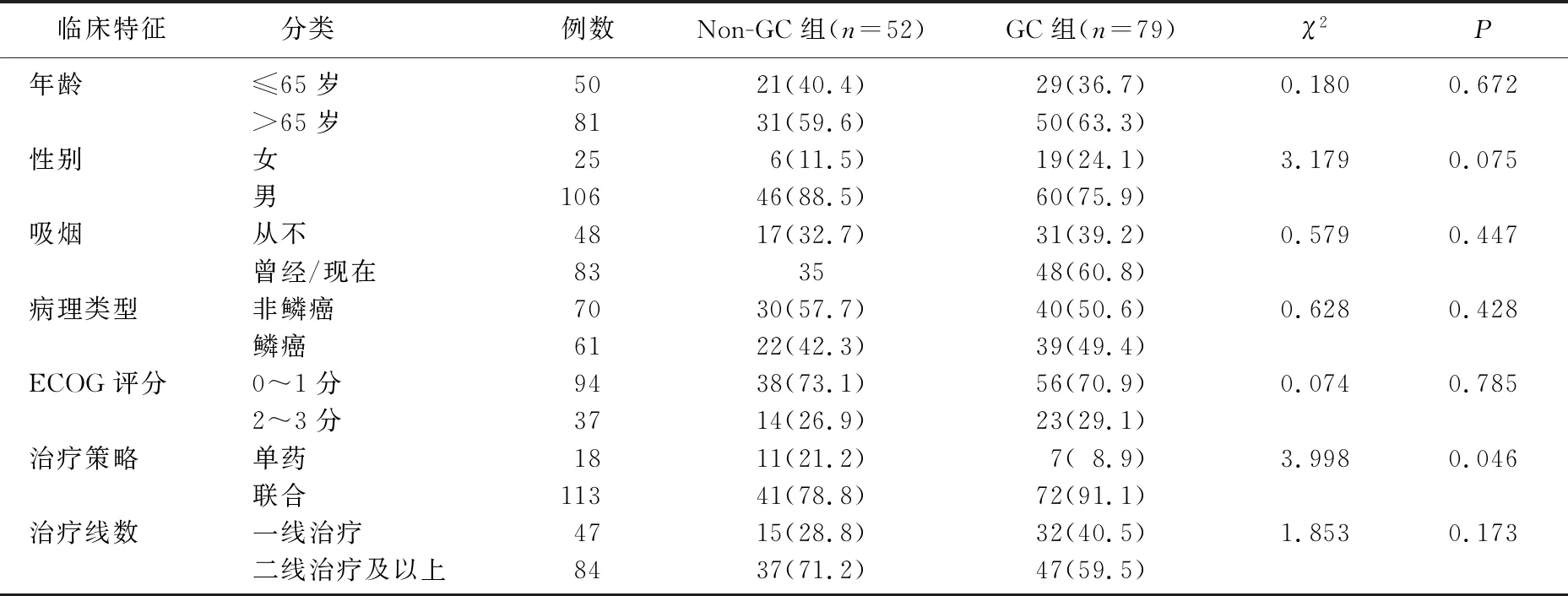
表1 131例接受ICI治疗的晚期NSCLC患者一般临床资料比较[n(%)]
2.2 GC使用对接受ICI治疗晚期NSCLC患者预后的影响
与Non-GC组比较, GC组OS(P=0.033)和PFS(P=0.013)较短,见图1。单因素Cox回归分析表明, GC的使用与ICI治疗晚期NSCLC患者的OS(HR=1.68, 95%CI: 1.02~2.76,P=0.043)相关,而年龄、性别、吸烟、病理类型、ECOG评分、治疗线数、治疗策略与OS无相关性。多因素Cox回归分析表明, GC使用是患者OS(HR=1.82, 95%CI: 1.07~3.08,P=0.026)预后的影响因素,见表2。单因素Cox回归分析表明, GC的使用与ICI治疗晚期NSCLC患者的PFS(HR=1.58, 95%CI: 1.04~2.40,P=0.031)相关,而年龄、性别、吸烟、病理类型、ECOG评分、治疗线数、治疗策略与PFS均无相关性。多因素Cox回归分析表明, GC的使用是影响患者PFS(HR=1.76, 95%CI: 1.13~2.74,P=0.012)的因素,见表3。

A: OS; B: PFS。图1 131例接受ICI治疗的晚期NSCLC患者OS及PFS曲线

表2 131例接受ICI治疗的晚期NSCLC患者OS的单因素及多因素分析
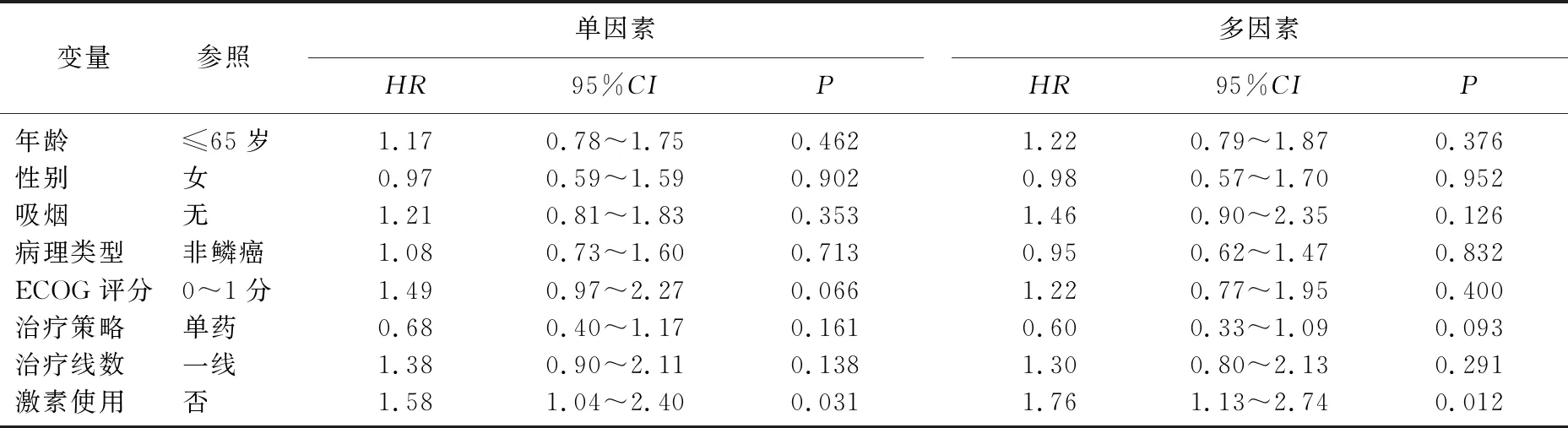
表3 131例接受ICI治疗的晚期NSCLC患者PFS的单因素及多因素分析
2.3 亚组分析
131例ICI治疗的晚期NSCLC患者中, 79例使用GC(GC组),将GC组根据GC用途不同分为非肿瘤症状相关组(n=16)、肿瘤症状相关组(n=13)、免疫相关不良事件(irAEs)组(n=17)及化疗前预处理组(n=33)。进一步探究上述因素对于ICI治疗晚期NSCLC患者预后的影响。卡方及Fisher检验分析显示, GC的用途与年龄、性别、吸烟、病理类型、ECOG评分、治疗线数均无相关性(P>0.05), 与治疗策略显著相关(P=0.024), 见表4。
生存分析表明,不同GC使用原因与晚期NSCLC患者的OS(P=0.006)和PFS(P=0.011)显著相关,见图2。单因素Cox分析提示, GC用于肿瘤相关症状与OS呈显著负相关(HR=4.43, 95%CI: 1.90~10.34,P=0.001)。多因素Cox分析显示, GC用于肿瘤相关症状是影响患者OS的独立不良预后因素(HR=4.18, 95%CI: 1.76~9.94,P=0.001), 见表5。单因素Cox分析显示, GC用于肿瘤相关症状与PFS呈显著负相关(HR=3.17, 95%CI: 1.57~6.40,P=0.001)。多因素Cox分析显示, GC用于肿瘤相关症状是影响患者PFS的独立影响因素(HR=2.81, 95%CI: 1.36~5.81,P=0.005), 见表6。

表4 GC组接受ICI治疗的晚期NSCLC患者一般临床资料比较[n(%)]

A: OS; B: PFS。图2 GC组接受ICI治疗的晚期NSCLC患者OS及PFS曲线

表5 GC组接受ICI治疗晚期NSCLC患者OS的单因素及多因素分析

表6 GC组接受ICI治疗晚期NSCLC患者PFS的单因素及多因素分析
3 讨 论
GC类药物在晚期NSCLC患者治疗过程中具有重要作用,例如紫杉醇与多西他赛等化疗药物必须用GC类药物预处理以防止液体潴留和过敏[12-13]。此外,患者化疗后出现恶心、呕吐、食欲不佳及放疗导致的放射性肺损伤等均需使用GC治疗[14-15]。ICI是晚期NSCLC患者的重要治疗手段之一,最新研究[16-17]发现, ICI治疗期间使用GC能够显著降低免疫治疗疗效,缩短患者生存时间。SVATON M等[18]发现, GC对接受ICI治疗的晚期NSCLC患者的OS和PFS无影响。由此可见, GC的使用对ICI治疗晚期NSCLC患者的预后影响仍不清楚,需要更多临床研究来进一步明确。
本研究中GC使用是降低晚期NSCLC患者ICI临床疗效的独立预后不良因素,与部分既往研究结果相符。MOUNTZIOS G等[17]发现,与对照组比较,IV期或复发的NSCLC患者在帕博利珠单抗治疗前或使用GC有更短的 OS和PFS。也有研究[18]发现, ICI治疗前后1个月内使用GC的患者OS和PFS较未使用GC的患者无显著差异。FUCG等[19]回顾性分析了151例接受ICI治疗的晚期NSCLC患者发现,在ICI治疗开始后4周内使用GC具有更差的临床结局。ICI抗癌机制为阻断PD-L1与PD-1的结合,恢复T细胞免疫监视作用,进而避免发生肿瘤免疫逃逸[20]。机制研究[21-23]发现, GC上调T细胞、自然杀伤细胞及树突状细胞上PD-1的表达,进而抑制T细胞活性及促进免疫逃避。GC也可以下调c-Fos表达,干扰激活蛋白-1(AP-1)、核转录因子-κB(NF-κB)和活化T细胞核因子(NF-AT)的活性,降低酪氨酸激酶家族里LCK和FYN的活性,从而减弱T细胞受体信号,抑制T细胞增殖和活化[24]。研究[19]还发现,GC可以通过调节外周血免疫细胞来降低免疫治疗效果。
采用ICI治疗的晚期NSCLC患者将GC常用于以下情况: ① 化疗前预处理[14]; ② 治疗COPD急性发作、自身免疫性疾病等非肿瘤相关症状[25]; ③ 因肿瘤导致的呼吸困难、恶心、呕吐、疼痛、脑转移、放射性肺损伤等肿瘤相关症状[26-29]; ④ 因免疫检查点抑制剂过度反应导致的免疫相关不良事件[30]。本研究根据上述具体用途进行亚组分析,结果表明,相比于其他用途, GC用于肿瘤相关症状提示更短的OS和PFS。RICCIUTI B等[31]回顾分析了650例接受ICI治疗的NSCLC患者基线时使用GC的情况, 66例患者因肿瘤相关症状使用GC, 27例患者因非肿瘤相关症状使用GC, 非肿瘤相关性类固醇组与未使用类固醇组的PFS和OS比较,差异无统计学意义(P>0.05), 在肿瘤相关性症状类固醇组中观察到OS显著缩短。SKRIBEK M等[33]回顾性分析196例接受ICI的NSCLC患者, 46.3%的患者接受了GC治疗,其中因肿瘤相关症状给药的患者OS和PFS均较对照组缩短[32]。本研究发现, GC用于irAEs或化疗前预处理与患者预后无相关性,但是本研究样本量较小,因此未来仍需多中心、大样本回顾性研究来验证。
本临床研究存在如下局限性: 首先,本研究是一项单中心回顾性研究且样本量偏小; 其次,本研究主要关注于NSCLC, GC使用与ICI疗效相关性在小细胞肺癌中尚未清楚; 最后, GC联合其他伴随药物(如抗生素、质子泵抑制剂等)对ICI抗肿瘤效果的影响也有待于更多临床研究来明确。
综上所述,本临床研究发现GC使用会显著降低ICI治疗晚期NSCLC的临床效果。进一步亚组分析表明, GC用于肿瘤相关症状为患者临床不良结局的独立影响因素。因此,晚期NSCLC患者在接受ICI治疗前后应谨慎使用GC类药物。
