植物精油及其活性成分防治结直肠癌作用机制的研究进展
2023-02-08林俊芝张定堃
刘 宏,李 佳,林俊芝,张定堃,杨 明,郑 川,
1.成都中医药大学附属医院 代谢性疾病中医药调控四川省重点实验室,四川 成都 610075
2.成都中医药大学肿瘤研究所,四川 成都 610075
3.成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137
4.江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330103
结直肠癌是全球范围内致死率排名第2 的恶性肿瘤,其发病率逐年上升且发病年龄趋于低龄化,给患者带来了极大的健康危害和经济负担[1]。尽管其在过去几十年内通过手术、放化疗和靶向治疗取得了一定临床进展,但在治疗过程中出现的严重不良反应、耐药性以及昂贵的医疗成本暴露出现有的结直肠癌治疗方案并不完美[2-3]。此外,越来越多的研究表明结直肠癌的发生发展是包括慢性炎症、肠道菌群失衡、细胞生长信号异常在内等多种机制共同作用导致的一种综合性病变[4]。因此,寻找多靶点、多效应、低毒高效的新型药物和治疗方法,是当前提高结直肠癌疗效的急迫需求。天然来源的植物精油因其广泛的药理活性和良好的安全性,在针对结直肠癌的药物研发中备受关注[5]。因此,本文总结了植物精油及其活性成分防治结直肠癌作用机制的研究进展,以期为其在结直肠癌药物研发和临床治疗中的研究提供新的思路。
1 植物精油的主要活性成分
植物精油主要由叶、花瓣、茎、树皮、种子等部位的特殊分泌细胞产生,以液滴的形式储存于植物的各种组织和器官中。精油的成分十分复杂,一种精油通常由几十至上百种化合物组成,根据其化学结构主要分为萜类、芳香族、脂肪族和其他化合物4 大类[5-7]。萜类化合物是一类由甲戊二羧酸衍生而成,具有2 个或2 个以上异戊二烯(C5单位)结构特征的化合物,在挥发油中所占比例最大,主要包括单萜、倍半萜及萜类含氧衍生物;芳香族化合物在植物精油中的含量仅次于萜类化合物,以C6-C3为基本骨架,主要包括简单苯丙素类和香豆素类化合物;脂肪族化合物几乎存在于所有的植物精油中,但其含量相对较少,主要包括一些小分子脂肪酸;其他成分如含硫含氮类和生物碱类化合物等,能够经水蒸气蒸馏而出,其含量极少但气味浓烈,对植物香气有较大贡献。而不同芳香植物含有的精油种类和活性组分不尽相同,决定了其药理活性的发挥方向及其作用机制。植物精油的主要活性成分见图1。
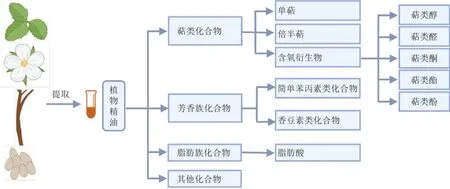
图1 植物精油的主要活性成分Fig.1 Main active components of plant essential oils
2 抗结直肠癌的作用机制
2.1 抑制慢性炎症和抗氧化应激
慢性炎症和氧化应激损伤与结直肠癌的发生发展密切相关。结肠炎相关结直肠癌(colitis-associated colorectal cancer,CAC)由炎症性肠病(inflammatory bowel disease,IBD)逐步发展而来。在早期肠道发生炎症、肠黏膜屏障受损时,肠道微生物抗原暴露,趋化免疫细胞游离至结肠黏膜并分泌促炎因子如白细胞介素-6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、γ 干扰素(interferon-γ,IFN-γ)等浸润于组织局部,塑造慢性炎症微环境[8]。同时,免疫细胞会分泌大量活性氧、活性氮如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧化酶-2(cyclooxygenase-2,COX-2),进而衍生具有高度氧化活性的自由基,诱导结肠上皮细胞DNA 损伤、基因突变及其随后的过度增殖和恶性转化[9]。研究发现,薄荷醇显著降低氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sulfate sodium,DSS)小鼠腺瘤数量和疾病活动指数评分(disease activity index,DAI),降低促炎细胞因子如IL-6、TNF-α 和髓过氧化物酶(myeloperoxidase,MPO)的分泌以及脾脏免疫细胞(白细胞、中性粒细胞和髓源性抑制细胞)的浸润程度[10]。菜籽多酚通过减少IL-12、IL-1β、TNF-α 等炎症因子分泌,在CAC 早期阶段发挥其化学预防活性[11]。当归挥发油能够减少AOM/DSS 小鼠荷瘤数、荷瘤体积以及肿瘤发生率,与其减少COX-2、iNOS、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)蛋白表达有关[12]。香芹酚[13]和6-姜烯酚[14]具有良好的抗炎和抗氧化应激作用,能够减 少 IL-1β、TNF-α、脂质过氧化物(lipidperoxidation,LPO)、MPO 和一氧化氮(nitric oxide,NO)含量,并显著增加抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)活性,促进结肠组织氧化还原稳态的恢复。
核因子-κB(nuclear factor-κB,NF-κB)是细胞活化和产生各种炎症介质的最常见效应分子,其过度激活是结肠慢性炎症维持和上皮细胞恶变的重要原因[15]。NF-κB 被激活后,NF-κB 抑制蛋白(inhibitor of NF-κB,IκB)发生磷酸化和降解,由此NF-κB 亚基p65 脱离IκB 的限制转入细胞核,激活其下游的促炎因子转录[16]。研究表明,红参油[17]、橄榄油多酚[18]、micheliolide[19]能够抑制结肠癌细胞中p65 和IκB 磷酸化,减少IL-6、IL-1β、TNF-α 以及iNOS、COX-2 等炎症介质分泌,抵抗发炎结肠黏膜中的氧化应激水平、减少结肠上皮细胞损伤,进而抑制CAC 的发生。小白菊内酯[20]与5-氨基水杨酸盐协同作用能够恢复AOM/DSS 模型小鼠体质量、改善结肠组织损伤,进行机制研究发现其抑制了TNF-α诱导的IκBα 磷酸化、NF-κB 核易位及其DNA 结合活性,并且降低促炎细胞因子和其余靶基因如B 细胞淋巴瘤因子-xL(B-cell lymphoma-extra large,BclxL)、B 淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)、细胞 FLICE 样抑制蛋白(cellular FLICE-like inhibitory protein,cFLIP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、细胞周期蛋白D1(Cyclin D1)、COX-2表达,在缓解炎症的同时抑制肿瘤细胞的增殖、侵袭、血管新生、抗凋亡等恶性行为。枳壳挥发油具有抑制CAC小鼠肿瘤炎症微环境的免疫调节作用,其机制可能与 Jagged 1/神经源性基因 Notch 同源蛋白(neurogenic locus notch homolog protein,Notch)/NFκB/程序性死亡配体1(programmed death ligand 1,PD-L1)信号通路有关[21]。
Toll 样受体4(Toll-like receptor 4,TLR4)是识别肠道病原微生物的重要受体,在结肠上皮细胞和固有层炎症细胞中均有表达[22]。TLR4 可激活下游的炎症信号通路,加重IBD 中的肠道炎症并促进肿瘤发展[22]。研究发现,迷迭香酸通过竞争性拮抗TLR4 抑制炎症微环境中结肠癌细胞NF-κB 和信号转导及转录激活蛋白 3(signal transducer and activator of transcription 3,STAT3)活化,降低炎症介质水平,从而产生对CAC 的预防作用[23]。双氢青蒿素通过抑制巨噬细胞中的TLR4 信号通路,降低细胞外信号调节激酶(extracellular signalregulated kinase,ERK)、STAT3 和NF-κB p65 磷酸化水平,逆转巨噬细胞活化和募集,减少巨噬细胞相关促炎因子的释放[24]。此外,该研究还评价了双氢青蒿素的器官毒性和药动学特征,发现其对肝脏和肾脏等主要器官的正常功能和病理特征无影响,且在肠和胃中分布较高,是防治CAC 有效且安全的药物。
2.2 抑制细胞增殖
细胞的失控和失序性增殖,是结直肠癌发生和迅速生长的关键。多种精油及其活性成分能够通过干扰肿瘤细胞的增殖而发挥抑制结直肠癌生长的作用。如双氢青蒿素以剂量相关性方式抑制结直肠癌HCT116 和RKO 细胞增殖[24]。鼠尾草精油及其主要芳香成分(α-thujone、1,8-桉树脑和樟脑)对结直肠癌Caco-2、HT-29 和HCT116 细胞具有体外抗增殖作用,而对正常结肠上皮细胞活力没有影响[25]。肉豆蔻油在体外对Caco-2 细胞的生长具有显著的抑制作用[26]。覆盆子油乳液在结直肠癌LoVo 细胞中强烈诱导自由基产生和DNA 链损伤,以剂量相关性方式抑制结肠癌细胞的增殖活性[27]。生姜精油减少1,2-二甲基肼(dimethylhydrazine,DMH)诱导的结肠畸变隐窝灶(aberrant crypt focus,ACF)数量,进行PCNA 免疫组化染色发现其能够降低隐窝基底区域和隐窝顶端区域的细胞有丝分裂指数[28]。杜松子油减少AOM 诱导的腺瘤和腺癌形成,进行免疫组化检测发现其能够降低肿瘤细胞增殖标记物Ki67 的表达水平[29]。Origanum onitesL.精油对结直肠癌CT26 和HT-29 细胞有杀伤作用,同时体内实验显示其口服给药可抑制小鼠CT26 细胞的生长[30];鱼腥草挥发油作用结直肠癌SW480 细胞后,可观察到细胞逐渐变小、皱缩,死亡细胞增多,同时在体内实验中观察到其减少了结肠癌的发生率[31]。
Wnt 信号传导与肠隐窝干细胞增殖和分化密切相关[32],其异常激活或过表达可导致β-连环蛋白(βcatenin)胞质和核积累、诱导Wnt 下游靶基因转录,继而促进结肠细胞恶性增殖和早期癌变形成[32-33]。DSS 介导的慢性炎症微环境可诱导β-catenin 细胞核易位、诱发结肠上皮的异型增生病变,而橄榄油能够抑制β-catenin 的这种异常表达,阻止肿瘤抑制基因p53失活,进而减少细胞恶性增殖和异型增生病灶形成[34]。藏茴香精油通过抑制致癌剂DHA 诱导的Wnt/β-catenin 信号通路激活,减少ACF 数量,对结直肠癌癌前病变具有良好的化学预防作用[35]。在膳食中加入ω-3 多不饱和脂肪酸[36],观察其对ApcMin/+小鼠结肠息肉的预防作用,发现ω-3 多不饱和脂肪酸可显著降低β-catenin及其下游促生长因子c-myc 表达,进而抑制细胞增殖活力、减少小鼠肠道息肉形成。6-姜酚通过下调Wnt/β-catenin 过表达,同时增加肿瘤抑制基因p53表达,抑制结肠癌细胞增殖指数[37]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)信号转导对肿瘤细胞的增殖和存活至关重要,是结直肠癌发生和进展的主要驱动因子之一,也是结直肠癌防治的有力药物靶标[38-39]。研究表明,橄榄油中最主要的多酚成分羟基酪醇能够显著下调人结肠癌WiDr、HT-29、CaCo2 以及HT-29 细胞异种移植瘤组织中的EGFR 表达,对细胞增殖和瘤体生长表现出良好的抑制效应,对其抗EGFR 机制进行深入研究发现,羟基酪醇通过促进EGFR pY1045 位点发生磷酸化,增加泛素连接酶活性从而实现EGFR 的泛素化降解[40]。分子对接技术显示月桂酸具有较高的EGFR 亲和力[41],体外实验发现其对人结肠癌细胞毒性和EGFR 表达抑制均呈现浓度相关性。
2.3 诱导细胞凋亡
凋亡受阻导致结肠上皮细胞的凋亡与增殖失去平衡,最终导致结直肠癌的发生。研究发现,多种植物精油及其活性成分能够通过线粒体依赖性凋亡途径来发挥其抗凋亡作用,主要表现为对含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)家族和Bcl-2 家族蛋白表达的调节。如双氢青蒿素上调促凋亡蛋白Bcl-2关联X 蛋白(Bcl-2-associated X protein,Bax)表达、下调抗凋亡蛋白Bcl-2 表达,增加Caspase-9 与聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)蛋白裂解,诱导结肠癌细胞凋亡[24]。Origanum onitesL.精油减弱结肠癌细胞迁移并诱导了细胞凋亡相关的形态学变化[30]。柠檬醛降低抗凋亡蛋白Bcl-2 和Bcl-xL 表达、促进Caspase-3裂解,在结肠癌细胞中激活由p53 和活性氧(reactive oxygen species,ROS)介导的线粒体凋亡通路[42]。芳樟醇促进结肠癌细胞内ROS 和羟基自由基积累,加剧细胞内氧化应激损伤,诱发凋亡级联[43]。在雪松树皮精油[44]、肉桂醛[45]、米糠油脂肪酸组分[46]干预结肠癌细胞的实验中,观察到凋亡诱导的一系列生化反应,包括线粒体膜电位损失、ROS 积累、Bax/Bcl-2 值以及Caspase 家族蛋白、多聚二磷酸腺苷酸核糖聚合酶(poly ADP ribose polymerase,PARP)蛋白表达上调等。
此外,有相当一部分植物精油的线粒体凋亡激活作用是通过影响结肠癌细胞内异常的信号通路来实现,主要包括磷酸肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated kinases,ERK)和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)等信号通路。如薏苡仁油通过降低Akt 磷酸化水平,启动下游Bcl-2、Bax 和Caspase-3 介导的凋亡程序[47]。当归挥发油促进结肠癌细胞凋亡和自噬,与其抑制PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路分子的表达有关[48]。血橙精油上调Bax/Bcl-2 值、诱导结肠癌细胞凋亡,蛋白印迹实验提示,该活性与Akt 磷酸化水平降低和p38 MAPK 活化有关[49]。D-柠檬烯对结肠癌细胞显示出剂量相关性地凋亡诱导作用,进行机制研究发现其能降低Akt 和糖原合成酶激酶3β 蛋白磷酸化水平[50]。香芹酚[51]、胡萝卜油提取物的戊烷部分[52]、β-2-himachalen-6-ol[53]能够抑制ERK 和Akt 蛋白磷酸化,调节凋亡相关蛋白表达,提示三者可能通过调控MAPK/ERK 和PI3K/Akt 信号通路触发凋亡。β-谷甾醇通过降低肿瘤组织中PI3K和Akt蛋白磷酸化,增加促凋亡因子线粒体细胞色素-C(cytochrome-C,Cyto-C)释放,激活Caspase-9、进而触发一系列凋亡事件[54]。肉桂醛能够降低PI3K/Akt 通路分子的转录活性,降低结肠癌细胞侵袭和黏附能力并诱导其凋亡[55]。
2.4 阻滞细胞周期
细胞周期异常是肿瘤细胞增殖失控因而发生恶变的重要原因,细胞周期检查点的异常持续激活在这一过程中扮演了重要角色。Cyclin D1 和Cyclin B1分别作为细胞G1/S 期、G2/M 期转换的关键限速因子,其过表达可导致细胞增生失控、细胞分化障碍,促进细胞的恶性转化[56-57]。而双氢青蒿素[24]、小白菊内酯[20]、6-姜酚[37]、micheliolide[19]等香气成分能够抑制Cyclin D1 蛋白表达,引发结肠癌细胞G1期阻滞。香芹酚处理HCT116 和LoVo 细胞后,Cyclin B1蛋白表达水平降低,导致细胞周期停滞在G2期[51]。鱼腥草挥发油作用于SW480细胞后,采用PI 单染法和Annexin FITC/PI 双染法检测细胞周期和凋亡率,结果显示G1期细胞增多、S 期减少,且总凋亡率增加[31]。薏苡仁油在体外呈剂量和时间相关性地抑制HT-29 细胞的活力,进行流式细胞术分析发现薏苡仁油诱导细胞周期G2期阻滞,并引发随后的细胞凋亡[47]。将胡萝卜油提取物的戊烷部分进行体外实验和流式细胞术分析,发现其能够诱导结肠癌细胞G1期阻滞和凋亡[52]。β-2-himachalen-6-ol 能够促进细胞周期负调控因子p21 的表达,阻止结肠癌细胞从G1期向S 期转变,进而抑制癌细胞生长[53]。
2.5 抑制血管新生
血管新生是加速结肠肿瘤生长、浸润以及启动侵袭、转移的关键事件,VEGF 在其中发挥了关键作用[58]。临床上,针对VEGF 的小分子抑制剂如贝伐珠单抗能够显著提高结肠癌的治疗有效率,但其价格昂贵,且已出现耐药现象[59]。植物精油来源广泛,成本相对低下,从中开发新的抗血管新生药物是一条重要的潜在途径。研究发现,富含D-柠檬烯的血橙精油能够以浓度和时间相关性方式降低结肠癌细胞中VEGF 蛋白表达,并抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的迁移和血管形成能力,表明其具有良好的抗血管新生活性[49]。6-姜酚通过降低结肠肿瘤组织中血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、促血管生成素-1(angiopoietin-1,Ang-1)、成纤维细胞生长因子(fibroblast growth factor,FGF)和生长分化因子-15(growth differentiation factor-15,GDF-15)的浓度来抑制血管生成,减缓结肠肿瘤生长[37]。来自结肠基质的结肠癌相关成纤维细胞(cancer-associated fibroblasts,CAFs)分泌的IL-6 和VEGF 能够促进HUVECs 的管形成能力,而二十碳五烯酸能够抑制这种由CAF 诱导的肿瘤血管新生[60]。
抗血管新生的另一研究热点是诱导肿瘤血管正常化。改善肿瘤新生血管形态、降低肿瘤血管通透性、改善肿瘤血管功能,是提高化疗药物递送效率的一种重要思路[61]。Feng 等[62]将从活血化瘀药姜黄中提取的精油作用于结肠癌细胞和HUVECs 的体外共培养模型,发现其能够降低抑制HUVECs 活性、增殖以及HUVECs 中的VEGFA 蛋白表达,并通过增加血管内皮细胞间的VE-钙黏蛋白连接(VEcadherin)和周细胞覆盖,诱导肿瘤血管结构正常化。目前植物精油及其活性成分诱导肿瘤血管正常化的研究较少,亟待开展更多相关研究。
2.6 改善肠道菌群结构
结直肠癌患者的肠道菌群组成和分布存在显著异常,主要表现为益生菌减少和致病菌增加[63]。致病菌如大肠杆菌、梭杆菌属、链球菌属和肠球菌属通过分泌致癌代谢物,诱导DNA 损伤、增强炎症、启动生长信号,促进结肠癌发生发展[64]。而益生菌及其代谢物(如短链脂肪酸)具有抗诱变、抑增殖、促凋亡、增强黏膜屏障、改善炎性微环境、激发免疫应答等抗癌效应,对结直肠癌具有良好的防治作用[65-66]。研究发现,部分植物精油及其活性物质能够改善结直肠癌小鼠肠道菌群结构及其代谢功能。如薄荷醇改善AOM/DSS 小鼠肠道微生物群落α 和β 多样性、增加产丁酸盐菌株丰度和粪便丁酸盐浓度,进而缓解小鼠结肠炎症并减少肿瘤数量[10]。广藿香精油减少ApcMin/+小鼠息肉数量、增强肠黏膜屏障并改善肠道炎症微环境,深入研究其作用机制,发现其能够降低小鼠肠道致病菌如脱硫弧菌、生殖支原体和艰难梭菌丰度,增加益生菌如嗜黏蛋白阿克曼菌、普通拟杆菌、解木聚糖拟杆菌和乳杆菌丰度,同时增加粪便中短链脂肪酸浓度,促进短链脂肪酸受体(GPR41、GPR43、GPR109a)和过氧化物酶体增殖物激活受体γ(peroxisome proliferatorsactivated receptor γ,PPARγ)表达[67]。β-谷甾醇抑制了BALB/c 荷瘤小鼠的结直肠癌生长,16S rDNA 分析显示其增加了肠道菌群的种类多样性,并增加戊糖乳杆菌等益生菌群丰度和粪便中短链脂肪酸浓度,进而发挥其诱导结肠癌细胞凋亡作用[54]。目前植物精油及其活性成分防治结直肠癌的肠道菌群调节机制多集中于对肠道菌群结构及其代谢产物的影响,对宿主抗肿瘤免疫反应、上皮细胞生长信号等肠道菌群与肠上皮细胞间的“对话”环节未给予充分关注,仍需进一步深入探索。
3 结语及展望
通过对文献进行归纳和分析发现,部分植物精油及其活性成分能够有效预防和治疗结直肠癌,其作用机制涉及抑制慢性炎症、抗氧化应激、抑制细胞增殖、诱导细胞凋亡、阻滞细胞周期、抑制血管新生、改善肠道菌群结构,其干预的信号通路(图2)包括NF-κB 通路、TLR4 通路、Wnt/β-catenin 通路、EGFR通路、PI3K/Akt 通路、MAPK/ERK 通路等。

图2 植物精油及其活性成分防治结直肠癌的信号通路图Fig.2 Signal path diagram of plant essential oils and their active components against colorectal cancer
可以看出,这些研究涵盖了结直肠癌从慢性炎症、癌前病变到肿瘤发生、发展的各个阶段。其中,植物精油及其活性成分突出的抗炎、抗氧化作用能够贯穿炎症相关性结直肠癌的始终,对这一临床预防和治疗难题显示出巨大的应用潜力。但植物精油及其活性成分的抗结直肠癌作用仅在细胞实验和动物实验层面得到验证,尚缺少临床研究的有力支撑。因此,研究者需要对其面临的关键问题展开更加深入的研究。
3.1 完善精油成分的质量控制
精油质量的稳定均一是其药效稳定性和可重复性的重要前提。部分具有抗结直肠癌作用的植物精油,包括红参[17]、枳壳[21]、鱼腥草[31]、广藿香[67]等挥发油成分并未得到明确,需要进一步鉴定和表征其药理活性物质,如通过电子鼻、色谱-质谱联用技术、红外吸收光谱法等技术,对精油的组分进行定性、定量检测,保证精油质量符合标准且成分统一[68]。此外,原材料产地、提取部位、提取工艺等不同将导致精油的组成成分和药理活性差异[69-71]。因此,从植物栽培、采收到精油提取、加工和贮存的各个生产过程,应制定标准统一的操作规程。
3.2 完善精油成分药动学和毒性评价
精油成分在体内的吸收、代谢迅速,但其具体代谢过程不明确。应开展相应的体内药动学检测,阐明精油进入人体后的吸收、转变、分布和排泄过程,并明确其发挥药效的主要物质基础。同时,精油的毒性评价和风险规避亦是临床应用前亟待解决的关键问题[72]。在本文搜集的诸多研究中,仅有双氢青蒿素[24]和鼠尾草精油[25]进行了初步的药物毒性评价,表明精油成分的安全性考察尚未得到重视。因此,在研究中应尽可能广泛地开展精油成分的初步毒性评价,包括对正常结肠上皮细胞活性影响、对各脏器是否有功能或病理性损害等,且在此基础上进一步明确有效浓度和安全浓度范围,以期为临床合理、安全用药提供参考。
3.3 采用组学技术明确精油成分作用机制
当前精油成分抗结直肠癌作用研究局限在炎症、增殖、凋亡、周期等癌细胞恶性表型的干预上,对分子机制的检测手段也相对单一,相较于近年来对结肠癌发病机制的前沿探索是相对滞后的。因此,在明确精油成分的抗结直肠癌疗效和作用倾向的基础上,结合肠道黏膜免疫、肿瘤干细胞、代谢重编程、DNA 甲基化、嗅觉受体等新靶点或新功能区域,依托肿瘤基因组学、转录组学、蛋白质组学和代谢组学以及单细胞测序、表观遗传检测等前沿技术,多维度探测和筛选精油及其芳香成分更突出、更深入的作用靶点,从而对其抗结直肠癌作用机制有更彻底、更精确的认识。
3.4 提高精油成分的结肠靶向性和生物利用度
尽管精油及其芳香成分具有良好的抗结肠炎、抗结肠肿瘤效应,但其存在水溶性和稳定性差、半衰期短而清除较快,且具有一定的胃肠道刺激性等主要内在问题,限制其作用的充分发挥和药用开发。近年来,研究者致力于采用新型制剂技术以获得效力更强、不良反应更小的递药策略,如天然脂质纳米颗粒封装的6-姜烯酚[73]、pH 依赖性肠溶包衣(EudragitL100+Eudragit NE30D)封装的紫米糠油[74]以及微胶囊包封的肉桂精油[75]和当归挥发油[76]能够在结直肠部位维持长时间的释放,表现出更为优越的抗炎、抗肿瘤和改善肠道菌群作用。因此,利用现代制剂技术,包括微胶囊、纳米粒、脂质体和自纳米乳化等新型药物载体来进一步增加精油成分的结肠组织靶向性和局部生物利用度[77-78],是未来值得深入探索的研究方向。
综上,完善精油质量控制以及药动学、毒性评价,揭示精油成分在体内的代谢规律和药效特征,运用组学等高通量检测技术,精确其效力组分和效力靶点,同时积极开发以结肠为靶向的新型药物递送系统,保障精油成分的安全性和有效性,可能是其突破在结直肠癌防治临床转化研究中瓶颈与桎梏的关键。
利益冲突所有作者均声明不存在利益冲突
