根皮素聚乙二醇-聚乳酸纳米胶束的制备、表征及口服药动学研究
2023-02-08董丹丹焦红军郝海军
董丹丹,焦红军*,郝海军
1.郑州大学第二附属医院 药学部,河南 郑州 450000
2.上海市中药研究所,上海 201401
根皮素属于二氢查耳酮化合物,主要存在于草莓、苹果、海棠叶、梨等果蔬或植物中。根皮素具有抗糖尿病、抗骨质疏松、抗氧化、保护神经系统、抗动脉粥样硬化、抗菌等药理活性[1-3],在化妆品领域也有较多应用[4]。根皮素溶解度为26.51 μg/mL[5]、稳定性差[6]、生物利用度仅为8.68%[5-6]。因此,提高根皮素生物利用度是根皮素研发的难点和重点。马记平等[5]对根皮素的磷脂复合物进行了研究,但磷脂复合物黏度较大,给药便捷性差;杨金枝等[7]将根皮素制备成纳米结构脂质载体,但辅料种类多、制备工艺复杂。
纳米胶束是由两亲性聚合物载体在水相中形成的一种“核-壳”型胶体载药系统,粒径一般小于100 nm,具有载药量高、抗稀释能力强等优势[8-11]。聚乙二醇-聚乳酸[methoxy poly(ethylene glycol)-poly(lactic acid),mPEG-PLA]聚合物材料在我国已实现量产,价格低廉,其结构由PEG 亲水端和PLA亲脂端组成的两亲性聚合物材料,具有良好的黏液渗透性能,可促进药物透过黏液层进入血液循环[12],且体内可生物降解,相容性高[13],其临界胶束浓度仅为7.71 mg/L[14],可抵抗体外稀释及体内水相环境对胶束结构的破坏,口服后可提高药物在胃肠道中的稳定性[15]、促进渗透、增加生物利用度及提高药效等[9-10,12]。本研究以mPEG-PLA 材料为载体制备根皮素mPEG-PLA 纳米胶束(phloretin mPEG-PLA nanomicelles,Phl@mPEG-PLA/NM),单因素考察结合Box-Behnken 设计-效应面法优化其处方工艺,并进行表征。以根皮素混悬液为对比,评价Phl@mPEG-PLA/NM 口服药动学行为,为根皮素新型制剂开发提供参考数据及研究资料。
1 仪器与材料
1.1 仪器
Agilent 1200 型高效液相色谱仪,美国安捷伦公司;FA1104 型电子天平,上海民桥精密科学仪器有限公司;HJ-4D 数显恒温测速磁力加热搅拌器,江苏省金坛市友联仪器研究所;Zetasizer Nono ZS-90型粒度测定仪,英国马尔文公司;JY92-IIN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;JEM-2100 透射电子显微镜(TEM),日本电子株式会社;RT61212 型溶出仪,深圳市锐拓仪器设备有限公司;HTM-BX 型超低温冰箱,佛山市汇泰美机械设备有限公司;TG16 台式高速离心机,上海卢湘仪离心机仪器有限公司;FD-1D-80 型真空冷冻干燥机,江苏天翎仪器有限公司;UGC-12MF 型氮吹仪,北京优晟联合科技有限公司。
1.2 材料
根皮素对照品,批号202008101,质量分数98.3%,成都普菲德生物技术有限公司;根皮素原料药,批号PT20200218,质量分数97.0%,上海卓鼎生物技术有限公司;聚乙二醇-聚乳酸(mPEG5000-PLA2000),批号20210325,广州碳水科技有限公司;地塞米松,批号529684,质量分数99.2%,成都瑞芬思生物科技有限公司;十二烷基苯磺酸钠(SDS),批号20191120,山东澳凯化工有限公司;甘露醇,批号20210525,寿光华力糖醇有限公司。
1.3 动物
SD 大鼠购自河南省动物实验中心,许可证编号SCXK-2016-0001,清洁级,体质量为(220±20)g。遵循郑州大学第二附属医院有关实验动物管理和使用的规定,均符合3R 原则。
2 方法与结果
2.1 Phl@mPEG-PLA/NM 的制备[16]
薄膜分散-探头超声法制备Phl@mPEG-PLA/NM。固定根皮素投药量10 mg 不变,取处方量的mPEG-PLA 置于圆底烧瓶中,加入适量乙醇超声溶解。于45 ℃水浴温度下缓慢旋转蒸法除去乙醇形成一层均匀的薄膜,置于45 ℃真空干燥箱中过夜,以除尽有机溶剂。加入适量蒸馏水水化一定时间,超声(功率为200 W),采用孔径为0.22 μm 的微孔滤膜滤过,即得Phl@mPEG-PLA/NM。加入5%冻干保护剂(乳糖-甘露醇1∶1,质量比)-30 ℃预冻2 d 后,置于-25 ℃冻干机中2 d,取出即得冻干粉。
2.2 根皮素含量测定
2.2.1 色谱条件 Symmetry-C18色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液(50∶50);柱温为30 ℃;进样体积为10 μL;测波长为280 nm;体积流量为1.0 mL/min。
2.2.2 线性关系考察 采用甲醇配制0.5 mg/mL 的根皮素储备液。取适量,采用甲醇-0.1%磷酸水溶液(50∶50)稀释至10.00、5.00、1.00、0.25、0.10、0.05 μg/mL,进样分析。以根皮素峰面积(Y)对其质量浓度(X)做线性回归,得回归方程Y=42 618X+36 459,r=0.999 8,结果表明根皮素在0.05~10 μg/mL 线性关系良好。
2.2.3 供试品溶液的配制 取Phl@mPEG-PLA/NM 混悬液1 mL 至10 mL 量瓶中,加入适量甲醇超声6 min,放置至室温后定容,摇匀。取5 mL 至100 mL 量瓶中,甲醇-0.1%磷酸水溶液(50∶50)定容,即得供试品溶液。
2.2.4 专属性考察 取mPEG-PLA 等辅料按照“2.1”项方法制备空白样品,按照“2.2.3”项方法制备空白样品溶液,另取根皮素对照品溶液、Phl@mPEG-PLA/NM 供试品溶液进样分析,色谱图见图1,结果表明辅料未对根皮素色谱峰产生干扰,理论塔板数以根皮素计不低于7500。
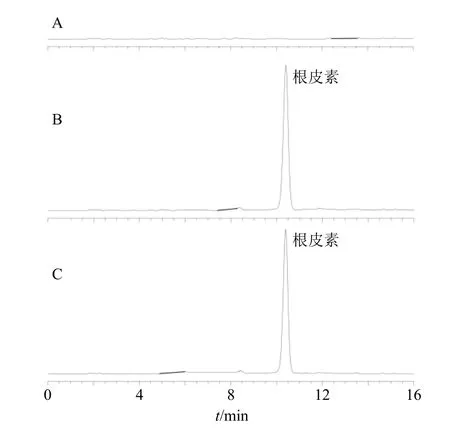
图1 空白辅料 (A)、根皮素对照品 (B) 和Phl@mPEGPLA/NM 样品溶液 (C) 的HPLC 图Fig.1 HPLC spectrum of blank excipients (A),phloretin reference substance (B) and Phl@mPEG-PLA/NM sample solution (C)
2.2.5 精密度试验 取0.05、1.00、10.00 μg/mL 的根皮素对照品溶液,连续测定6 次,计算得根皮素峰面积的RSD 分别为0.63%、0.19%、0.24%,结果表明仪器精密度良好。
2.2.6 稳定性试验 取Phl@mPEG-PLA/NM 供试品溶液,分别于制备后0、3、6、9、12、24 h 进样测定,计算得根皮素峰面积的RSD 为0.92%,结果表明供试品溶液在24 h 内稳定性良好。
2.2.7 重复性试验 取Phl@mPEG-PLA/NM,按“2.2.3”项方法平行制备6 份供试品溶液,进样测定,计算得根皮素质量分数的RSD 为1.30%,结果表明该实验重复性良好。
2.2.8 加样回收率试验 分别取 0.5 mLPhl@mPEG-PLA/NM 混悬液,共9 份,置于10 mL 量瓶中,分为3 组(低、中、高质量浓度组),分别加入质量浓度为0.5 mg/mL 的根皮素对照品溶液0.5、1.0、1.5 mL,制备供试品溶液。按“2.2.1”项色谱条件进样测定,计算根皮素加样回收率,结果显示,根皮素的平均加样回收率为101.06%,RSD 为1.50%,结果表明本实验准确度较高。
2.3 包封率、载药量及沉降率的测定[16-18]
取0.5 mL 的Phl@mPEG-PLA/NM 混悬液,按“2.2”项下方法测定载药胶束中总根皮素量(m总药量);另取Phl@mPEG-PLA/NM 0.5 mL 置于超滤离心管(截留相对分子质量为3000)中,12 000 r/min 离心(离心半径8.6 cm)8 min,HPLC 测定超滤管外液中根皮素游离药物量(m游离);取载药胶束直接冷冻干燥,称定质量(m总)。计算包封率和载药量。
包封率=(m总药量-m游离)/m总药量
载药量=(m总药量-m游离)/m总
沉降率用来衡量胶束的稳定性[18],是胶束重要指标之一。取新制备的纳米胶束(M新)置于温度为4 ℃冰箱中2 d,取适量于8000 r/min 离心(离心半径8.6 cm)10 min 分离析出药物,取离心液采用0.22 μm 的微孔滤膜滤过,并测定根皮素量(M2d),计算药物沉降率。
沉降率=(M新-M2d)/M新
2.4 纳米胶束粒径、多分散指数(polydispersity index,PDI)和ζ 电位测定
取Phl@mPEG-PLA/NM 适量,加入纯化水稀释40 倍,震荡混匀,置于激光粒仪中测定其粒径、PDI值和ζ 电位值。
2.5 Phl@mPEG-PLA/NM 制备工艺单因素研究
2.5.1 mPEG-PLA 用量考察 固定根皮素用量为10 mg,水化温度为40 ℃,水相体积为9 mL,水化时间为2 h,超声时间为10 min 等条件不变,分别考察mPEG-PLA 用量对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响。结果见表1,随着mPEG-PLA 用量的增加,包封率逐渐增加,用量达到100 mg 后包封率趋稳,说明载体载药基本达饱和状态,继续增加用量时导致载药量下降。胶束的沉降率呈明显的下降趋势,提示增加载体用量有助于提高纳米胶束的稳定性[15]。可见载体用量对纳米胶束影响较大,后续需对mPEG-PLA 用量继续进行优化。
表1 mPEG-PLA 用量对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 1 Effects of mPEG-PLA amounts on Phl@mPEGPLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)

表1 mPEG-PLA 用量对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 1 Effects of mPEG-PLA amounts on Phl@mPEGPLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
2.5.2 水化体积的考察 固定根皮素用量为10 mg,mPEG-PLA 用量为100 mg,水化温度为40 ℃,水化时间为2 h,超声时间为10 min 等条件不变,考察水化体积对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响。结果见表2,随着水化体积的增加,包封率和载药量先变大后下降。可能是水化体积较小时,mPEG-PLA 材料的舒展程度不足,且药物浓度过高,容易达过饱和状态,最终影响了载药。水化体积过大时,部分药物可进入水相,另一方面,mPEG-PLA 浓度下降,影响了载体的包载能力[12]。沉降率先减小后增大,说明水化体积也对胶束的稳定性产生一定影响。故后续需对水化体积进行优化。
表2 水化体积对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 2 Effects of hydration volume on Phl@mPEG-PLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
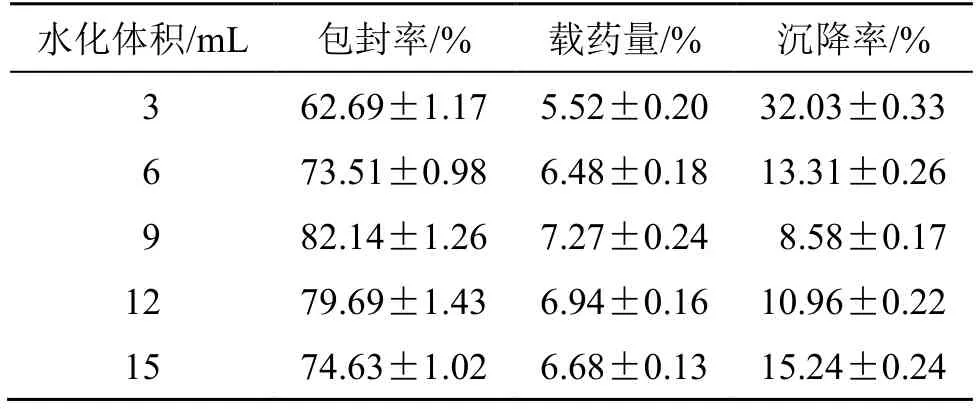
表2 水化体积对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 2 Effects of hydration volume on Phl@mPEG-PLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
2.5.3 水化温度的考察 固定根皮素用量为10 mg,mPEG-PLA 用量为100 mg,水化体积为9 mL,水化时间为2 h,超声时间为10 min 等条件不变,考察水化温度对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响。结果见表3。随着水化温度的升高,纳米胶束的包封率和载药量逐渐增加,说明适当提高水合温度利于mPEG-PLA 包载药物,但温度达到50 ℃时包封率、载药量开始下降,可能由于过高的温度影响mPEG-PLA 稳定性,进而影响包载药物,也可能对已形成的胶束产生破坏作用。水化温度对沉降率也有较大影响,故后续需对水化温度继续进行优化。
表3 水化温度对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 3 Effects of hydration temperature on Phl@mPEGPLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
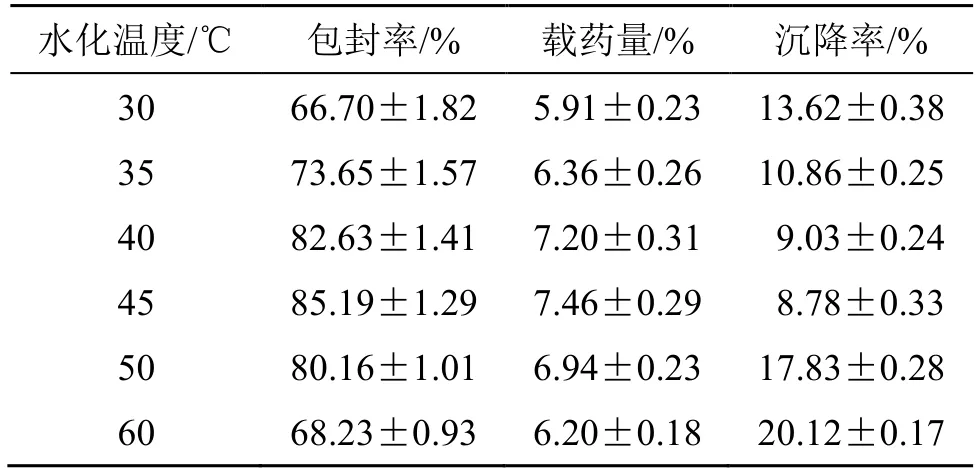
表3 水化温度对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 3 Effects of hydration temperature on Phl@mPEGPLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
2.5.4 水化时间 固定根皮素用量为10 mg,mPEGPLA 用量为100 mg,水化体积为9 mL,水化温度为45 ℃,超声时间为10 min 等条件不变,考察水化时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响。结果见表4。随着水化时间的增加,纳米胶束的包封率和载药量逐渐增加,说明适当增加水化时间对mPEG-PLA 包载药物产生积极影响,但水化时间达到4 h 时胶束的包封率和载药量均出现下降,沉降率上升。可能由于胶束是热力学不稳定体系,过长的水化时间可能对胶束产生破坏作用。由于水化时间为3 h 时,胶束包封率、载药量和沉降率均相对理想,故选之。
表4 水化时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 4 Effects of hydration time on Phl@mPEG-PLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)

表4 水化时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 4 Effects of hydration time on Phl@mPEG-PLA/NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
2.5.5 超声时间的考察 固定根皮素用量为10 mg,mPEG-PLA 用量为100 mg,水化体积为9 mL,水化时间3 h,水化温度为45 ℃等条件不变,考察超声时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响。由结果(表5)可知,过长的超声时间可能破坏纳米胶束结构,超声时间为12 min 时,胶束的各个指标均相对理想。
表5 超声时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 5 Effects of ultrasonic time on Phl@mPEG-PLA/ NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
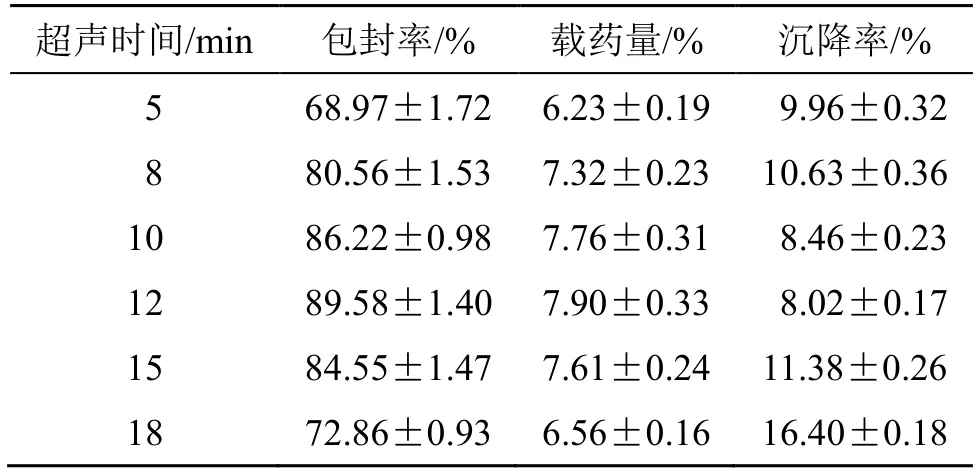
表5 超声时间对Phl@mPEG-PLA/NM 包封率、载药量和沉降率的影响 (,n=3)Table 5 Effects of ultrasonic time on Phl@mPEG-PLA/ NM encapsulation efficiency,drug loading and sedimentation rate (,n=3)
2.6 Box-Behnken 设计-效应面法优化处方工艺
2.6.1 试验设计 采用包封率、载药量和沉降率3个指标对Phl@mPEG-PLA/NM 处方工艺进行优化,并分别作为因变量Y1、Y2和Y3。根据“2.5”项单因素考察发现,mPEG-PLA 用量(X1)、水化体积(X2)和水化温度(X3)对该3 个指标影响较大,根据单因素考察结果确定各考察因素的水平见表6。
为综合反映包封率、载药量和沉降率3 个指标对处方工艺的影响,将该3 个指标作归一化处理,按照如下步骤计算总评归一值(overall desirability,OD)。包封率和载药量的计算公式为dmax=(Mi-Mmin)/(Mmax-Mmin);沉降率计算公式为dmin=(Mmax-Mi)/(Mmax-Mmin),公式中Mi为实际值,Mmin和Mmax分别为试验中最小值和最大值;将所得包封率和载药量的dmax及沉降率的dmin值带入OD=(d1d2…dk)1/k,k为指标数,即得各组试验的OD 值,结果见表6。
2.6.2 数学模型、显著性检查及结果 利用Design Expert V8.0.6软件对表6中数据进行多元回归拟合,得OD 方程为OD=0.970+0.060X1+0.029X2+0.068X3-0.048X1X2+0.088X1X3-0.087X2X3-0.290X12-0.130X22-0.580X32,R2=0.993 1,Radj2=0.984 3。显著性检查结果见表7,模型P值具有极显著性水平;失拟项为0.069 7>0.05,提示无显著性水平,因此,拟合得到的数学模型基本无干扰性。
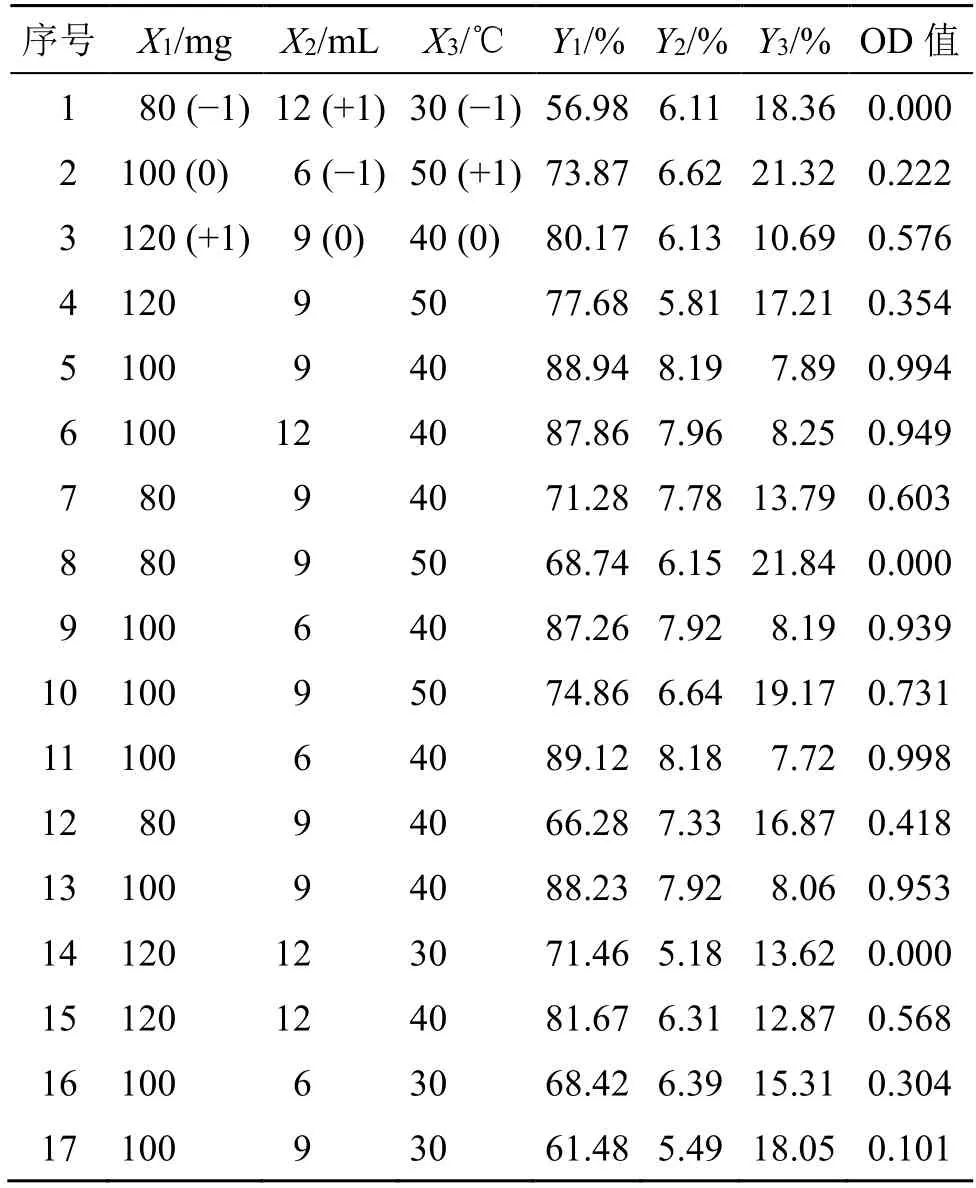
表6 Box-Behnken 设计-效应面法优化处方工艺的试验设计与结果 (n=3)Table 6 Experiments design and results of Box-behnken design-response surface method to optimize formulation process (n=3)
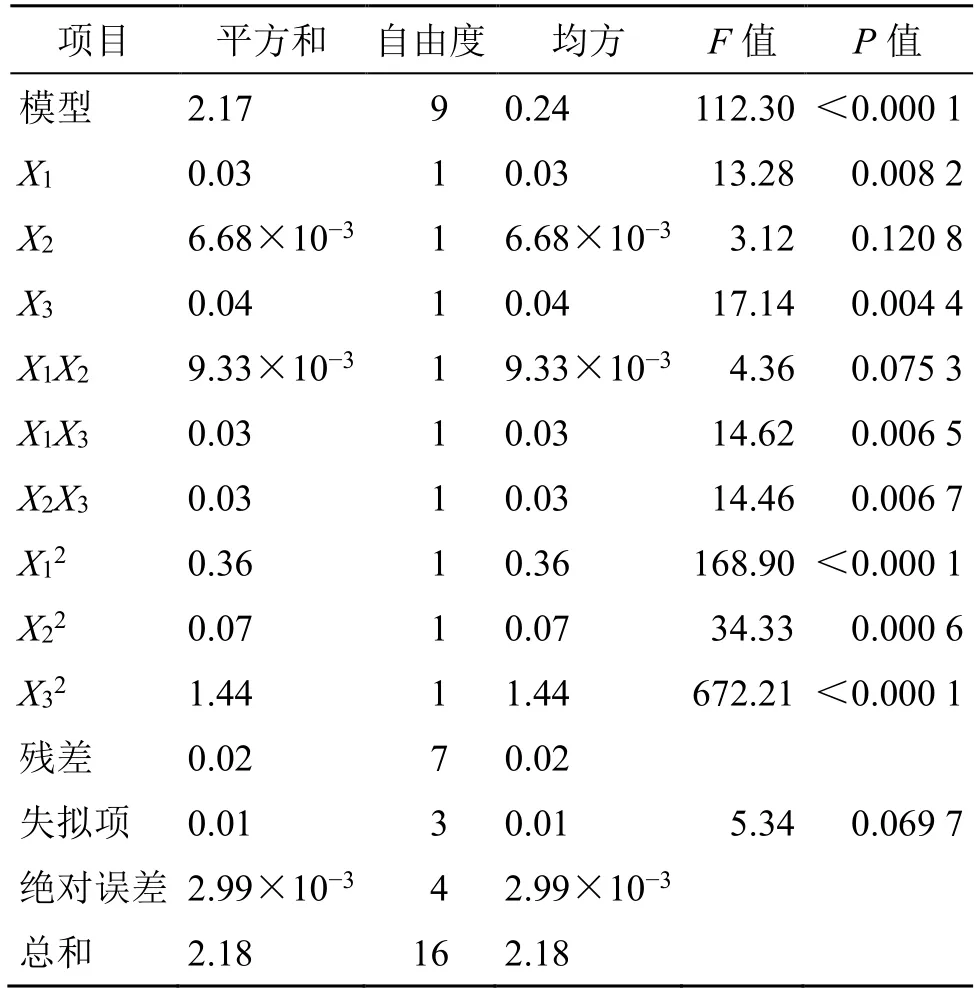
表7 方差分析 (OD 值)Table 7 Analysis of variance (OD values)
方差分析结果显示,X1、X3、X1X3、X2X3、X12、X22和X32均有统计学意义。各因素对响应值OD 的3D 响应面图见图2,Phl@mPEG-PLA/NM 最佳处方为mPEG-PLA 用量为104.09 mg、水化体积为9.21 mL、水化温度40.21 ℃,预测包封率为90.16%,载药量为9.04%,沉降率为7.79%。

图2 自变量 (X1,X2,X3) 与响应值 (OD) 的三维图Fig.2 Three-dimensional plot of independent factors (X1,X2,X3) and response values (OD)
2.7 工艺验证
为便于操作,将Phl@mPEG-PLA/NM 处方调整为mPEG-PLA 用量为105 mg、水化体积为9.5 mL、水化温度40 ℃。平行制备3 批纳米胶束并冻干,外观见图3,根皮素原料药混悬液可见不溶性药物颗粒及沉淀,但纳米胶束呈现透明的蓝色乳光,两者有明显差别,冻干粉外观均一饱满。测定各主要指标并计算偏差,公式为偏差=(预测值-实际值)/预测值,结果见表8。各指标的相对偏差均小于±5%,说明Box-Behnken 设计-效应面法优化Phl@mPEGPLA/NM 处方时具有重现性好、精确度高的特点。冻干粉复溶后测得平均粒径为(85.07±6.12)nm,PDI 为0.065±0.008,粒径分布见图4;平均ζ 电位为(-23.56±1.49)mV,ζ 电位见图5。

图3 Phl@mPEG-PLA/NM 外观Fig.3 Appearance of PHL-mPEG-PLA nanomicelles
表8 预测值和实际值的比较 (,n=3)Table 8 Comparison of predictive and actual value (,n=3)

表8 预测值和实际值的比较 (,n=3)Table 8 Comparison of predictive and actual value (,n=3)
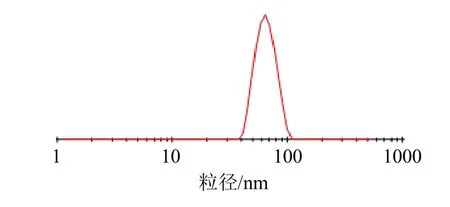
图4 Phl@mPEG-PLA/NM 的粒径分布Fig.4 Distribution diagram of particle size Phl@mPEGPLA/NM

图5 Phl@mPEG-PLA/NM 的ζ 电位Fig.5 Diagram of ζ potential of Phl@mPEG-PLA/NM
2.8 TEM 观察
采用纯化水将Phl@mPEG-PLA/NM 混悬液稀释40 倍,震荡混匀,吸取适量滴至铜网上,1.5%磷钨酸钠染色,室温自然晾干,置于TEM 下观察其外貌,结果见图6。可见,纳米胶束为类球形,无黏连现象。

图6 纳米胶束的TEM 图 (×14 000)Fig.6 TEM picture of nanomicelles (× 14 000)
2.9 体外释药及模型拟合
取根皮素原料药作为对照,加入无水乙醇溶解,取适量(使根皮素质量为10 mg)加入空白释药介质至4 mL,备用。取适量Phl@mPEG-PLA/NM 冻干粉适量(使根皮素质量为8 mg),加空白释药介质至4 mL 制备混悬液。分别置于活化的透析袋中,两端扎紧后置于温度为(37±1)℃、体积为1000 mL 的1.5%的SDS 水溶液中,于转速为75 r/min 条件下比较释药情况,于0.50、0.75、1.00、1.50、2.00、4.00、6.00、12.00、18.00、24.00、48.00、72.00 h 取样,取样量和补加空白释药介质均为3 mL。用0.22 μm 滤膜滤过后测定根皮素含量,结果见图7。根皮素在4 h 基本释放完全,但Phl@mPEG-PLA/NM 释药过程表现出一定的缓释特点,在6、12、24、72 h的累积释放率分别为27.03%、42.95%、63.17%、82.76%。纳米胶束体外释药模型拟合结果见表9,根据相关系数R2判断,Phl@mPEG-PLA/NM 体外释药过程与Higuchi 模型拟合程度最高,拟合方程为Mt/M∞=0.113t1/2+0.034。

图7 体外释放曲线 (,n=6)Fig.7 Release profiles in vitro (,n=6)

表9 药物释放模型和相关系数Table 9 Fitting release model and coefficient
2.10 冻干粉稳定性考察
取Phl@mPEG-PLA/NM 冻干粉置于恒温恒湿箱中(温度30 ℃,湿度65%),于0、15、30、45、60、90 d 取样测定复溶后包封率、粒径及沉降率,结果见表10。冻干粉在90 d 内包封率和粒径基本维持不变,说明稳定性较高。
表10 稳定性考察 (,n=3)Table 10 Study of stability (,n=3)

表10 稳定性考察 (,n=3)Table 10 Study of stability (,n=3)
2.11 药动学研究
2.1 1.1 药动学研究方案 取12 只健康SD 大鼠(雌雄兼具),分为根皮素原料药和Phl@mPEG-PLA/NM 2 组,自由饮水但禁食12 h。按60 mg/kg 分别进行ig 给药,分别于10、15、30 min 及1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0 h 于眼眶后静脉丛取血约250 μL,至离心管中(肝素浸润),震荡混匀,3500 r/min 离心(离心半径8.6 cm)4 min,取上层淡黄色血浆,冷冻保存。
2.1 1.2 血浆样品的处理[19]室温下解冻血浆样品,精密吸取100 μL 至空白离心管中,加入50 μL地塞米松内标溶液(1000 ng/mL)、100 μL 甲醇和1 mL 醋酸乙酯,涡旋5 min 后超声30 s,8000 r/min离心(离心半径8.6 cm)5 min。取上清液于40 ℃水浴中氮气缓慢吹干,加入100 μL 甲醇复溶后8000 r/min 离心5 min,取上清液测定。
2.1 1.3 溶液的配制及线性关系考察 采用甲醇配制浓度为1000 ng/mL 的地塞米松对照品溶液,作为内标溶液。用甲醇配制质量浓度为1.6 μg/mL 的根皮素对照品溶液,并稀释至1600、800、400、100、50、25 ng/mL,分别取200 μL,40 ℃水浴中氮气缓慢吹干,加入200 μL 空白血浆,涡旋5 min 后超声30 s。按“2.11.2”项方法处理,即得根皮素血浆对照品溶液(含内标),以根皮素与地塞米松峰面积比为纵坐标(y),质量浓度为横坐标(x),得回归方程y=0.014 6x+0.500 6,r=0.995 8,结果表明根皮素线性范围为25~1600 ng/mL。
2.1 1.4 方法学考察 取空白血浆、血浆对照品(根皮素质量浓度为400 ng/mL)和血浆样品溶液(根皮素原料药ig 给药4 h)分别进样,结果见图8,血浆内源性物质不干扰根皮素和地塞米松的色谱峰,专属性高。

图8 空白血浆 (A)、血浆样品 (B) 和血浆对照品溶液 (C)的HPLC 图Fig.8 HPLC of blank plasma (A),plasma sample (B),plasma reference solution (C)
取25、400、1600 ng/mL 的根皮素血浆对照品溶液,同1 d 内连续测定6 次,计算得根皮素与地塞米松峰面积比值的RSD 分别为6.17%、5.02%、3.90%,结果表明日内精密度良好;于6 d 内分别进行测试,计算得根皮素与地塞米松峰面积比值的RSD 分别为8.23%、4.73%、5.45%,结果表明日间精密度良好。
取血浆样品溶液于0、2、4、8、12、24 h 进样测试,计算得根皮素与地塞米松峰面积比值的RSD为7.91%,结果表明稳定性良好。
取25、400、1600 ng/mL(低、中、高质量浓度)的根皮素血浆对照品溶液,每个质量浓度均3 份,进样测试根皮素与地塞米松峰面积比值,带入血浆对照品标准曲线计算根皮素的测得含量,并与实际含量比较,计算得3 种质量浓度下的平均回收率为94.16%,RSD 为8.82%,可见本实验的准确度较高。
2.1 1.5 药动学结果 药-时曲线见图9,血药浓度数据用DAS 2.0 软件非房室模型对数据进行分析,主要药动学参数见表11。与根皮素原料药混悬液的主要药动学参数tmax、t1/2、Cmax、AUC0~t等药动学参数相比,Phl@mPEG-PLA/NM 主要药动学参数发生显著变化(P<0.05、0.01)。Phl@mPEG-PLA/NM 将根皮素的tmax延后至(2.04±0.42)h,且t1/2增加至(4.60±0.84)h。且Cmax增加至2.82 倍,说明mPEGPLA 纳米胶束极大促进了根皮素的口服吸收,相对口服生物利用度提高至3.34 倍。

图9 药-时曲线 (,n=6)Fig.9 Profiles of plasma concentration-time (,n=6)
表11 主要药动学参数 (,n=6)Table 11 Main pharmacokinetic parameters (,n=6)
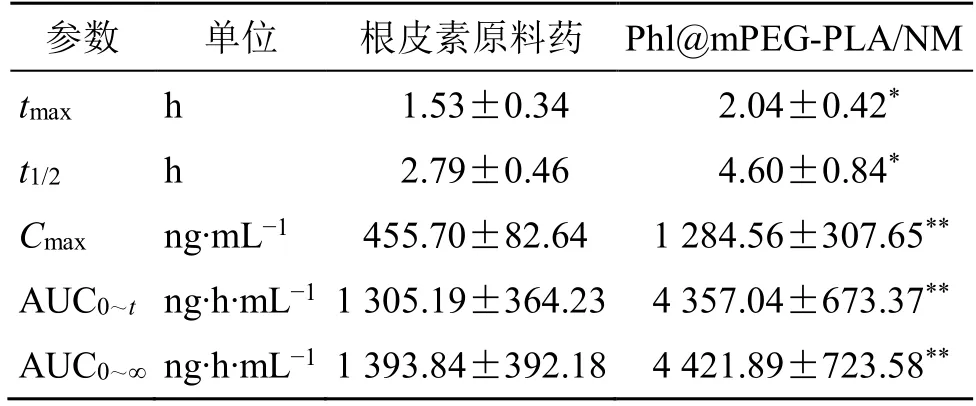
表11 主要药动学参数 (,n=6)Table 11 Main pharmacokinetic parameters (,n=6)
与根皮素原料药比较:*P<0.05 **P<0.01*P < 0.05 **P < 0.01 vs phloretin drug substance
3 讨论
mPEG-PLA 作为两亲性高分子材料,在水相中的浓度超过临界胶束浓度后可形成纳米胶束,可提高药物的溶解度、溶出度及生物利用度[10,20],制备方法简单。本研究报道的Phl@mPEG-PLA/NM 无需使用表面活性剂,减少了辅料种类,避免了潜在的毒副作用及不良反应。
纳米胶束常用的制备方法有溶剂挥发法、薄膜分散法等,但薄膜分散法制得胶束的包封率和载药量较高[21-22]。可能是由于通过薄膜分散法可使药物与载体充分融合、接触,使疏水性药物更易被聚合物中疏水性链段缔合、包裹从而形成胶束[17]。溶剂挥发法需加热搅拌除去有机溶剂,可能会影响聚合物材料的稳定性,而且也可能存在溶剂残留问题。Phl@mPEG-PLA/NM 体外释药具有一定的缓释特点,这可能是由于根皮素分子结构中活泼性基团与聚合物载体基团之间,形成了某种作用力(如氢键等)[22-23],使药物从胶束的内核扩散至释药介质阻力较大所致。
一室模型与二室模型拟合结果均不理想,故最终采用了基于统计矩理论的非房室模型进行计算。Phl@mPEG-PLA/NM 的tmax延后至(2.04±0.42)h,可能是由于Phl@mPEG-PLA/NM 粒径较小,极易吸附于胃肠道中延缓了入血速度[24],另外胶束载体材料的阻滞作用也可能对tmax产生影响。纳米胶束的t1/2得到延长,说明增加了药物在体内的血药浓度水平,有助于提高生物利用度。
Phl@mPEG-PLA/NM 的口服相对生物利用度提高至3.34 倍,可能是由于根皮素包裹进mPEGPLA 胶束内核后药物的亲水性得到提高,有利于与肠道亲水性黏液层接触,进而利于药物吸收;纳米胶束可增加药物肠道渗透吸收[25-26];药物的粒径得到极大下降,利于溶解度的提高及与胃肠道充分接触[27-28];mPEG-PLA 表面的mPEG 接枝可避免网状内皮系统吞噬[10,29],增加体循环时间,因而最终提高了根皮素的口服吸收生物利用度。本研究完成了Phl@mPEG-PLA/NM 制备工艺及口服药动学评价,将来继续对注射药动学、药效学进行研究,为该制剂提供更为完整的研究资料。
利益冲突所有作者均声明不存在利益冲突
