转录组分析在血液样本时间和供体特征刻画中的应用研究
2023-02-08张瑾刘开会张颖郝金萍张广峰徐小玉畅晶晶刘兴朋杨雪莹叶健
张瑾,刘开会,张颖,郝金萍,张广峰,徐小玉,畅晶晶,刘兴朋,杨雪莹,叶健
转录组分析在血液样本时间和供体特征刻画中的应用研究
张瑾1,2,刘开会2,张颖2,郝金萍2,张广峰2,徐小玉2,畅晶晶2,刘兴朋3,杨雪莹2,叶健1,2
1. 中国人民公安大学,北京 100038 2. 公安部鉴定中心,北京 100038 3. 瑞金市公安局,瑞金 342500
案件现场生物物证信息深度挖掘与刻画,可以为案件侦查、涉案人员查找提供丰富可靠线索,是当前法医DNA检验的有效补充,也是国内外法庭科学的研究热点之一。本研究以血液样本为研究对象,证实了0~168天内离体血液样本转录组变化的时间相关性,并建立随机森林模型实现不同离体时间血液样本分类。同时,进一步证实相同离体时间段内,不同吸烟习惯和不同性别供体来源的血液样本转录本具有显著差异,、和可以作为供体吸烟习惯判别标志,Y染色体非重组区(non-recombining Y, NRY)的转录本和可以作为供体性别特征判别标志。本研究为法庭科学领域建立基于转录组分析的血液样本遗留时间和供体特征刻画方法提供了理论基础和实验依据。
法庭科学;血液;遗留时间;吸烟习惯;性别
案件现场生物样本是应用最为广泛的物证种类之一,可以为案发过程重建、涉案人员查找提供重要线索。随着生命科学技术和理论研究的不断发展,生物物证核酸深度解析为涉案人员个体识别和亲权鉴定提供了重要技术手段,如目前DNA STR分析已经成为对涉案人员进行比对的金标准[1,2]。面对案件复杂程度和犯罪手段的不断“升级”,深入发掘物证信息,提升物证证据能力和证明力,已经成为法庭科学和公安技术发展的新趋势。通过包括种族、身高、肤色、发质、骨骼、面部特征等在内的生物物证供体特征分析刻画[3],供体的香烟、毒品、药物等摄入习惯刻画[4],供体生活时空信息刻画[5],以及生物物证遗留时间刻画[6],可以为案件侦办提供更为直接、可靠、全面的侦查线索,为涉案人员的主动查找提供技术手段。
生物物证遗留时间(time since deposition, TSD)推断,因其在案发时间分析、犯罪过程重建、犯罪主体甄别中的重要作用,近年来备受国内外法庭科学瞩目。研究人员应用免疫电泳[7]、光学检验[8~15]、RNA降解程度分析[16~24]、DNA降解程度分析[25~27]、外源性核酸变化分析[28]等不同技术手段,从生物斑迹蕴含的蛋白质、核酸、微生物等不同角度,开展了生物斑迹遗留时间、生物节律等时间信息关联关系和预测方法研究。已有研究证实,离体血液样本转录本丢失具有时间相关性[29]。本研究收集制备了不同离体时间血液样本,考察了血液转录组在不同离体时间段的变化情况,并分析比较了血液转录组在供体性别、吸烟习惯特征中的差异,证实了血液转录组在血液离体时间、供体吸烟习惯和供体性别分析鉴定中的应用潜力,为血液样本时间和供体特征刻画提供方法。
1 材料与方法
1.1 实验样本采集与制备
采集无关健康汉族志愿者(男性10人,女性10人)外周血液样本,EDTA抗凝处理后,在EDTA抗凝管中置于4℃恒温密闭保存,于不同取样时间点收集样本检测,取样时间点包括新鲜采集(D0)和离体保存0.5天(D0.5)、1天(D1)、2天(D2)、4天(D4)、7天(D7)、14天(D14)、21天(D21)、28天(D28)、56天(D56)、84天(D84)、112天(D112)、140天(D140)、168天(D168)。实验样本分组和组内样本数量见表1。本研究获得公安部鉴定中心伦理委员会批准,所有志愿者均签署知情同意书。
1.2 转录组测序
应用TRIzolTMReagent (Thermo Fisher, 美国)按照说明书方法分离纯化血液样本总RNA[30],使用Ribo-ZeroTMrRNA Removal Kit (Illumina, 美国)去除核糖体RNA后,使用NEBNext®Magnesium RNA Fragmentation Module (New England Biolabs, 美国)将RNA打断至250~300 bp大小的片段,使用M-Mulv reverse transcriptase system (Thermo Fisher, 美国)反转录为cDNA,应用Agencourt AMPure XP (Backman Coulter, 美国)富集250~300 bp大小的cDNA片段,使用NEBNext®UltraTMRNA Library Prep Kit (New England Biolabs, 美国)构建文库,在Novaseq 6000 Sequencing System (Illumina, 美国)测序平台上进行150 bp双端测序[31,32]。下机raw data去除接头、含N reads和低质量reads后获得clean data,计算Q20(测序错误率<1%的序列百分比)、Q30(测序错误率<0.1%的序列百分比)。选用Hisat2 v2.0.4进行参考基因组(_Ensembl_97)定位[33,34]。选用HTSeq v0.9.1计算转录本FPKM (expected number of fragments per kilobase of transcript sequence per millions base pairs sequenced),即每百万fragments中来自某一基因每千碱基长度的fragments数目[35,36]。
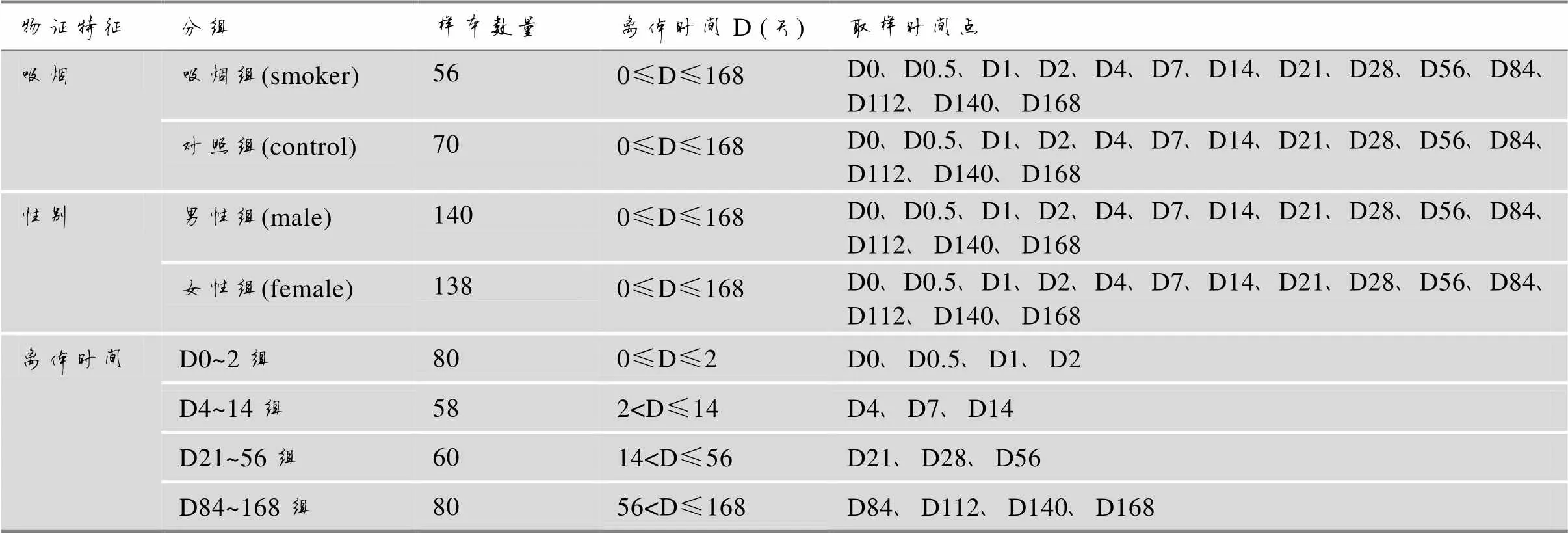
表1 实验样本分组
吸烟组(smoker)及其对照组(control)样本均来源于男性志愿者,入组吸烟组的志愿者均自述近2年有吸烟习惯、每日吸烟5支以上,入组对照组的志愿者均自述近2年无吸烟习惯;男性组(male)、女性组(female)、吸烟组(smoker)及其对照组(control)样本均包含4℃恒温密闭保存0~168天的样本。
1.3 统计分析
使用Novomagic平台(https://magic.novogene.com)进行主成分分析(principal component analysis, PCA)和差异转录本分析。使用Microsoft Excel 2010进行相对表达比(relative expression ratio, RER)计算、相对表达比分布分析和FPKM分布分析。使用Graphpad 5.0进行置信区间(confidence interval, CI)统计。
1.4 随机森林模型构建
使用R软件randomForest包构建随机森林模型,使用pROC包计算AUC值,通过important函数得到MDA(mean decrease accuracy)排序[37~39]。
2 结果与分析
2.1 测序质量与数据
各组样本合计278个,均成功构建文库并获得转录组测序数据,raw reads、clean reads、Q20和Q30统计见表2。278个样本平均获得57 849 014.65条raw reads和56 644 226.98条 clean reads,碱基≥Q30占比平均为94.83%,比对到参考基因组的平均比对率为97.28%。
2.2 供体特征相关差异转录本
PCA可以应用方差分解提取数据的主要元素和结构,样本转录组结构越相似,在PCA图中的距离越接近,反之则距离越远[40]。本研究应用主成分分析,考察不同离体时间血液样本组间差异,结果表明,随着血液样本离体时间延长,样本组间转录组差异逐渐增大,而同一时间段组内样本则具有相近的转录组结构(图1A)。同时,在针对吸烟组和对照组以及男性组和女性组的PCA分析中,样本呈现与不同离体时间组相似的分布规律和形态,但并未表现出与吸烟特征或性别特征相关的分布差异(图1,B和C)。这提示离体血液样本转录组变化具有时间相关性,并且与吸烟和性别特征相比,时间特征对血液样本转录组结构差异影响更为显著,可以根据转录组结构差异刻画血液样本离体时间。
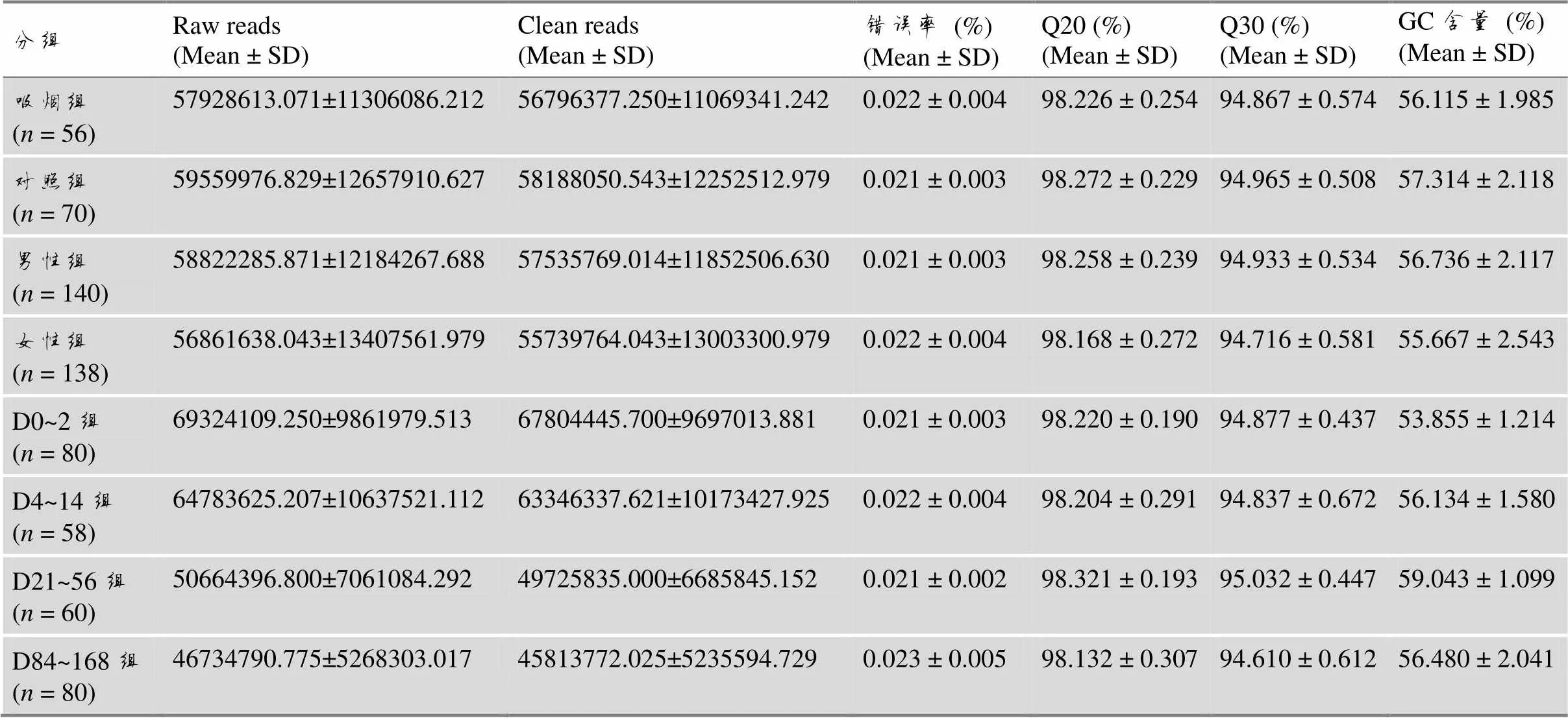
表2 测序质量与数据
根据不同离体时间血液样本的分布特征,本研究进一步考察了相同离体时间下吸烟习惯和性别特征对血液样本分布的影响。结果表明,在离体时间相同的血液样本中,吸烟组与对照组样本在0~2天、4~14天、21~56天时间段均呈现出不同程度的分散分布(图1,D~G),男性组与女性组也在0~2天、4~14天、21~56天、84~168天时间段分别呈现出不同程度的分散分布(图1, H~K),提示血液样本转录组中可能存在可以用于吸烟习惯和性别特征判别的标志转录本。
通过差异表达分析,在吸烟组中发现差异转录本25个,其中上调差异转录本14个,下调差异转录本11个(图2A,表3)。参考文献[16],根据以下方法计算差异转录本(differential expressed transcripts)与管家基因(house-keeping genes)和的相对表达比:
RER=FPKMdifferential expressed transcripts/
FPKMhouse-keeping genes
比较发现,上调转录本、和下调转录本与管家基因、的相对表达比(RER/ACTB、RER/GAPDH、RER/ACTB、RER/ACTB和RER/GAPDH)在吸烟组和对照组样本中具有不同的分布区域(图3),可以作为样本是否具有吸烟特征的判别标志。
同时,在女性样本与男性样本的差异表达分析中,共有差异转录本1577个(上调差异转录本1049个,下调差异转录本528个)(图2B)。进一步分析差异转录本在基因组中的定位,定位于X染色体的差异转录本有65个,定位于Y染色体的差异转录本有18个,其中有7个转录本位于Y染色体非重组区(non-recombining Y, NRY)(表4),这些转录本具有单倍体遗传特性,可以用于男性性别鉴定[41]。对这些NRY转录本在男性、女性血液样本中的FPKM进行统计,结果表明,NRY转录本在女性样本中FPKM值均小于1,多数女性样本中FPKM值为0(图4),可以应用NRY转录本的FPKM值进行性别特征判断。
2.3 供体特征综合分析
PCA结果表明,离体血液样本转录组呈现不同离体时间段的分散分布。本研究应用随机森林算法,随机抽取70%的样本作为训练集,建立了不同离体时间血液样本分类模型。交叉验证结果表明,当mtry取值11、ntree取值900时,错误率最低,最低为5% (图5A),此时,根据MDA排序,获得11个重要特征变量(表5)。同时绘制ROC (receiver operating characteristic)曲线,计算ROC曲线下面积AUC (area under curve),通常情况下,它的值介于1.0和0.5之间,当 AUC>0.5时,AUC越接近于1,模型分类预测性能越好。本研究建立的模型中,D0~2、D4~14、D21~56和D84~168各组样本可以根据转录本FPKM很好区分(AUC>0.75),其中D21~56和D84~168组间可能存在少量误判(AUC = 0.765),与PCA分析结果一致(图6,图1A)。在剩余30%的样本中进行测试,D0~2、D4~14、D21~56和D84~168各组分类正确率分别为92.31%、85.71%、76.92%和100% (表7;图5,B和C),表明基于血液样本转录组的随机森林模型可以有效实现不同离体时间血液样本分类,为血液样本离体时间刻画提供方法。
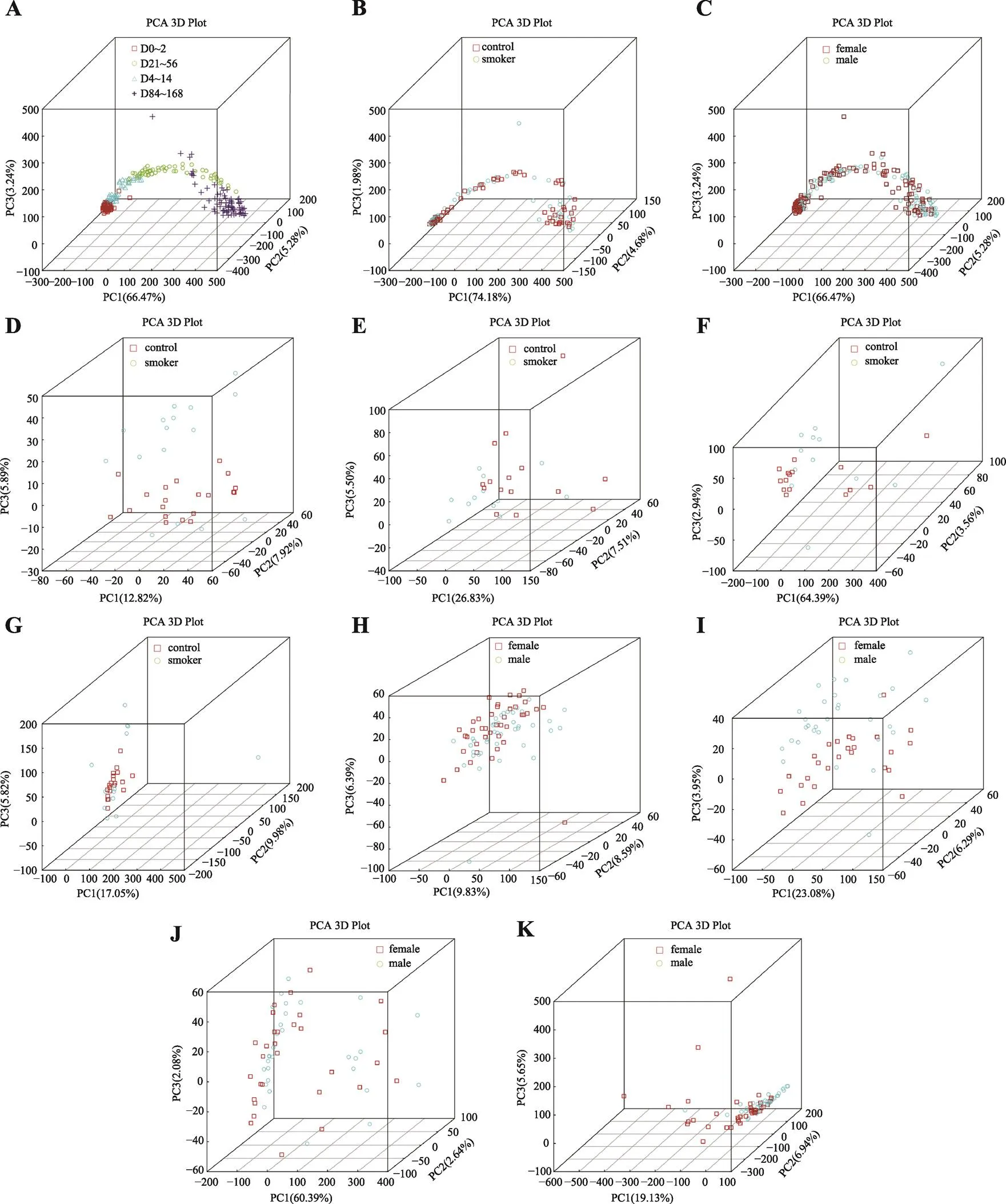
图1 主成分分析中的血液样本分布
A:不同离体时间(0~2天、4~14天、21~56天和84~168天)血液样本分布;B:0~168天时间段吸烟组(smoker)及对照组(control)血液样本分布;C:0~168天时间段男性组(male)及女性组(female)血液样本分布;D:0~2天时间段吸烟组(smoker)及对照组(control)血液样本分布;E:4~14天时间段吸烟组(smoker)及对照组(control)血液样本分布;F:21~56天时间段吸烟组(smoker)及对照组(control)血液样本分布;G:84~168天时间段吸烟组(smoker)及对照组(control)血液样本分布;H:0~2天时间段男性组(male)及女性组(female)血液样本分布;I:4~14天时间段男性组(male)及女性组(female)血液样本分布;J:21~56天时间段男性组(male)及女性组(female)血液样本分布;K:84~168天时间段男性组(male)及女性组(female)血液样本分布。坐标轴分别表示第一、第二、第三主成分,百分比则表示该主成分对样品差异的贡献值;图中的每个点表示一个样品,同一个组的样品使用同一种颜色表示。
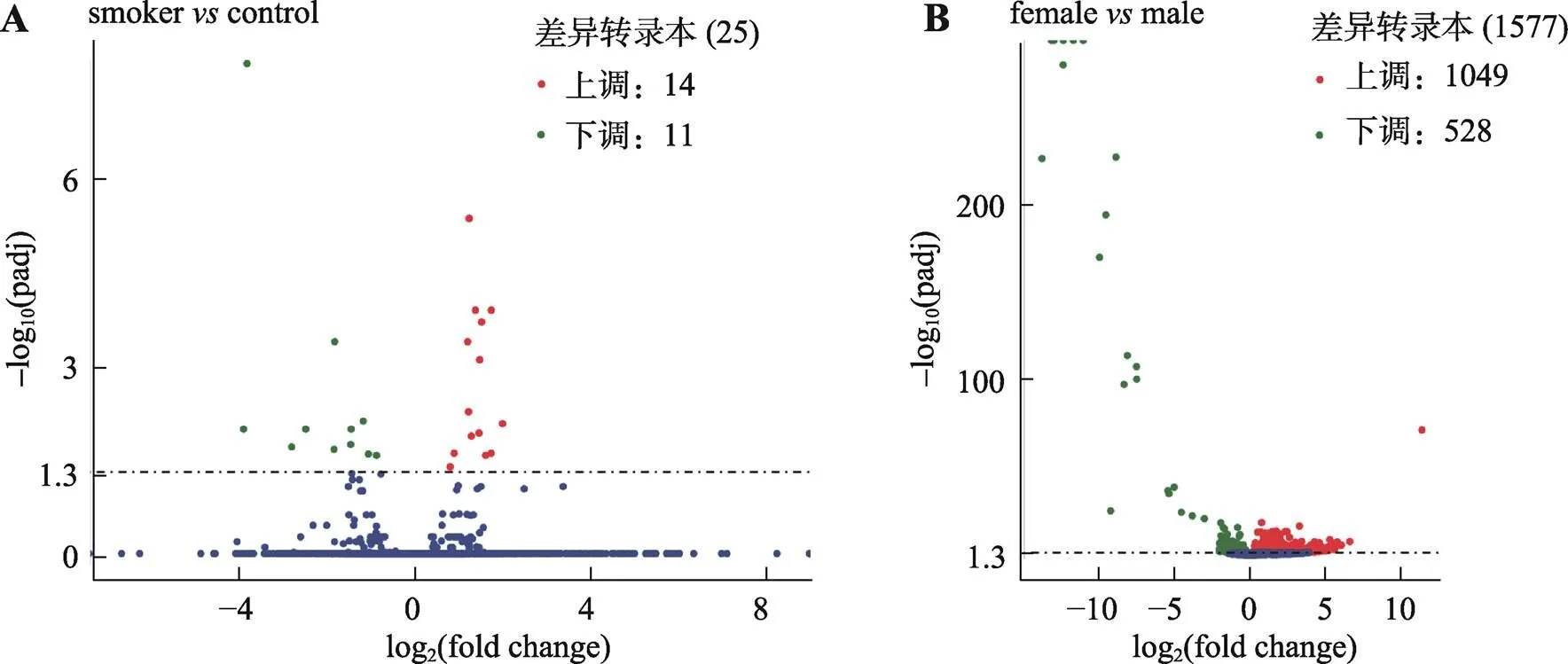
图2 供体特征相关差异转录本
A:吸烟组(smoker)及对照组(control)差异分析火山图;B:男性组(male)及女性组(female)差异分析火山图。有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示;横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性(|log2foldchange| > 0.5,-adjusted < 0.05)。
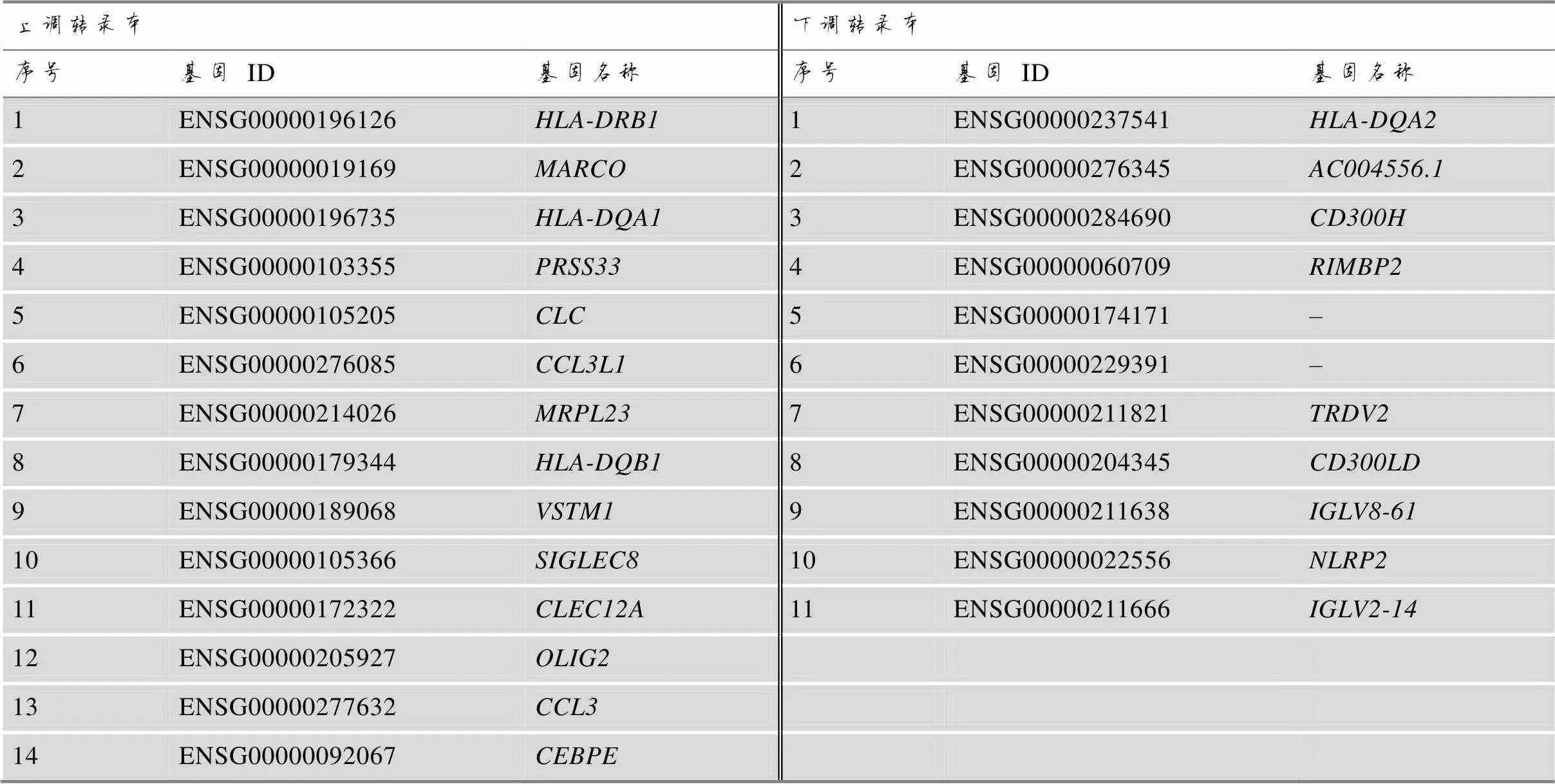
表3 吸烟特征相关差异转录本
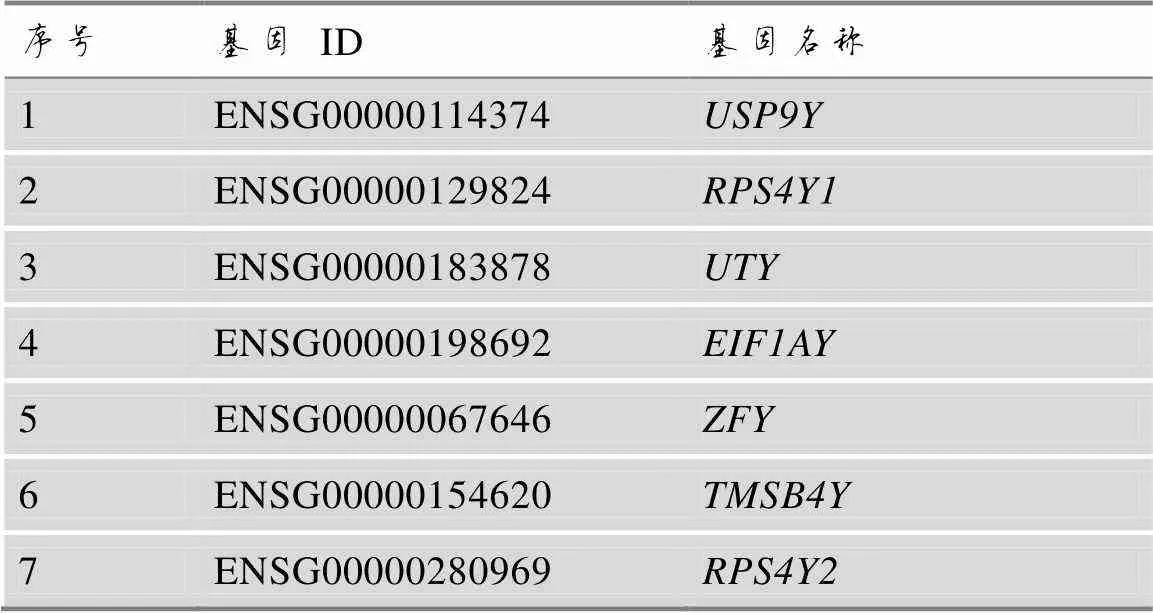
表4 位于Y染色体非重组区的差异转录本
根据吸烟特征差异转录本与管家基因相对表达比分布,本研究选择、和作为吸烟特征判别标志,计算吸烟组及其对照组血液样本、和与管家基因和的相对表达比(RER/ACTB、RER/GAPDH、RER/ACTB、RER/ACTB和RER/GAPDH),分别统计得出吸烟组和对照组基因相对表达比的置信区间,以≥lower 95% CI[上调转录组本(和)]和≤upper 95% CI[下调转录本()]作为“吸烟”特征的判断标准,以≤upper 95% CI[上调转录组本(和)]和≥lower 95% CI[下调转录本()]作为“不吸烟”特征的判断标准(表6)。随机抽取10%样本进行五次十折交叉验证,正确率最高为92.31%、最低为46.15%,其中,RER/ACTB、RER/GAPDH和RER/ACTB五次交叉验证平均正确率高于70%,具有较好的实践参考意义(表7)。
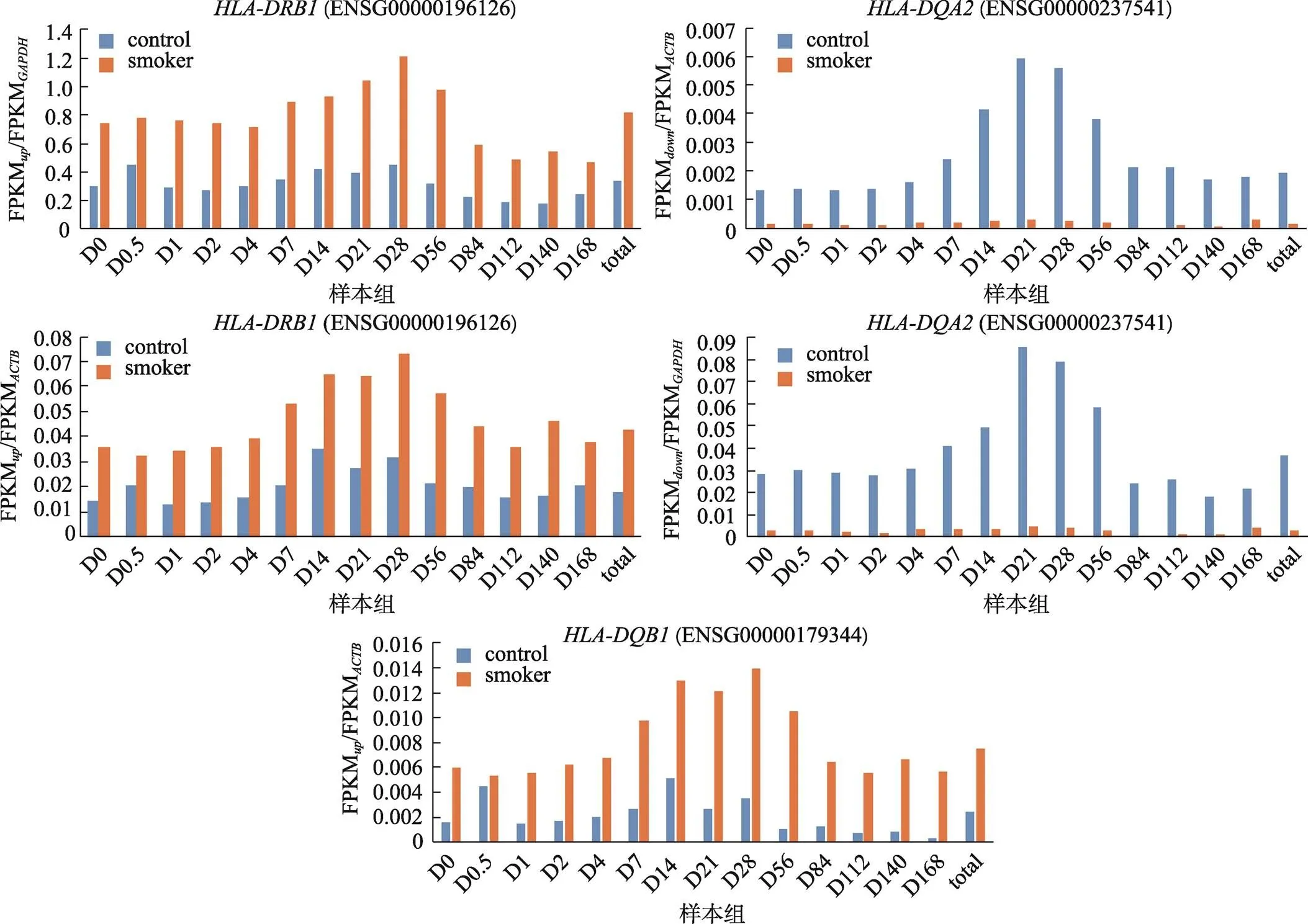
图3 吸烟特征判别标志转录本与管家基因相对表达比分布图
3个吸烟特征判别标志转录本与管家基因相对表达比在对照组和吸烟组分布区域不同;蓝色代表对照组(control)样本相对表达比,黄色代表吸烟组(smoker)样本相对表达比;D0~D168分别代表离体时间为0~168天的样本FPKM平均值的相对表达比,total代表所有不同离体时间样本FPKM平均值的相对表达比。
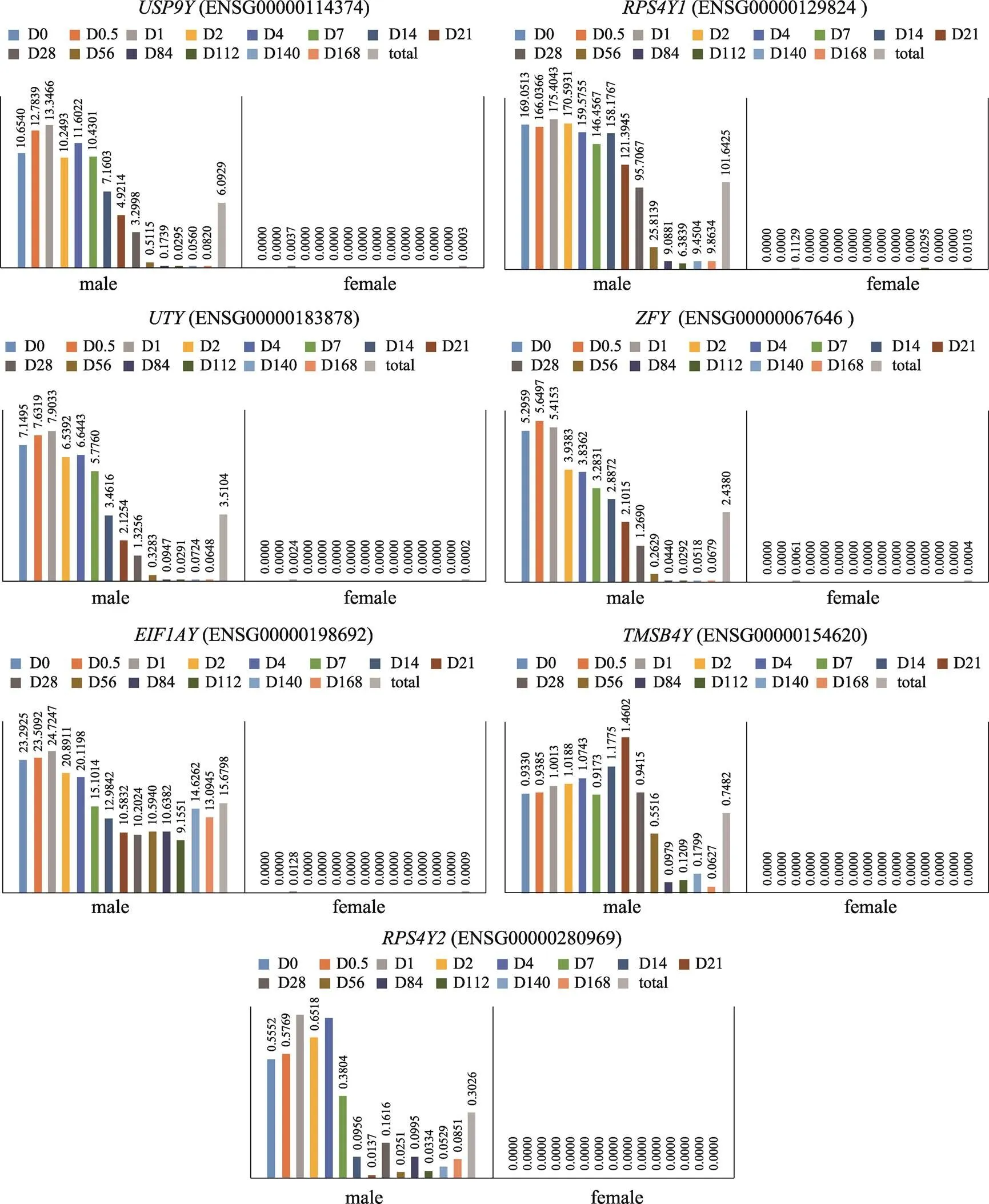
图4 位于Y染色体非重组区基因FPKM分布
Male和female分别代表男性组和女性组;D0~D168分别代表离体时间为0~168天的样本FPKM平均值,total代表所有不同离体时间样本FPKM平均值。
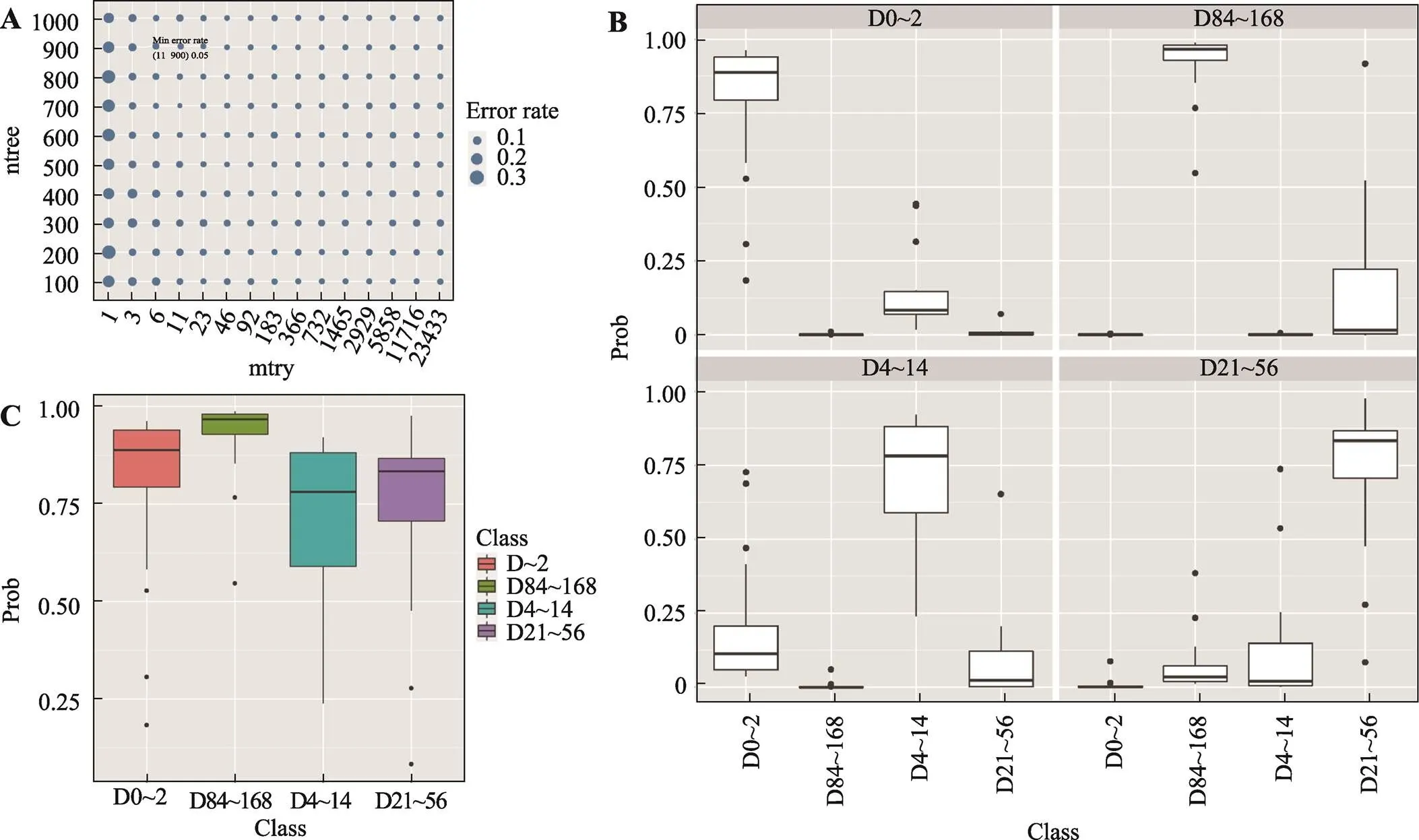
图5 随机森林模型错误率分布与交叉验证
A:随机森林模型错误率分布矩阵图;B:测试集各分组预测概率箱形图;C:测试集的预测概率箱形图。测试集的预测概率值(Prob)即为在不同分组的可能性,可能性最高的分组即为模型对该样本的分类分组,当分类分组与样本真实分组一致是,分类结果视为正确。

表5 随机森林模型11个重要特征转录本
根据NRY转录本FPKM分布特征,本研究选择在不同离体时间男性样本中FPKM平均值均≥1的转录本和作为性别特征判别标志,分别以FPKM≥1和FPKM<1作为男性和女性判断依据,随机抽取样本进行5次十折交叉验证,正确率均为100% (表7)。
3 讨论
生物物证是案件现场最为常见的物证之一,不仅可以通过法医DNA STR检验为涉案相关个体识别、亲子鉴定等提供重要线索,还蕴含着RNA、DNA和微生物等更为丰富的生物分子信息,可以为供体特征[3,42]、组织来源[43~47]、生活习惯[4,6]、年龄推断[48]、时空信息[5]等的分析与刻画提供重要依据。其中,在生物物证离体时间推断领域,已有研究证实离体生物样本中核酸降解变化具有时间相关性,并应用嵌套方差分析、逻辑回归、一元二次回归等模型建立了基于RNA降解的血液样本离体时间分析方法。但由于样本数量、观测时间有限,以及DNA本身在较长时间内的稳定性[49]、分子标记相对单一等,尚未建立确切的现场生物斑迹遗留时间分析方法。
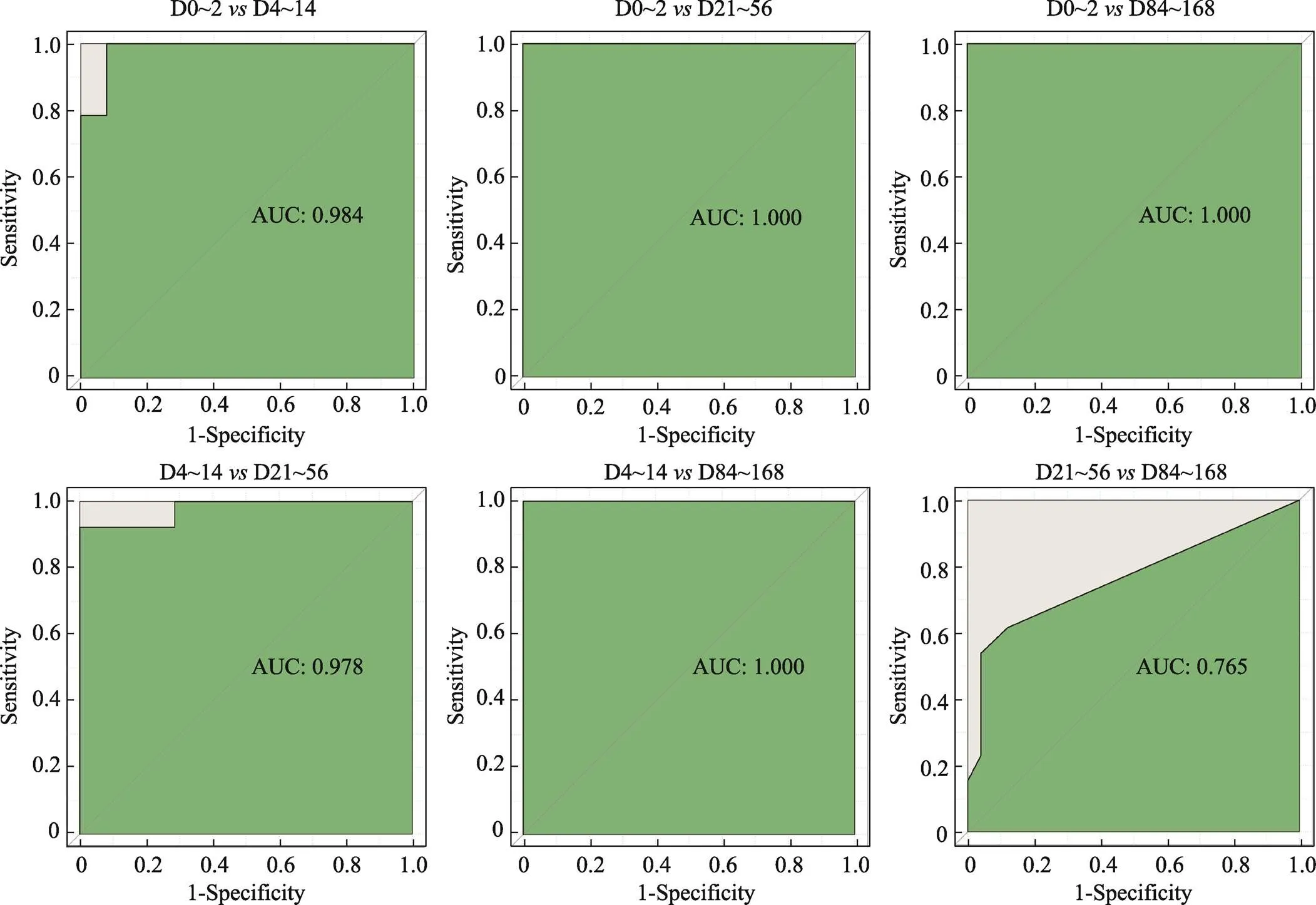
图6 随机森林模型ROC曲线及AUC值
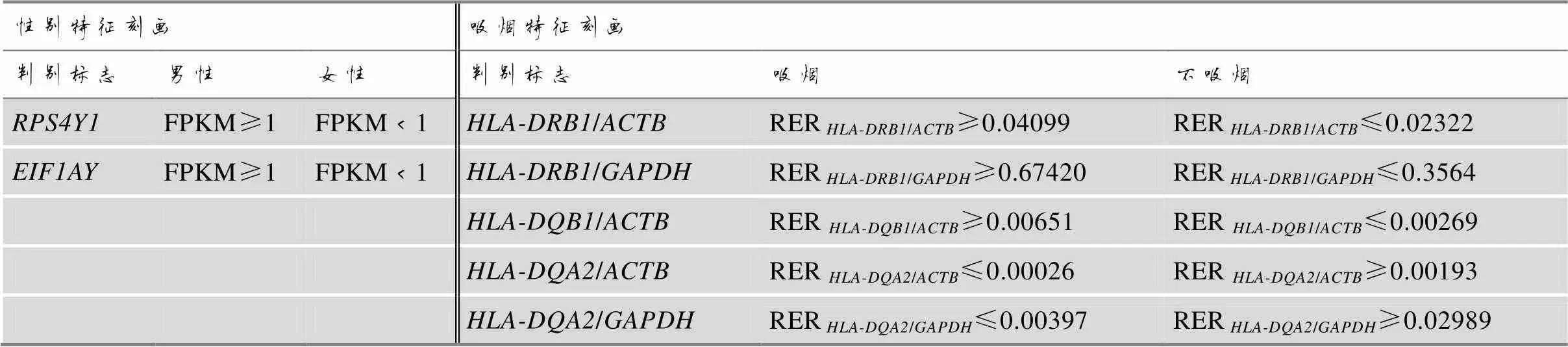
表6 特征判别标志及判别阈值
随着RNA检测技术的发展,研究人员认为,获得更多的RNA标志片段,有望提升血液斑迹离体时间分析准确率,可以为建立血液斑迹时间分析方法提供更为可靠的基因信息。Katelyn等[29]应用转录组测序技术,证实血液样本转录本丢失的时间相关性,并筛选出、、、作为目的片段,应用荧光定量PCR技术分别检测其3′端和5′端含量变化,建立了基于、、3′端、5′端片段Cq值差值的离体时间线性回归方程,在8份离体时间不超过1年的血液斑迹中测试,遗留时间推断误差不超过6周[24]。本研究同样应用转录组测序技术,证实了随离体时间延长,血液样本中可检测到的转录本(FPKM>1)数量下降且大量转录本的丰度呈现下降趋势,与文献报道一致。在此基础上,本研究基于主成分分析进一步证实了离体血液样本转录组变化的时间相关性,并应用随机森林模型,在血液样本中较好的实现以离体时间为要素的样本分类(AUC>0.75),同时发现、、、、、、、、、、等11个基因在随机森林分类中贡献度高,可能成为血液样本离体时间分析的潜在基因标志。同时,本研究针对这些贡献度高的转录本进行功能聚类分析,并未获得具有统计学意义(<0.05)的功能通路,因此,这些转录本随离体时间延长丰度下降且在模型分类中表现出更高的贡献度,可能与已知的基因自身功能关联较小,是否由mRNA降解方式[50]或组织降解相关功能导致,还需开展深入研究。
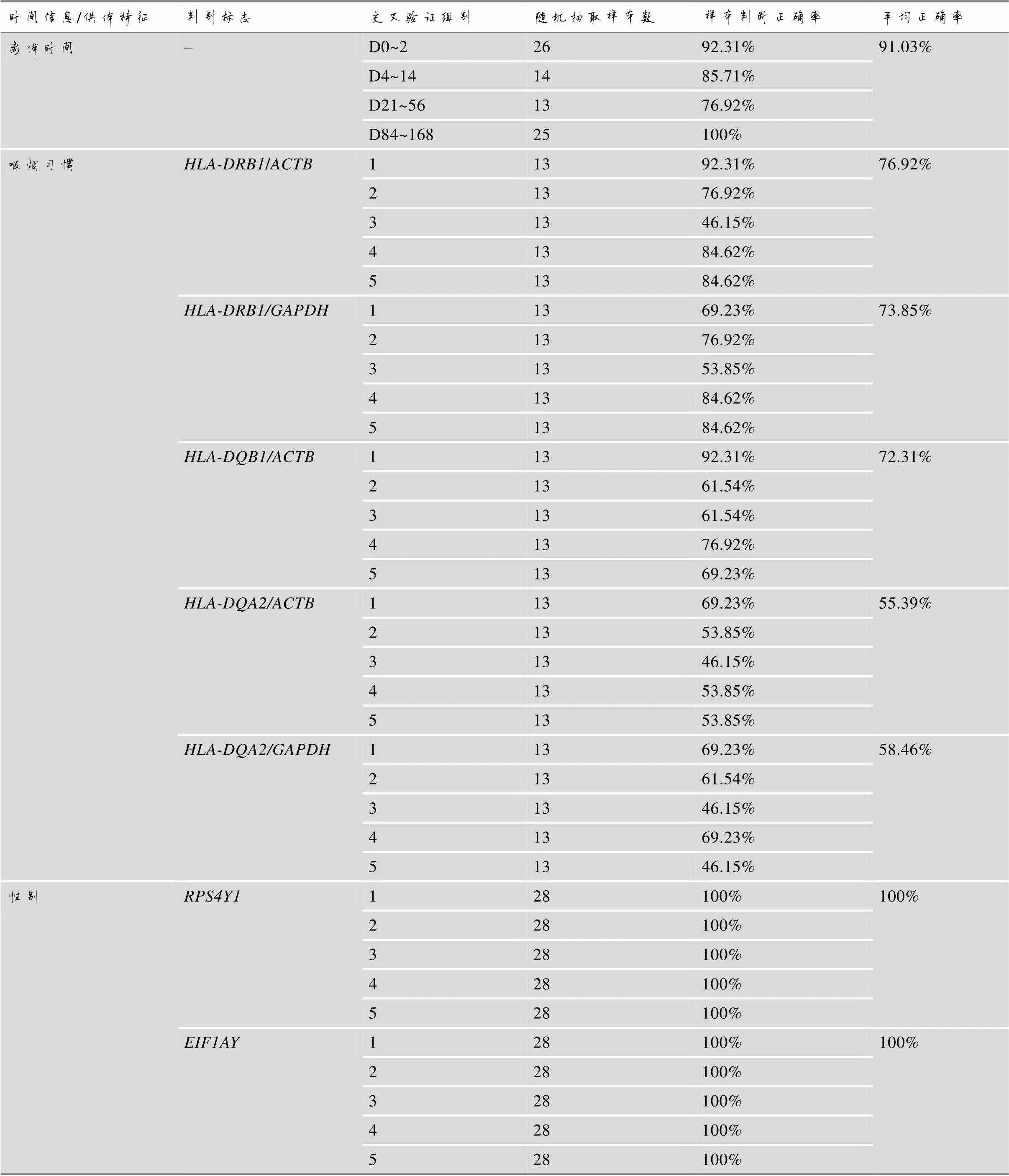
表7 样本离体时间和供体特征分析交叉验证结果
在证实了血液样本转录组变化具有时间相关性的同时,本研究考察了相同离体时间段内供体性别特征、吸烟习惯相关的转录组水平差异。结果表明,NRY转录本和在不同离体时间男性样本中FPKM平均值均≥1,在女性样本中FPKM平均值均<1,十折交叉验证正确率均为100%,可以作为血液样本供体性别特征的判别标志。、和在吸烟组及其对照组中表达差异显著(|log2foldchange| > 0.5,-adjusted < 0.05),其与管家基因和的相对表达比在吸烟组及其对照组中具有不同分布。十折交叉验证中,RER/ACTB、RER/GAPDH和RER/ACTB的平均正确率高于70%、正确率最高为92.31%,可以作为供体特征吸烟习惯的判别标志。、和,同属于编码人类主要组织相容性复合体(major histocompatibility complex,MHC)的基因簇,定位于第6染色体,参与编码MHC-II类分子,通过抗原加工提呈在机体免疫应答中发挥重要作用[51~53]。本研究对25个吸烟相关转录本进行功能聚类分析,获得21个具有统计学意义(<0.05)的功能通路,其中包括类风湿性关节炎(rheumatoid arthritis)、哮喘(asthma)功能通路。这与文献报道中吸烟是类风湿性关节炎、哮喘发生的危险因素一致[53,54],提示、和的表达改变,可能与吸烟影响机体免疫继而诱发机体免疫功能障碍和相关疾病有关。而吸烟特征判别标志基因表达改变与吸烟相关的功能机制、烟草中哪些成分是基因表达改变的诱发因素仍需要深入研究,进而为供体吸烟特征判别方法的建立和刑事案件侦办提供科学可靠的技术支撑。同时我们也注意到,与相比,和在吸烟特征判断中的正确率较高,这可能与二者较高的FPKM值和在吸烟组中上调的表达方式有关,当然,不同差异转录本的吸烟特征判别效能还需要进一步研究评判。
本研究选取4℃恒温密闭保存的EDTA抗凝血为研究对象,有效避免了环境温度、湿度、微生物改变等导致的血液样本转录组变化,客观证实离体血液样本转录组变化的时间相关性以及相同离体时间段内来源于不同吸烟习惯、性别特征供体的血液样本在转录组水平的差异,为血液样本时间分析和供体吸烟习惯、性别特征刻画提供方法。同时,EDTA抗凝后4℃恒温密闭保存,是酒精检测、毒品检测、毒物检测、兴奋剂检测等血液样本的标准保存方式,本研究建立的时间和供体特征分析方法可以为上述检测中样本采集时间和样本来源争议解决提供有效途径。需要指出的是,环境温度、湿度、光照、微生物等对于离体血液样本核酸降解变化具有不可忽视的重要影响[55~57],本研究仅考察了4℃恒温密闭保存的EDTA抗凝血液样本转录组与物证特征关联关系,还需进一步研究不同温度、湿度、光照条件下的血液样本转录组变化,以适应不同环境案件现场物证刻画需要。同时,在明确标志转录本与血液样本时间和供体特征关联关系的基础上,研究建立样本需求量小、实验方法简单、实验周期短、与当前法医DNA实验室发展相匹配的标志转录本检验分析方法,实现更为广泛、更具实践应用价值的案件现场血液斑迹时间和供体特征刻画,可以为案件侦办和涉案人员的主动查找提供更为直接、可靠、全面的侦查线索和技术手段。
[1] 侯一平. 法医物证学: 第4版. 北京: 人民卫生出版社, 2016, 1–5.
[2] 布尔特尔, 侯一平(译). 法医DNA分型专论: 方法学(第3版). 科学出版社, 2013, 83–90.
[3] Li M, Li Y, Yang YF, Yan YW, Liu F, Li CX, Zeng FM, Zhao WT. Human facial shape related SNP analysis in Han Chinese populations., 2020, 42(7): 680–690.
刘明, 李祎, 杨亚芳, 晏于文, 刘凡, 李彩霞, 曾发明, 赵雯婷. 中国汉族人群脸部特征相关SNP位点研究. 遗传, 2020, 42(7): 680–690.
[4] Zhang T, Yang RQ. Review of the application of spectral imaging and mass spectrometry imaging infingerprint analysis., 2015, (1): 71–75.
张婷, 杨瑞琴. 指印中化学物质光谱质谱成像分析技术研究进展. 中国司法鉴定, 2015, (1): 71–75.
[5] Mei HC, Zhu J, Quan YK, Wang GQ. Inferring the donor’s living spatial-temporal information by stable isotope analysis of the biological evidence., 2016, 41(2): 87–92.
梅宏成, 朱军, 权养科, 王桂强. 稳定同位素检验推断生物物证供体的生活时空信息. 刑事技术, 2016, 41(2): 87–92.
[6] Zhang J, Gao S, Chang JJ, Zhang Y, Yang XY, Liu KH. Advances in the research of predicting the time since deposition of evidentiary stains., 2018, 33(1): 39–42.
张瑾, 高珊, 畅晶晶, 张颖, 杨雪莹, 刘开会. 现场生物斑迹遗留时间推断研究进展. 中国法医学杂志, 2018, 33(1): 39–42.
[7] Rajamannar K. Determination of the age of bloodstains using immunoelectrophoresis., 1977, 22(1): 159–164.
[8] Li B, Beveridge P, O'Hare WT, Islam M. The estimation of the age of a blood stain using reflectance spectroscopy with a microspectrophotometer, spectral pre-processing and linear discriminant analysis., 2011, 212(1–3): 198–204.
[9] Bremmer RH, Nadort A, van Leeuwen TG, van Gemert MJC, Aalders MCG. Age estimation of blood stains by hemoglobin derivative determination using reflectance spectroscopy., 2011, 206(1–3): 166–171.
[10] Hanson EK, Ballantyne J. A blue spectral shift of the hemoglobin soret band correlates with the age (time since deposition) of dried bloodstains., 2010, 5(9): e12830.
[11] Gao QY, Gao SM. Authentication of age of blooding using UV visible reflection spectrum., 2015, 35(8): 2221–2224.
高茜钰, 高士明. 利用紫外可见反射光谱鉴定血迹陈旧度. 光谱学与光谱分析, 2015, 35(8): 2221–2224.
[12] Edelman G, van Leeuwen TG, Aalders MCG. Hyperspectral imaging for the age estimation of blood stains at the crime scene., 2012, 223(1–3): 72–77.
[13] Edelman G, Manti V, van Ruth SM, van Leeuwen T, Aalders M. Identification and age estimation of blood stains on colored backgrounds by near infrared spectroscopy., 2012, 220(1–3): 239–244.
[14] Doty KC, McLaughlin G, Lednev IK. A Raman “spectroscopic clock” for bloodstain age determination: the first week after deposition., 2016, 408(15): 3993–4001.
[15] Thanakiatkrai P, Yaodam A, Kitpipit T. Age estimation of bloodstains using smartphones and digital image analysis., 2013, 233(1–3): 288–297.
[16] Alshehhi S, McCallum NA, Haddrill PR. Quantification of RNA degradation of blood-specific markers to indicate the age of bloodstains., 2017, 6: e453–e455.
[17] Anderson S, Howard B, Hobbs GR, Bishop CP. A method for determining the age of a bloodstain., 2005, 148(1): 37–45.
[18] Bauer M, Polzin S, Patzelt D. Quantification of RNA degradation by semi-quantitative duplex and competitive RT-PCR: a possible indicator of the age of bloodstains?, 2003, 138(1–3): 94–103.
[19] Anderson SE, Hobbs GR, Bishop CP. Multivariate analysis for estimating the age of a bloodstain., 2011, 56(1): 186–193.
[20] Mohammed AT, Khalil SR, Ali HA, Awad A. Validation of mRNA and microRNA profiling as tools in qPCR for estimation of the age of bloodstains., 2018, 15(6): 1–7.
[21] Glynn CL. Potential applications of microRNA profiling to forensic investigations., 2020, 26(1): 1–9.
[22] Hampson C, Louhelainen J, McColl S. An RNA expression method for aging forensic hair samples., 2011, 56(2): 359–365.
[23] Alshehhi S, Haddrill PR. Estimating time since deposition using quantification of RNA degradation in body fluid specific markers., 2019, 298: 58–63.
[24] Fu J, Allen RW. A method to estimate the age of bloodstains using quantitative PCR., 2019, 39: 103–108.
[25] Wang Y. Measurement of DNA degradation kinetics in serum, urine and saliva based on automatic STR analysis system [Dissertation]. Dalian Medical University, 2014.
王瑶. 基于STR自动检测系统对DNA在血清、尿液和唾液中降解动力学的测定[学位论文]. 大连医科大学, 2014.
[26] Johnson LA, Ferris JAJ. Analysis of postmortem DNA degradation by single-cell gel electrophoresis., 2002, 126(1): 43–47.
[27] Cossette ML, Stotesbury T, Shafer ABA. Quantifying visible absorbance changes and DNA degradation in aging bloodstains under extreme temperatures., 2021, 318: 110627.
[28] Díez López C, Kayser M, Vidaki A. Estimating the time since deposition of saliva stains with a targeted bacterial DNA approach: a proof-of-principle study., 2021, 12: 647933.
[29] Weinbrecht KD, Fu J, Payton ME, Allen RW. Time- dependent loss of mRNA transcripts from forensic stains., 2017, 7: 1–12.
[30] Ramaprasad A, Subudhi AK, Culleton R, Pain A. A fast and cost-effective microsampling protocol incorporating reduced animal usage for time-series transcriptomics in rodent malaria parasites., 2019, 18(1): 26.
[31] Jang JS, Berg B, Holicky E, Eckloff B, Mutawe M, Carrasquillo MM, Ertekin-Taner N, Cuninngham JM. Comparative evaluation for the globin gene depletion methods for mRNA sequencing using the whole blood- derived total RNAs., 2020, 21(1): 890.
[32] Lopez JP, Diallo A, Cruceanu C, Fiori LM, Laboissiere S, Guillet I, Fontaine J, Ragoussis J, Benes V, Turecki G, Ernst C. Biomarker discovery: quantification of microRNAs and other small non-coding RNAs using next generation sequencing., 2015, 8: 35.
[33] Kim D, Langmead B, Salzberg SL. HISAT: a fast spliced aligner with low memory requirements., 2015, 12(4): 357–360.
[34] Raplee ID, Evsikov AV, de Evsikova CM. Aligning the aligners: comparison of RNA sequencing data alignment and gene expression quantification tools for clinical breast cancer research., 2019, 9(2): 18.
[35] Anders S, Pyl PT, Huber W. HTSeq—a Python framework to work with high-throughput sequencing data., 2015, 31(2): 166–169.
[36] Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation., 2010, 28(5): 511–515.
[37] Tiedt S, Prestel M, Malik R, Schieferdecker N, Duering M, Kautzky V, Stoycheva I, Böck J, Northoff BH, Klein M, Dorn F, Krohn K, Teupser D, Liesz A, Plesnila N, Holdt LM, Dichgans M. RNA-seq identifies circulating miR-125a-5p, miR-125b-5p, and miR-143-3p as potential biomarkers for acute ischemic stroke., 2017, 121(8): 970–980.
[38] Li J, Zhao FQ, Wang YD, Chen JR, Tao J, Tian G, Wu SL, Liu WB, Cui QH, Geng B, Zhang WL, Weldon R, Auguste K, Yang L, Liu XY, Chen L, Yang XC, Zhu BL, Cai J. Gut microbiota dysbiosis contributes to the development of hypertension., 2017, 5(1): 14.
[39] Kong YQ, Liu JK, Gu JQ, Xu JY, Zheng YN, Wei YL, Wu SY. Optimization scheme of machine learning model for genetic division between northern Han, southern Han, Korean and Japanese., 2022, 44(11): 1028–1043.
孔永强, 刘金凯, 顾佳琪, 徐景怡, 郑雨诺, 魏以梁, 伍少远. 南–北方汉族人、韩国人和日本人遗传划分机器学习模型优化方案. 遗传, 2022, 44(11): 1028–1043.
[40] Lin HJ. The prediction and functional analysis of IncRNA in embryonic development process [Dissertation]. Nanchang University, 2016.
林海军. 胚胎中lncRNA的预测及其在胚胎发育过程中的功能分析[学位论文]. 南昌大学, 2016.
[41] Ming TY, Jiang LR, Liu J, Chang JJ, Hou YP, Zhang GF, Wang Z. Y-Chromosomal genetic markers: forensic application and prospect., 2022, 47(4): 411–418.
[42] 明天悦, 蒋礼蓉, 刘京, 畅晶晶, 侯一平, 张广峰, 王正. Y染色体遗传标记的法医学应用及展望. 刑事技术, 2022, 47(4): 411–418.
Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome., 2012, 486(7402): 207–214.
[43] Zhao YX, Hu S, Ye J, Sun QF, Ji AQ. Researches of mRNA profiling for forensic body fluid identification., 2019, 44(5): 388–394.
赵一霞, 胡胜, 叶健, 孙启凡, 季安全. mRNA分析在体液斑迹组织来源推断中的应用研究进展. 刑事技术, 2019, 44(5): 388–394.
[44] Zhang Q, Zhao HM, Li YJ, Chen J, Chang JJ, Yang RQ, Wang C. Application of non-coding RNA in body fluid stain identification., 2020, 35(5): 514–517. 张琦, 赵禾苗, 李永久, 陈静, 畅晶晶, 杨瑞琴, 王冲. 非编码RNA在体液斑迹鉴定中的应用. 中国法医学杂志, 2020, 35(5): 514–517.
[45] Lehman DC. Forensic microbiology., 2012, 25(2): 114–119.
[46] García MG, Pérez-Cárceles MD, Osuna E, Legaz I. Impact of the human microbiome in forensic sciences: a systematic review., 2020, 86(22): e01451–20.
[47] Ventura Spagnolo E, Stassi C, Mondello C, Zerbo S, Milone L, Argo A. Forensic microbiology applications: a systematic review., 2019, 36: 73–80.
[48] Jia F, Sun XK, Yu SB, Yu J, Lin CM, Kan XS, ShaoW. An age estimation method based on DNA methylation detection in the field of forensic science., 2021, 3(4): 373–378.
贾菲, 孙学科, 喻少波, 于蛟, 林春美, 阚旭升, 邵武. DNA甲基化水平的法医学个体年龄推断. 中国法医学杂志, 2021, 36(4): 373–378.
[49] Mameli A, Scudiero CM, Delogu G, Ghiani ME. Successful analysis of a 100 years old semen stain generating a complete DNA STR profile., 2019, 61: 78–81.
[50] Xu TS, Li XG, Jiao DJ, Xie ZH, Dai ZM. Mechanism of 5′-to-3′ degradation of eukaryotic and prokaryotic mRNA., 2015, 37(3): 250–258.
许禔森, 李学贵, 焦德杰, 谢兆辉, 戴忠民. 真核生物和原核生物mRNA 5′至3′方向的降解机制. 遗传, 2015, 37(3): 250–258.
[51] Althaf MM, El Kossi M, Jin JK, Sharma A, Halawa AM. Human leukocyte antigen typing and crossmatch: a comprehensive review., 2017, 7(6): 339–348.
[52] Gao H, Han Y, Zhai XX, Gao FS. The research progress of antigen presentation by MHC molecules., 2017, 29(5): 450–461.
高花, 韩勇, 翟晓鑫, 高凤山. MHC分子抗原递呈机制的研究进展. 生命科学, 2017, 29(5): 450–461.
[53] Lu BH. Effects of smoking on autoantibodies and disease activity in patients with rheumatoid arthritis [Dissertation]. Hubei Minzu University, 2020.
鲁邦华. 吸烟对类风湿关节炎自身抗体及疾病活动的影响[学位论文]. 湖北民族大学, 2020.
[54] Jiang WQ, Chen ZY, Zhou LL, Lian SY, Zhang XM. Investigation on disease cognition status and influencing factors of control level in patients with bronchial asthma., 2022, 22(2): 342–346.
蒋文青, 陈宗喻, 周垒垒, 练思雨, 张先明. 支气管哮喘患者疾病认知状况调查及控制水平的影响因素分析. 现代生物医学进展, 2022, 22(2): 342–346.
[55] Heneghan N, Fu J, Pritchard J, Payton M, Allen RW. The effect of environmental conditions on the rate of RNA degradation in dried blood stains., 2021, 51: 102456.
[56] Zhao CC, Zhao MZ, Zhu Y, Zhang L, Zheng Z, Wang Q, Li YG, Zhang P, Zhu SS, Ding SJ, Li JB. The persistence and stability of miRNA in bloodstained samples under different environmental conditions., 2021, 318: 110594.
[57] Salzmann AP, Arora N, Russo G, Kreutzer S, Snipen L, Haas C. Assessing time dependent changes in microbial composition of biological crime scene traces using microbial RNA markers., 2021, 53: 102537.
Application of transcriptome in time analysis and donor characterization in blood samples
Jin Zhang1,2, Kaihui Liu2, Ying Zhang2, Jinping Hao2, Guangfeng Zhang2, Xiaoyu Xu2, Jingjing Chang2, Xingpeng Liu3, Xueying Yang2, Jian Ye1,2
Asan effective supplement to the current forensic DNA typing and one of the research hotpots in forensic science, the in-depth mining and characterization of biological evidence can provide rich and reliable clues for case investigation. In this study, the time-dependent variations of transcriptome were confirmed inblood samples within 0-168 days and a random forest model was established to realize the classification of blood samples with different TSD (time since deposition). Meanwhile, significant differences were observed in the transcripts of blood samples with different smoking habits and genders within a certain time period.,andwere identified as markers for smoking habit identification, while the transcripts forandfrom the non-recombining region of the Y chromosome (NRY) were identified as markers for male sex identification. Thus, this study provides a theoretical foundation and experimental strategy for establishing a transcriptome-based method for characterizing blood sample retention time and donor characteristics in the field of forensic investigation.
forensic science;blood; time since deposition; smoking habit; gender
2022-10-31;
2022-11-29;
2022-12-09
公安部技术研究计划项目(编号:2017JSYJC22),公安科技成果推广引导计划项目(编号:2020TGYDBGAES25)和中央级公益类科研院所基本科研业务费专项资金项目(编号:2020JB008)资助[Supported by the Science and Technology Development Programs of Ministry of Public Security P.R.C (No. 2017JSYJC22), the Public Security Scientific and Technological Achievements Promotion and Guidance Programs of Ministry of Public Security P.R.C (No. 2020TGYDBGAES25), and the Basic research Funds for Public Welfare Research Institutes of the Central Government (No. 2020JB008)]
张瑾,在读博士研究生,副高级警务技术任职资格,研究方向:法医物证学。E-mail: zhangjin1101@126.com
杨雪莹,博士,正高级警务技术任职资格,研究方向:法医物证学。E-mail: yxystyhhp@163.com
叶健,博士,主任法医师,研究方向:法医物证学。E-mail: yejian77@126.com
10.16288/j.yczz.22-293
(责任编委: 朱波峰)
