α-Fe2O3催化臭氧氧化耦合陶瓷膜处理含酚废水
2023-02-07王勇张耀宗毕莹莹杜明辉孙晓明
王勇,张耀宗,毕莹莹,杜明辉,孙晓明*
1.中国环境科学研究院, 国家环境保护生态工业重点实验室
2.华北理工大学建筑工程学院
含酚废水主要来源于煤化工、石油化工和制药等行业,具有高毒性且难生物降解,严重危害人体健康和生态环境安全[1-2],常规的生物法难以将其去除。催化臭氧氧化法是降解含酚废水的有效处理方法[3-6],该工艺在催化氧化过程可以产生强氧化剂羟基自由基(·OH)[7],·OH 可以有效处理有毒有害的难降解有机物。然而,催化氧化工艺仍面临着催化效率较低、催化剂易流失、活性组分易中毒失活等问题[8-9]。研究表明,微纳米金属氧化物如α-Fe2O3[10]、α-MnO2[11]、MgO[12]等具有强烈的臭氧催化活性。这类金属氧化物通常无毒、成本低、易制备,应用前景广阔。在实际应用中,微纳米催化剂常通过负载在活性炭、Al2O3或其他载体上组成复合催化剂[13-15],这类复合催化剂与污染物和O3的接触水平较低,不利于吸附和催化作用,限制了有机物的降解效率[16-17]。另一方面,微纳米催化剂可以单独参与类似均相的O3催,提高O3利用率,增强催化效果[18-19]。但是,该催化体系存在催化剂容易流失的问题。采用出水效率高、结构稳定及耐酸碱的陶瓷膜对微纳米催化剂进行截留、回收,从而实现工艺的连续稳定运行,具有一定可行性[20-21]。
笔者选取微米级α-Fe2O3催化臭氧氧化模拟含酚废水,采用陶瓷膜截留回收催化剂,在恒压条件下,探究α-Fe2O3耦合陶瓷膜工艺对含酚废水的处理效果。通过设置压力梯度,研究体系的出水效率、膜污染水平,优化运行过程的操作压力;通过对运行过程的渗透通量变化,判断膜堵塞状态,分析膜阻力构成;在连续流条件下,研究催化氧化体系对含酚废水的持续处理能力,以期为高效处理含酚废水提供参考。
1 材料与方法
1.1 材料与装置
微米级α-Fe2O3粒径约为500目;O3由北京同林生产的3S-T5型臭氧发生器制备,臭氧发生器气源为99.99%纯氧;试验用苯酚为分析纯,购于国药集团化学试剂有限公司;陶瓷膜有效过滤面积为100 mm×100 mm,膜孔径约为0.1 µm;试验用模拟废水通过苯酚和去离子水配置,COD约为125 mg/L;O3浓度控制在140~150 mg/L,流量为200 mL/min。
试验装置主要包括催化臭氧氧化反应器、纯氧气瓶、臭氧发生器(3S-T,北京同林科技有限公司)、臭氧浓度检测器(3S-J5000,北京同林科技有限公司)、磁力搅拌器、给水池、集水瓶、水泵和电子天平。其中,反应器由平板陶瓷膜、曝气头和磁力搅拌装置组成,反应器有效容积为5 L,装置顶部加盖密封,设有进出水孔和尾气孔(图1)。
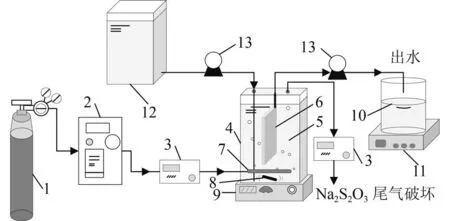
图1 试验装置Fig.1 Experimental apparatus
1.2 试验方法
1.2.1 间歇试验
在反应器中配置0.5 g/L α-Fe2O3和50 mg/L苯酚的混合废水,通过曝气头进行O3曝气,每隔5 min取样一次,检测实时的COD,研究α-Fe2O3催化臭氧氧化效果;在无苯酚条件下,检测曝气过程中溶液的溶解O3浓度,达到浓度平衡后停止曝气,继续检测溶解O3浓度,研究反应过程中α-Fe2O3对臭氧的催化分解作用;通过投加叔丁醇(TBA)进行自由基淬灭试验,验证催化氧化过程中间接生成的·OH。
1.2.2 连续流试验
在反应器预先投加0.5 g/L α-Fe2O3和5 L去离子水,充分混合后,设置出水端水泵的操作压力,通过陶瓷膜对废水进行抽滤,并进行臭氧曝气。同时,通过调节进水泵,将废水由给水池持续输送到反应器,保持进出水流量一致。抽滤后的尾水由集水瓶收集,测量尾水的实时质量,计算陶瓷膜通量,考察膜污染形成机制,探究连续运行条件下的苯酚降解效果和膜污染情况;使用同一批α-Fe2O3和陶瓷膜片进行连续运行试验,每连续运行30 min后使用100 mL去离子水进行反冲洗,考察组合工艺对废水的持续处理能力。
1.3 检测方法
采用COD快速测定仪(5B-3B,连华科技)测定COD;采用液相臭氧测量计(SPH006CN+,英国百灵达)测定液相O3浓度;采用臭氧浓度检测器(3SJ5000,北京同林)测定气相O3浓度。
通过流量(V)随时间(t)的变化来研究膜堵塞行为,其中,V通过液体质量的变化与水密度的关系进行换算,质量的变化使用电子天平进行实时记录。
1.4 模型介绍
在催化臭氧氧化过程中使用准一级反应动力学模型进行氧化反应速率常数的计算,在陶瓷膜过滤过程中使用串联阻力模型和4种膜污染模型对膜污染情况和膜污染形成机制进行分析。
1.4.1 准一级反应动力学
按照准一级动力学方程拟合COD去除率,计算动力学反应速率常数,公式如下:

式中:c为t时刻COD去除率,%;k为反应速率常数,s-1。
1.4.2 串联阻力模型
串联阻力模型可以用来描述膜污染过程中的阻力变化,其表达式为:
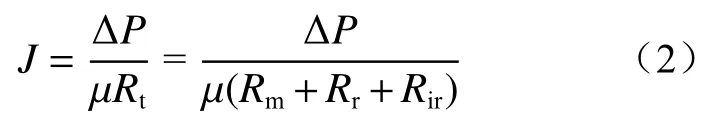
式中:J为膜通量,m/s; ΔP为操作压力,Pa;µ为动力学黏度,Pa·s;Rt为总阻力,m-1;Rm为固有阻力,m-1;Rr为可逆污染阻力,m-1;Rir为不可逆污染阻力,m-1。
膜通量计算公式如下:

式中:ΔV为体积流量,m3;Δt为过滤时间,s;A为过滤面积,m2。
各组分膜阻力测算方法如下:首先过滤100 mL去离子水并记录通量为J0,计算Rm;过滤100 mL含α-Fe2O3和苯酚的混合液,每过滤10 mL记一次膜通量,最后10 mL混合液的平均通量记为J1,计算Rt;将过滤完α-Fe2O3混合液的陶瓷膜用去离子水反冲洗2 min,清洗完成后,过滤100 mL去离子水,进一步充分清洗,该通量记为J2,计算反洗后阻力(Rb);通过Rt、Rm和Rb可推算出滤饼层污染产生的可逆和不可逆污染膜阻力,计算公式如下:

1.4.3 膜堵塞模型
完全堵塞、中间堵塞、滤饼堵塞和标准堵塞4种经典膜污染模型示意图[22]及方程如图2及表1所示。
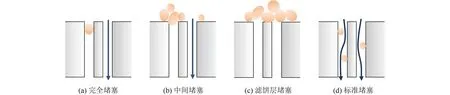
图2 膜污染堵塞模型Fig.2 Membrane fouling blocking model

表1 膜堵塞模型公式Table 1 Formula of membrane blocking model
2 结果与讨论
2.1 催化氧化效果
为研究α-Fe2O3以及陶瓷膜催化臭氧氧化苯酚的效果,对比了单独 O3、O3-膜、O3-α-Fe2O3催化臭氧氧化和装备膜(O3-α-Fe2O3-膜)条件下的废水处理效果(图3)。由图3可见,投加催化剂的2种条件下反应速率明显优于单独O3,反应均在30 min时达到97%以上的最大COD去除率。未投加催化剂时,单独O3和O3-膜的COD去除率仅有61.87%和66.52%。另一方面,陶瓷膜表现了微弱的催化作用,去除效果略高于单独O3,这可能是由于陶瓷膜的主要成分为Al2O3,而Al2O3也具有臭氧催化作用[23]。
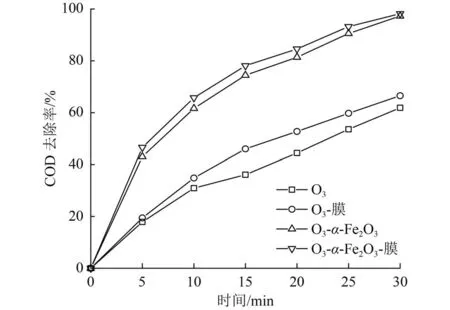
图3 催化氧化效果Fig.3 Catalytic oxidation effect
采用式(1)得到氧化反应速率常数(k)、相关系数方差(R2)和标准偏差(S)如表2所示。由表2可见,4项试验的R2均大于0.98,说明准一级动力学可以很好地描述O3氧化污染物的反应过程。通过比较4项试验中的k可知,投加α-Fe2O3显著提高了反应速率。投加α-Fe2O3的k是单独臭氧氧化时的2.8倍,进一步在增加陶瓷膜的条件下,k由-0.304 s-1提至-0.356 s-1。因此,在 O3-α-Fe2O3-膜的条件下表现了最佳的COD去除效果。

表2 催化氧化准一级动力学参数Table 2 Pseudo-first-order kinetics parameters of catalytic oxidation
2.2 污染物降解机制
为了明确催化氧化和吸附对污染物去除的贡献情况,对反应机理进行了研究。苯酚在反应过程的降解由多种因素导致,除了催化氧化本身的矿化作用,这种降解过程还依赖于有机污染物首先在催化剂表面的吸附平衡,然后由吸附过程转变为催化氧化的矿化过程[24]。为了更进一步确定α-Fe2O3和陶瓷膜吸附在反应过程中的作用,在未使用O3曝气的情况下考察其吸附去除污染物的情况(图4)。可以看到,投加α-Fe2O3和添加膜时,COD去除率随着吸附时间变化并未出现明显的提高,且当α-Fe2O3投加量由0.1g/L增至1g/L时吸附量仅提高到10.23%,吸附作用在15 min前有一定作用,但随后趋于平缓,在吸附30 min时均已达到吸附饱和。这说明α-Fe2O3和陶瓷膜对苯酚的直接吸附并不明显,催化氧化过程中苯酚的降解并不由吸附作用主导。
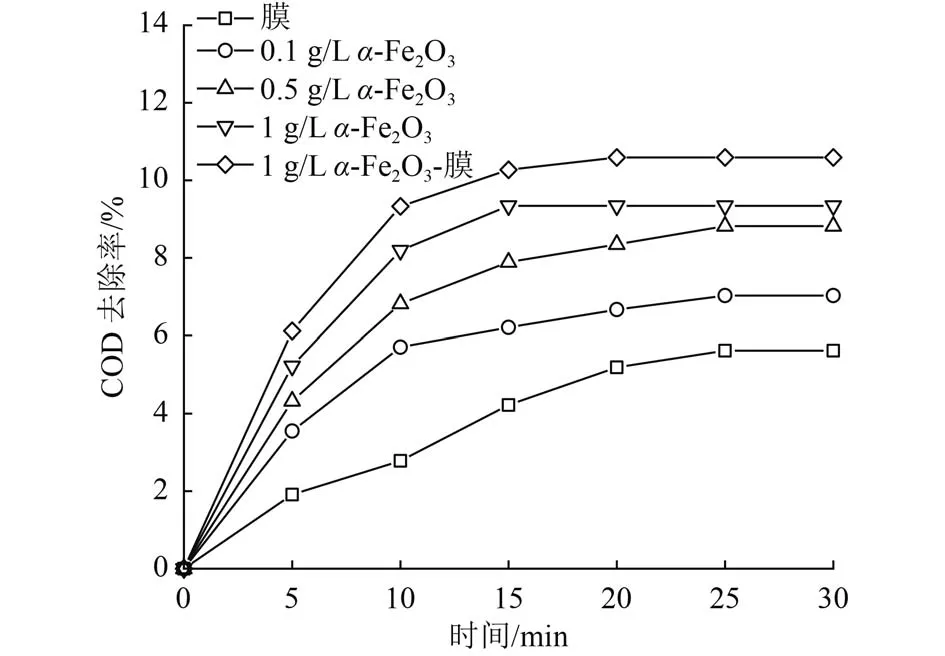
图4 α-Fe2O3和陶瓷膜吸附去除COD差异Fig.4 Difference of COD removal by α-Fe2O3 and ceramic membrane adsorption
α-Fe2O3的加入可以促进臭氧分解和传质作用[25-26],为研究催化剂和陶瓷膜在试验中对O3分解速率的影响,考察了O3在自然状态、O3-膜、O3-α-Fe2O3、α-Fe2O3-膜条件下的分解情况,溶解臭氧浓度达到平衡后停止曝气(虚线之后),结果如图5所示。O3-α-Fe2O3-膜与 O3-α-Fe2O3在曝气 15 min 时最先达到溶解臭氧平衡浓度(5.9和8.4 mg/L),O3-膜与单独O3曝气对照组延后5 min后也达到平衡浓度(11.0和12.7 mg/L)。另一方面,停止曝气后O3-α-Fe2O3-膜表现了最佳的臭氧分解速率,其次分别为O3-α-Fe2O3、O3-膜、O3。O3-α-Fe2O3-膜条件下的臭氧平衡浓度和后续的分解速率明显优于其他条件,表明α-Fe2O3和陶瓷膜对臭氧分解有不同程度的促进作用。
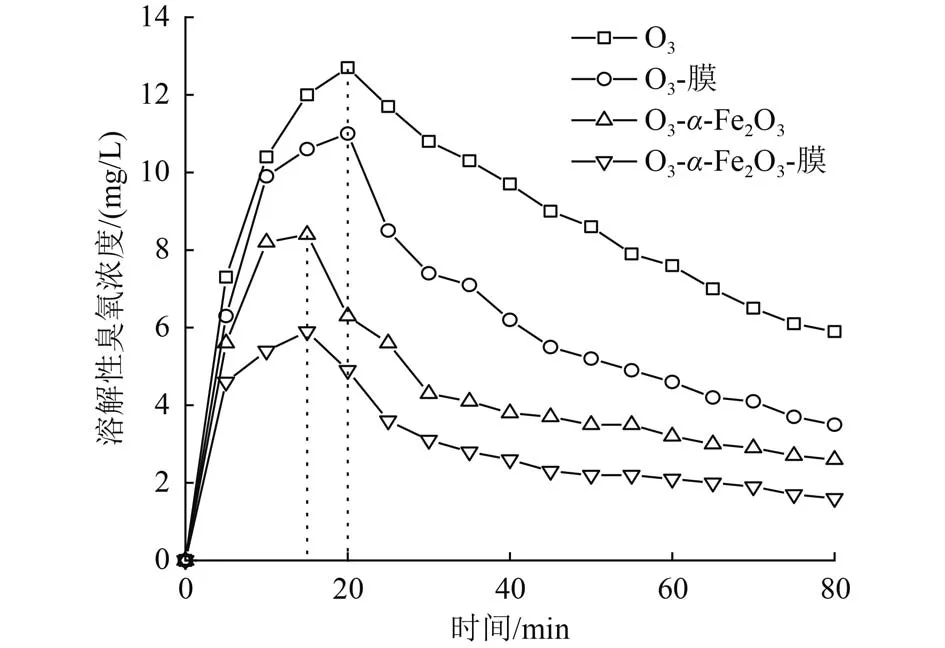
图5 催化氧化和陶瓷膜对O3的分解作用Fig.5 Catalytic oxidation and decomposition of ozone by ceramic membrane
另一方面,苯酚的降解由臭氧的直接氧化及·OH的氧化控制,·OH的产生可能是废水COD高去除率的主要原因[27-28],为进一步探究催化氧化过程强氧化剂·OH产生情况,进行了自由基屏蔽试验。TBA是常用的自由基屏蔽剂,与·OH反应速率常数为 6×108s-1。而在介质中性或酸性(pH≤7)时,TBA与O3几乎不反应。图6为催化臭氧氧化苯酚时投加TBA后COD去除率随时间的变化。反应60 min后,投加20和50 mg/L TBA时催化氧化过程的COD去除率分别为90.25%和77.10%,低于未投加TBA的97.67%,这说明反应被明显抑制了,催化氧化过程产生的·OH是高COD去除率的重要因素。
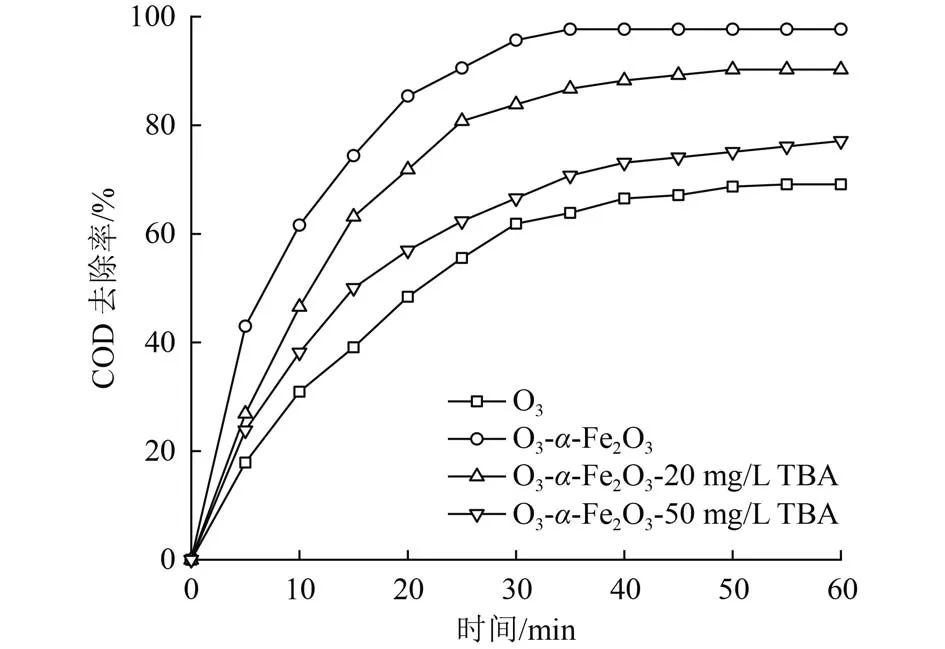
图6 TBA捕获·OH对COD去除率的影响Fig.6 Effect of TBA capture ·OH on COD removal rate
2.3 陶瓷膜过滤α-Fe2O3运行参数
2.3.1 操作压力影响
在反应过程中,操作压力在α-Fe2O3分离及滤出废水时提供驱动力。根据达西定律[29-31],渗透通量与操作压力成正比。虽然提高压力可以增加渗透通量,但也会加速膜表面污垢的积累,形成膜污染,从而导致渗透通量下降。为了平衡渗透通量和膜污染之间的冲突,优化操作压力至关重要。由图7可见,渗透通量随操作压力升高而增加,由操作压力10 kPa 时的 0.20 m3/(m2·h)至 35 kPa 的 0.90 m3/(m2·h),增幅逐渐减弱,在30 kPa之后逐渐趋于平缓。因此,虽然30 kPa的初始渗透通量低于35 kPa,但从连续运行来看,保持30 kPa的操作压力更有利于试验进行。
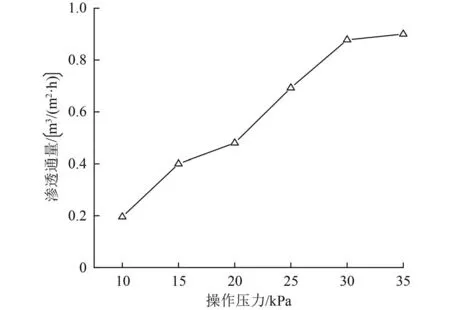
图7 操作压力对纯水渗透通量的影响Fig.7 Effect of operating pressure on pure water permeation flux
在不同的操作压力下,使用陶瓷膜对催化氧化过程中的α-Fe2O3及苯酚废水的混合物进行过滤,得到膜比通量(J/J0)随时间的变化关系。由图8(a)可以看到,当操作压力由10 kPa升至35 kPa时,反应结束时J/J0分别逐渐降至0.813、0.799、0.792和0.767。在操作压力超过30 kPa的条件下,由于α-Fe2O3在膜表面累积迅速,膜污染加快,导致J/J0降低速度增加。进一步对污染后的陶瓷膜进行反冲洗,计算得到陶瓷膜各类型阻力随操作压力变化的关系,结果如图8(b)所示。由图8(b)可见,当操作压力由10 kPa增至30 kPa时,各类型阻力相应增加,说明膜污染情况逐渐加深。另一方面,各操作压力条件下的Rr均占Rt的50%以上,而Rir仅分别为Rt的5.71%、6.47%和8.67%,表明在一定操作压力下的膜阻力可通过反冲洗恢复。但是,当操作压力由30 kPa增至35 kPa时,Rt继续增加,Rr却呈下降趋势,Rir明显增加,说明当操作压力达到一定程度,一部分可逆污染向不可逆污染逐渐转化,滤饼逐渐形成,通过常规反冲洗手段无法恢复膜通量[32]。
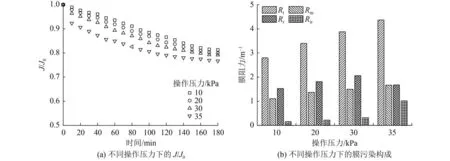
图8 操作压力对陶瓷膜过滤影响Fig.8 Effect of operating pressure on ceramic membrane filtration
综上,无论是在保证出水通量,还是在膜污染控制方面,将操作压力保持在30 kPa最能满足工艺的连续运行,较好矿化污染物的同时,最大限度地减少膜表面上的浓差极化和污垢沉积,保证废水处理效率。
2.3.2 膜污染类型
为了明确该工艺的膜污染类型,对4个经典膜污染模型进行拟合,得到的拟合参数如图9所示。完全堵塞模型、中间堵塞模型、滤饼堵塞模型和标准堵塞模型的R2分别为0.947、0.988、0.984和0.969,说明膜污染过程主要归因于中间堵塞模型和滤饼堵塞模型。这可以表明,溶液中的催化剂逐渐在陶瓷膜上富集,形成滤饼层,且表面滤饼层存在着可累积性。另一方面,造成的膜污染基本发生在膜表面,孔内污染几乎可以忽略,未发生诸如标准堵塞所描述的α-Fe2O3进入膜孔内的现象,这说明膜可以对α-Fe2O3进行有效拦截。在试验过程中,随着膜污染的逐渐加深,有必要及时对膜进行反冲洗以恢复膜通量,保证装置运行。
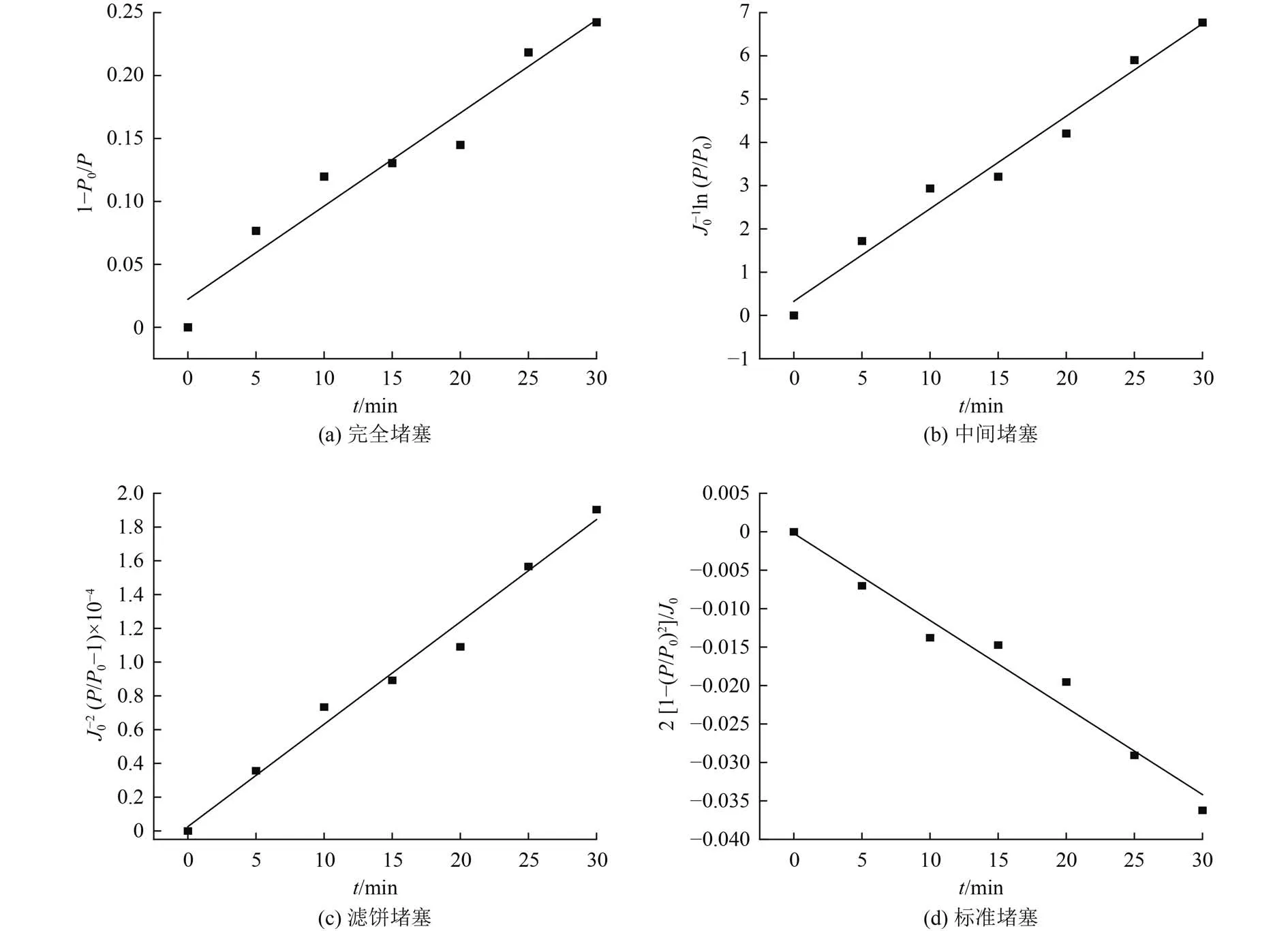
图9 膜污染堵塞模型拟合结果Fig.9 Fitting results of membrane fouling blockage model
2.4 催化氧化耦合陶瓷膜稳定性分析
考虑到在间歇试验无法反映实际工程中连续进水的运行状态,需要进行连续流试验。因此,在连续进水条件下,恒定操作压力为30 kPa时,水力停留时间(HRT)需满足30 min。表3为连续运行过程中COD去除率的变化。由表3可见,COD去除率随着反应时间未出现明显降低,均维持在85%以上。说明在运行过程中,随着催化剂在陶瓷膜表面的逐渐富集,催化剂投加量的降低对催化氧化反应速率影响有限。限于装置设计,废水降解效果并未达到间歇试验的处理效率,可进一步优化装置,延长HRT。
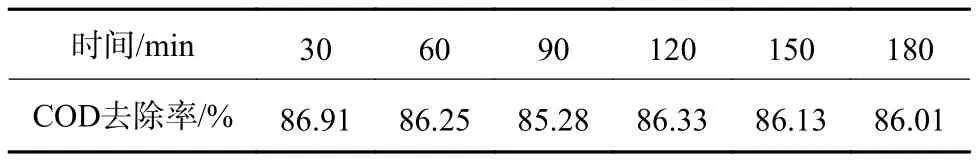
表3 连续运行过程COD去除率变化Table 3 Change of COD removal rate during continuous operation
图10显示了连续运行过程中出水通量及膜污染阻力的构成。由图10可见,连续运行6个周期时,反冲洗后的J/J0恢复至初始值的97.5%,运行结束时J/J0降至0.927。另一方面,在反应过程中的膜污染情况得到了有效的控制,陶瓷膜表面的α-Fe2O3并未进一步增加膜阻力。但是运行过程中的可逆污染在缓慢转为不可逆污染,反应结束时得到最大的不可逆污染阻力,占总膜阻力的12.94%。仅使用去离子水的简单反冲洗对膜污染恢复效果明显,这可能是由于α-Fe2O3的低吸附性和陶瓷膜表面的疏水特性[33-34]。
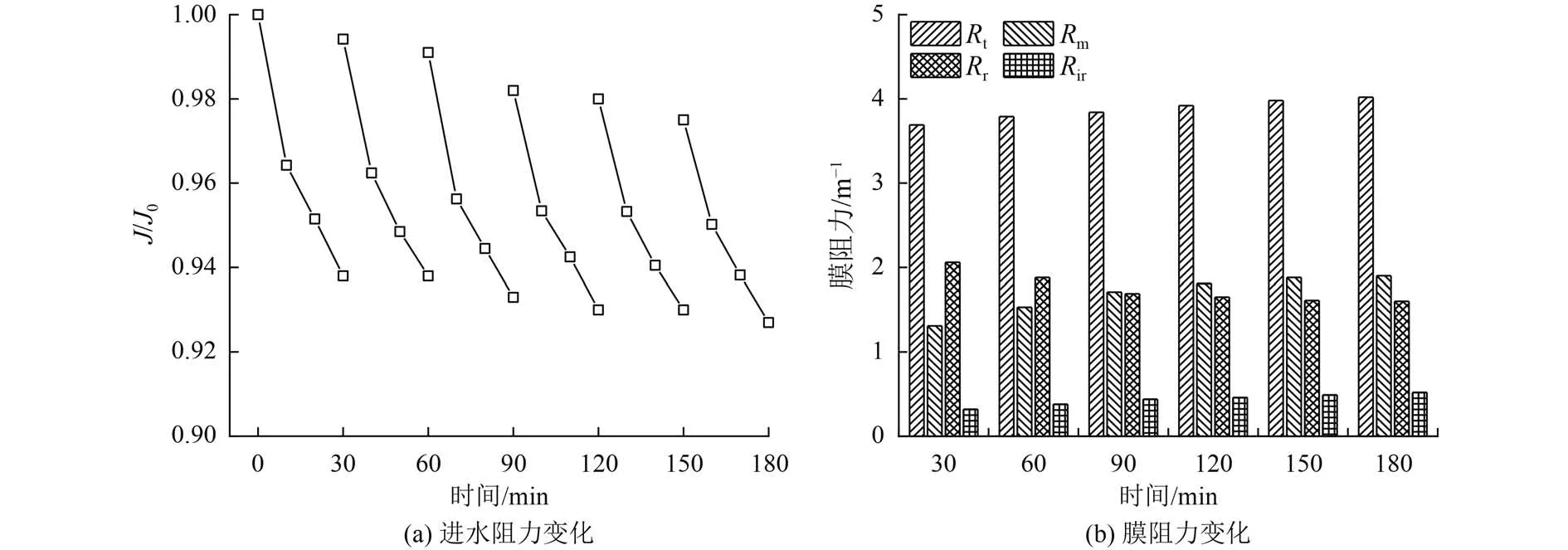
图10 连续进水过程COD去除率和陶瓷膜阻力变化Fig.10 COD removal rate and ceramic membrane resistance change in continuous influent process
3 结论
(1)α-Fe2O3催化臭氧氧化含酚废水间歇试验表明,反应30 min时达到最大COD去除率(97.88%)。催化反应过程产生的·OH是苯酚废水高降解效率的主要原因。
(2)陶瓷膜过滤α-Fe2O3间歇试验表明,操作压力保持在30 kPa达到最佳工况,可以保证废水较高降解率的同时,弱化膜表面上的浓差极化和污垢沉积的影响,保证废水处理效率。陶瓷膜在反应结束时表现为中间堵塞和滤饼堵塞模型,可通过反冲洗来有效恢复通量。
(3)α-Fe2O3催化臭氧氧化耦合陶瓷膜连续试验表明,操作压力为30 kPa,运行6个周期后,出水COD去除率保持在85%以上,出水通量为初始通量的92.7%。反应过程中陶瓷膜总阻力缓慢上升,可逆阻力有向不可逆阻力转化的趋势,但不可逆阻力未出现明显增长,反应体系稳定运行。
