基于 RNAi的家蝇 β-葡萄糖苷酶功能分析
2023-02-06吴书东修江帆尚小丽
吴书东,彭 建,国 果,修江帆,尚小丽*
(1.贵州省感染免疫与抗体工程特色重点实验室,贵州 贵阳 550025;2.贵州医科大学 基础医学院现代病原生物学特色重点实验室,贵州 贵阳 550025)
0 引言
【研究意义】木质纤维素是农业有机废弃物的主要成分,广泛存在于自然界,是世界上最丰富的可再生高聚物,也是可利用的生物质新能源,是由纤维素(32%~47%)、半纤维素(19%~30%)、木质素(5%~24%)、少量蛋白质(3%~5%)和灰分(4%~12%)等组成的聚合物[1-2]。然而木质纤维素具有非常致密的、抗逆性强的纤维网络结构,是农业有机废弃物进行资源化利用的难点。对木质纤维素降解的方法主要有物理法、化学法、物理化学法和生物法(酶解法),其中,生物法是指利用原生动物、细菌、真菌及某些高等植物能够分泌木质纤维素酶的特性,将产生的酶用于特异性降解木质纤维素。由于生物法较其他方法具备对环境友好和能源再生等特点,近年来研究和使用最广泛[3-5]。植物及微生物来源的纤维素酶虽具备特异性高的特点,但也存在生产成本高,且活性和化学稳定性低。因此,寻找工业上重要的木质纤维素酶替代来源或新木质纤维素降解方法逐渐成为研究热点。【前人研究进展】目前大量科学研究证明,多种昆虫可作为生物转化器用于对木质纤维素类有机废弃物的降解利用。现已发现具备木质纤维素降解作用的昆虫有黄粉虫(Tenebriomolitor)[6]、象鼻虫(Cyrtotrachelusbuqueti)[7-8]、斑衣鱼(Zygentoma)[9]、黑水虻(Hermetiaillucens)[10]、白蚁(Termitidae)[11]等。家蝇(Muscadomestica)生命力旺盛、繁殖力强、易于规模化饲养。有研究表明,蝇类幼虫可作为优良的资源昆虫品种用于有机废弃物处理[12-15]。通过利用家蝇作为生物转化器对孽生环境中农业有机废弃物进行转化,发现可有效利用酒糟生产蝇蛆蛋白和生物有机肥[16-17],随后通过试验证明家蝇对秸秆类木质纤维素具有降解作用,同时随着研究的深入,首次证实了家蝇体内含有内源性纤维素酶——BG酶(β-Glucosidase,β-葡萄糖苷酶)[18],并初步对重组家蝇BG蛋白的酶学特性和组织定位进行了研究。RNA干扰技术(RNA interference,RNAi)是一种双链RNA (double-stranded RNA,dsRNA)分子在mRNA水平关闭相应序列基因表达使其沉默的过程,是一种序列特异性的转录后基因沉默(Post-transcriptional gene silencing,PTGS)。目前,RNAi作为分析基因功能的潜在策略已被广泛应用。【研究切入点】作为纤维素降解的重要限速酶BG,其在家蝇体内的具体功能尚不明确。【拟解决的关键问题】因此,利用RNAi技术干扰家蝇内源纤维素酶BG基因的表达,探究BG基因被干扰后对消化道纤维素酶活性的影响,初步分析家蝇BG在家蝇体内的功能,为利用RNAi技术深入研究家蝇BG在木质纤维素降解中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 家蝇(Muscadomestica)于贵州医科大学现代病原生物学特色重点实验室传代繁殖,温度28℃,相对湿度70%,光照周期12L∶12D。
1.1.2 质粒与菌株 克隆载体pMD19-T、感受态细胞Escherichia.coli-DH5α均购买于宝生物工程(大连)生物有限公司。
1.1.3 主要试剂 RNAiso plus、无水乙醇、氯仿、异丙醇、葡萄糖、琼脂糖、LB肉汤培养基、醋酸-醋酸钠溶液、氨苄(Ampicilin)粉末(贵州凯信生物科技有限责任公司),滤纸片(杭州特种纸业有限公司),水杨苷、羧甲基纤维素钠(CMC)、微晶纤维素(MCC,Sigma),DNA marker DL2000、6×Loading Buffer(TaKaRa公司)、3,5-二硝基水杨酸(DNS)、DEPC水、磷酸盐缓冲盐溶液(PBS,索莱宝)。逆转录试剂:PrimeScript@RT reagent Kit with gDNA Eraser;MiniBEST小量质粒抽提纯化试剂盒:TaKaRa MiniBEST Plasmid Purification Kit Ver.4.0;DNA凝胶回收试剂盒:TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0;PCR扩增试剂盒:Ex TaqTM Version 2.0 plus dye(以上试剂盒均购于日本TaKaRa公司);dsRNA合成试剂盒:MEGAscriptR RNAi Kit(赛默飞);BCA蛋白浓度测定试剂盒(索莱宝)。
1.2 方法
1.2.1 引物设计 利用Primer 5.0和DNA Club设计BG、绿色荧光蛋白(GFP)特异性引物及干扰引物,GAPDH为内参基因,所用引物见表1。

表1 试验用引物名称及序列Table 1 Name and sequence of the tested primers
1.2.2 dsRNA的制备 用TaKaRa小量质粒抽提纯化试剂盒提取预先构建质粒pMD19T-BG,以提取的质粒DNA为模板进行PCR扩增,反应体系为50 μL:质粒DNA模板1.5 μL,2×Ex Taq酶25 μL,上下游引物各1 μL,ddH2O 21.5 μL。BG的PCR反应条件:95℃预变性5 min;94℃变性30 s,47℃退火60 s,72℃延伸30 s,共32个循环;72℃延伸10 min,4℃保存。GFP的PCR反应条件:95℃预变性5 min;94℃变性30 s,56℃退火45 s,72℃延伸30 s,共32个循环;72℃延伸10 min,4℃保存。PCR 产物经1%琼脂糖凝胶电泳后用TaKaRa凝胶回收试剂盒进行纯化,置于-20℃保存。以回收的DNA片段为引物,分别以两端加有T7启动子序列的引物进行PCR扩增,PCR反应条件:94℃预变性5 min;94℃变性30 s,分别以61.5℃、63℃、64℃退火60 s,72℃延伸30 s,共32个循环;72℃再延伸10 min,产物经电泳后进行回收纯化。按MEGAscriptR RNAi Kit试剂盒说明书先建立转录反应体系:胶回收产物 2 μg,10×T7reaction Buffer、ATP solution、CTP solution、GTP solution、UTP solution、T7Enzyme Mix各2 μL,Nuclease-free Water补足至20 μL,37℃恒温水浴 8 h;所得溶液中加入10×T7Digestion Buffer、DNase Ⅰ、RNase各2 μL,Nuclease-free Water 21 μL,37℃恒温水浴1.5 h以去除DNA和ssRNA;通过向上步获得溶液中加入Nuclease-free Water 150 μL,10×Binding Buffer 50 μL,100% Ethanol 250 μL。再经过柱、洗涤后进一步纯化dsRNA,用1%琼脂糖凝胶电泳检测,ND2000检测dsRNA浓度,置于-80℃备用。
1.2.3 RNAi家蝇2龄幼虫 采用显微超微量注射仪将400 ng BG-dsRNA从家蝇2龄期幼虫倒数第2节腹节处导入,以注射GFP-dsRNA的幼虫为对照,各组幼虫均饲养于28℃人工气候箱中。
1.2.4 家蝇总RNA的提取及cDNA的合成 根据RNAiso PLUS的步骤在干扰后不同时间点提取幼虫消化道的总RNA,通过电泳检测和ND2000紫外分光光度计测定A260/A280的比值、浓度,选择A260/A280为1.8~2.0的样品,并以1 μg总RNA作为模板用PrimeScript@RT reagent Kit with gDNA Eraser逆转录试剂盒合成cDNA。
1.2.5 定量PCR检测基因沉默效率 在干扰后的9 h、12 h、15 h、18 h、21 h、24 h、30 h、36 h、48 h收集幼虫消化道,每个时间点取4只幼虫的消化道组织装入1.5 mL EP管后冻存于-80℃冰箱,提取收集样品的总RNA,逆转录成cDNA,以逆转录的cDNA为模板,GAPDH为内参基因,利用qRT-PCR检测干扰后BG基因的表达量,反应体系为10 μL:cDNA 1 μL、BG-F 0.4 μL、BG-R 0.4 μL、SYBR Premix Ex Taq Ⅱ(2×)5 μL、ddH2O 3.2 μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,共40个循环,溶解曲线确定扩增片段特异性,每个重复3次。
1.2.6 家蝇幼虫粗酶液的制备 用ddH2O清洗家蝇幼虫体表,超纯水中浸泡1 h,尽量排除幼虫肠道内容物,75%酒精浸泡10 min,ddH2O洗2次,滤纸吸干体表水分,取20只幼虫置于1.5 mL EP管中,加入0.1 mol/L醋酸-醋酸钠缓冲液(pH 5.6)500 μL,用手持均质仪研磨匀浆后,在4℃、12 000 r/min离心10 min,所得上清为粗酶液,将其吸出转至新无菌无酶EP管中,置于-80℃保存备用。
1.2.7 滤纸酶、BG、CBH及EG酶活性检测 离心管中分别加入滤纸片、水杨苷、微晶纤维素、羧甲基纤维素钠10 mg和0.3 mL醋酸-醋酸钠缓冲液,滴加0.1 mL粗酶液,混匀后50℃水浴1 h;加0.3 mL DNS试剂,沸水浴5 min,冷却至室温;缓冲溶液稀释定容至3 mL,于540 nm波长测 OD540,每个样本3次重复。阴性对照以缓冲液代替粗酶液,根据葡萄糖标准曲线计算生成的葡萄糖含量。以50℃,pH 5.6条件下,每1 min产生1 mol 葡萄糖所需的酶量定义为1个酶活性国际单位(IU)。纤维素酶活性大小用比活力[19]即1 mg蛋白中的酶单位数量来表示。
纤维素酶比活力(IU/mg)=5.56m/(VCt)
式中,m为产生的葡萄糖含量(mg);5.56为1 mg 葡萄糖的微摩尔数(1 000/180=5.56)C为粗酶液蛋白浓度(mg/mL),V为反应液中加入的粗酶液体积(mL),t为反应时间(min)。
1.3 数据处理
利用Excel 2007整理数据及绘图,各处理相关指标数据均以平均数±标准差表示。利用SPSS Statistics 25.0,采用Duncan新复极差法对数据在显著性水平0.05条件下进行单因素方差分析。
2 结果与分析
2.1 家蝇BG基因的扩增
以pMD19T-BG为模板用特异性的克隆引物,经PCR扩增后显示在1 000~2 000 bp有1条特异性的条带(图1),该条带与预期结果(1 689 bp)相一致。

注:M,DL2 000 DNA Marker;1,BG 基因扩增产物。Note:M, DL2 000 DNA Marker;1,amplification product of BG gene.图1 家蝇 BG基因PCR扩增产物的琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophoretogram of PCR amplification product of BG gene of M. domestica
2.2 目的片段连接T7启动子及dsRNA的合成
分别采用3对带有T7启动子的特异性引物进行PCR扩增,经电泳检测在500~750 bp出现1条特异性的条带(图2a),大小与预期结果一致。将产物进行切胶回收,在T7聚合酶的作用下转录合成dsRNA,经洗涤、过柱纯化后得到dsRNA,经1%琼脂糖凝胶检测在500~750 bp出现1条特异性条带(图2b),经检测,dsRNA的吸光度值之比A260/A280为2.0~2.1,说明合成的dsRNA纯度符合后续试验要求,且合成的dsRNA浓度分别为751 ng/μL、465 ng/μL和398 ng/μL。

注:M,DL2 000 DNA Marker;1,2,3,PCR扩增产物。
Note:M,DL2 000 DNA Marker;1,2 and 3,PCR amplification product.
图2BG基因连接T7启动子后的PCR产物及
合成的dsRNA电泳图谱
Fig.2 Electrophoresis of PCR products and synthesized dsRNA afterBGgene connected to T7promoter
2.3 干扰后不同时间点消化道中BG基因沉默效率
如图3所示,干扰后9 h,BG基因的表达量与对照组无显著差异;干扰后12 h、15 h、18h、21 h、24 h、30 h和48 hBG基因表达量分别显著下降33.5%、41%、62%、29%、22%、17%和11%。其中,干扰后18 h达到最佳干扰效果,随时间的延长家蝇消化道内受抑制的BG基因的表达逐渐恢复。说明,合成的BG-dsRNA可成功沉默家蝇BG基因,并在干扰后18 h达最佳干扰效果。

注:ns、*、**和***分别表示无显著性,在0.05、0.01和0.001水平上显著。Note:The ns,*,**,*** indicates no significance,significance at 0.05 level,at 0.01 level and at 0.001 level,respectively.图3 注射dsRNA后消化道组织中BG基因的相对表达量 Fig.3 Relative expression of BG gene in digestive tract tissue after dsRNA injection
2.4 干扰前后滤纸酶活性
由图4可知,家蝇消化道不同时间的滤纸酶活性(Filter paper activity,FPA)在干扰后9 h、12 h、18 h和24 h,与对照组相比FPA显著降低,分别降低31%、36%、49%和34%。说明,干扰BG基因抑制家蝇消化道的滤纸酶活性。
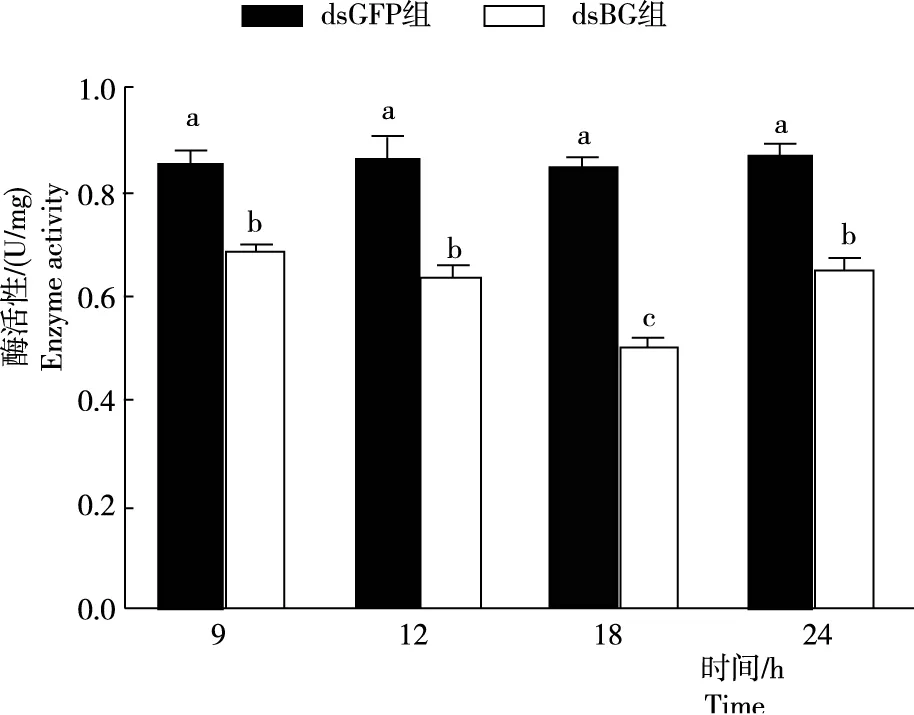
注:同一时间的不同小写字母表示P<0.05水平上显著,下同。Note:Different lowercase letters in the same time indicate significant difference at P<0.05 level.The same below.图4 注射dsRNA 后家蝇的 FPAFig.4 FPA in digestive tract tissue of M. domestica after dsRNA injection
2.5 干扰前后BG酶活性
从图5可知,干扰后9 h,BG酶活性与对照组相比无显著变化;干扰后的12 h、18 h和24 h,BG酶活性显著降低,分别降低24%、36%和26%。说明,干扰BG基因抑制家蝇消化道的BG酶活性。

图5 注射dsRNA后家蝇的BG酶活性 Fig.5 BG activity of M. domestica after dsRNA injection
2.6 干扰前后外切纤维素酶(CBH)酶活性
从图6可见,注射dsRNA后9 h、12 h、18 h和24 h后,CBH酶活性均无显著变化。

图6 注射dsRNA后家蝇的CBH活性Fig.6 CBH activity of M. domestica after dsRNA injection
说明,干扰BG基因不影响家蝇消化道的CBH酶活性。
2.7 干扰前后EG酶活性
从图7可见,注射dsRNA后9 h、12 h、18 h和24 h后,dsGFP阴性对照组与dsBG组测定的EG酶活性无显著差异。说明,干扰BG基因不影响家蝇消化道的EG酶活性。

图7 注射dsRNA后家蝇的EG活性 Fig.7 EG activity of M. domestica after dsRNA injection
3 讨论
与传统的基因功能研究方法相比,RNAi技术在基因功能研究上有其独特的优点,其技术灵敏、易行,结果稳定。在本研究中,干扰组采用家蝇2龄期幼虫注射400 ng BG-dsRNA、对照组采用家蝇2龄期幼虫注射400 ng GFP-dsRNA,与对照组相比,在干扰后18 h达最佳干扰效果,家蝇BG的表达量下降62%,在24 h时表达量虽开始出现上调,但仍低于对照组BG mRNA的表达水平,由此提示合成的dsRNA可成功沉默家蝇BG基因的表达。RNAi的沉默效应具有特异性但也具有时效性,这导致干扰后达最佳沉默效率后出现上调的原因。但在不同物种中时效性的表现不同。如WU等[20]通过注射及饲喂dsRNA的方式对白蚁内切葡聚糖酶进行干扰显示,在干扰后的72 h白蚁基因的表达仍处于受抑制状态,且一直呈下降趋势。而本研究干扰时效结果与苏佩佩等[21]利用RNAi研究家蝇几丁质酶功能结果趋势类似,表明,在干扰后12 h家蝇MdCht2干扰效果最佳,且24 h同样出现上调。
现有昆虫木质纤维素酶研究表明,不同种类的昆虫其木质纤维素酶的组成不同,同一类木质纤维素酶,昆虫种类不同,酶的底物特异性、在昆虫各组织器官的分布和行使的功能也有变化。本研究中通过设置不同的底物即可检测出干扰前后家蝇体内纤维素酶的变化,由于纤维素酶间的相互协作和反馈调节机制,当BG酶受到抑制时,其余2种酶的活性是否也相应发生变化有待进一步验证。对家蝇BG基因进行干扰后,滤纸酶活性和BG酶活性降低,而CBH酶和EG酶活性未受影响。与LIU等[22]报道的情况类似,即当对白蚁内源性编码CBH酶的基因进行干扰后,仅有CBH酶活性受到抑制,EG酶及β-葡萄糖苷酶活性不受影响。但该结果与课题组前期的研究结果[23]存在差异,其对重组家蝇BG酶活性研究发现,重组家蝇BG酶在体外同时具有BG、EG和CBH 3种酶的活性。分析原因,一方面可能是家蝇BG在被干扰后β-葡萄糖苷酶活性受抑制,阻碍纤维二糖水解为葡萄糖,导致纤维二糖的堆积,但在干扰24 h后BG酶活性逐渐恢复,短暂的抑制使负反馈机制尚未进行或纤维二糖的堆积尚不能引起负反馈反应;另一方面可能是家蝇内源BG酶本身在体内仅具有BG酶功能,不具备EG和CBH酶的功能。
4 结论
在体外完成dsRNA的合成并成功抑制BG基因在家蝇体内表达,利用RNAi技术初步探明家蝇内源性BG基因在家蝇体内的功能发现,BG基因的表达受到抑制可显著降低滤纸酶和β-葡萄糖苷酶活性但对家蝇体内CBH及EG酶活性无影响,为后期继续利用RNAi技术深入研究家蝇BG对木质纤维素降解作用奠定基础。
