骨质疏松兔颅骨骨缺损模型的建立
2023-02-05田彬刘长松程为
田彬 刘长松 程为
骨质疏松症是以骨组织微结构破坏和骨量减少为主要病理特征的一种全身性骨骼疾病[1]。骨质疏松症患者的牙槽骨局部表现为骨密度减低、骨愈合减缓和骨吸收增加,因此易于发生骨组织缺损。我国正在逐步步入老龄化社会,骨质疏松症的发病率逐年提高[2,3]。大量的口腔种植相对禁忌的骨质疏松症患者在缺牙局部同时存在骨组织的缺损,因此给口腔种植带来极大的挑战,很多学者已经开始着手这方面的研究。因此,建立一个可靠、可行且相对简单的骨质疏松症的骨缺损动物模型来进行相关的前期实验研究具有至关重要的意义[4]。我们的研究建立了骨质疏松兔的颅骨缺损动物模型,从而为深入研究骨质疏松症患者的骨增量的研究奠定基础。
1.材料与方法
1.1 实验动物 48 只雌性5月龄,体重(2.5±0.25)kg 的普通级新西兰大白兔,首都医科大学附属北京口腔医院实验动物伦理委员会审查通过实验动物的使用(伦理号:KQYY-201803-002)。
1.2 骨质疏松造模实验 将所有动物随机分为2组(A 组,B 组),每组24只动物。再将每组随机分成4 组,每组6 只动物。其中A 组为:A1、A2、A3、A4,B 组为:B1、B2、B3、B4。速新眠II 0.2 ml/kg和舒泰10 mg/kg 混合后肌肉注射,全身麻醉实验兔。沿腹中线做5 cm 纵行切口切开腹腔。(1)A 组(造模组):结扎双侧卵巢及附件后摘除,关闭创口。(图1)(2)B 组(对照组):找到卵巢后切取邻近的等量脂肪组织即缝合创口。

图1 卵巢切除手术图
1.3 验证骨质疏松造模实验 卵巢切除手术后3个月将A1及B1组实验动物全部处死,取股骨头。股骨头通过微型计算机断层扫描系统(microCT:Siemens Inveon Micro,德国)进行360°旋转扫描,数据三维重建进行分析。标本扫描后,脱钙处理,切片行HE染色。
1.4 颅骨缺损造模实验 剩余6组动物(均为进行完上述手术的实验组或对照组),进行颅骨缺损造模。
实验兔全身麻醉,于颅顶区制备圆形直径5 mm 的全层骨缺损(诺瓦格MD20种植机)。骨缺损在颅骨的一侧距离骨缝2 mm 的位置,硬脑膜完整(图2)。骨缺损仅以新鲜出血形成的血凝块充盈,缝合骨膜、皮下组织、皮肤。
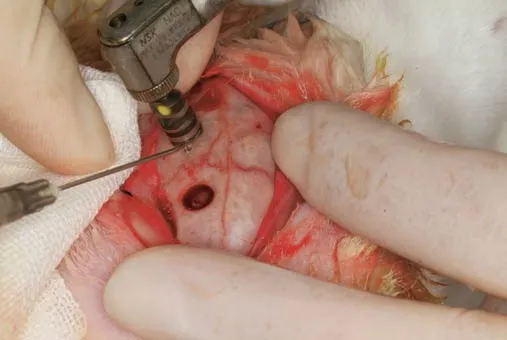
图2 颅骨缺损造模手术图
分别在颅骨手术后4 周处死A2、B2 组,术后8周处死A3、B3组,术后12周处死A4、B4组。
动物处死前2周耳缘静脉注射10 mg/ml钙黄绿素注射液,动物处死前3、4 天注射10 mg/ml 茜素红注射液。实验兔处死后取颅骨标本,脱水,缺损区制备硬组织磨片。共聚焦显微镜(Olympus,日本)激发标本的钙黄绿素的绿色荧光和茜素红的红色荧光,采集图像。然后,甲苯胺蓝染色标本。对标本进行组织形态学分析:新骨面积比(%)=(新形成骨面积,mm2)/(总面积,mm2)×100(%)。
1.5 统计分析 采用SPSS 20.0 统计软件进行数据分析,计量资料以“均数±标准差”表示,统计方法采用ANOVA 单因素方差分析比较各组间及组内差异,P<0.05认为差异有统计学意义。
2.结果
2.1 大体观察 实验兔术后伤口无红肿、开裂及腹腔积脓感染等,愈合良好。A 组实验动物卵巢摘除术后三个月时,毛色灰暗,体重增加明显,与B组有显著性差异(图3)。

图3 实验兔体重统计图(n=24,A:实验组;B:对照组。NS:无统计学差异;*:P<0.05)
2.2 股骨头MicroCT 图重建 股骨Micro CT三维重建图可见:A1 组股骨头骨密度低于B1 组,皮质骨厚度变薄,骨髓腔增大;松质骨骨小梁稀疏、连接率降低、孔隙率增加。A1 组股骨颈骨皮质厚度变薄,明显薄于B1组。(图4)

图4 实验兔卵巢切除3个月前、后股骨头MicroCT重建图
2.3 股骨头HE 染色图(图5)B1 组(未切除卵巢组)骨皮质较厚,厚度均匀、完整;松质骨骨小梁丰富,粗大,排列密集,骨量丰富。

图5 实验兔股骨头脱钙切片HE染色图
A1 组相比B1 组:骨皮质明显变薄,厚度不均匀;松质骨骨小梁变细,稀疏,数目变少,部分断裂消失;骨量明显减少,髓腔扩大。
2.4 兔颅骨磨片的荧光检测(图6)激光共聚焦显微镜下,螯合钙黄绿素的新生骨组织在特定波长激发光下呈现亮绿色,螯合茜素红的新生骨组织呈现红色。分别拍摄的两种荧光条带,合成图像,读取灰度值,通过Image J 图像分析软件进行统计学分析。
⑮Jane Yakowitz Bambauer,“The New Intrusion”,Notre Dame Law Review,88(1),2012,pp.205 ~277.

图6 颅骨骨组织缺损区域不脱钙磨片荧光融合图片及统计图
颅骨术后4 周,骨缺损边缘只有很少量的不规则新骨形成,骨缺损的中心区新生骨组织极少观察到。两组间没有显著性差异,均形成约5%的新生骨组织。
颅骨术后8 周,新骨形成量略有增加,骨质疏松组A3组仅比4周时A2组新骨略多,对照组B3组缺损区边缘向中心区不规则生长新生骨组织,A3组明显少于B3组。
颅骨术后12 周,B4 组可观察到岛状的新生骨组织位于骨缺损中心区,B4 新生骨几乎达到10%,而A4 组仅向缺损中心区略有增多(新骨形成量约7%),两组间差异有统计学意义。
2.5 组织形态学检测(甲苯胺蓝染色)(图7)甲苯胺蓝染色的组织学切片与荧光标记图片一致(图7)。新生骨组织被染成蓝色,主要位于骨缺损边缘和骨组织表面,骨缺损的中心区也少量存在。

图7 甲苯胺蓝染色的骨组织缺损区域组织形态学图片及统计图
结果统计学分析发现颅骨缺损手术后4 周A2组与B2组无显著性差异,术后8周、12周A3、A4组新骨形成量均显著低于B3、B4 组,差异有统计学意义。
3.讨论
随着我国老龄人口逐年增多,骨质疏松作为一个社会性的健康问题,越来越受到医学各专业的关注。缺牙同时伴随牙槽骨骨缺损而需要种植牙的骨质疏松症患者日益增多,因此首先需要进行动物模型的相关研究。
3.1 骨质疏松动物模型的建立 目前,小鼠、大鼠、兔、犬、羊、猪等均可用于建立骨质疏松的动物模型,这些动物在实验研究中各有优缺点。大鼠[2,5]、小鼠体型较小,难以提供足够的骨量进行骨重建方面的研究。犬雌激素分泌明显低于人类,不适合做骨质疏松动物模型。羊[6、7]为食草反刍动物,钙、磷及维生素代谢与人相差较大。猪及灵长类动物生长周期长,实验周期长,因此成本较高。兔饲养周期短,成熟快,骨骼改建短期内就可观察到骨组织改变,从而缩短实验周期。兔体型中等;出生5-8个月性成熟后,骺板闭合,与人类相似[8];兔的颌骨体积较小、骨量较少,骨缺损造模及骨重建手术不易观察效果;颌骨骨重建手术后动物的活动及进食均影响实验结果;胚胎学上兔颅骨与颌骨均通过膜内成骨方式成骨,具有同源性,因此兔颅骨是研究颌骨重建与改建的首选材料[9]。基于以上原因,我们选择兔作为实验动物。
3.2 骨质疏松颅骨缺损模型的建立 伴随着老龄化社会的到来,老龄人口越来越多,其中60岁以上人群骨质疏松的发病率约为59.89%。这部分庞大数量的骨质疏松老龄患者的牙齿缺失常常伴随牙槽骨的缺损,成为目前临床中的一大难题。因此急需建立骨缺损的骨质疏松动物模型进行前期的研究。骨缺损的动物模型已经相对成熟,但能否将其应用于骨质疏松的动物模型上,文献中鲜有报道。
在胚胎学上,颅骨与颌骨具有同源性,均通过膜内成骨方式成骨;解剖学上,二者形态、结构相似,均由内、外的皮质骨夹中间的松质骨构成。因此将颌面部骨替代材料在兔颅骨缺损模型中检测具有明显的优势。当骨缺损的范围超出了机体骨组织的再生极限——临界骨缺损(critical size defects,CSD),必须借助骨替代材料才能使骨缺损达到愈合[15]。对于兔颅骨的临界骨缺损有多种理论[16],不同的研究选用不同的形状以及不同的尺寸作为临界骨缺损进行骨组织工程学的研究,以往文献中鲜有关于骨质疏松兔的颅骨缺损的研究,我们经过文献考证及前期实验,选择了在兔颅骨制备直径5 mm 圆形全层骨缺损进行实验研究。本实验的第二部分实验结果(荧光照片及不脱钙磨片甲苯胺蓝组织学结果)可见,兔颅骨制作直径5 mm的圆形骨缺损,骨质疏松组术后骨缺损区域新骨形成率在4 周、8 周、12 周均低于对照组,尤其是8 周和12 周时明显低于对照组;且所有骨质疏松组骨缺损区域新骨形成均低于10%。由此可以得出,我们建立了骨质疏松兔颅骨骨缺损模型,为后续的研究奠定了基础。
