三种补肾方含药血清对衰老骨髓间充质干细胞成骨分化及Runx2 表达的影响
2023-02-04杨强健董克芳林少如
杨强健,董克芳*,王 凡,林少如,黄 勇,李 为
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第二附属医院,湖南 长沙 410005
骨质疏松症是一种常见的代谢性骨病,严重危害公众的健康,其特点主要是骨量减少、微结构破坏,是老年人骨折常见的根本原因[1-2]。 骨转换失衡是骨质疏松症发病的基本病理机制之一,而导致这一病理过程的原因可能与骨髓间充质干细胞(bone marrow mesenchymal stem cel1s, BMSCs)的成骨、成脂分化能力的失衡直接相关[3]。 BMSCs 存在于许多组织中,可以分化为成骨细胞、脂肪细胞、软骨细胞、神经细胞和心肌细胞等[4]。随着人们年龄的增长,机体逐渐衰老,骨重建逐渐处于负平衡状态,人体的骨骼成分丢失,从而引起骨质疏松症的发生[5]。因此,探寻促进成骨分化进而诱导衰老BMSCs 向成骨方向分化,是防治骨质疏松症的重要研究方向。 目前,在临床上治疗骨质疏松症的药物品种繁多,作用机制各异,但都存在潜在的不良反应[6-7],中医药防治骨质疏松症有独特的优势,近年来,包括中药在内的食物疗法防治骨质疏松症开始引起人们的关注。 与传统化学合成药物相比,有着几千年用药经验的中药以不良反应较少、长期使用效果更明显等特点而得到认可[8]。 健骨二仙丸是岭南伤科萧劲夫教授针对骨质疏松症的多年临床验方,由明代王三才《医便·卷一·龟鹿二仙胶》中龟鹿二仙胶加续断、山药组成,并有研究证实,健骨二仙丸能有效促进成骨细胞分化而调控骨转化失衡[9]。 金匮肾气丸出自东汉末年张仲景《金匮要略·消渴小便不利淋病脉证并治》,六味地黄丸出自宋代钱乙所著《小儿药证直诀》,均是温肾补精的经典方剂,能有效防治骨质疏松症等疾病[10-11]。 因此,本实验采用健骨二仙丸、六味地黄丸和金匮肾气丸含药血清干预衰老BMSCs,研究3 种补肾方对衰老BMSCs 成骨分化过程中细胞形态变化和Runt 相关转录因子2(Runt-related transcription factor2, Runx2)表达的影响,以探究其防治骨质疏松症的作用机制。
1 材料
1.1 实验动物
SPF 级雄性SD 大鼠40 只,购自湖南斯莱克景达实验动物有限公司,合格证号SYXK(湘)2019-0004,鼠龄3~4 周,体质量(100±10) g,自由取食涉水,饲养在温度20~22 ℃、湿度40%~70%的环境下。实验操作均在湖南中医药大学动物实验中心完成,动物使用许可证号SYXK(湘)2019-0009。
1.2 药物、试剂及仪器
健骨二仙丸(由龟甲、鹿角胶、党参、枸杞子、续断、山药按1∶1∶3∶6∶6∶6 比例组成,共345 g);六味地黄丸(由熟地黄、山药、山茱萸、泽泻、茯苓、牡丹皮按8∶4∶4∶4∶3∶3 比例组成,共78 g);金匮肾气丸(由干地黄、山药、山茱萸、泽泻、茯苓、牡丹皮、桂枝、附子按8∶4∶4∶4∶3∶3∶1∶1 比例组成,共81 g)。 上述中药超微饮品均由湖南中医药大学第二附属医院提供。
DMEM/F12 培养基(赛默飞世尔科技有限公司,批号:ZQ1318);大鼠BMSCs(武汉普诺赛生命有限公司,批号:CP-R131);胰酶消化液、双抗(青链霉素)(上海碧云天生物技术有限公司,批号:C0201、SV30010);胎牛血清(美国Gibico 公司,批号:10099141)。
超净工作台(北京亚泰科隆仪器技术有限公司,型号:YT-CJ-2NB);直热式CO2培养箱(上海三腾仪器有限公司,型号:DH-1601);倒置生物显微镜(北京中显恒业仪器仪表有限公司,型号:DSZ2000X);低速离心机(上海知信实验仪器技术有限公司,型号:SL02);多功能酶标分析仪(深圳市会松科技发展有限公司,型号:MB-530)。
2 方法
2.1 含药血清的制备
40 只大鼠适应性喂养1 周后,随机分成4 组,制备含药血清[12],分别为空白血清组、健骨二仙丸组、六味地黄丸组和金匮肾气丸组,每组10 只。 给药剂量按体表面积方法换算[13],含药血清组分别按照75.9、85.8、89.1 g/kg 剂量灌胃给药,每天2 次,连续7 d,最后1 天给药结束后1 h 腹主动脉取血,置无菌管中。 所采集的血液在室温下静置2 h 后,3500 r/min 离心15 min(离心半径10 cm),吸取上清,0.22 μm 一次性滤过器过滤除菌,56 ℃水浴锅灭活30 min,-80 ℃超低温冷冻冰箱储存备用。
2.2 BMSCs 培养
将BMSCs 细胞株培养于含10% FBS+1%双抗的DMEM/F-12 培养基中,37 ℃、5% CO2、饱和湿度培养箱中培养。
2.3 衰老BMSCs 制备及分组
参照相关文献[14]方法,将培养好的第3 代BMSCs细胞以5×103个细胞/孔种植于96 孔板中,用浓度为500 μmol/L 的30% H2O2分别处理24 h,制备衰老BMSCs。 将其分为6 组:模型组、诱导组、空白血清组、健骨二仙丸含药血清组、六味地黄丸含药血清组、金匮肾气丸含药血清组。
2.4 衰老BMSCs 成骨诱导
分组完成后,以2.0×105/cm2的浓度接种于6 孔板中,每孔加2 mL 含10% FBS 的L-DMEM 培养液。 当细胞贴壁生长达到60%~70%融合时,将培养基更换为成骨培养基、含药血清、空白血清,分别进行诱导,诱导条件分别为:(1)模型组,DMEM/F12 培养基;(2)诱导组,成骨培养基;(3)血清组,成骨培养基中分别加入健骨二仙丸含药血清、金匮肾气丸含药血清、六味地黄丸含药血清和空白血清,培养2周,每隔3 天更换1 次培养液。
2.5 指标检测
2.5.1 衰老BMSCs 代谢活力检测 500 μmol/L 的30% H2O2分别处理24 h,采用CCK-8 法[15]进行检测。 取对数增长的BMSCs,以1×104个细胞/孔密度接种于96 孔板内,每孔100 μL,各组均设5 个复孔。细胞贴壁后,按照如上方法处理相应的时间后,加入10 μL/孔的CCK-8,用完全培养基配制CCK-8溶液,去除含药培养基,每孔加入100 μL 含有CCK-8的培养基。37 ℃、5% CO2继续孵育4 h 后于多功能酶标分析仪分析,450 nm 处测定细胞吸光度(OD)值。
2.5.2 细胞形态学的观察 将制备好的衰老BMSCs 诱导相应时间后,PBS 清洗细胞2 遍,加4%多聚甲醛固定30 min。 PBS 清洗2 遍,加入茜素红染液,室温染色30 min,PBS 清洗3 遍后于显微镜下拍照。 分别于培养后第4、8、12、16 天通过倒置显微镜数字摄像系统采集图像,观察并采集各孔中细胞的形态学和组织学变化图像。
2.5.3 Western blot 法检测Runx2 蛋白表达 冰冷PBS 洗涤细胞,加入裂解液,收集悬液,超声破碎,裂解后,4 ℃、12 000 r/min离心15 min(离心半径10 cm)。根据BCA 蛋白定量试剂盒使用说明测定蛋白浓度。制胶,电泳,转膜切胶;转膜后封闭(1×PBST 配制5%脱脂牛奶);一抗孵育(Runx2 稀释比例1∶1000);二抗孵育(鼠抗稀释比例1∶5000);孵育1×PBST 缓冲液漂洗3 次,每次10 min;ECL 显色曝光成像。
2.5.4 RT-PCR 检测Runx2 mRNA 相对表达量 Trizol 提取总RNA,RNA 反转录,NCBI 上搜索目的基因序列,运用primer 5 软件设计引物,由上海生工合成引物,引物名称及序列见表1。
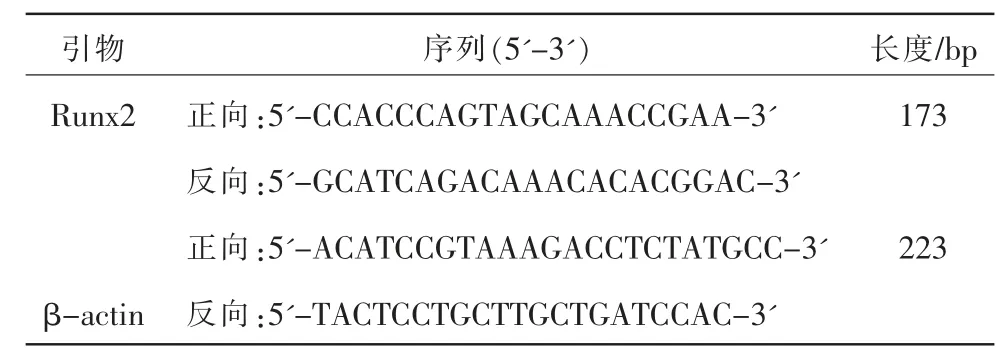
表1 引物名称及序列
2.6 统计学分析
3 结果
3.1 BMSCs 代谢活力比较
与正常BMSCs 相比,H2O2处理后的BMSCs 细胞OD 均值明显降低(P<0.05),可见经H2O2处理后的BMSCs 细胞活性降低。 详见图1。
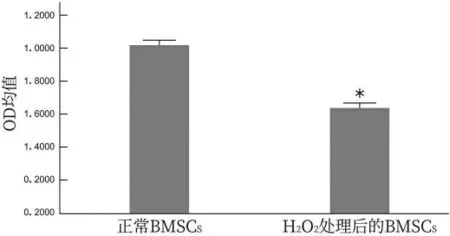
图1 BMSCs 经H2O2 处理后细胞活性情况
3.2 各组细胞形态学观察
对比模型组,诱导组和空白血清组衰老BMSCs在分化过程中,茜素红染色增多,即钙离子增多,成骨分化增多;对比诱导组及空白血清组,各含药血清组衰老BMSCs 在分化过程中,茜素红染色增多,即钙离子增多,成骨分化增多;且除模型组外,各组随着时间推移,茜素红染色不断增加,即钙离子增多,成骨分化增多。 详见图2。
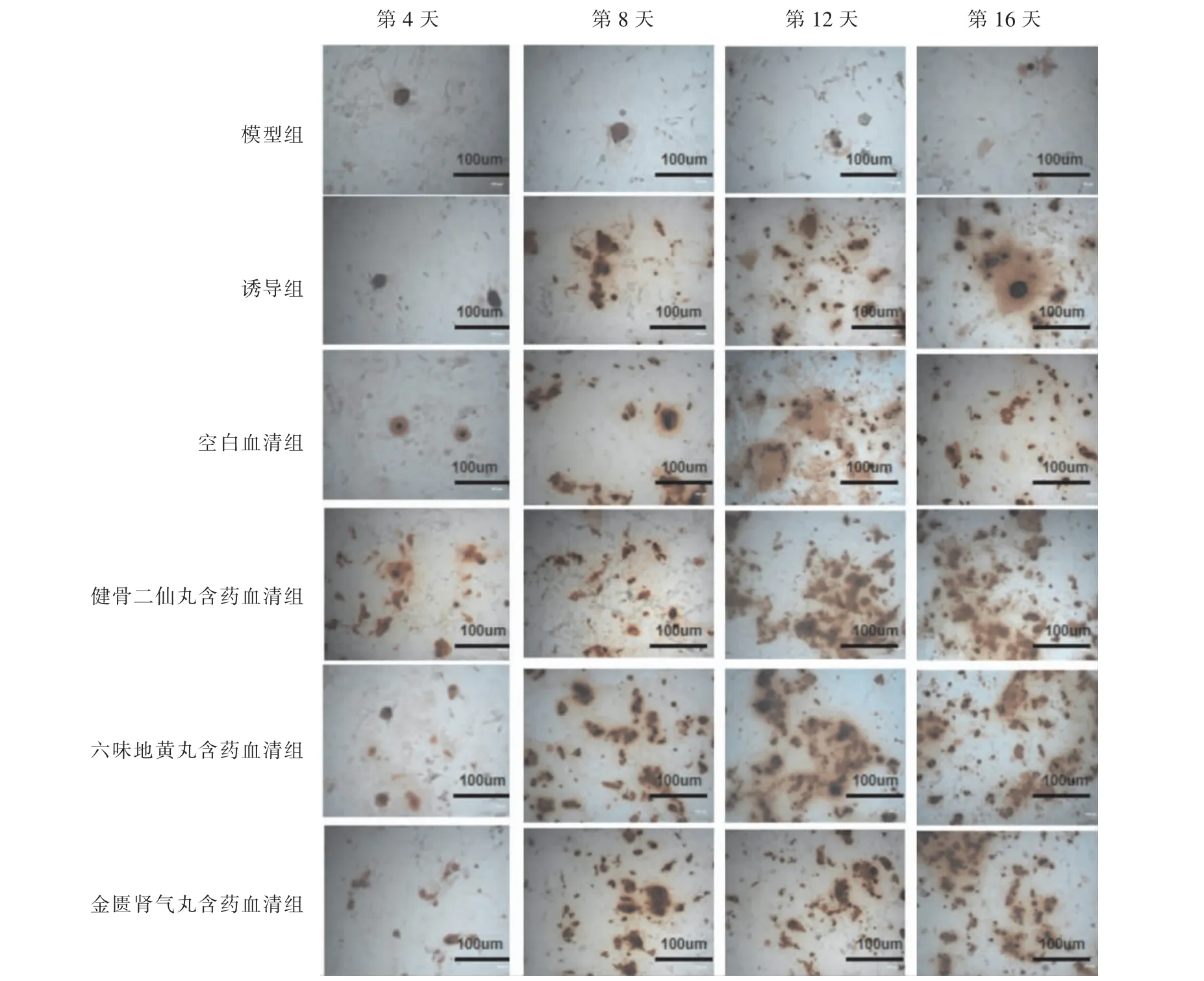
图2 各组不同时间衰老BMSCs 茜素红染色图(×100)
3.3 各组Runx2 mRNA 和蛋白表达比较
在第4、8、12、16 天,对比模型组,诱导组、空白血清组Runx2 mRNA 和蛋白表达水平均升高(P<0.05);对比诱导组、空白血清组,健骨二仙丸含药血清组、金匮肾气丸含药血清组Runx2 mRNA 和蛋白表达水平均升高(P<0.05)。在第4、8、16 天,对比诱导组,六味地黄丸含药血清组Runx2 mRNA 和蛋白表达水平升高(P<0.05)。在第4、12、16 天,对比空白血清组,六味地黄丸含药血清组Runx2 mRNA 和蛋白表达水平升高(P<0.05)。 详见表2、图3~4。
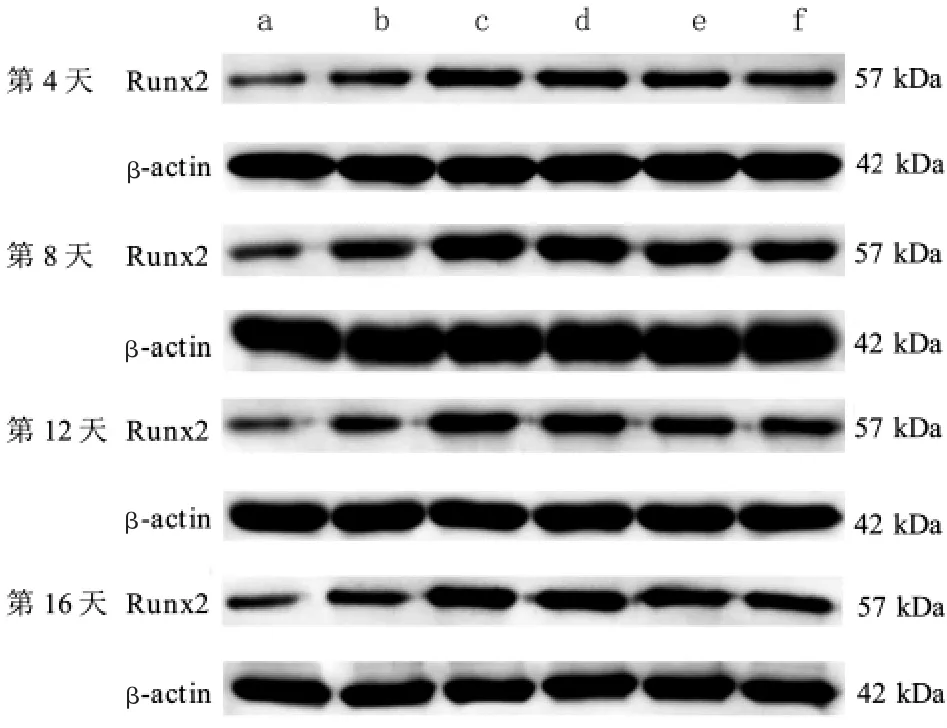
图3 各组衰老BMSCs 中Runx2 蛋白电泳图
表2 各组衰老BMSCs 中Runx2 mRNA 相对表达量(±s,n=3)

表2 各组衰老BMSCs 中Runx2 mRNA 相对表达量(±s,n=3)
注:与模型组相比,▲P<0.05;与诱导组相比,★P<0.05;与空白血清组相比,■P<0.05。
组别模型组诱导组空白血清组健骨二仙丸含药血清组金匮肾气丸含药血清组六味地黄丸含药血清组第4 天1.01±0.16 1.52±0.18▲1.70±0.21▲3.27±0.32▲★■2.93±0.10▲★■2.61±0.62▲★■第8 天1.11±0.17 2.18±0.17▲2.36±0.43▲3.86±0.49▲★■3.64±0.66▲★■2.86±0.28▲★第12 天1.23±0.07 2.90±0.08▲2.65±0.16▲4.33±0.47▲★■3.91±0.16▲★■3.17±1.04▲■第16 天1.32±0.11 3.02±0.32▲3.12±0.41▲4.93±0.50▲★■4.56±0.61▲★■4.09±0.65▲★■
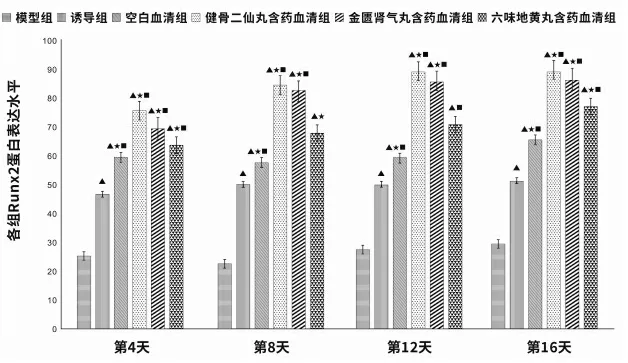
图4 各组衰老BMSCs 中Runx2 蛋白表达水平
4 讨论
骨质疏松症是一种全身性、炎症性的骨骼疾病,患者即使在轻微外力作用下即可发生脆性骨折,进而造成创伤[16]。 其发病机制与Runx2、Wnt/β-catenin、PI3K/Akt 等多种影响骨代谢的信号通路有关[17-18]。Runx2 是骨发育过程中重要的转录因子,对成骨细胞的分化、软骨细胞成熟、破骨细胞的分化及细胞外基质的分泌都有重要的调控作用。 因此,研究Runx2基因的表达调控、传导通路,对治疗骨代谢疾病具有重要意义[19]。BMSCs 是成骨细胞的起源,具有自我更新及多向分化的潜能,在一定条件下可通过成骨分化促进骨生成[20],随着人们年龄的增长,机体最终逐渐衰老,各器官功能逐渐减退,衰老BMSCs趋向成脂分化而非成骨分化。因此,治疗骨质疏松症及其骨折等并发症可通过促进BMSCs 成骨分化来实现[21]。
中医学无骨质疏松症明确命名,多将其归类为“骨痿”“骨枯”等范畴,认为骨质疏松症是先天遗传、饮食劳倦、年老体衰、六淫、情志等原因所致,病位在肾,与肝、脾有关,病机为肝肾亏虚。 大量研究表明,各种补肾单药或合方可促进BMSCs 成骨分化,如LIN 等[22]发现牛膝多糖可以显著促进MC3T3-E1 细胞增殖、分化和矿化,使成骨基因Runx2、成骨细胞特异性转录因子(Osterix, Osx)的mRNA 表达量有所提高。Runx2、Osx 可以调节骨桥蛋白、唾液蛋白和骨钙素的表达,从而促进骨形成的发生。健骨二仙丸是由《医方考》中龟鹿二仙胶加续断、山药组成的经验方,主要作用是补肾填髓。 徐卫峰等[23]的研究表明,龟鹿二仙胶可以通过逆转骨形成/骨吸收的不平衡来预防骨质疏松症。六味地黄丸方剂源自宋代《小儿药证直决》,是治疗肾阴虚证的常用、有效方剂。研究表明,六味地黄丸可提高临床患者骨密度[24]、改善临床症状[25],对钙的吸收和骨的重建有益。金匮肾气丸由干地黄、山药、山茱萸、茯苓、泽泻、牡丹皮、附子、桂枝组成,具有温补肾阳、化气行水之功效。 张倩等[26]研究显示,金匮肾气丸通过影响碱性磷酸酶、白细胞介素-6、骨保护素的表达抑制破骨细胞活性,促进骨形成,改善骨组织微结构,提高骨密度,以改善骨质疏松症。 因此,本实验探究3 种补肾中药对衰老BMSCs 成骨分化及Runx2 的影响,对于防止骨质疏松症具有重要意义。
本研究结果显示,健骨二仙丸含药血清组、金匮肾气丸含药血清组、六味地黄丸含药血清组在衰老BMSCs 分化过程中,均可使茜素红染色增多,即钙离子增多,成骨分化增多。 健骨二仙丸含药血清组、金匮肾气丸含药血清组在各个时间点均能促进Runx2 的表达,对比诱导组,差异有统计学意义(P<0.05);而六味地黄丸含药血清亦能促进Runx2 的表达,但对比诱导组,仅在第4、8、16 天差异具有统计学意义(P<0.05),对比空白血清组,仅在第4、12、16天差异具有统计学意义(P<0.05)。
综上所述,使用3 种补肾方含药血清对衰老BMSCs 进行干预,可增加钙离子而使茜素红染色增多,促进Runx2 表达,促进其成骨分化,增加骨量生成。今后将进一步加强其机制研究,为临床使用补肾方药防治疗骨质疏松症提供理论依据。
