2 型糖尿病合并非酒精性脂肪性肝病肝细胞损伤模型的建立及探讨
2023-02-04勾阳阳曾广娴
勾阳阳,曾广娴,喻 嵘*,陈 聪*
1.贵州中医药大学,贵州 贵阳 550025;2.黔西南州中医院,贵州 兴义 562400;3.湖南中医药大学,湖南 长沙 410208
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是2 型糖尿病(type 2 diabetes, T2DM)的常见并发症之一,二者相互影响,呈恶性促进[1-3]。高糖、高脂的过度摄入,使人体的碳水化合物、脂质等物质发生代谢紊乱,是导致T2DM 合并NAFLD发病的主要原因。 中医学认为“毒损肝络”病机在T2DM 合并NAFLD 发展过程中贯穿始终。前期研究也发现,T2DM 合并NAFLD 的中医病机为气阴两虚、痰瘀互结、毒损肝络[1-2]。 现代医家普遍认为,“毒邪”泛指所有较甚的致病邪气,其中包括六淫之邪较盛或较久的外毒、 体内代谢产物蓄积蕴结而生的内毒[4-5]。 “肝络”是中医络病理论运用于内伤杂病辨治的体现,“毒损肝络”是指毒邪久伤肝络,引起肝脏出现痰凝津滞、气血瘀滞,以致气机升降失调,营卫不和,肝络失养的病变过程。 在T2DM 合并NAFLD 的发病中,“肥甘之味”被认为是损伤“肝络”的主要因素[6-8]。 根据病机,采用滋阴益气、活血解毒法治疗,发现可有效改善糖尿病MKR 鼠的血糖、血脂、肝功能[1-2]。 本课题组通过建立T2DM 合并NAFLD 的体外肝细胞损伤模型,改变肝细胞培养的微环境,模拟机体高糖、高脂环境下,肝细胞之间营养物质和代谢产物交换的过程,使其形成“毒损肝络”的状态,进一步探讨肝细胞损伤的机制,以期为中医药的治疗提供实验依据。
1 材料
1.1 细胞
正常大鼠肝细胞系,购于上海中乔新舟生物科技有限公司(NO.ZQ0078),培养基:10%胎牛血清(fetal bovine serum, FBS)、90% DMEM 培养基培养(1 mL 抗生素,含100 U/mL 青霉素及100 μg/mL 链霉素);培养箱环境:5% CO2,37 ℃。 培养液2~3 d更换1 次,显微镜下观察细胞生长密度达85%~95%传代。 实验场地由贵州中医药大学基础医学院教学实验中心提供。
1.2 主要试剂
DMEM 高糖培养基(美国Hyclone 公司,批号319005121)、胎牛血清(浙江天杭生物科技有限公司,批号18050302)。
1.3 主要仪器
CO2培养箱(赛默飞世尔科技,thermo scientific midi40);超净工作台(苏州智净,SW-CJ-2G 型)。
2 方法
2.1 肝细胞形态学观察
制备密度为1×105/mL 的细胞悬液,在6 孔板孔中,每孔加入1 mL 细胞悬液,放入37 ℃、5% CO2培养箱。 培养24 h 后取出培养板,弃培养液,加入4%多聚甲醛固定约30 min,磷酸盐缓冲液(phosphate buffered saline, PBS)洗3 次。 加入苏木素染色液染核,1 min 后弃染色液PBS 洗5 次,于倒置光学显微镜下观察。
2.2 肝细胞鉴定
调细胞密度为1×105/mL 的细胞悬液,6 孔板(放入爬片)加入1 mL 细胞悬液,放入37 ℃,5%CO2培养箱。培养24 h 后取出培养板,弃原培养液,PBS 洗2 次,加入4%多聚甲醛固定约30 min,PBS洗3 次,每次5 min。 滴加100 μL 1% Triton 至爬片孵育2 min,PBS 洗3 次,每次5 min;加入100 μL 5%牛血清白蛋白,室温孵育30 min。 弃牛血清白蛋白,加入CK18 一抗(1∶100 用PBS 稀释),放置4 ℃过夜。 加入PBS 洗3 次,每次5 min。 避光加入配置好的荧光二抗工作液,37 ℃孵育40 min,PBS 洗3次,每次5 min。 滴加100 μL 4',6-二脒基-2-苯基吲哚工作液复染细胞核,室温孵育4 min,PBS洗3次,每次5 min。 滴加一滴防淬灭荧光封片剂封片。激光共聚焦荧光显微镜下观察、拍片。
2.3 肝细胞损伤模型建立
调5×104/mL 的细胞悬液,接种于96 孔板,每孔100 μL,放入37 ℃、5%CO2细胞培养箱中培养24 h。 用不含FBS 的DMEM 基础培养液撤血清培养6 h 后进行分组,正常组通过完全培养基培养,高糖(high glucose,HG)组通过在完全培养基基础上加入葡萄糖注射液,调D-葡萄糖终浓度为30、50、100、150、200 mmol/L;油酸(oleic acid, OA)组通过在完全培养基基础上加入油酸溶液,终浓度为0.1、0.2、0.3、0.4、0.5 mmol/L;再通过HG 5 个浓度组与OA 5 个浓度组排列组合,分设25 个联合刺激组。 每个浓度设6 个复孔、5个干预时间点,每组均设调零孔加入培养基及干预药物,不加细胞。 在培养12、24、36、48、60 h,分别取出培养板,每孔避光条件下加入CCK8 液10 μL,放入37 ℃、5% CO2培养箱继续避光孵育2 h,酶标仪450 nm 波长测各孔的OD 值,重复实验3 次,取均值。 计算抑制率:抑制率=[(正常组OD 值-调零孔)-(实验组OD 值-调零孔)]/(正常组OD 值-调零孔)。
2.4 油红O 染色法
调细胞密度为1×105/mL 的细胞悬液,接种于6孔板,每孔1 mL,培养24 h 后取出培养板,撤血清同步化处理6 h,弃培养液,PBS 洗涤2 次,分为:正常组、HG 组(100 mmol/L D-葡萄糖)、OA 组(0.2 mmol/L OA)、HG+OA 组(100 mmol/L D-葡萄糖+0.2 mmol/L OA),每孔分别加入1 mL 对应造模浓度的培养基,放入37 ℃、5% CO2培养箱培养24 h。取出培养板,弃培养基,PBS洗涤2次, 加入细胞样品固定液25 min,弃固定液,PBS 洗3 次。 加入油红O 染色液,密闭染色15 min,弃染色液,PBS 洗5 次。加入Mayer 苏木素染色液复染核1 min, 弃染色液,PBS洗5 次。 加入oro buffer 1 min,弃去后晾干。 于倒置光学显微镜下观察、拍片。
2.5 生化指标测定
分组及干预同“2.4”。每孔分别加入1mL 对应造模浓度的培养基,放入37 ℃,5% CO2培养箱培养24 h。 取出培养板,收集培养液离心(3000 r/min,20 min)。 收集细胞,加入PBS 分别调整每组细胞密度为1.5×106/mL,超声粉碎细胞,离心(3000 r/min,20 min)收集上清。在全自动生化分析仪上设置相应参数,分别检测细胞上清液中谷丙转氨酶(alanine transaminase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)含量;细胞沉淀裂解后上清液中甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)含量。
2.6 肝细胞CK8、CK18 蛋白检测
分组及干预同“2.4”。 每孔分别加入1 mL 对应造模浓度的培养基,放入37 ℃、5% CO2培养箱培养24 h。 收集细胞后提总蛋白,蛋白定量,加入上样缓冲液后变性。 取10 μg 蛋白,SDS-PAGE 凝胶电泳后转膜,采用5%脱脂牛奶,封闭1 h;去封闭液后,稀释一抗,4 ℃孵育过夜。 TBST 洗3 次,5 min/次。稀释二抗(按照说明书),用二抗稀释液室温孵育膜1 h,用TBST 洗3 次,5 min/次。 采用增强化学发光液(enhanced chemiluminescence, ECL)化学法显影,在全自动化学发光分析仪中拍照,读取数据,采用β-actin 作为内参校正。
2.7 肝细胞培养上清中炎症因子含量测定
分组及干预同“2.4”。 每孔分别加入1 mL 对应造模浓度的培养基,放入37 ℃、5% CO2培养箱培养24 h。 收集上清液,离心(3000 r/min,5 min)后取上清,避光条件下取出试剂盒中酶标板,按照酶联免疫试剂盒说明书检测肝细胞上清液中炎症因子含量。重复实验3 次,取均值,根据每个指标标准品浓度绘制标准曲线,依据样本OD 值及稀释倍数,对照标准曲线,计算每孔样本的实际浓度。
2.8 统计学处理
采用SPSS 26.0 统计软件,数据满足正态性和方差齐性检验,采用单因素方差分析(One-way ANOVA),结果以“±s”表示。 以P<0.05 为差异有统计学意义。
3 结果
3.1 肝细胞的鉴定
细胞形态:生长状态良好的肝细胞直径约20 μm,为多边形,细胞核大而圆,位于细胞正中,部分细胞可以见到双核;分化较好的细胞体伸出明显的树枝样突起连接相邻细胞,生长到融合状态时,呈铺路石样外观。 免疫荧光染色:细胞核呈蓝色荧光,CK18蛋白阳性表达呈红色荧光。 详见图1。
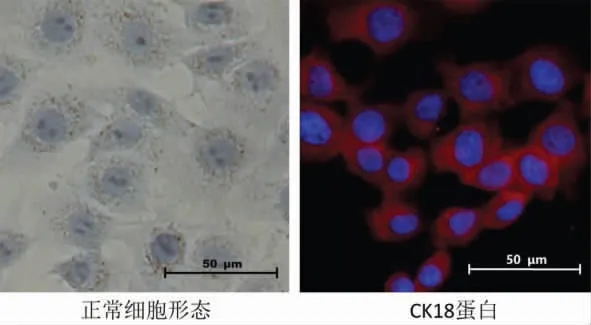
图1 肝细胞形态及CK18 蛋白表达(免疫荧光,×400)
3.2 各组肝细胞增殖抑制率的比较
与正常组相比,当D-葡萄糖终浓度为150 mmol/L 时,肝细胞增殖开始出现抑制(P<0.01);当D-葡萄糖终浓度为200 mmol/L 时,各时间点肝细胞增殖受到显著抑制(P<0.01)。0.1 mmol/L OA 刺激肝细胞36、48、60 h 与0.2 mmol/L OA 刺激肝细胞24、36、48、60 h 同0.3、0.4、0.5 mmol/L 各时间点刺激肝细胞OD值与正常组对比明显下降(P<0.01 或P<0.05),且肝细胞增殖抑制率随OA 浓度增加及刺激时间延长呈上升趋势。 肝细胞经HG 联合OA 刺激,30 mmol/L HG+0.1 mmol/L OA 刺激12 h,50 mmol/L HG+0.1 mmol/L OA刺激12 h、24 h、36 h,50 mmol/L HG+0.2 mmol/L OA 刺激12 h 均未出现抑制作用,其余各组联合浓度刺激均表现出明显抑制作用(P<0.01),经100 mmol/L HG 联合0.2 mmol/L OA 刺激肝细胞24 h 后,细胞增殖抑制率接近半数抑制浓度。 见表1~3。
表1 不同浓度HG 对细胞增殖OD 值的影响(±s,n=6)
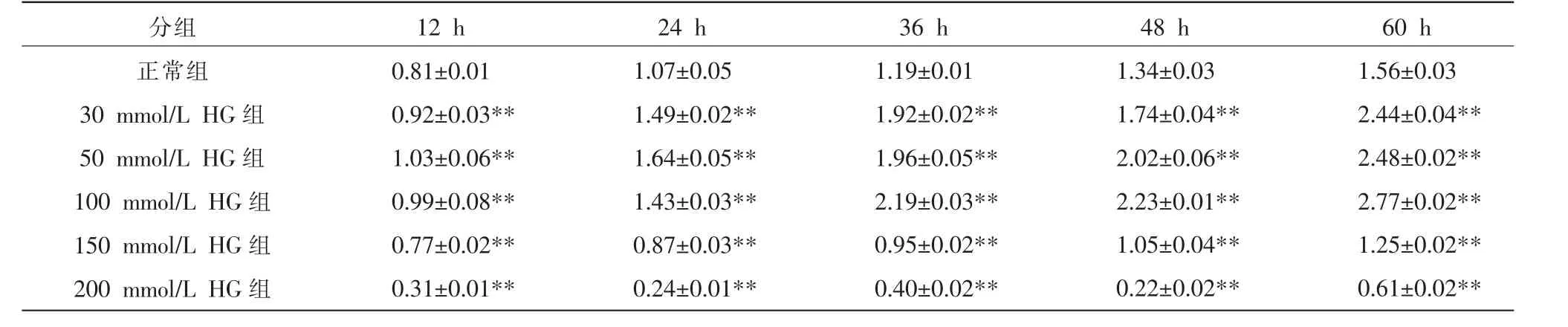
表1 不同浓度HG 对细胞增殖OD 值的影响(±s,n=6)
注:与正常组比较,**P<0.01。
分组正常组30 mmol/L HG 组50 mmol/L HG 组100 mmol/L HG 组150 mmol/L HG 组200 mmol/L HG 组12 h 0.81±0.01 0.92±0.03**1.03±0.06**0.99±0.08**0.77±0.02**0.31±0.01**24 h 1.07±0.05 1.49±0.02**1.64±0.05**1.43±0.03**0.87±0.03**0.24±0.01**36 h 1.19±0.01 1.92±0.02**1.96±0.05**2.19±0.03**0.95±0.02**0.40±0.02**48 h 1.34±0.03 1.74±0.04**2.02±0.06**2.23±0.01**1.05±0.04**0.22±0.02**60 h 1.56±0.03 2.44±0.04**2.48±0.02**2.77±0.02**1.25±0.02**0.61±0.02**
表2 不同浓度OA 对细胞增殖OD 值的影响(±s,n=6)
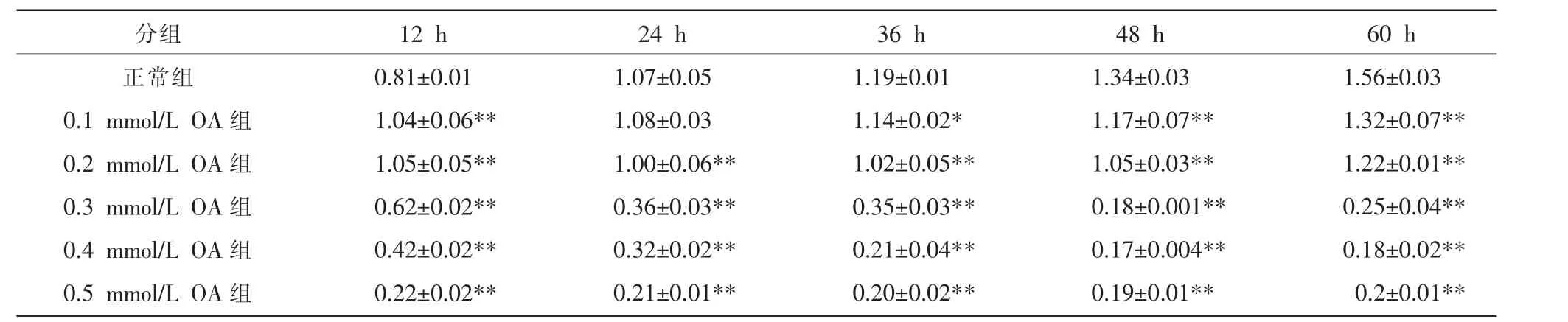
表2 不同浓度OA 对细胞增殖OD 值的影响(±s,n=6)
注:与正常组比较,*P<0.05,**P<0.01。
分组正常组0.1 mmol/L OA 组0.2 mmol/L OA 组0.3 mmol/L OA 组0.4 mmol/L OA 组0.5 mmol/L OA 组12 h 0.81±0.01 1.04±0.06**1.05±0.05**0.62±0.02**0.42±0.02**0.22±0.02**24 h 1.07±0.05 1.08±0.03 1.00±0.06**0.36±0.03**0.32±0.02**0.21±0.01**36 h 1.19±0.01 1.14±0.02*1.02±0.05**0.35±0.03**0.21±0.04**0.20±0.02**48 h 1.34±0.03 1.17±0.07**1.05±0.03**0.18±0.001**0.17±0.004**0.19±0.01**60 h 1.56±0.03 1.32±0.07**1.22±0.01**0.25±0.04**0.18±0.02**0.2±0.01**
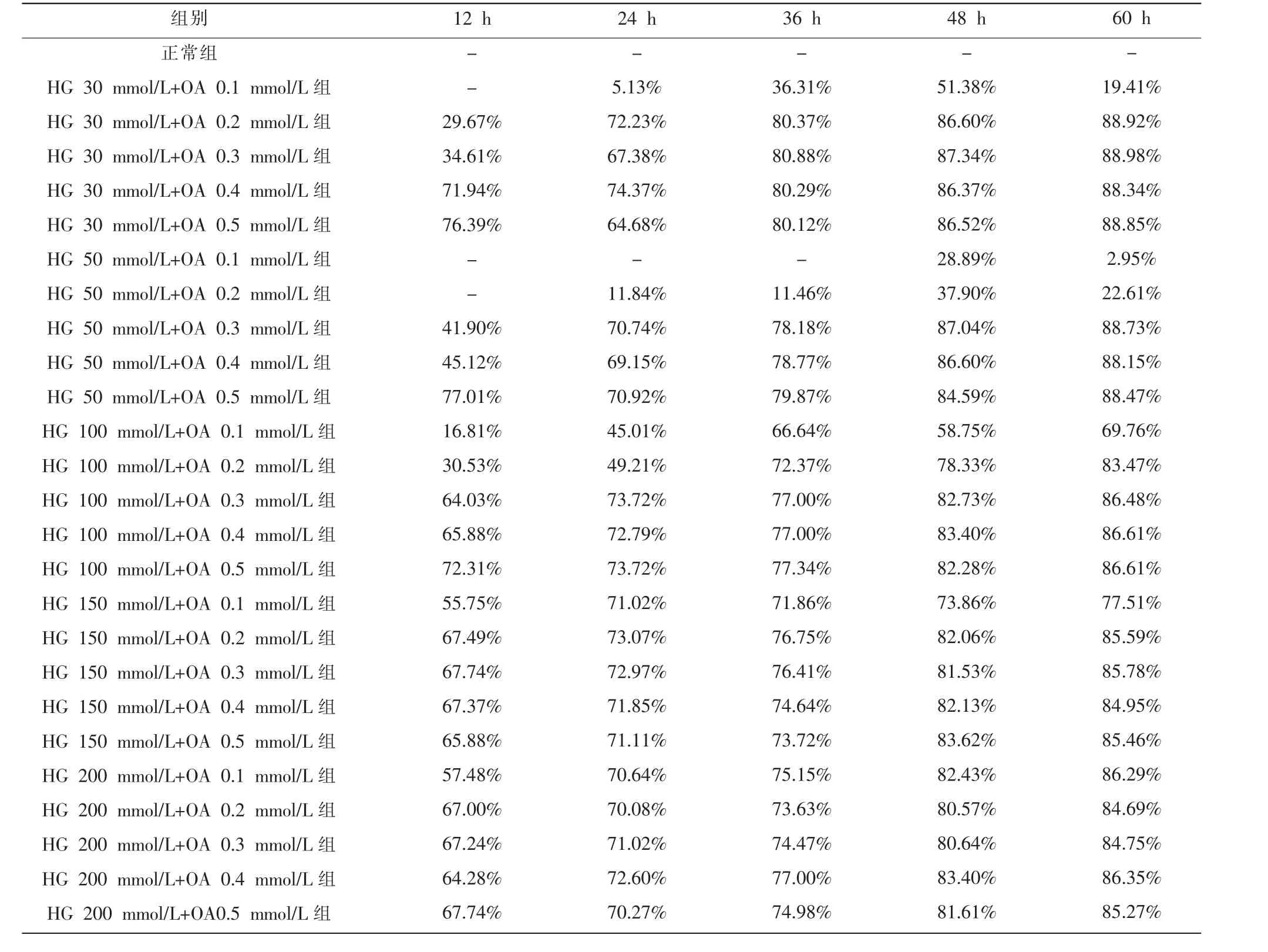
表3 HG 联合OA 对肝细胞增殖抑制率的影响(n=6)
3.3 各组肝细胞内脂滴的比较
与正常组相比,油红O 染色显示,肝细胞经100 mmol/L HG 组刺激24 h 后,细胞质内开始出现少量脂滴;经0.2 mmol/L OA 组刺激24 h 后,细胞内脂滴明显多于正常组和HG 组;经100 mmol/L HG联合0.2 mmol/L OA 刺激24 h 后,HG+OA 组细胞内脂滴出现大量蓄积,均多于正常组、HG 组及OA 组。详见图2。
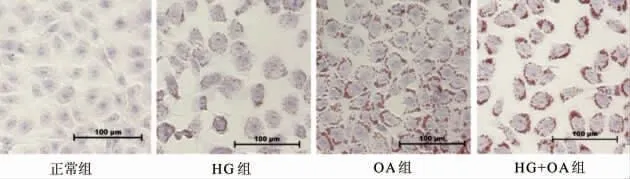
图2 肝细胞脂肪变性(油红O 染色,×400)
3.4 各组肝细胞ALT、AST、TG、TC 含量的比较
与 正 常 组 相 比,HG 组、OA 组 及HG+OA 组ALT、AST、TG、TC 指标均升高(P<0.01 及P<0.05)。与HG 组、OA 组比较,HG+OA 组ALT、AST、TC 指标均显著高于HG 组(P<0.01 及P<0.05)。详见表4。
表4 各组肝细胞生化指标(±s,n=6)
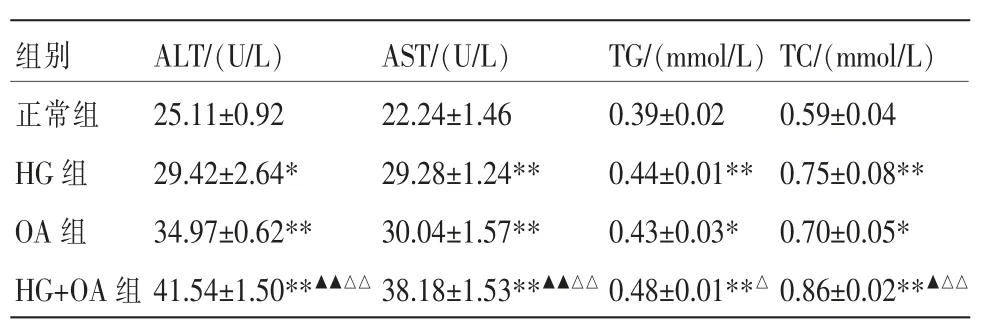
表4 各组肝细胞生化指标(±s,n=6)
注:与正常组比较,*P<0.05,**P<0.01;与HG 组比较,▲P<0.05,▲▲P<0.01;与OA 组比较,△P<0.05,△△P<0.01。
组别正常组HG 组OA 组HG+OA 组ALT/(U/L)25.11±0.92 29.42±2.64*34.97±0.62**41.54±1.50**▲▲△△AST/(U/L)22.24±1.46 29.28±1.24**30.04±1.57**38.18±1.53**▲▲△△TG/(mmol/L)0.39±0.02 0.44±0.01**0.43±0.03*0.48±0.01**△TC/(mmol/L)0.59±0.04 0.75±0.08**0.70±0.05*0.86±0.02**▲△△
3.5 各组肝细胞内CK8、CK18 蛋白的比较
与正常组相比,HG 组、OA 组及HG+OA 组细胞内CK8、CK18 蛋白表达均增加(P<0.01);与HG 组比较,HG+OA 组细胞内CK8、CK18 蛋白表达均显著高于HG 组(P<0.01);与OA 组比较,HG+OA 组细胞内CK8、CK18 蛋白表达均显著高于OA 组(P<0.01及P<0.05)。 详见表5、图3。
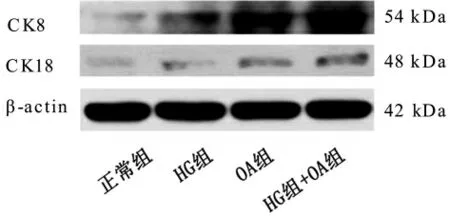
图3 各组肝细胞内CK8、CK18 蛋白相对表达量
表5 各组肝细胞内CK8、CK18 蛋白相对表达量(±s,n=6)

表5 各组肝细胞内CK8、CK18 蛋白相对表达量(±s,n=6)
注:与正常组比较,**P<0.01;与HG 组比较,▲▲P<0.01;与OA 组比较,△P<0.05,△△P<0.01。
组别正常组HG 组OA 组HG+OA 组CK8/β-Actin 0.06±0.04 0.53±0.08**0.70±0.04**0.80±0.03**▲▲△CK18/β-Actin 0.06±0.02 0.09±0.01 0.13±0.03**0.20±0.01**▲▲△△
3.6 各组肝细胞上清中NLRP-3、Caspase-1、IL-1β含量的比较
与正常组相比,HG 组和HG+OA 组细胞培养上清中炎症因子NLRP-3、Caspase-1、IL-1β 含量均增加(P<0.01 及P<0.05)。 与HG 组比较,HG+OA 组细胞培养上清中炎症因子NLRP-3、Caspase-1、IL-1β含量均显著升高(P<0.01)。 与OA 组比较,HG+OA组细胞培养上清中炎症因子NLRP-3、Caspase-1、IL-1β 含量均显著升高(P<0.01)。 详见表6。
表6 各模型组肝细胞培养上清NLRP-3、Caspase-1、IL-1β 含量(±s,n=6)

表6 各模型组肝细胞培养上清NLRP-3、Caspase-1、IL-1β 含量(±s,n=6)
注:与正常组比较,*P<0.05,**P<0.01;与HG 组比较,▲▲P<0.01;与OA 组比较,△△P<0.01。
NLRP-3/(ng/mL)18.42±0.91 19.78±0.26*19.40±0.13 21.65±0.52**▲▲△△Caspase-1/(pmol/L)29.83±0.23 34.59±0.42**35.82±0.84**41.02±1.75**▲▲△△IL-1β/(pg/mL)36.10±0.33 39.77±1.37**41.87±0.07**47.86±0.56**▲▲△△组别正常组HG 组OA 组HG+OA 组
4 讨论
《非酒精性脂肪性肝病防治指南(2018 更新版)》中指出,NAFLD 的诊断除病理学影像学发现肝组织脂肪变性外,肝脏生物化学指标异常是主要诊断依据,其中包括血清氨基酸转移酶和(或)TG 的持续增高。 该指南中还指出,当NAFLD 合并T2DM 时,血清氨基酸转移酶和(或)CK-18 的持续增高的患者是诊断NASH 的高危人群[9]。 本实验通过油红O 染色及细胞生化检测发现,HG 联合OA 诱导的肝细胞脂滴蓄积以及TG、TC 指标均显著高于正常培养的肝细胞,同时HG 联合OA 诱导肝细胞后,细胞培养上清中的ALT、AST 含量显著高于正常组。提示肝细胞出现脂肪变性,肝细胞功能受损。通过检测细胞培养上清中的NLRP-3、Caspase-1、IL-1β 炎症因子含量,发现HG 联合OA 诱导肝细胞后,细胞培养上清中的相关炎症因子含量显著高于正常组,提示诱导后的细胞中NLRP-3 相关炎症信号通路被过度激活,肝细胞内产生炎症反应。 有研究发现CK8 以及CK18 的异常,与癌症及肝脏的损伤程度呈正相关[10-11]。通过检测肝细胞内的CK8、CK18 蛋白的表达发现,HG 联合OA 组的CK8、CK18 蛋白表达较正常组均显著升高,进一步说明HG 联合OA 可诱导肝细胞发生损伤。 相比单纯HG 或OA 刺激,HG 联合OA 诱导肝细胞损伤更显著,提示T2DM 合并NAFLD 体外细胞损伤模型成功建立。
研究认为肝脏中的微循环是“肝络”的基本构成[12]。南征教授团队通过实验发现,“毒损肝络”的现代病理机制是肝内炎症反应[13]。通过文献研究发现,“毒损肝络”病机在T2DM 合并NAFLD 发展过程贯穿始终,其中的“毒”既是病理产物,又是致病因素,这与细胞炎症因子的作用轨迹具有相似性[14-16]。 “毒”在机体代谢中均存在恶性循环。清代医家叶天士言:“经主气,络主血”,“初为气结在经,久则血伤入络”(《临证指南医案》),体现了邪毒致病从无形到有形的过程[17-19]。 基于吴以岭教授团队近年来总结前人经验提出的“络脉—微血管”论[20],结合肝脏微循环的生理功能,本实验在建立T2DM 合并NAFLD 的体外细胞损伤模型时,通过改变肝细胞培养的微环境,模拟机体高糖、高脂环境下,肝脏微循环与肝细胞之间营养物质和代谢产物交换的过程,制备“毒损肝络”细胞损伤模型。 当100 mmol/L HG 联合0.2 mmol/L OA 诱导肝细胞24 h 培养条件下,肝细胞增殖出现半数抑制,肝功能出现明显改变,肝细胞脂肪变性、炎症反应和细胞损伤程度远高于HG 组合OA 组,提示高糖高脂环境改变肝脏微循环条件,相当于疾病久积“血伤入络”的状态。
中医学认为T2DM 合并NAFLD 的主要病因之一为过食“肥”“甘”,本实验基于中医理论及前期研究认识,运用HG 联合OA 模拟病因,制造“毒损肝络”的状态,再依据T2DM 合并NAFLD 病机演变,早期(脾气亏虚)、中期(湿热内蕴)、后期(肝肾阴虚、痰瘀互结),发现本实验模型组肝细胞内脂质大量蓄积,肝细胞功能受损,出现了形质和功能的同时改变。 此时的肝细胞更接近于T2DM 合并NAFLD 中后期的改变,细胞内产生有形实邪的蓄积和相互搏结。 同时,肝细胞内炎症因子NLRP-3、Caspase-1、IL-1β 含量均升高,提示“毒损肝络”状态下存在肝内炎症的发生,且其发生的物质基础可能与NLRP-3 炎性小体及其下游炎性分子的过度活化有关。 因此,针对脾气亏虚、湿热内蕴、肝肾阴虚、痰瘀互结导致“毒损肝络”病机,可采用滋阴益气活血解毒法,使得肝细胞内外炎性微环境得到改善,则肝络疏达;肝细胞功能得到改善,则肝体得养;同时肝细胞内脂质蓄积含量明显减少,则肝积得化;从而从根本上达到改善肝细胞损伤的目的。
