棉铃虫JNKs基因的克隆及表达分析
2023-02-03于思琪汤金荣张彩虹EITHINZARSOE梁革梅
于思琪, 汤金荣, 张彩虹, EI THINZAR SOE, 梁革梅,2*
(1.中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193; 2.中国农业科学院西部农业研究中心, 昌吉 831100)
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)高度保守,在细胞增殖、分化和迁移等过程中发挥着重要作用,还参与细胞对环境的应激适应、炎症反应、抗逆性等多种重要的生理过程[1]。MAPK通过4级磷酸化级联反应给邻近的蛋白质传递信号[2],主要有4条信号通路,分别为:c-Jun氨基末端激酶途径(c-Jun N-terminal kinase,JNK)、蛋白激酶 P38 途径(protein kinase 38,P38)、细胞外信号调节蛋白激酶途径(extracellular signal-regulated protein kinase,ERK)和ERK5/BMK1(big MAP kinase 1)途径[3]。JNK信号通路是MAPK中的重要通路之一,已有文献报道昆虫JNK 在响应杀虫剂、低温、外来病原微生物、紫外辐射的应激反应中发挥着重要作用,如:低温可以诱导激活西花蓟马Frankliniellaoccidentalis体内JNK、P38信号通路,引起应激反应[4];烟粉虱Bemisiatabaci的JNK基因在响应细菌、真菌的胁迫时发挥着重要作用[5];白纹伊蚊Aedesalbopictus的JNK基因响应热灭活细菌胁迫,且在30 min时表达量达到最大[6];当棉铃虫Helicoverpaarmigera受到紫外辐射时,其JNK信号通路被激活并发生一系列的应激反应[7]。而且JNK信号通路还参与昆虫的发育和免疫反应等,如JNK在果蝇Drosophila的形态发育和免疫反应过程中发挥作用[8];白纹伊蚊幼虫的JNK基因被干扰后48 h死亡率会显著增加[9]。
Bt是目前世界上产量最大、应用最广的生物杀虫剂。由于Bt杀虫蛋白具有杀虫效果好、安全、高效等优点[10-13],Bt杀虫基因已广泛用于抗虫转基因作物的研制[14],但是靶标害虫对其也存在一系列的应激与免疫反应,甚至有些靶标害虫产生了抗性[1,15-21]。因此,明确Bt蛋白杀虫机制和昆虫对杀虫蛋白产生应激反应的作用机制对延长Bt产品的使用寿命具有重要意义。研究表明,小菜蛾Plutellaxylostella中肠Bt杀虫蛋白受体受位于抗性基因座内的MAPK途径调控,与敏感品系相比,Bt Cry1Ac抗性品系中MAP4K4基因显著上调,并反式调控多个抗性基因差异表达[22-25]。
JNK途径可由多种生物因子或非生物因子激活,昆虫取食Bt杀虫蛋白后其免疫系统会产生一系列的应激、免疫反应[26-27]。因此,我们推测JNKs可能参与棉铃虫抵御Bt杀虫蛋白伤害及对其产生抗性的过程。本研究克隆得到两条棉铃虫JNK基因序列,分别命名为HaJNK1、HaJNK2,通过荧光定量PCR分析了HaJNKs的时空表达谱,并比较了棉铃虫取食Cry1Ac蛋白后对HaJNKs表达量的影响,以期为进一步揭示棉铃虫HaJNKs基因在抵御Bt杀虫蛋白及对其产生抗性机制中的作用奠定理论基础。
1 材料与方法
1.1 材料
供试昆虫:棉铃虫96S敏感品系,1996年采自河南省新乡市棉田,在实验室人工饲养至今,未接触任何Bt杀虫蛋白或杀虫剂。幼虫用人工饲料饲养,成虫饲喂10%的糖水[28]。饲养温度为(27±2)℃,光周期为L∥D=14 h∥10 h,相对湿度为(75±10)%。
供试杀虫蛋白:Cry1Ac蛋白,购自北京绽诺思特生物科技有限公司。
1.2 方法
1.2.1样品收集
不同组织:选取2日龄的5龄棉铃虫90头,每30头作为1个重复,共3个重复。幼虫置于冰上解剖并分别截取以下10种组织:头、表皮、唾液腺、脂肪体、前肠、中肠、后肠、马氏管、血淋巴、性腺,取样后在0.7% NaCl溶液中清洗,滤纸吸干,然后立刻置于1.5 mL离心管中,放入液氮或-80℃保存。
不同发育时期:收集不同发育时期的棉铃虫,卵400粒、1龄幼虫100头、2龄幼虫50头、3龄幼虫20头、4龄和5龄幼虫各10头、雌蛹、雄蛹、雌成虫、雄成虫各10头为1次重复,每个时期设3次重复。取样后立刻置于液氮或-80℃保存。
1.2.2RNA提取与cDNA合成
按照说明书用TRIzol试剂提取总RNA,并在NanoDrop 1000(Thermo Fisher)紫外分光光度计检测总RNA的浓度和质量,确保A260/A280、A260/A230均在1.8~2.2范围内,之后用琼脂糖凝胶电泳检测质量。按照HiScript III RT SuperMix for qPCR(+gDNA wiper)试剂盒说明书合成cDNA第一链(南京诺唯赞生物科技股份有限公司),并置于-20℃保存(用于定量的样品取1 μg RNA用于反转录)。
1.2.3HaJNK基因的克隆
根据NCBI数据库的棉铃虫HaJNK序列,利用primer3 plus设计PCR特异性引物(表1),以4龄幼虫中肠cDNA为模板,进行PCR扩增,体系如下:2 × Phanta Max Master Mix 25 μL,上、下游引物各2 μL,cDNA模板2 μL,超纯水 19 μL。反应条件为:95℃预变性3 min;95 ℃变性15 s,60℃退火15 s,72℃延伸1 min 30 s,35个循环,72℃延伸5 min。2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒回收目的条带并纯化,而后将纯化产物连接到pEASY-Blunt Simple(全式金北京生物技术有限公司)克隆载体上,并转化至Trans1-T1感受态细胞中,待细胞复苏后,取200 μL涂在含有氨苄抗生素的培养基上,37℃过夜培养,之后挑取单克隆,菌液PCR验证后挑取阳性菌液送至深圳华大基因有限公司进行测序。
1.2.4序列分析以及进化树的构建
利用DNAMAN软件对测序结果进行拼接并比对,利用NCBI中ORF finder预测开放阅读框,并翻译成氨基酸序列。利用ExPaSy(http:∥web.expasy.org/compute_pi)预测HaJNK蛋白的分子量和等电点,Sig-nalP 4.1 Server(http:∥www.cbs.dtu.dk/services/Sig-nalP/)预测HaJNK的信号肽,NCBI CDD(Conserved Domain Database)预测HaJNK的保守结构域,利用SWISS MODEL(https:∥swissmodel.expasy.org/)预测蛋白的三级结构。利用NCBI-Blast(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)在线搜索得到棉铃虫HaJNK的同源蛋白,使用MEGA 7.0软件邻接法(neighbor-joining,NJ)构建系统发育树。
1.2.5RT-qPCR分析HaJNK的时空表达
基于HaJNK基因序列,用Primer5设计RT-qPCR特异性引物,内参基因为RPS15(基因序列号:AY818611.1)与18S(基因序列号:AB620126.1),合成并进行引物扩增效率检测(表1)。模板为棉铃虫不同发育时期、不同组织的cDNA,利用ABI QuantStudio 6(Thermo Fisher)高产率实时荧光定量PCR仪扩增。反应总体系20 μL:2×TaqPro Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,超纯水为7.2 μL,cDNA模板2 μL。反应条件参照TaqPro Universal SYBR qPCR Master Mix试剂盒的说明书:95℃预变性30 s;95℃变性10 s,60℃退火/延伸20 s,40个循环;采用2-ΔΔCt法分析HaJNK基因的相对表达量[29]。

表1 本研究所用引物
1.2.6取食Cry1Ac对HaJNKs基因表达量的影响
用20、40、80 ng/μL Cry1Ac分别处理4龄棉铃虫,分别在0、3、6、12、24、48 h时取样,每次取10头为1个重复,每个时间段3个生物学重复。进行荧光定量PCR检测HaJNKs基因的变化。
1.3 数据分析
利用SPSS Statistics 26软件对试验数据进行分析。采用单因素方差分析(One-way ANOVA)分析不同发育时期、组织的表达量之间以及Cry1Ac处理前后HaJNK表达量的差异显著性。
2 结果与分析
2.1 HaJNK基因克隆和生物信息学分析
经克隆及多次重复测序得到两条HaJNK序列,分别命名为HaJNK1、HaJNK2,其开放阅读框分别为1 191 bp和1 143 bp,分别编码396、380个氨基酸。部分序列对比如图1所示。预测HaJNK1和HaJNK2的蛋白分子量分别为45.07 kD和43.32 kD,等电点为6.49、6.06。HaJNK1与HaJNK2均存在于细胞质中,无信号肽。HaJNK1与HaJNK2蛋白的三维结构存在差异,HaJNK1在起始位置多两个发夹结构(图2)。

图1 棉铃虫HaJNKs的部分DNA序列与氨基酸序列
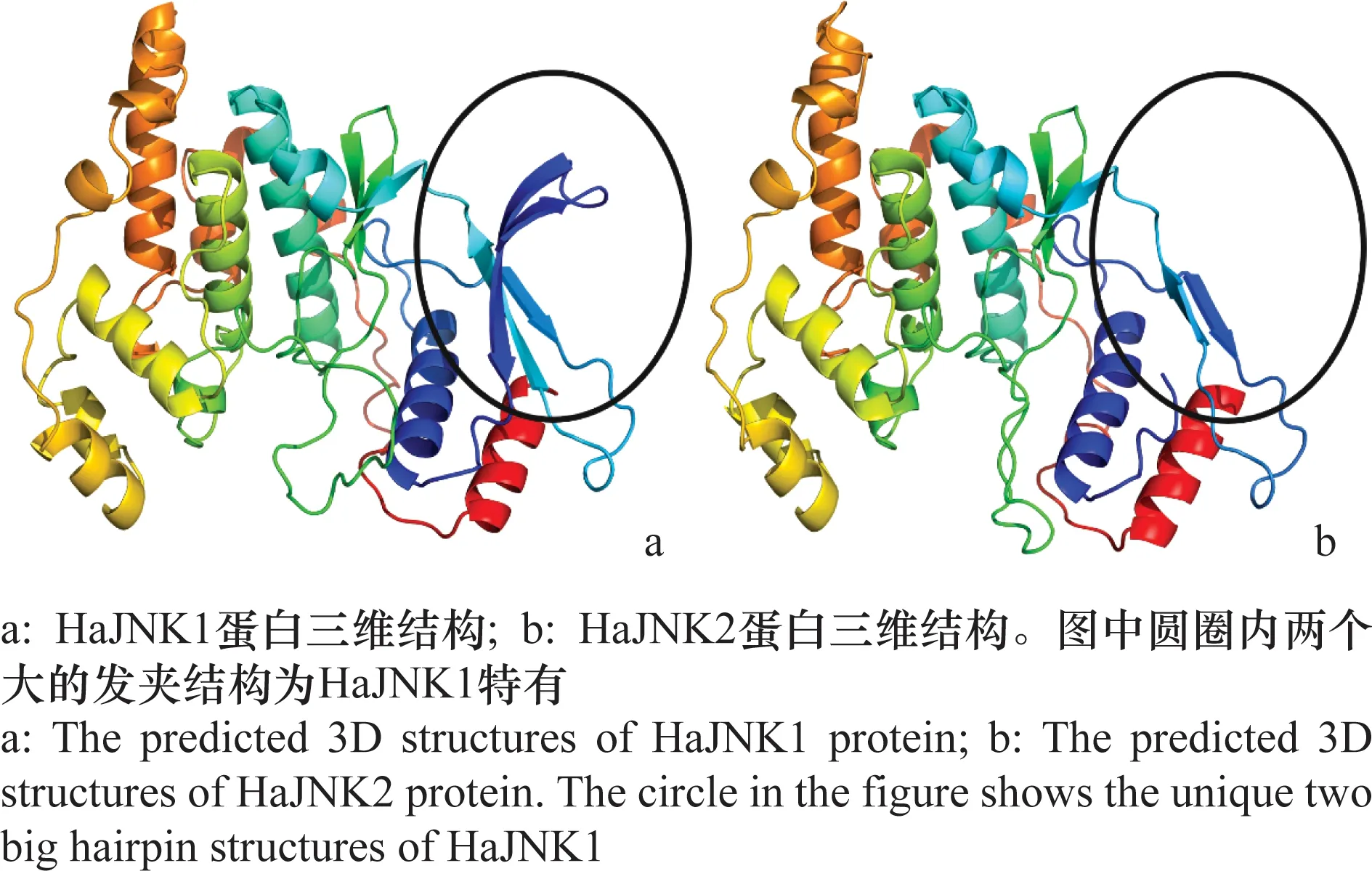
图2 预测的棉铃虫HaJNKs蛋白三维结构
2.2 HaJNK进化树分析
序列对比结果显示,棉铃虫的HaJNK与鳞翅目昆虫的同源性都较高,其中HaJNK1与黏虫聚为一支,亲缘关系较近, HaJNK2与家蚕聚为一支,它们的亲缘关系较近(图3)。

图3 基于HaJNK氨基酸序列采用邻接法构建棉铃虫和相关昆虫的系统进化树
2.3 HaJNK的时空表达谱
2个HaJNK基因在棉铃虫的各个发育阶段都有表达,不同发育阶段的表达量存在显著差异(HaJNK1:F=47.81,P=0.001;HaJNK2:F=38.34,P=0.001)。HaJNK1和HaJNK2均在卵期表达量最高,其次HaJNK1在雌成虫、2龄幼虫中表达量较高,HaJNK2表达量较高的是雌成虫和1龄幼虫(图4)。

图4 HaJNK基因在棉铃虫不同发育时期的表达量
2个HaJNK基因在棉铃虫的不同组织中均有表达,不同组织中的表达量存在显著差异(HaJNK1:F=31.39,P=0.001;HaJNK2:F=20.88,P=0.001)。其中HaJNK1在性腺中表达量最高,其次是唾液腺,头和表皮中也有较高的表达量;HaJNK2在头部表达量最高,显著高于其他组织(图5)。
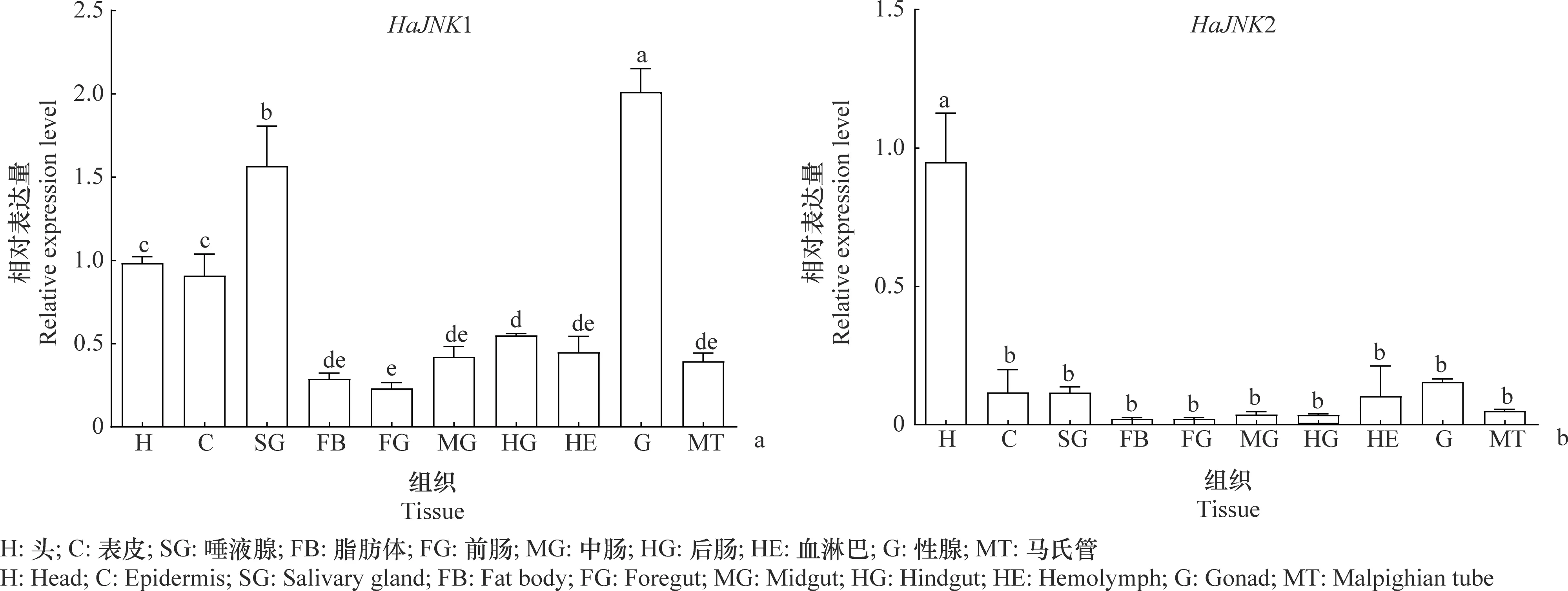
图5 HaJNK基因在棉铃虫不同组织的表达量
2.4 取食Cry1Ac后HaJNKs表达量变化
取食相同浓度Cry1Ac不同时间的棉铃虫中HaJNKs的表达量存在显著差异,P值均小于0.05。随时间的变化HaJNK1和HaJNK2的表达量都呈现先升高后降低的趋势(图6)。HaJNK1和HaJNK2的表达量分别在20 ng/μL的Cry1Ac处理6 h、40 ng/μL的Cry1Ac处理12 h和80 ng/μL的Cry1Ac处理12 h后达到最高;HaJNK1和HaJNK2均在80 ng/μL Cry1Ac处理12 h时表达量达到最高。
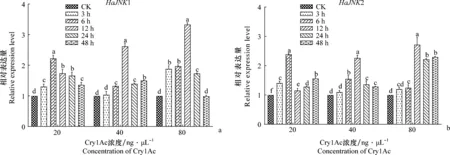
图6 不同浓度Cry1Ac胁迫处理后棉铃虫HaJNKs表达量的变化
3 结论与讨论
MAPK信号通路在调节生物生长、发育、繁殖过程中起到至关重要的作用,也是免疫反应中的关键因子,JNK作为其中一种重要通路发挥的作用不可小觑[6]。已有报道表明JNK在昆虫抵御低温、紫外、外来病原微生物胁迫过程中起到了重要作用。本文利用1对引物克隆棉铃虫的HaJNK基因,通过大量样本测序发现,除了已经被鉴定过的HaJNK1之外,还发现HaJNK2基因,同时两个HaJNK基因还存在不同的剪切本。经过序列比对,发现棉铃虫HaJNK2与HaJNK1序列一致性达98.77%,Query Cover为92.00%。经生物信息学分析发现两个HaJNK在起始位置相差16个氨基酸(图1b),蛋白三维结构预测发现,这16个氨基酸编码的蛋白质折叠成为2个发夹结构(图2a)。由于前人研究发现激酶的磷酸化会受到发夹结构的影响,而磷酸化水平会直接影响蛋白质功能[30]。因此,我们推测这可能造成HaJNK1和HaJNK2在棉铃虫体内发挥不同的功能。
进化树分析结果表明,棉铃虫HaJNK1与二化螟、家蚕进化为同一支,再与棉铃虫HaJNK2聚为一支,它们在亲缘关系上较近。因此,可能与其他鳞翅目昆虫的JNK基因存在类似的功能,参与抵御外来病原微生物等的应激及免疫反应。时空表达谱分析表明HaJNKs在棉铃虫不同组织、不同龄期均有表达,说明HaJNK存在于棉铃虫的整个生命过程中,可能参与生物体的生长、发育、繁殖等过程。随着棉铃虫的生长发育HaJNKs的表达量呈现出先高后低的趋势,HaJNKs在卵期高表达,显著高于其他发育时期,HaJNK1在性腺中表达量最高,其次是唾液腺,HaJNK2在头部表达量最高,其次是性腺。报道显示,果蝇卵期JNK高表达可能是因为JNK通路参与卵的形成,并在卵泡细胞和其他上皮细胞的形态发生过程中起到重要作用[31];棉铃虫头部HaJNK表达量高可能是由于复眼视网膜细胞是昆虫感受外界光刺激的主要场所,HaJNK将外界光刺激的胞外信号转导至胞内,因此含有复眼的头部HaJNK高表达[7]。我们推测HaJNK基因在棉铃虫各发育时期、组织中发挥着重要的功能,除参与卵形成、感受光刺激等功能外,还可能参与性别分化[32],且两种HaJNK基因在不同的组织中发挥的功能有所不同。
棉铃虫受到Cry1Ac胁迫诱导后HaJNKs的表达量呈现出先升高后降低的趋势。低浓度(20 ng/μL)Cry1Ac处理6 h后,HaJNK1和HaJNK2表达量达到最高,分别为对照组棉铃虫的2.23倍、2.39倍;高浓度(40 ng/μL、80 ng/μL)Cry1Ac处理12 h后,HaJNK1和HaJNK2表达量达到最高,其中80 ng/μL处理分别为对照组棉铃虫的3.32倍、2.71倍。这与其他昆虫中的报道类似,经过Cry蛋白处理后亚洲玉米螟Ostriniafurnacalis的MAPKs基因有明显的上调现象[33],推测受到Cry蛋白的胁迫后引起了MAPK通路的免疫反应。烟粉虱被病原菌侵染后JNK的mRNA水平与蛋白磷酸化水平显著升高,说明JNK信号通路在烟粉虱抵抗病原菌侵染过程中起到重要作用[5];JNK信号通路被果蝇免疫反应中的LSP所激活,参与果蝇的免疫反应[8]。而且,棉铃虫取食Cry1Ac后HaJNK表达量的升高,也可能激活MAPK通路,通过反式调控棉铃虫中肠上相关Bt受体蛋白基因的表达,降低受体蛋白与Bt蛋白的结合,从而减少对棉铃虫的为害[34-35]。关于HaJNK在Cry1Ac对棉铃虫的毒力过程中的作用,后续我们将进一步探索研究。
