V-ATPase H表达量下调增强棉铃虫对Cry1Ac的抗性
2023-02-03李舜佳杨飞帆孙莹莹刘晓光魏纪珍安世恒
李 品, 姚 雪, 李舜佳, 杨飞帆, 孙莹莹,刘晓光, 魏纪珍, 安世恒
(河南农业大学植物保护学院,河南省害虫绿色防控国际联合实验室, 郑州 450002)
棉铃虫Helicoverpaarmigera(Hübner)(Lepidoptera: Noctuidae)是一种世界性农业害虫,它为害棉花、玉米、小麦、大豆、花生和蔬菜等许多作物[1-2]。目前防治棉铃虫的主要手段是种植转苏云金芽胞杆菌Bacillusthuringiensis(Bt)杀虫蛋白的转基因作物。然而大面积地种植转Bt基因棉花加剧了棉铃虫对Bt蛋白的抗性问题[3]。为了更好地利用Bt转基因技术防治棉铃虫,需要对Bt蛋白的作用机制和棉铃虫的抗性机制进行深入研究。
目前我国种植的转Bt杀虫蛋白基因的棉花表达的是CryAc蛋白。已鉴定的Cry1A类蛋白受体主要有钙黏蛋白(cadherin, CAD)、氨肽酶N(aminopeptidase N, APN)、碱性磷酸酶(alkaline phosphatase, ALP)和ABC转运蛋白(ATP binding cassette transports),这些受体的变异也是昆虫对Cry1A类蛋白产生抗性的主要原因[4]。这些研究丰富了我们对Cry1A类蛋白杀虫机制及昆虫对Cry1A类蛋白的抗性机制的理解,但是还不能完全解释Cry1A类蛋白的作用机制及昆虫对Cry1A类蛋白的抗性机制。目前报道一些液泡型H+-ATP酶(vacuolar H+-ATPase, V-ATPase)的亚基蛋白可以与Cry蛋白结合。例如Chen等[5]通过双向电泳分离棉铃虫中肠BBMV(brush border membrane vesicles)蛋白,然后通过配体印迹(ligand blot)和质谱检测鉴定到V-ATPase蛋白是Cry1Ac蛋白的结合蛋白。邹朗云[6]通过ligand blot证实棉铃虫的V-ATPase B可以与Cry1Ac,Cry2Ab和Cry1C结合。关于V-ATPase亚基蛋白与棉铃虫对Cry蛋白的敏感性的关系还未见报道。
V-ATPase存在于许多细胞内腔室中,包括核内体,溶酶体膜等,它参与细胞质pH的调节[7]。V-ATPase是由14个亚基组成的多蛋白复合体,形成两个不同的结构域,参与质子跨膜易位的跨膜结构域(V0)[8-11]和负责ATP水解的可溶性催化结构域(V1)[12]。V0由a、c、c′、c″、d和 e共6个亚基组成,主要功能是形成允许质子跨膜通过的孔[13]。V1由A、B、C、D、E、F、G和H 8个亚基组成,主要功能是参与ATP的水解[14]。前期我们通过转录组测序和数字基因表达谱(digital gene expression profiling,DGE)分析了不同Cry1Ac抗性棉铃虫品系的差异基因,发现V-ATPaseH在抗性棉铃虫种群中普遍低表达[15]。因此我们推测V-ATPase H可能是Bt杀虫蛋白的一个靶标。本研究采用实时荧光定量技术测定了该基因在Cry1Ac抗性和敏感品系棉铃虫幼虫中肠中及敏感棉铃虫受到Cry1Ac诱导时的表达情况;通过在昆虫Sf9细胞中过表达该基因确定该基因的表达分布,并通过细胞毒力试验检测其对Cry1Ac毒力的影响。本研究结果为进一步研究V-ATPase H的作用方式和在抗性机制中的作用,以及昆虫对Bt杀虫蛋白的抗性治理等提供重要线索。
1 材料与方法
1.1 供试昆虫
棉铃虫敏感品系(JY)购于河南省济源白云实业有限公司;抗性品系(LF60)为中国农业科学院植物保护研究所梁革梅研究员馈赠。Cry1Ac原蛋白购自北京诺思特生物科技有限公司,经胰蛋白酶活化[16]获得活化的Cry1Ac蛋白。LF60对Cry1Ac原蛋白的抗性倍数约1 000倍[15],它是由1998年采自河北廊坊田间的野生型棉铃虫敏感种群,在室内经Cry1Ac原蛋白梯度筛选77代后,使用60 μg/mL Cry1Ac原蛋白稳定饲养的抗性种群[15,17]。两种棉铃虫品系均在培养箱内使用人工饲料进行饲养,培养条件为温度(27±1)℃、相对湿度为(75±10)%、光周期L∥D=16 h∥8 h[18]。
1.2 昆虫细胞系
草地贪夜蛾Spodopterafrugiperda卵母细胞系(Sf9 cell line)由亚利桑那大学李显春教授馈赠,用含10%热激失活牛血清(fetal bovine serum,FBS)(圣路易斯,美国)和0.5%青霉素-链霉素(Gibco,纽约,美国)的Sf-900TMⅡ SFM(1×)培养基(Gibco,纽约,美国)于(28±1)℃的生化培养箱(型号:SHP-250,上海,中国)中传代培养[16]。
1.3 棉铃虫V-ATPase H基因在不同品系中的表达量测定
分别选取龄期和大小一致的抗、感品系的棉铃虫,收集其3~5龄幼虫各5~10头。将棉铃虫幼虫置于冰上10 min后解剖出全部的中肠组织,在生理盐水中去除围食膜及食物残渣,冲洗干净,迅速放入液氮中备用。每组样品均进行3次生物学重复。待样品准备完毕,使用RNA提取试剂盒和反转录试剂盒(诺唯赞,南京,中国)提取中肠组织的总RNA并反转录获得cDNA。
采用双内参法,内参基因分别为EF-1α(U20129.1)和β-actin(HM629442.1)。引物(表1)由北京擎科生物科技有限公司合成。PCR反应体系(20 μL):10 μmol/L qV-ATPase H上、下游引物或10 μmol/LEF-1α上、下游引物或10 μmol/Lβ-actin上、下游引物各0.4 μL,2×ChamQ Universal SYBR qPCR Master Mix 10 μL,cDNA 1 μL,ddH2O 8.2 μL。反应程序:95℃ 2 min;95℃ 15 s,56℃ 15 s,68℃ 20 s,38个循环(ABI 7500 Fast 实时荧光定量PCR仪,Eppendorf,汉堡,德国)。相对表达量的计算采用双内参的计算方法,公式如下[19]。得到表达量后,以对照为标准进行归一化作图。

表1 本研究所用引物

式中E为扩增效率。
1.4 幼虫取食Cry1Ac蛋白后其中肠V-ATPase H的表达测定
选取大小一致的4龄末期敏感品系棉铃虫,置于24孔养虫盒中,每孔1头,饥饿处理12 h后,进入5龄期。然后用含25 μg/mL Cry1Ac原蛋白(大约LC30浓度)的人工饲料[20]饲喂饥饿后的5龄幼虫,对照组为饲喂含50 mmol/L Na2CO3缓冲液(溶解Cry1Ac,作为缓冲对照,调节Cry1Ac处理的死亡率)。分别取4~5头棉铃虫样品,解剖取其中肠,每组样品均进行3次生物学重复。中肠的解剖、RNA的提取、cDNA的合成和qRT-PCR见1.3。
1.5 棉铃虫V-ATPase H的亚细胞示踪定位
以棉铃虫cDNA为模板,利用V-ATPaseH基因的特异性引物[12](表1)在Mastercycle Pro S型PCR仪中完成V-ATPaseH基因编码区(sequence coding for amino acids in protein,CDS)的扩增。PCR反应体系(50 μL):Phanta Max Super-Fidelity DNA Polymerase 1 μL、2×Phanta Max Buffer 25 μL、cDNA 1 μL、dNTP Mix 1 μL、10 μmol/L V-ATPase H CDS上、下游引物各2 μL和ddH2O 18 μL。PCR程序为95℃ 3 min;95℃ 15 s,55℃ 20 s,72℃ 1 min 50 s,38个循环;72℃ 10 min。使用PCR产物回收试剂盒(诺唯赞,南京,中国)纯化PCR产物,然后将其连接到克隆载体上得到ZT-4-V-ATPase H。
以克隆载体为模板,利用特异性引物V-ATPase H-SacⅠ-F和V-ATPase H-BglⅡ-R扩增V-ATPaseH基因编码区。PCR反应体系(50 μL):ddH2O 18 μL、10 μmol/L V-ATPase H Sac Ⅰ-F和10 μmol/L V-ATPase H Bgl Ⅱ-R各2 μL、dNTP Mix 1 μL、ZT-4-V-ATPase H质粒模板1 μL、Phanta Max Super-Fidelity DNA Polymerase 1 μL和2×Phanta Max Buffer 25 μL。PCR扩增条件:95℃ 3 min;95℃ 15 s, 58℃ 20 s, 72℃ 1 min 30 s, 35个循环;72℃ 10 min。PCR产物纯化后将片段连接至表达载体GFP-pIEx(His标签的pIEx-GFP载体为山东大学赵小凡老师馈赠)。
将9 ×105个Sf9细胞平铺于12孔板内,于(28±1)℃黑暗静置培养过夜,使细胞充分贴壁。配制A、B与C液。A液为无血清和抗生素的细胞培养基,B液为A液中加入2 μg V-ATPase H-GFP-pIEx质粒,C液为A液中加入8 μL转染试剂。用1 mL A液清洗细胞,去除血清和抗生素后,把100 μL C液滴到100 μL B液中,最后将B和C液的混合液滴加到细胞中,培养箱中孵育5 h;用A液清洗细胞,去除血清和抗生素后,加入1.5 mL含10%热激失活牛血清和0.5%青霉素-链霉素抗生素的Sf-900TMⅡ SFM(1×)无血清培养基。培养24 h后,荧光显微镜(莱卡显微系统公司,上海,中国)下拍照。
1.6 Cry1Ac对表达V-ATPase H细胞的毒力测定
将上一步拍照的细胞继续培养至48 h,记录存活细胞数量。加入含有已活化的200 μg/mL Cry1Ac蛋白处理转染后的细胞,于(28±1)℃培养箱中处理4 h,记录经过Cry1Ac蛋白处理后的存活细胞数量。具体毒力测定方法参考文献[21]。运用Abbott公式[22]计算细胞死亡率,死亡率=(处理前的细胞数量-处理后的细胞数量)/处理前的细胞数量× 100%。
收集转染后的细胞至1.5 mL离心管中,离心后,用1 mL 1× PBS缓冲液重悬沉淀2次,再次离心并保留沉淀,加入高效RIPA裂解液、终浓度为1 mmol/L PMSF、5× 蛋白上样缓冲液并混匀,煮沸5 min,离心后放置-20℃备用。
SDS-PAGE(SDS-PAGE凝胶试剂盒,中晖赫彩,陕西,中国)电泳后转至硝酸纤维膜上;5% BSA 4℃封闭过夜;加入1∶1 000稀释的鼠抗His-Tag单克隆抗体(一抗),室温孵育1 h,清洗。加入1∶10 000稀释的辣根过氧化酶标记的羊抗鼠IgG抗体(二抗)(一抗与二抗,亚科因,武汉,中国),室温孵育1 h,清洗。在Tanon4600化学发光成像分析系统(天能,上海,中国)中拍照确定V-ATPase H蛋白在细胞内的表达情况。
1.7 数据统计分析
使用DPS 7.05软件进行数据分析。图1中敏感品系(JY)与抗性品系(LF60)(在进行方差分析时,先进行对数转换)之间的差异显著性、图2中同一时间点对照组与处理组(在进行方差分析时,先进行对数转换)之间的差异显著性以及图4中细胞死亡率(在进行方差分析时,先进行平方根转换)之间的差异显著性均采用t测验分析。
2 结果与分析
2.1 V-ATPase H基因在Cry1Ac抗、感棉铃虫品系中的表达差异
荧光定量PCR检测结果表明,V-ATPaseH基因在3、4龄和5龄棉铃虫幼虫中肠组织中均有表达,在敏感品系3龄幼虫的中肠中相对表达量最高(图1)。与敏感品系JY相比,抗性品系LF60的3、4龄和5龄棉铃虫幼虫mRNA的相对表达量明显降低(3龄:F= 199.81,df= 5,P= 0.000 1;4龄:F= 22.54,df= 5,P= 0.009; 5龄:F= 28.66,df= 5,P= 0.005 9)(图1)。
2.2 敏感棉铃虫取食Cry1Ac后V-ATPase H的转录水平降低
JY品系棉铃虫5龄幼虫持续取食含LC30剂量Cry1Ac原蛋白的人工饲料3~24 h后,与对照相比中肠组织内V-ATPaseH的转录水平显著下降,但36 h时无显著差异(3 h:F= 137.17,df=5,P= 0.000 3; 6 h:F= 96.47,df=5,P= 0.000 6; 12 h:F= 8.40,df=5,P= 0.044 2;24 h:F= 326.01,df=5,P= 0.000 1; 36 h:F= 0.69,df=5,P=0.451 1)(图2)。
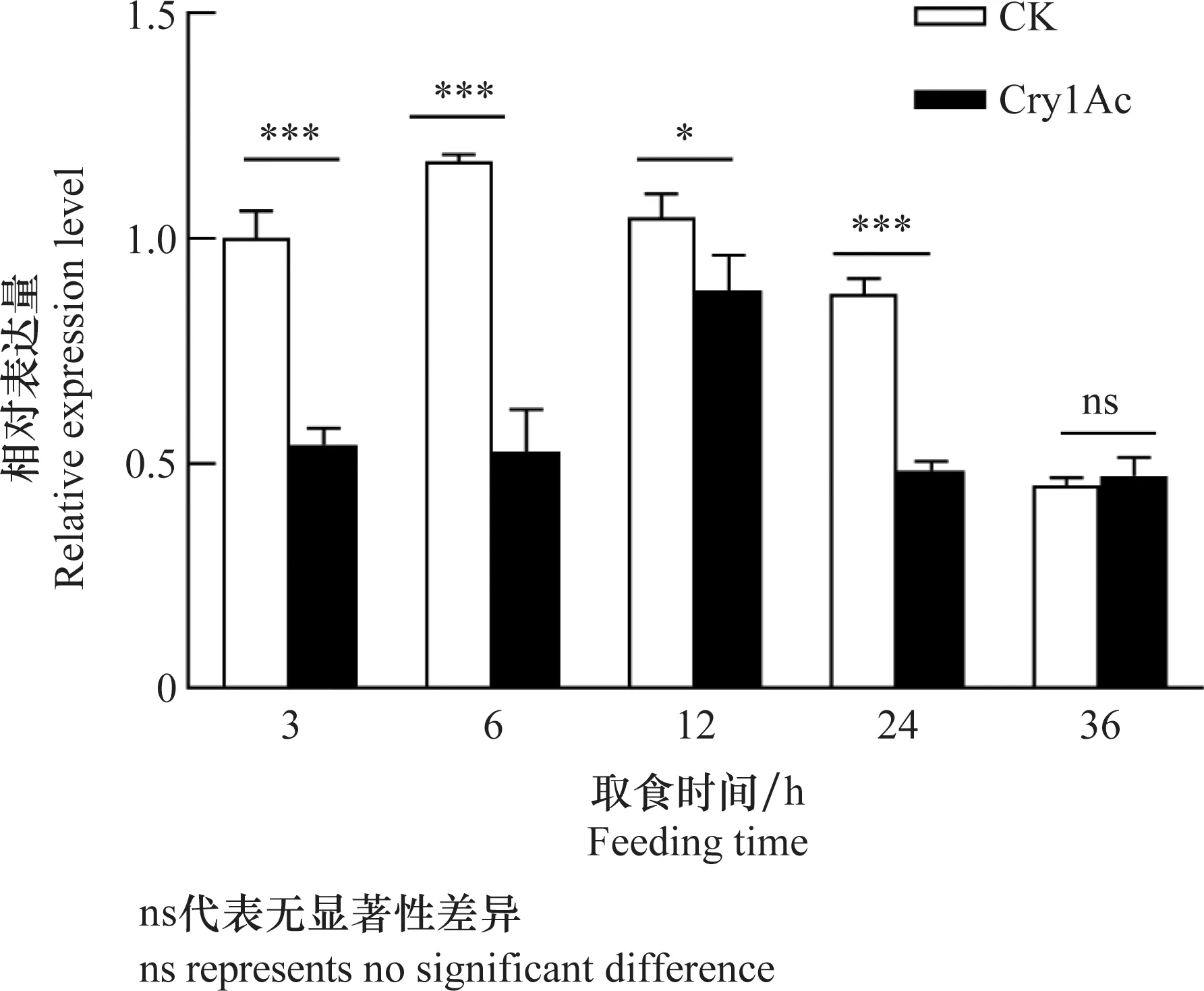
图2 取食Cry1Ac蛋白对棉铃虫5龄幼虫中肠中V-ATPase H基因表达量的影响
2.3 V-ATPase H的亚细胞分布
用GFP-pIEx和V-ATPase H-GFP-pIEx质粒分别转染Sf9细胞,荧光显微镜下能观察到绿色荧光,说明相应蛋白已经成功在细胞中表达,通过观察可知V-ATPase H在细胞核和细胞质中均有表达(图3)。
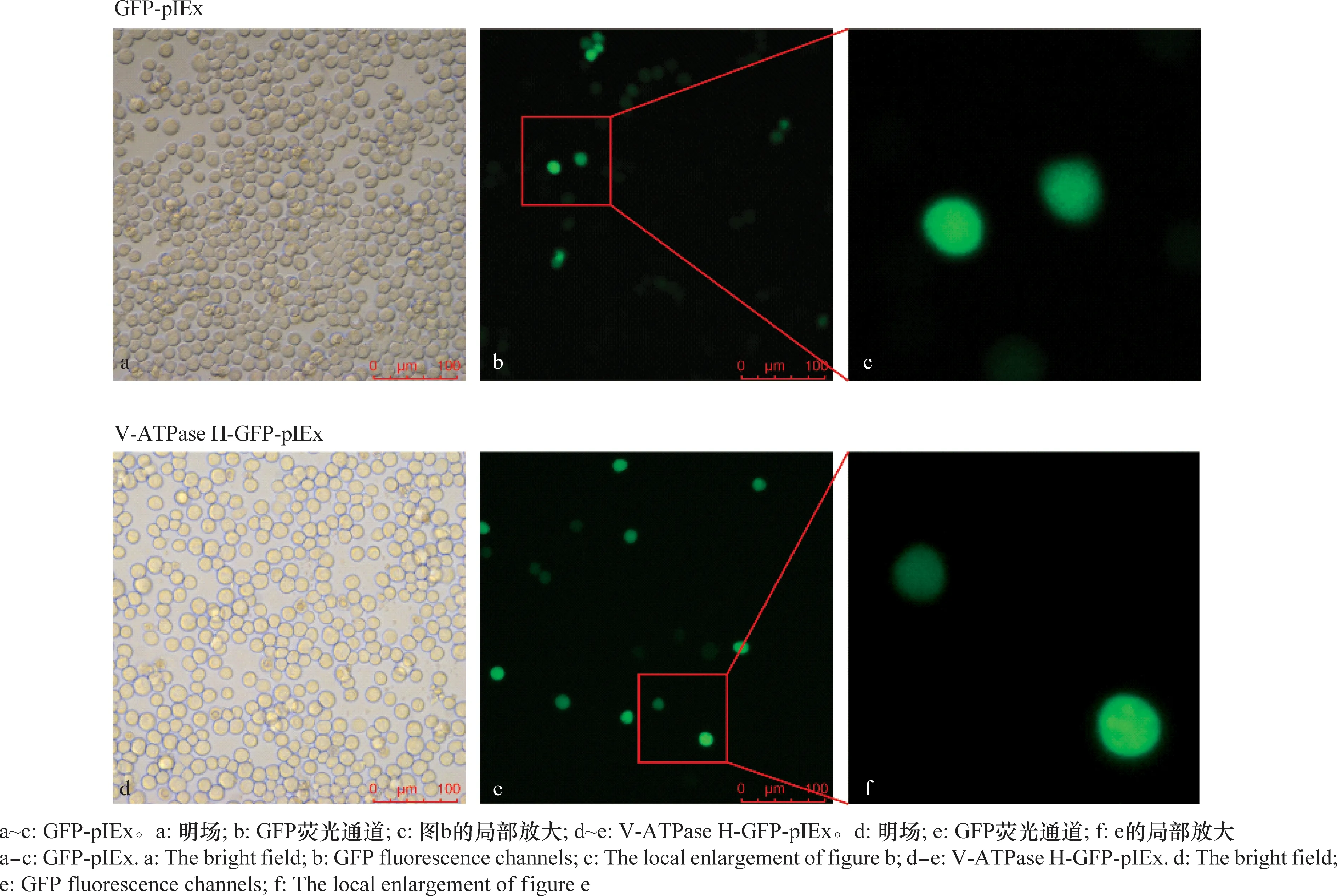
图3 V-ATPase H在细胞内的表达和分布
2.4 表达V-ATPase H蛋白增强了Cry1Ac对细胞的毒力
利用Western blot证实棉铃虫V-ATPase H蛋白能在Sf9细胞内表达(图4a)。使用终浓度为200 μg/mL Cry1Ac活化蛋白处理表达了棉铃虫V-ATPase H的Sf9细胞,Sf9细胞的死亡率提高了30.2%(P= 0.000 1,F= 208.81,df=5,图4b)。表明过表达V-ATPase H增强了细胞对Cry1Ac的敏感性。
图4 过表达V-ATPase H对Cry1Ac细胞毒性的影响
3 结论与讨论
本课题组前期通过转录组测序和DGE分析了不同抗Cry1Ac棉铃虫品系与敏感品系之间的差异基因,发现V-ATPaseH基因在抗性种群中普遍低表达[15]。本研究通过荧光定量PCR进一步证实了抗性棉铃虫品系中V-ATPase H表达量降低(图1),这与其他V-ATPase亚基基因(V-ATPaseB基因)在Cry1Ac抗性棉铃虫品系中表达量显著降低的结果一致[6,23]。此外,V-ATPase亚基基因被报道在棉铃虫和甜菜夜蛾中通过改变其表达量影响Bt蛋白的毒力[23-24], 因此推测V-ATPase H可能通过降低表达来增强棉铃虫对Cry1Ac的抗性。
为了进一步探索V-ATPase H在Cry1Ac毒力和棉铃虫抗性中的作用,本研究通过荧光定量PCR检测了敏感棉铃虫受到Cry1Ac诱导时,V-ATPaseH基因的表达情况。结果表明在受到Cry1Ac诱导时,棉铃虫V-ATPaseH基因的表达量显著降低(图2),在类似的V-ATPase众多亚基中,如V-ATPaseA等受到Cry1Ac诱导时表达量显著降低[15,25-26]。这说明V-ATPaseH基因可能与其他V-ATPase众多亚基一样在受到Cry1Ac胁迫时通过降低表达来增加对Cry1Ac的耐受性。
此外,V-ATPase亚基蛋白作为Bt蛋白受体的研究也有报道。例如,甜菜夜蛾SpodopteraexiguaV-ATPase B是Cry2Aa的功能受体,RNA干扰(RNA interference,RNAi)V-ATPaseB能显著降低甜菜夜蛾对Cry2Aa的敏感性[24]。敲除二化螟Chilosuppressalis幼虫的V-ATPaseA基因会导致二化螟幼虫对表达Cry2Aa和Cry1Ca水稻的敏感性显著降低[27]。为了进一步证实V-ATPase H在Cry1Ac毒力中的功能。本研究通过在Sf9细胞内表达V-ATPase H,然后进行细胞毒力测定,结果表明在细胞内过表达V-ATPase H会增加Cry1Ac对细胞的毒力(图4),这种现象与之前报道的在细胞内过表达ATP合酶α亚基会增加Cry2Ab对细胞的毒力[28],以及在细胞内过表达APN1和ALP2会增强Cry1Ac 对细胞的毒力结果类似[21,29]。
本研究首次报道了棉铃虫V-ATPase H参与了Cry1Ac对棉铃虫毒力及棉铃虫对Cry1Ac抗性形成。然而值得注意的是V-ATPase H与V-ATPase其他亚基的分布一致,主要分布在细胞内或细胞内细胞器膜上[30],甚至在细胞核内也有分布(图3)。这与常见的Bt蛋白受体分布于细胞膜上的情况不同。V-ATPase H如何参与到Cry1Ac的毒力过程还有待进一步的研究。
