隆突性皮肤纤维肉瘤磁共振影像特征分析
2023-02-03陈梓盼陈晓东罗树存罗文暄骆俊佳邓康罗泽斌
陈梓盼 陈晓东 罗树存 罗文暄 骆俊佳 邓康 罗泽斌
1广东医科大学附属医院健康管理中心,湛江 524001;2广东医科大学附属医院放射影像中心,湛江 524001;3广东医科大学附属医院放射影像学研究室,湛江 524001
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种少见的发生在真皮及皮下间叶组织的低度恶性肿瘤,具有局部侵袭性,术前误诊率高(误诊率可高达52%~87%),术后容易复发(复发率可高达50%~70%),术前正确诊断对手术方案制定及患者预后有重要影响[1]。正确认识DFSP术前磁共振影像征象,有助于提高DFSP术前正确诊断率。本研究收集14例DFSP患者的磁共振影像资料进行分析,旨在提高对DFSP术前的影像学认识。
资料与方法
1.一般资料
本文为描述性研究。收集广东医科大学附属医院2011年3月至2022年6月经病理及免疫组化检测确诊的14例DFSP患者的磁共振影像资料,其中男9例、女5例,年龄21~58(43.8±12.2)岁。患者主要以皮肤结节/肿块等症状体征就诊。纳入标准:(1)经病理证实为DFSP病例;(2)有完整磁共振检查影像资料的DFSP病例;(3)患者及家属知情同意。排除标准:(1)影像检查怀疑DFSP但无病理证实的病例;(2)无完整磁共振检查影像资料的DFSP病例。本研究符合《赫尔辛基宣言》要求。
2.扫描方法
采用3.0T MR(美国GE MR750)超导型磁共振扫描仪进行磁共振成像。所有患者均取仰卧位、双臂上举、头先进。胸腹部扫描则在扫描过程中嘱患者吸气后屏住呼吸以减少呼吸伪影。分别进行平扫横断位T1加权成像(T1WI),T2加权成像(T2WI)压脂/不压脂序列,冠状位T2WI和/或矢状位T2WI,增强扫描三平面T1WI压脂序列。T1WI:重复时间(TR)500~700 ms,回波时间(TE)10~18 ms;T2WI:TR 1 800~4 500 ms,TE 70~90 ms。弥散加权成像(DWI)序列b值=800。增强扫描采用钆喷酸葡胺注射液(拜耳医药保健有限公司,国药准字HJ20160596,规格469.01 mg/ml×15 ml),剂量为0.1 mmol/kg,使用磁共振专用高压注射器,注射速率为2~3 ml/s,随后注入20 ml生理盐水。
3.图像分析
由2位有10年以上工作经验的高年资磁共振诊断医师对图像进行观察分析,记录DFSP患者的磁共振表现,包括平扫及增强扫描的磁共振信号情况,肿瘤数量、部位、大小、形态、边缘浸润情况等。采用双盲法阅片,意见不统一时协商达成共识。
结 果
1.临床特点
14例均为单发,均位于皮肤或皮下浅层,表现为突出皮肤表面的结节/肿块。最大长径21~160(57.1±37.0)mm,平均体积大小为57.1 mm×40.4 mm×28.4 mm。14例均位于躯干,其中胸部2例、背部4例、腹壁3例、锁骨区2例、肩部1例、臀部1例、腹股沟1例。14例DFSP患者的临床资料见表1。
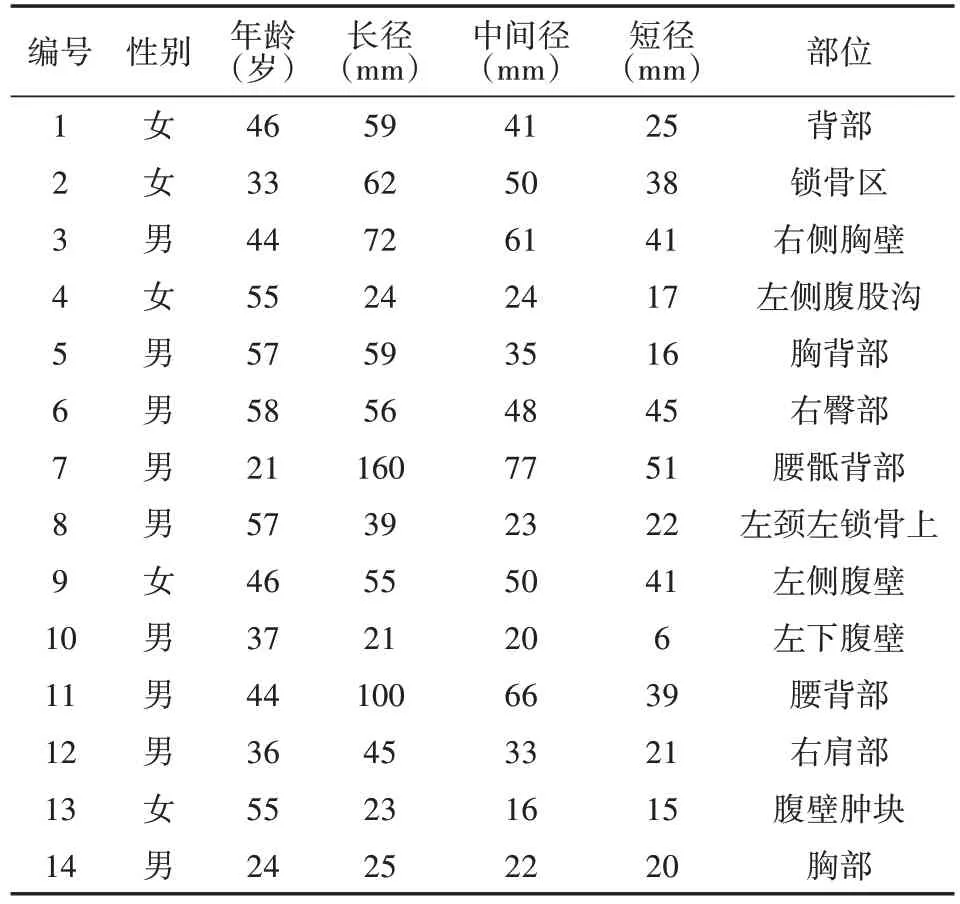
表1 14例隆突性皮肤纤维肉瘤患者临床资料
2.磁共振影像学表现
平扫T1WI信号与肌肉相仿或稍低,T2WI高信号(图1~3),6例病灶内可见少量线状低信号分隔(图2),3例DWI明显高信号(图2),10例增强扫描病灶呈明显均匀强化,4例呈不均匀强化,内可见斑片低强化区域。6例病灶内T2WI压脂低信号分隔增强扫描强化不明显。1例肿块内可见流空血管影(图3)。1例肿块内见T1WI平扫呈高信号,且T2WI压脂序列对应区域的信号无减低且亦为高信号(图2),手术病理证实为出血。所有病例未见坏死、囊变、钙化。周围软组织未见水肿。14例病灶均局限在皮肤及皮下脂肪组织内,5例出现脂肪尾征(图1),4例出现筋膜尾征(图2)。14例病灶与深层周围结构分界清楚,未见邻近深层结构受侵犯改变。

图1 女性,46岁,背部肿物就诊,隆突性皮肤纤维肉瘤。A为矢状位T2加权成像(T2WI)不压脂序列,可见背部皮肤隆起性肿块,T2WI信号稍高;B为矢状位T1WI平扫不压脂序列,可见背部肿块信号与邻近肌肉相仿;C为横断位T2WI不压脂序列,可见肿块内片状稍低信号影,病灶右侧尚见沿皮下脂肪延伸的条片状影;D为横断位T1WI压脂增强序列,可见肿块明显强化,内可见片中低强化区域,肿块沿右侧皮下脂肪延伸,呈“脂肪尾征”
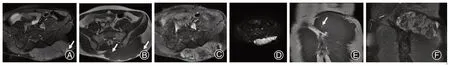
图2 男性,21岁,腰骶背部肿物就诊,隆突性皮肤纤维肉瘤。A为横断位T2加权成像(T2WI)压脂序列,可见腰骶背部皮下巨大肿块,T2WI压脂信号较高,内可见多发线状低信号分隔,病灶右侧尚见沿筋膜延伸的索条状影,呈“筋膜尾征”改变(白箭头);B为横断位T1WI平扫不压脂序列,可见背部肿块信号与邻近肌肉相仿,内可见散在片状高信号影(白箭头),且T2WI压脂序列对应区域的信号无减低且亦为高信号(图A白箭头);C为横断位T1WI压脂增强序列,可见肿块明显不均匀强化,内多发片状低强化区,病灶右侧尚见沿筋膜延伸的索条状影,呈“筋膜尾征”改变;D为横断位弥散加权成像(DWI)序列,可见肿块明显高信号,内多发条状低信号影;E为冠状位T1WI平扫不压脂序列,内可见散在片状高信号影(白箭头);F为冠状位T1WI压脂增强序列,可见肿块明显不均匀强化

图3 女性,33岁,左锁骨区肿物就诊,隆突性皮肤纤维肉瘤。A为横断位T2加权成像(T2WI)压脂序列,可见左锁骨区皮肤表面隆起性肿块,T2WI压脂信号较高,肿块外侧部可见流空信号的血管影断面(白箭头);B为横断位T1WI平扫不压脂序列,可见肿块信号与邻近肌肉相仿;C为横断位T1WI压脂增强序列,可见肿块明显均匀强化;D为矢状位T2WI压脂序列,肿块下部可见条状流空信号血管影(白箭头);E为矢状位T1WI压脂增强序列,肿块下部可见条状流空信号血管影(白箭头);F为冠状位T2WI压脂序列,肿块内下部可见流空信号的血管影断面(白箭头);G为冠状位T1WI压脂增强序列,可见肿块明显均匀强化,肿块内下部可见流空信号的血管影断面(白箭头)
讨 论
1.DFSP的临床病理特征
DFSP是一种低级别、具有局部侵袭性的软组织肉瘤,发生于真皮或表浅皮下组织。该肿瘤约占所有软组织肉瘤的5%,占所有皮肤软组织肉瘤的18%[2]。DFSP可发生于任何年龄,但临床上多发生于年轻人至中年人患者,发病高峰年龄为25~45岁,男性略多于女性[2]。本研究14例患者平均年龄为43.7岁,男女比例为9∶5,与前述研究结果相仿。DFSP具有潜在的恶性趋向,术后容易复发,术后复发与多种因素有关,目前研究多认为与肿瘤病理组织类型、肿瘤大小、生长部位、与邻近结构关系、手术切缘距离等因素有关[2-4]。传统化疗方案对DFSP效果较差。辅助放疗可以降低DFSP复发率,但尚缺乏强有力的证据支持[1-2]。DFSP确诊往往依赖病理检查,常规镜下典型病理表现为较一致的梭形细胞构成,常呈车轮状、席纹状、漩涡状、编织状或束状排列,侵及周围皮下脂肪组织的纤维间隔,则呈特征性的蜂窝状、多层状组织学图像。DFSP常规镜下不典型时,往往需要结合免疫组化帮助确诊,DFSP免疫组化的显著特点是CD34强阳性,Vimentin阳性,XIIIa因子阴性。但需要注意的是,有6%~10%的DFSP并不表达CD34,而有15%~25%的DFSP会表达XIIIa因子;还有些肉瘤如成肌纤维肉瘤、上皮样肉瘤等会出现CD34的阳性表达;某些良性纤维组织细胞病变也会出现CD34的阳性表达[2]。
2.DFSP磁共振影像表现
DFSP多为单发,少数可以多发病灶。主要发生于躯干,其次为头颈部及四肢,四肢多发生于靠近躯干端。本研究亦呈现以上特点。14例均表现为突出皮肤表面的结节/肿块,呈“悬吊征”,有报道这是DFSP与其他浅表肿瘤鉴别的重要特征之一[5]。
本组14例DFSP平扫T1WI信号与肌肉相仿,T2WI压脂明显高信号,这是由于DFSP病灶内含胶原成分减少导致的。胶原成分多会导致病变的T2弛豫时间缩短(信号减低),而DFSP胶原成分减少,则T2弛豫时间增加(信号增高),因此与其他纤维性肿瘤T2WI低信号不同,DFSP在T2WI上呈较高信号[6]。3例DWI为高信号,反映了DFSP作为一种低度恶性肿瘤水分子扩散受限的病理生理[7]。6例病灶内可见少量线状低信号分隔,增强扫描低信号分隔强化不明显,其病理基础可能为病灶内的纤维基质成分,有研究认为这是判断DFSP为纤维组织来源的重要依据[8-10]。
10例增强扫描病灶呈明显均匀强化,4例呈不均匀强化,内可见斑片低强化区域。DFSP由于肿瘤细胞间血管丰富,因此磁共振增强扫描往往明显强化,其内出现的斑片状低强化区域对应的T2WI为高信号,有研究报道这些低强化区在多期相动态增强扫描中可呈渐进性强化,其病理基础可能与肿瘤内存在编织状排列的梭形细胞、胶原纤维及细小的毛细血管网有关,导致对比剂进入瘤灶内以后的流速缓慢[8]。
14例病灶局限在皮肤及皮下脂肪组织内,5例出现脂肪尾征,4例出现筋膜尾征。其病理基础为肿瘤侵及皮下脂肪组织的纤维间隔或累及筋膜层在磁共振影像上的反映。有报道认为“尾征”的出现反映肿瘤对邻近组织的侵袭程度,提示肿瘤的恶性程度增高,可能对手术切除范围的划定有重要意义[7,11]。
有趣的一点是,此前有研究其所有病例增强扫描均未见明显迂曲增粗强化的肿瘤血管影,在T2WI上亦未见呈流空效应的肿瘤血管影,并推测这可能是DFSP的一个特征之一[8]。而本组有1例病例病灶内可见迂曲增粗的血管影,增强扫描及T2WI上呈流空效应的肿瘤血管影,与此前的研究不相符,而本例中迂曲增粗的血管影主要位于病灶边缘,推测此血管有可能是肿瘤的供血血管,也有可能是肿瘤早期包埋皮肤表面的血管,随着肿瘤的增大而推挤到肿瘤边缘,具体是哪种情况,还有待后续进一步研究。
徐敏涛等[12]研究DFSP病例均未见出血,并认为可能这是DFSP的特征之一,但本组病例中1例出现片状T1WI平扫高信号影,经手术病理证实为肿瘤内出血,该病例的病理诊断也很不典型,最后经多方会诊确诊为黏液性隆突性皮肤纤维肉瘤-纤维肉瘤,推测出血的原因有可能与局部的纤维肉瘤转化有关,事实上有文献报道局部纤维肉瘤转化也预示着DFSP的预后不好,因此磁共振上发现DFSP出血征象时,有可能与DFSP患者的预后相关[2]。另外一方面,由于该病例的DFSP肿块巨大,出血也有可能是由于肿瘤太大局部血供不足导致。具体出血原因以及出血是否与患者预后相关,亦有待后续进一步研究。
需要注意的是,本研究收集的14例病灶最大径达160 mm,20~30 mm的病例仅4例,其余均为39 mm以上的大病灶为主,与其他研究病例大小分布情况相仿[12]。推测由于DFSP临床表现缺乏特异性,早期阶段表现为息肉状皮肤突起或皮肤硬结,早期的小病灶临床医师往往直接不经磁共振或CT等大型检查,直接按照皮肤其他疾病如增生瘢痕、瘢痕疙瘩等诊治,容易导致误诊的同时,也导致了早期小的病灶影像学磁共振/CT检查缺乏,从而有可能导致影像资料收集产生偏倚现象。
3.DFSP的鉴别诊断
DFSP需与其他可发生在皮肤及浅表皮下组织的病变鉴别,包括真皮纤维瘤、脂肪瘤/脂肪肉瘤、血管瘤、神经源性肿瘤、结节性筋膜炎、皮肤表皮样囊肿、皮肤皮脂腺囊肿等。(1)真皮纤维瘤属于乏血供肿瘤,磁共振增强扫描强化不明显。(2)脂肪瘤/脂肪肉瘤含脂肪信号,在压脂序列呈低信号可资鉴别。(3)血管瘤T2WI压脂呈明显高信号的“亮灯泡征”,内可见斑点/条片状低信号影(钙化/静脉石)或“蚯蚓状”流空血管影。(4)神经源性肿瘤多位于深层肌间隙,多沿神经干走行的梭形病灶,神经鞘瘤可见细胞密集的A区(T2WI稍高信号)和细胞疏松的B区(T2WI明显高信号),增强扫描A区强化明显,B区早期强化不明显,神经纤维瘤T2WI信号及增强扫描强化程度均低于DFSP。(5)结节性筋膜炎大部分起源于筋膜,好发于四肢,肌间型及肌内型位置均较深,皮下型位于皮下脂肪间隙内,一般不突出于皮肤表面。(6)皮肤表皮样囊肿一般不突出于皮肤表面,增强扫描无强化。(7)皮肤皮脂腺囊肿临床上容易鉴别,磁共振增强扫描无强化,合并感染时鉴别难度增加。
4.本研究的局限性
本研究较大的不足在于病例数相对较少,广东医科大学附属医院自2011年以来的病例库中DFSP有术前磁共振影像资料的极少,推测一方面由于DFSP为少见病例,另一方面由于DFSP生长缓慢,早期表现为皮肤硬结或瘢痕疙瘩样,临床往往直接按照其他皮肤病变直接手术处理。另外本研究仅对DFSP患者的磁共振影像进行分析,而不同的影像检查方法具有互补性,后续的研究可以结合CT和/或超声影像表现进行综合性分析。
总之,DFSP磁共振影像学表现具有一定的特征性,正确认识这些影像征象有助于提高对DFSP的认识,为DFSP的病理诊断及临床诊治提供有用的参考。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明陈梓盼:数据分析;陈晓东、陈梓盼:论文撰写;陈晓东、罗泽斌:研究设计;罗树存、罗文暄、骆俊佳、邓康:图像收集
