右旋糖酐40制备过程中细菌内毒素含量的影响因素
2023-02-02问清江孙晓宇郑巧霞
问清江, 慕 娟, 孙晓宇, 郑巧霞, 丁 浩
(陕西省微生物研究所,陕西 西安 710043)
右旋糖酐40(Dextran 40)是临床医学最常用的血浆代用品,静脉注射后可以提高血浆胶体渗透压,吸收血管外的水分而增加血容量,从而维护血压,扩充血容量,还可使已经聚集的红细胞和血小板解聚,降低血液黏滞性,改善人体血液微循环,具有防止弥散性血管内凝血的作用,主要用于治疗失血性休克[1-11]。细菌内毒素(Endotoxin)是革兰阴性菌细胞壁的脂多糖(Lipopolysaccharde,LPS),主要由菌体死亡解体释放。 内毒素是常见的外源性致热原,属于强免疫刺激因子,进入机体后能导致严重的炎症级联反应,从而引起一系列的病理生理反应,在极微量的情况下便可引起人体白细胞减少、微循环障碍、全身炎症反应、发热、低血压、心动过速、多器官功能衰竭甚至死亡等严重不良反应。所以,在药物尤其是注射剂的生产中,细菌内毒素的去除和严格控制非常重要,关乎人们的生命安全[12-14]。LPS是一个结构复杂的大分子物质,但是不同种类革兰阴性菌的LPS均有共同组成部分。LPS分子结构大致分为O-特异性链(O-抗原)、核心多糖(核心区)、类脂A 三个部分(图1)。类脂A 由氨基葡萄糖、磷酸和脂肪酸组成,是脂多糖不可缺少的组成部分,几乎参与内毒素介导的所有生物活性。核心区和O-抗原具有亲水性,类脂A具有疏水性。在水中分子量约为50~500 kDa。细菌内毒素的计量单位为活性单位(endotoxin units,EU)[16-17]。 目前,我国右旋糖酐40原料药的产品标准中还没有内毒素含量指标,但是美国、英国和欧洲的同类产品中具有内毒素指标(≤10 EU/g),因此造成我国的右旋糖酐40的产品质量与美国、英国和欧洲存在差距,使用药物安全性存在隐患[18-20]。我们在改进右旋糖酐40原料药生产新工艺研究过程中,将细菌内毒素也作为一个指标,对乙醇分级沉淀、超滤膜分离[21-28]及其他相关因素进行了研究,初步探索了细菌内毒素的结构、分子大小等与右旋糖酐40制备过程中的相互关系,最终使得右旋糖酐40原料药的细菌内毒素含量达到国际标准。

图1 细菌内毒素的典型结构示意[15]Fig.1 Schematic diagram of endotoxin structure[15]a:细菌内毒素结构;b:类脂A分子结构a:Endotoxin structure;b:Mdecular structure of lipid A
1 材料与方法
1.1 材料
1.1.1 供试菌株 肠膜状明串珠菌Leuconstocmesenteriodes-1226 (Lm-1226)由中国药品生物制品检定所提供。
1.1.2 主要试剂与仪器设备 白砂糖(一级,孟连昌裕糖业有限责任公司);右旋糖酐酶(Y200301,宁夏夏圣实业集团有限公司);鲎试剂(湛江博康海洋生物有限公司);细菌内毒素检测用水(湛江博康海洋生物有限公司);其他试剂为市售分析纯。生化培养箱(SPX-150BIII,天津泰斯特仪器有限公司);隔水式培养箱(GH-500,北京科伟永兴仪器有限公司);实验膜分离设备(LABSTAR UF5,北京安石环境工程有限公司);分光光度计(722,上海精密科学仪器有限公司);糖度计(WYT-J,成都豪创光电仪器有限公司);数显恒温磁力搅拌器(85-2,杭州仪表电机有限公司);电热鼓风干燥箱(101,北京科伟永兴仪器有限公司);高效液相色谱仪(2010A-HT,苏州贝锐仪器科技有限公司);内毒素凝胶法测定仪 (ET-96,天津市天大天发科技有限公司)。
1.2 方法
1.2.1 右旋糖酐的酶解 将肠膜状明串珠菌Lm-1226的斜面种子接入种子培养基,25 ℃培养36 h,种子液接入发酵培养基培养28 h;发酵结束后直接加入右旋糖酐酶进行酶解(酶浓度0.19 IU/mL,温度50 ℃,时间3.5 h);加入1%(质量分数)的活性碳继续搅拌保温40 min过滤,收集滤液为酶解待分离液。
1.2.2 乙醇沉淀分离纯化右旋糖酐40的制备 取一定量的1.2.1中的酶解待分离液,按照42%~46%(体积分数)加入乙醇,搅拌均匀,40 ℃放置12 h,倾出大部分上清液,剩余部分离心分离,沉淀部分为大分子等杂质,收集上清液进一步乙醇沉淀分离纯化;按照50%~60%加入乙醇,搅拌均匀,室温放置24 h,倾出上清液,收集沉淀,用75%乙醇洗涤沉淀3次,60 ℃烘干,粉碎为右旋糖酐40成品备用。
1.2.3 右旋糖酐发酵液的预处理及酸水解 将稀释后的右旋糖酐发酵液经板框过滤、陶瓷膜滤过及5 kDa 超滤截流浓缩为右旋糖酐发酵液处理液;然后在0.08%(质量分数)盐酸,95~100 ℃条件下水解3.0 h;加入1%(质量分数) 的活性碳继续搅拌保温40 min过滤,收集滤液为待分离液。
1.2.4 超滤分离纯化右旋糖酐40的制备 将1.2.3中的待分离液进行超滤分离纯化。①100 kDa+5 kDa、100 kDa+10 kDa和100 kDa+20 kDa二膜组合超滤,首先经100 kDa膜超滤得截留液并制备成干品,滤过液继续经5 kDa(或10、20 kDa)膜超滤,截留液制备成干品;②100 kDa+20 kDa+50 kDa三膜组合超滤,首先经过100 kDa膜超滤,截留液制备成干品,滤过液继续经20 kDa膜超滤,截留液再经50 kDa膜超滤,截留液和滤过液均制备成干品。截留液用 60%乙醇沉淀、干燥、粉碎备用;滤过液通过减压浓缩,用50%~60%乙醇沉淀,干燥,粉碎备用。
1.2.5 细菌内毒素的测定[18,29-30]根据公式 MVD=(c·L)/λ(MVD代表溶液最大稀释倍数,c代表溶液浓度,L代表内毒素限值,λ代表鲎试剂灵敏度)计算出相应稀释倍数,用内毒素检查用水依次梯度进行稀释,并及时用封口膜封住试管口。准确称取适量待测右旋糖酐40固体样品,加入细菌内毒素检查用水进行超声溶解,得右旋糖酐40样品原液,将其适当稀释后检测,按照浓度计算限值(右旋糖酐固体样品假设MVD=1)。
1.2.6 分子量与分子量分布[18]取右旋糖酐40样品适量,加流动相溶解并稀释制成每1 mL约含10 mg的溶液,振摇,室温放置过夜作为供试品溶液。另取 4~5 个已知分子量的右旋糖酐对照品,依法检查(2020 版《药典》四部通则0514),样品 10%大分子部分重均分子量不得大于120 000,10%小分子部分重均分子量不得小于5 000。
2 结果与分析
2.1 乙醇沉淀分离纯化右旋糖酐40
2.1.1 不同浓度乙醇沉淀分离纯化右旋糖酐40对细菌内毒素含量的影响 右旋糖酐发酵液在右旋糖酐酶作用下,降解为一定分子量分布的酶解液,经活性炭吸附除杂并收集滤液,将滤液进行乙醇分级沉淀分离纯化成右旋糖酐40,并对分离纯化的样品进行细菌内毒素检测,同一待分离右旋糖酐溶液选择不同浓度乙醇沉淀分离右旋糖酐40,乙醇浓度对右旋糖酐40细菌内毒素含量的影响见表1;乙醇分级沉淀分离纯化右旋糖酐40采取一次沉淀除杂,二次沉淀右旋糖酐40的方法,由于出发右旋糖酐溶液不同导致相同乙醇浓度沉淀产品细菌内毒素含量不同(表2)。结果表明,同一待分离液选取不同浓度的乙醇进行分离纯化,随着乙醇浓度的增加,相应沉淀产品的细菌内毒素含量逐渐降低;在乙醇分步沉淀中,随着乙醇浓度逐级提高,分离产品的细菌内毒素含量随之降低。细菌内毒素是一种脂多糖,其由O-特异性链(O-抗原)、核心多糖(核心区)、类脂A 三个部分构成(图1),核心区和O-抗原为亲水性,类脂A为疏水性,在水溶液中呈聚集状态。乙醇浓度的高低决定了细菌内毒素在溶液中的溶解性,乙醇浓度越高,溶液中的细菌内毒素含量越高,沉淀中的细菌内毒素含量越低。右旋糖酐是醇不溶性物质,随着乙醇浓度的提高,溶解性降低;而且分子量越大,沉淀乙醇浓度越低,因此可以通过不同乙醇浓度逐级分离纯化不同分子量的右旋糖酐。在保证右旋糖酐40重均分子量和分子量分布的前提下,可以通过乙醇再沉淀分离去除细菌内毒素,提高产品品质。

表1 乙醇浓度对右旋糖酐40细菌内毒素含量的影响
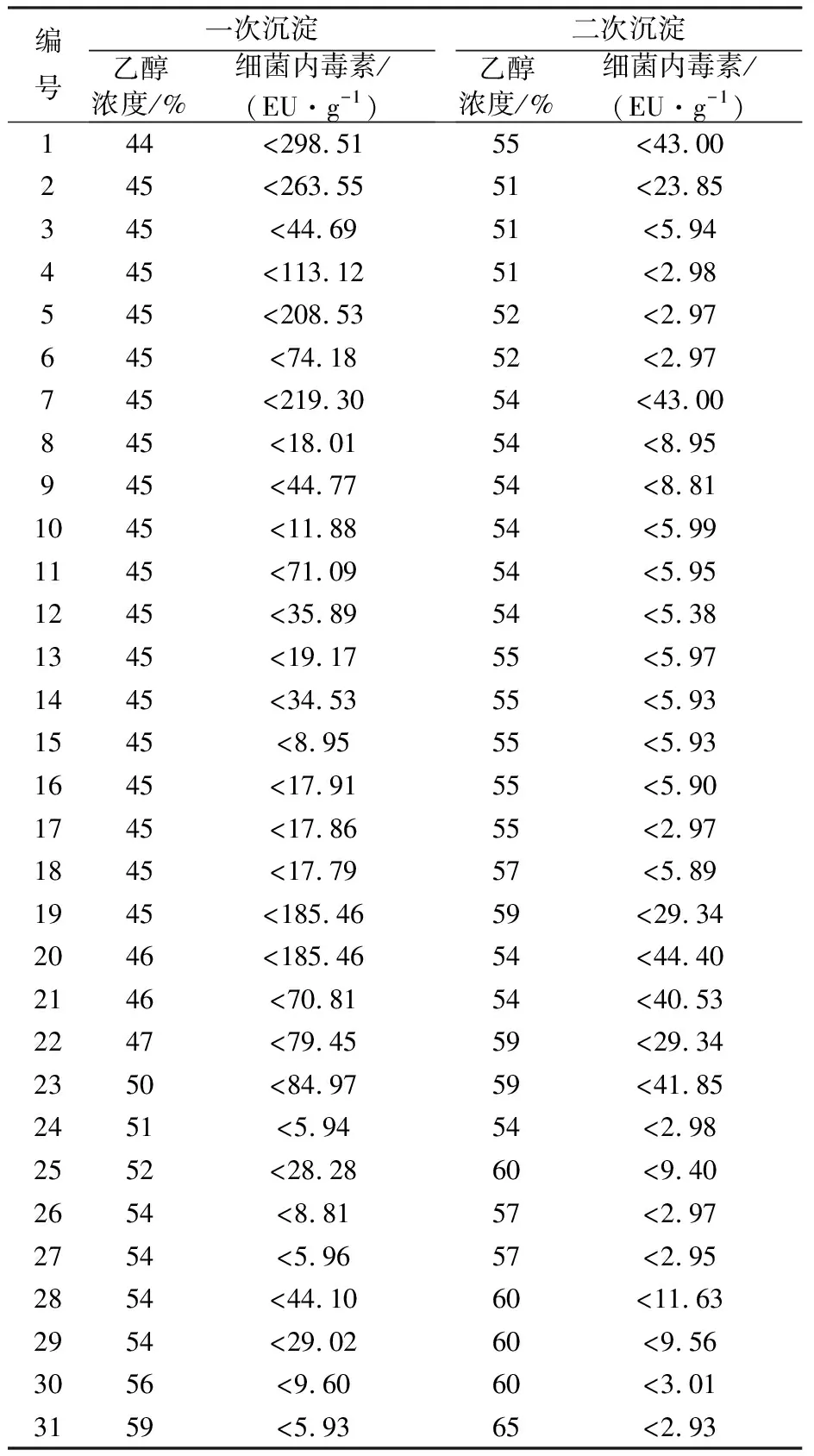
表2 乙醇分步沉淀对右旋糖酐40细菌内毒素含量的影响Table 2 Effect of ethanol step precipitation on endotoxin content of dextran 40
2.1.2 右旋糖酐40分离纯化用水等对细菌内毒素含量的影响 将右旋糖酐40粗品加水溶解为10%溶液,按照乙醇浓度45%~50%一次沉淀除杂,再按照51%~59%二次沉淀制备右旋糖酐40。在分离纯化过程中分离纯化产品细菌内毒素没有降低,反而出现杂乱升高的异常情况(表3)。分析这一现象首先从环境因素着手,如称量样品、溶解、乙醇沉淀、干燥等操作过程暴露于开放环境中的,空气中的细菌落入试液和成品可能引入细菌内毒素;使用非洁净的试验器具,因器具污染也会引入细菌内毒素。因此,在非无菌环境中尽可能减少空气中的暴露及污染等有可能造成细菌内毒素引入的发生,分离过程中尽可能避免环境影响(表3),以改善细菌内毒素含量杂乱的现象,明确了环境因素是引起分离纯化细菌内毒素异常的原因之一;但是终产品的细菌内毒素仍然高于出发品,分析分离纯化用水可能存在问题,于是对实验室去离子水进行细菌内毒素含量检测(表4),去离子水细菌内毒素含量最高<56.25 EU/mL(存放时间30 d),最低<3.125 EU/mL,按照后者计算,每1 g右旋糖酐粗品分离纯化时因水引入细菌内毒素31.25 EU,纯化用水会影响到右旋糖酐40分离纯化中细菌内毒素的指标。因此右旋糖酐40分离纯化时不仅要考虑环境因素,而且需要选择细菌内毒素含量达标的纯化用水。

表4 水中细菌内毒素含量
2.1.3 右旋糖酐40的分离纯化 用细菌内毒素含量<0.125 EU/mL的娃哈哈纯净水替代实验室去离子水进行右旋糖酐40的分离纯化(表5),结果大大改善了细菌内毒素的去除效果,所有终产品的细菌内毒素含量均<6.00 EU/g,最低含量<3.00 EU/g,优于国际标准(≤10 EU/g);分离纯化的右旋糖酐40的重均分子量和分子量均符合《中国药典》(2020版二部)质量标准(重均Mr 32 000~42 000,10%大分子Mr≤120 000,10%大分子Mr≥5 000)。
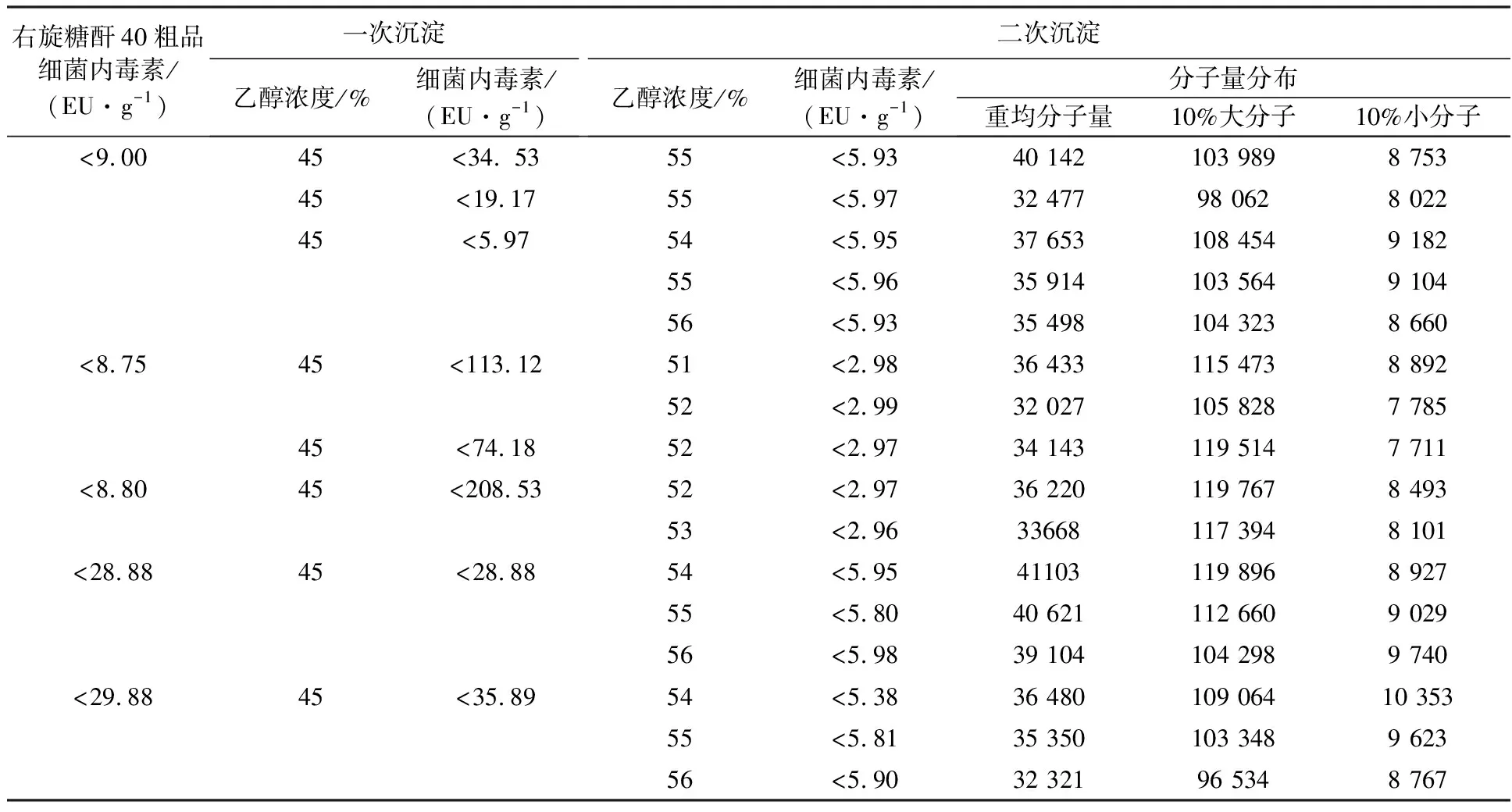
表5 乙醇沉淀分离纯化右旋糖酐40结果
2.2 超滤分离纯化右旋糖酐40对细菌内毒素含量的影响
将右旋糖酐发酵液经过板框过滤、陶瓷膜微滤及超滤预处理,盐酸水解和活性炭吸附除杂为待分离溶液。通过100 kDa+5 kDa、100 kDa+10 kDa和100 kDa+20 kDa二膜组合和100 kDa+20 kDa+50 kDa三膜组合超滤分离纯化右旋糖酐40,对其相应成品进行内毒素检测分析(表6、7)。100 kDa超滤膜与5 kDa、10 kDa和20 kDa分别组合成二次超滤,随着第二次超滤膜截留分子量的增大,去除细菌内毒素的效果增强,分离纯化的终产品中的细菌内毒素含量降低,100 kDa+20 kDa超滤分离纯化的右旋糖酐40的细菌内毒素含量有望达到10 EU/g以下;100 kDa+20 kDa+50 kDa三膜组合超滤分离纯化右旋糖酐40的细菌内毒素含量达到3 EU/g以下,重均分子量及分子量分布达到《中国药典》(2020版二部)标准。超滤分离纯化右旋糖酐40及细菌内毒素的去除与其分子量大小不同有关,右旋糖酐40的重均分子量为32 000~42 000,细菌内毒素的分子量为50~500 kDa,二者之间存在差异,通过对超滤膜进行组合,最终达到分离纯化右旋糖酐40的目标,在重均分子量和分子量分布保证的前提下,细菌内毒素含量优于国际标准(≤10 EU/g)。右旋糖酐水解处理液经过100 kDa+20 kDa+50 kDa三膜组合超滤分离纯化(首先经过100 kDa膜超滤,滤过液继续经20 kDa膜超滤,截留液再经50 kDa膜超滤),其滤过液浓缩、乙醇沉淀制备成右旋糖酐40,细菌内毒素含量和分子量分布双达标。
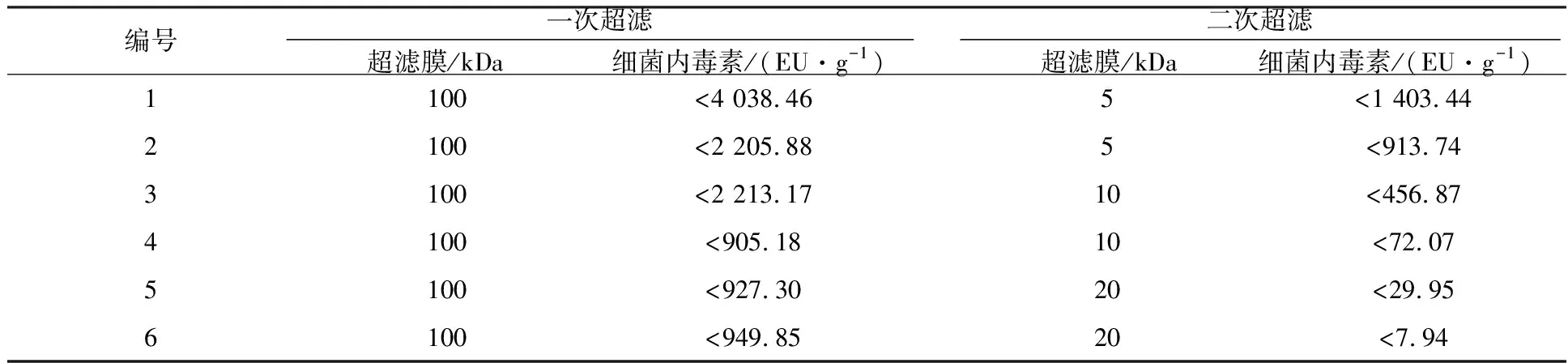
表6 二膜组合超滤分离纯化对右旋糖酐40细菌内毒素含量的影响

表7 三膜组合超滤分离纯化对右旋糖酐40细菌内毒素含量的影响
3 讨 论
目前,我国右旋糖酐40分离纯化主要采用乙醇分级沉淀法,为了与国际接轨,将细菌内毒素引入右旋糖酐40原料药的质量标准。首先需要对乙醇分离纯化过程中对细菌内毒素含量的影响因素进行探究。通过乙醇浓度对右旋糖酐40细菌内毒素含量的影响及乙醇分步沉淀对右旋糖酐40细菌内毒素含量的影响研究发现,细菌内毒素分子结构中疏水性类脂A决定了其水溶液中的聚集状态及乙醇溶液中的溶解性,乙醇浓度越高,溶液中的细菌内毒素含量越高,沉淀中的细菌内毒素含量越低,可以通过不同乙醇浓度逐级分离纯化不同分子量的右旋糖酐40而达到分离纯化的目的,同时去除细菌内毒素,提高产品品质。针对分离纯化过程中出现的细菌内毒素异常情况,通过进行环境因素和纯化水对细菌内毒素的影响研究发现,二者均会影响细菌内毒素的去除,因此控制好这两个方面从而保证右旋糖酐40的分离纯化,使产品的分子量分布和细菌内毒素含量双达标。选用细菌内毒素含量达标的纯净水进行右旋糖酐40的分离纯化,产品的细菌内毒素含量均<6.00 EU/g,最低含量<3.00 EU/g,优于国际标准(≤10 EU/g),重均分子量和分子量均符合《中国药典》(2020版二部)质量标准。超滤也用于右旋糖酐40的分离纯化,根据分子量大小的不同,通过不同截留分子量的膜将右旋糖酐分离为不同分子量的产品,细菌内毒素是大分子的脂多糖(LPS)物质,其水中分子量约为50~500 kDa。首先通过100 kDa+5 kDa、100 kDa+10 kDa和100 kDa+20 kDa二膜组合超滤,产品细菌内毒素含量随着二次超滤膜截留分子量的增大而减小,100 kDa+20 kDa超滤分离纯化的右旋糖酐40的细菌内毒素含量有望达到10 EU/g以下。经过100 kDa+20 kDa+50 kDa三膜组合超滤分离纯化,右旋糖酐40的细菌内毒素含量达到3 EU/g以下,重均分子量及分子量分布达到《中国药典》(2020版二部)标准。总之,在现有的右旋糖酐40生产工艺路线基础上,进行一些工艺条件的改善和控制,细菌内毒素含量可以作为右旋糖酐40原料药质量指标,而且可以达到和超过国际最高标准,为右旋糖酐40大输液制剂等的生产减少安全负荷,提高产品品质,降低药物不良反应的潜在风险。
