一种基于光交联明胶-聚丙烯酰胺的神经组织工程构建物
2023-02-02安玉川桑胜波
安玉川,成 荣,孙 蕾,桑胜波
(1.太原理工大学 a.微纳传感与人工智能感知山西省重点实验室,b.新型传感器与智能控制教育部重点实验室,太原 030024;2.山西省六维人工智能生物医学研究院,太原 030031)
时至今日,神经损伤引发的神经功能障碍仍严重影响人类的健康与生活[1]。在过去的几十年中,许多天然聚合物(如胶原[2]、丝素蛋白[3])及合成聚合物[4]被开发并成功用于周围神经损伤的修复。但效果仍然不如自体移植物,这是由于未达到周围神经修复的黄金标准[4-5]。因此,开发用于神经再生的组织工程构建物仍具有很大的研究和临床价值[6]。
在20世纪80年代,有研究者将硅胶管成功应用于临床修复,但是它不可降解的特性,降低了神经修复效果,不利于神经组织的生长。因此,人们开始使用可降解的生物材料来制造神经组织工程构建物,如明胶、壳聚糖和海藻酸钠等,这类材料被广泛应用,但是其在机械性能方面仍有缺失。近年来,SOUCY et al[7]使用光固化明胶(GelMA)和甲基丙烯酰胺取代的弹性蛋白原(MeTro)的合成制备可调节的机械性能神经组织工程构建物,具有良好的实验结果,但该材料制作成本高,机械性能调节范围较小,仍具有一定的局限性。因此,研究可调节机械性能的复合生物材料仍有价值。
GelMA是一种以明胶为基底,通过接枝反应使得甲基丙烯酸酐基团接入,进而生成可由蓝光引发聚合凝胶的生物合成材料[8],具有良好的生物相容性和生物降解性,被广泛应用于生物组织再生,包括关节组织[9]、心肌组织[10]等。但是,这种水凝胶在体内降解速率过快[11],且机械性能较弱[12],不利于神经组织细胞长期的黏附。
聚丙烯酰胺(PAM)是一种亲水性好且柔韧强的生物合成材料[13],具有良好的机械性能和可控的降解性能[14],现已广泛应用于生物化学及医药[15-18]领域。通过添加催化剂可激发PAM本身的光固化特性,提高复合水凝胶的可塑性,并且改变PAM的比例,可实现复合水凝胶的弹性调节[19-21]。然而,纯PAM水凝胶材料生物相容性较差,不适合作为组织工程神经构建物。
综上所述,本文根据两种材料的特点,制备了 GelMA-PAM复合水凝胶作为雪旺细胞的体外三维生长环境,并表征了不同比例GelMA-PAM复合水凝胶的形貌、理化性能和机械性能,同时测试了雪旺细胞在复合水凝胶上的体外生长状况,评估了支架对雪旺细胞生长、分化的影响,优化了复合水凝胶的混合比例,制备出机械性能强且生物相容性好的组织工程神经构建物。
1 实验
1.1 材料制备
1.1.1GelMA制备
由文献[22]可知,明胶与甲基丙烯酸酐(MA)能够发生接枝反应,将甲基丙烯基团引入到明胶上,得到可由紫光引发聚合的GelMA.具体操作方法如下:称取5 g明胶加入到50 mL磷酸缓冲盐溶液(PBS溶液)中;将溶液整体移至50 ℃水浴锅中使明胶完全溶解,配成10%的明胶溶液;将8 mL的MA以1 mL/min的速度加入到10%的明胶溶液中,并且将上述溶液在50 ℃水浴锅中搅拌反应3 h;随后加入200 mL的PBS溶液(预热至50 ℃),用于稀释MA与明胶的反应溶液;4 h后将反应液装入12~14 ku的透析袋中;6 d后将反应液离心,取上清液冷冻干燥得到GelMA.
1.1.2GelMA-PAM复合水凝胶制备
首先将5 mg蓝光引发剂溶于超纯水1 mL中配置成质量浓度为0.5%的溶液;加入100 mg GelMA配置成10%的光交联明胶溶液。然后向溶液加入预定比例的丙烯酰胺(AM)单体,搅拌均匀后,倒入直径为100 mm的圆形模具中,在紫外灯下照射1 min,固化聚合成GelMA-PAM复合水凝胶支架。GelMA-PAM混合比例如表1所示。
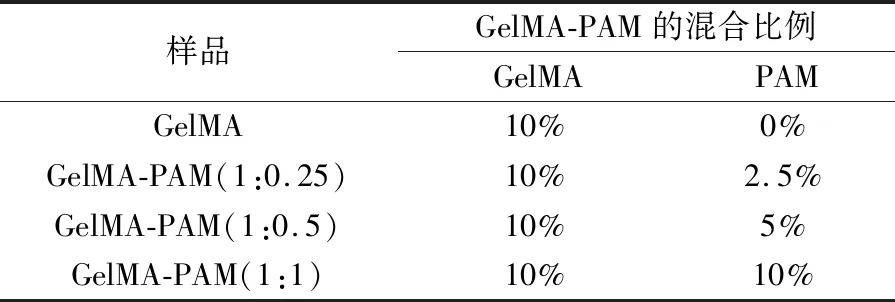
表1 GelMA和PAM的混合比例Table 1 Ratio of PAM and GelMA
1.2 GelMA-PAM复合水凝胶的性能测试
1.2.1傅里叶变换红外光谱
使用红外光谱仪(德国,布鲁克光谱,Tensor 27)分析水凝胶的红外光谱。通过KBr压片法得到样品的傅里叶变换红外光谱(FTIR).在4 cm-1分辨率下对每个样品在400~4 000 cm-1范围内进行扫描,每个样品总共扫描了64次。
1.2.2溶胀率测试
先将GelMA-PAM复合水凝胶支架用天平称重(记为w0),再浸入37 ℃的PBS溶液中浸泡。分别在浸泡1,3,6,12 h后,将支架取出,吸出表面多余水分,测定此时的支架重量为w1,根据如下公式(1)
wS=[(w1-w0)/w0]×100% .
(1)
计算出不同时间间隔的溶胀率以及溶胀平衡状态下的溶胀率。
1.2.3机械性能测试
通过电子材料试验机(美国,Instron公司,Instron 3343)测定GelMA-PAM复合支架的应力-应变曲线。在室温下,以0.5 mm/min的恒定速率压缩样品,采用变形5%~20%时的应力-应变曲线斜率来计算杨氏模量,每个样品测量3次取平均值。
1.2.4支架形貌分析
用扫描电子显微镜(日本,高新公司,SU8000)分析不同混合浓度比例的复合水凝胶支架形貌。首先将复合材料支架冷冻干燥,再将支架进行喷金处理,最后在12~15 kV加速电压下观察支架的微观形态。
1.2.5孔隙率表征
首先制作不同比例的水凝胶支架各3个,测量其体积V;放入PBS溶液中浸泡至完全溶胀后测量重量记为w3;将水凝胶放入无水乙醇中,完全析出水分后,测量重量为w2;根据公式(2)计算出孔隙率并取平均值,其中ρ为酒精的密度[23]。
wp=[(w3-w2)/(ρ×V)]×100% .
(2)
1.2.6细胞活性检验
在制作水凝胶支架时,将PBS溶液替换为Gibco高糖培养基DMEM,同时通过培养液中的酚红指示剂来调节溶液的pH值,增加材料支架富含的营养;将溶液经过滤头做除菌处理,制备成无菌的水凝胶支架;将水凝胶支架放入24孔板中用培养液浸泡24 h,去除未交联的丙烯酰胺单体和催化剂;将第三代大鼠雪旺细胞以105 cm-2的密度接种在GelMA-PAM混合支架上,置于培养箱中培养;分别在1,3,5 d进行细胞活性检测。细胞活性检测实验步骤如下:首先将支架用PBS冲洗两次,加入活细胞染色试剂(Calcein-AM)染色孵育1 h;用PBS清洗3次,加入死细胞染料试剂(PI)染色0.5 h;将支架用PBS溶液清洗3次,放置于细胞成像多功能微孔板检测系统(美国,伯腾仪器有限公司,Cytation 5)中观察。
1.2.7细胞增殖检验
细胞接种过程与细胞活性实验相同。在1,3,5 d分别检测了CCK-8的光度值,观察细胞增殖的情况。具体操作过程如下:首先将24孔板内的培养液吸出,同时用PBS溶液将细胞清洗3次;将配置好的CCK-8染色剂加入24孔板中;将孔板重新放入培养箱中孵育3 h;将孵育后的100 μL染色剂移入96孔板内并除去气泡;放入细胞成像多功能微孔板检测系统中测量其吸光度。
1.2.8细胞形态检测
将接种到支架上的细胞进行细胞骨架染色实验,观察不同比例支架上的细胞形态,统计细胞的伸长情况。具体实验步骤如下:将培养3 d的水凝胶支架与细胞用PBS清洗预处理后待用;在24孔板中加入体积分数为4%的多聚甲醛将支架固定20 min;加入TritonX-100通透液通透20 min;在避光条件下加入鬼闭环太染色试剂,并在室温条件下孵育40 min;用PBS清洗后加入细胞核DAPI染剂避光孵育10 min;最后用PBS清洗干净,置于细胞成像多功能微孔板检测系统中拍照观察。
1.2.9细胞免疫检测
将接种到支架上的细胞进行细胞免疫检测,观察不同比例支架上的细胞分化的形态。将培养3 d后的复合材料支架进行预处理,过程如下:先用PBS清洗,再加入4%的多聚甲醛固定20 min,最后加入TritonX-100通透20 min.细胞免疫检测实验过程如下:首先在室温条件下加入体积分数5%山羊血清封闭1 h;在4 ℃条件下加入S100B Rabbit pAb一抗溶液过夜;第二天在室温条件下加入羊抗兔二抗溶液孵育1 h;用PBS清洗并加入DAPI染剂避光孵育10 min;最后用PBS清洗干净,置于细胞成像多功能微孔板检测系统中拍照观察。
2 结果与讨论
2.1 GelMA-PAM水凝胶支架成分分析

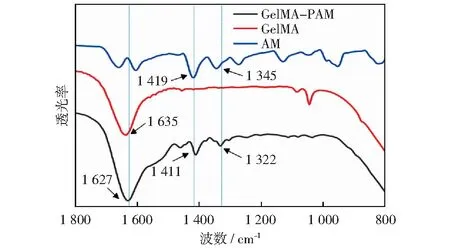
图1 GelMA-PAM、AM、GelMA的红外光谱图Fig.1 Infrared spectra of GelMA-PAM, AM, and GelMA
2.2 GelMA-PAM复合水凝胶形貌分析
通过扫描电子显微镜测试,观察复合水凝胶支架的内部结构以及孔隙的大小。如图2所示,纯GelMA与3种不同比例的复合水凝胶都具有良好的通孔结构,这种通孔结构有利于细胞的黏附以及营养的交换,且孔径的大小随着PAM比例的增加而减小。纯GelMA水凝胶的平均孔径约为100~200 μm;而GelMA与PAM比例为1∶0.25时,水凝胶的平均孔径略有减小;当两者比例为1∶0.5时,水凝胶的平均孔径减小为80 μm左右;当比例为1∶1时,水凝胶的平均孔径只有50 μm左右。该现象是因为在GelMA-PAM水凝胶交联的过程中,GelMA与AM单体、GelMA自身以及AM单体分别交联成孔,形成双网络结构,且该结构会随AM质量浓度的增加而加强,从而减小复合水凝胶的平均孔径。

图2 GelMA-PAM复合水凝胶支架不同比例的SEM图Fig.2 SEM images of different scales of GelMA-PAM composite hydrogel scaffolds
2.3 GelMA-PAM水凝胶支架理化特性
检测复合水凝胶的溶胀性和孔隙率,分析复合水凝胶的理化特性。图3(a)展示了不同时间段内水凝胶的溶胀率,在1~3 h内,PAM浓度比例越高的支架,溶胀的速率越快。从整个时间段来看,GelMA-PAM复合水凝胶的溶胀率一直高于纯GelMA水凝胶的溶胀率。当浸泡至12 h,所有水凝胶达到溶胀平衡保持不变。这表明了复合水凝胶支架对细胞营养液有较好的吸收作用。图3(b)记录了水凝胶在溶胀平衡时的溶胀率,纯GelMA水凝胶的平衡溶胀比为5.6,而GelMA-PAM复合水凝胶的平衡溶胀比可达到11.1,接近于纯GelMA水凝胶的两倍,说明复合水凝胶具有更好的亲水性。这是因为PAM链具有良好的亲水性,而复合水凝胶中具有大量PAM链网络,从而提高了水凝胶的保水性,可以更好地储存细胞所需的培养液。
不同浓度比例的复合水凝胶孔隙率如图4所示。从图中可知纯GelMA水凝胶的孔隙率为50%左右,且随着PAM浓度的增加,水凝胶的孔隙率下降。这是因为PAM中AM交联产生了PAM链网格,因此,水凝胶的交联密度随PAM浓度的增加而上升,从而导致孔隙直径的缩小以及孔隙率的减小,这与支架的微观内部结构分析结果相同。
2.4 GelMA-PAM复合水凝胶机械性能
纯GelMA水凝胶与GelMA-PAM复合水凝胶的压缩应力-应变曲线如图5所示。图5(a)为应力-应变曲线,在应变5%~20%范围内应力曲线的斜率代表了复合水凝胶的韧性,斜率越大韧性越高。由此可以看出,混合比例为1∶1的GelMA-PAM混合水凝胶韧性最强,且随着PAM比例下降,应力-应变曲线斜率下降,证明了PAM的引入提高了复合水凝胶的韧性。图5(b)为水凝胶的杨氏模量,通过对比,1∶1的GelMA-PAM混合水凝胶表现了出了极高的强度,是纯GelMA水凝胶的10倍以上。这是因为一方面PAM本身就具有良好的韧性与杨氏模量,它的加入使复合水凝胶机械性能提高;另一方面,根据2.2的讨论可知,PAM质量浓度增加,水凝胶孔径减小、孔壁增厚,从而提高了水凝胶的抗压能力。这为神经细胞的黏附提供了良好的支撑环境。
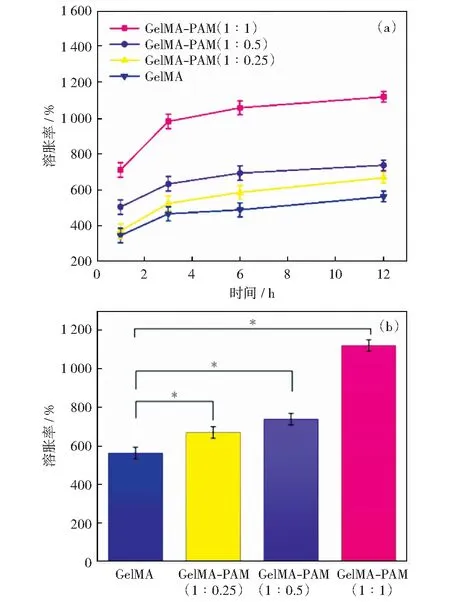
图中*表达p<0.01有显著的统计学差异图3 GelMA-PAM复合水凝胶支架不同比例浓度0~12 h溶胀率及最终溶胀率Fig.3 Swelling rate and final swelling ratios of GelMA-PAM composite hydrogel scaffolds at different proportions and concentrations from 0 to 12 h
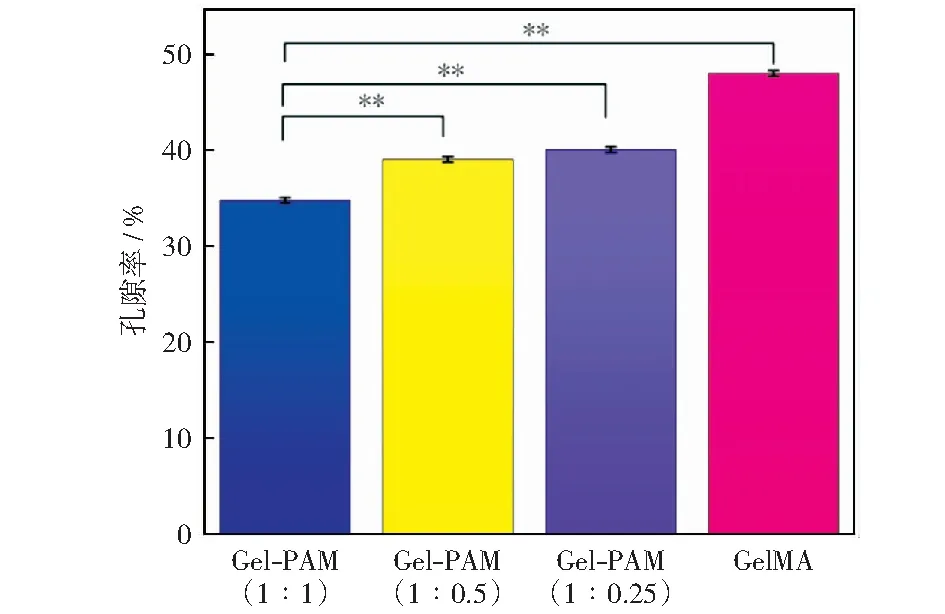
图中**表达p<0.01有显著的统计学差异图4 GelMA-PAM复合水凝胶支架不同浓度比例的孔隙率Fig.4 Porosity of GelMA-PAM composite hydrogel scaffolds with different concentration ratios
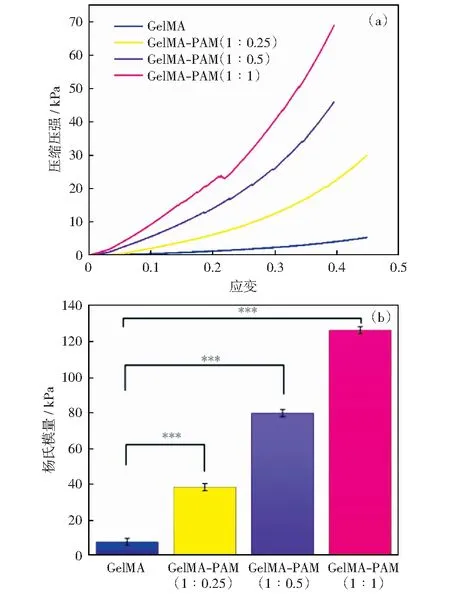
图中***表达p<0.01有显著的统计学差异图5 GelMA-PAM复合水凝胶支架不同浓度比例的应力-应变曲线及杨氏模量Fig.5 Stress-strain curves and Young’s modulus of GelMA-PAM composite hydrogel scaffolds at different concentration ratios
2.5 GelMA-PAM水凝胶支架生物相容性
为了研究复合水凝胶支架的生物相容性,笔者对复合水凝胶进行了生物活性检测。图6为细胞的活死染色图,绿色代表活性细胞,红色代表死细胞。笔者发现随着复合水凝胶中PAM浓度增加,细胞的总体数量与密度均下降。但当PAM质量浓度为2.5%时,支架的细胞活性检测与纯GelMA水凝胶差距较小,这两组支架上的细胞分布均匀,细胞族群呈分散性分布。而GelMA-PAM(1∶0.5)和GelMA-PAM(1∶1)的支架都呈现出了雪旺细胞的聚集。通常均匀分散的细胞群有利于细胞生存功能的表达。因此,上述结果表明,适宜的PAM浓度并不会影响复合水凝胶的生物相容性,对雪旺细胞的生长行为无不良影响。
细胞的活性图如图7所示,这是通过测量CCK-8吸光度量化细胞的数目。通过对比发现,随着培养时间的增加,除了PAM质量浓度10%的复合水凝胶在第5 d时细胞数量减少,其余比例水凝胶中细胞数量均增加。这一结果与细胞活性检测结果基本一致。综上,两组实验结果说明在当PAM的质量浓度为2.5%时,GelMA-PAM复合水凝胶支架生物兼容性良好,可以促进雪旺细胞的附着与生长。对GelMA-PAM复合水凝胶支架上的细胞进行了细胞骨架染色,如图8所示,绿色荧光代表了细胞骨架形态,蓝色荧光代表了细胞核的形态。由图8可以看出,所有水凝胶支架上的细胞均有不同程度的伸展,大部分细胞的形态由圆形变成梭形,这是雪旺细胞分裂期生长的典型特征。尤其在GelMA-PAM(1∶0.25)的支架上细胞的长度伸展到平均80 μm左右,证明了该复合材料支架对雪旺细胞有很好的黏附和支撑作用。
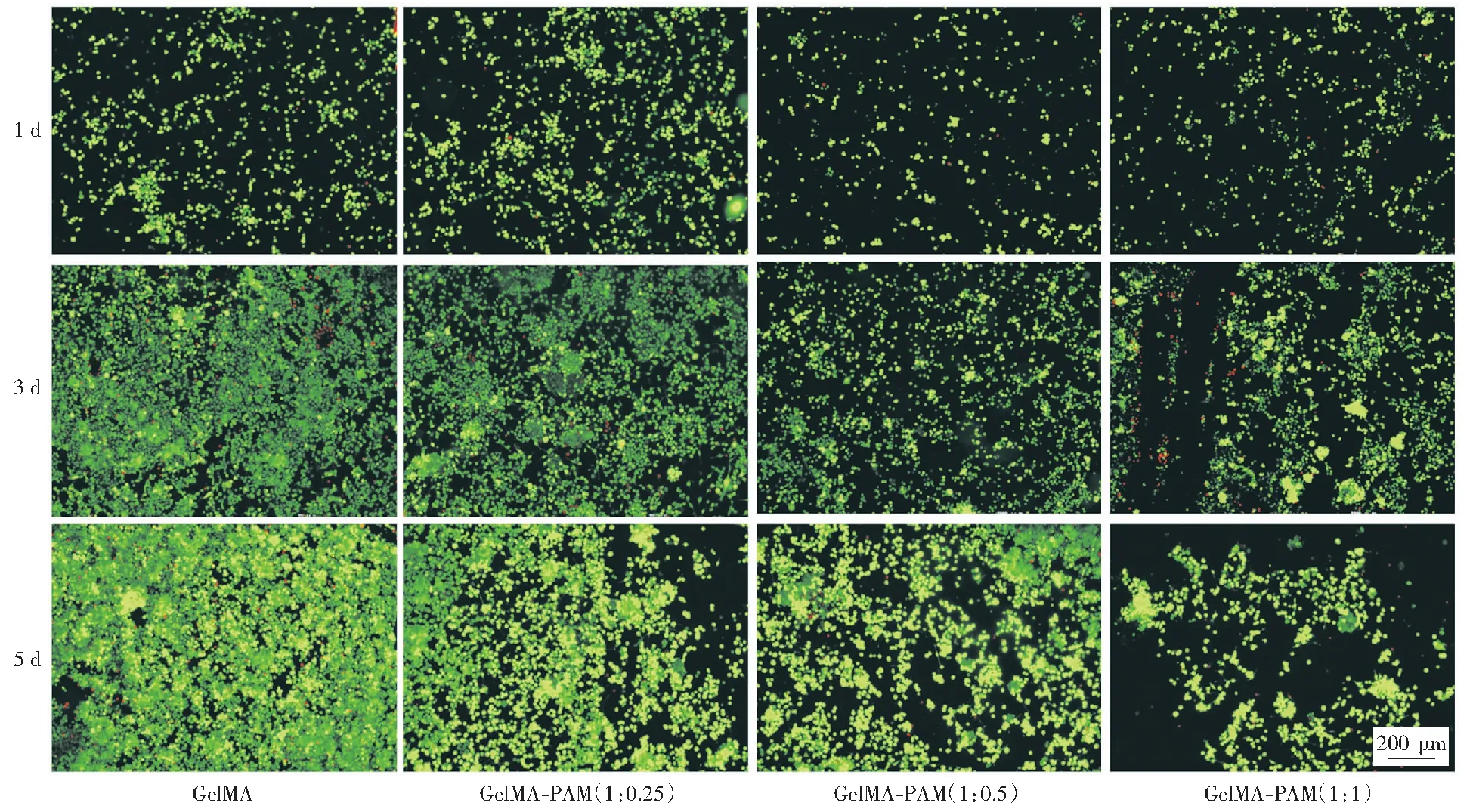
图6 GelMA-PAM复合水凝胶上细胞活死染色图Fig.6 Staining of live and dead cells on GelMA-PAM composite hydrogels
细胞的免疫荧光染色如图9所示,通过S100B特定蛋白的染色表达,反映了雪旺细胞的分化蛋白表达情况。绿色荧光代表特定蛋白在细胞中的分布情况,蓝色为细胞核的位置。图中各比例支架上的细胞均有特定分化蛋白的表达,证明了复合材料支架能够支撑雪旺细胞的分化。对比不同比例的复合水凝胶支架, GelMA-PAM(1∶0.25)支架比其他支架的雪旺细胞轮廓清楚,蛋白染色表达清晰,说明该支架具有更好的雪旺细胞相容性。
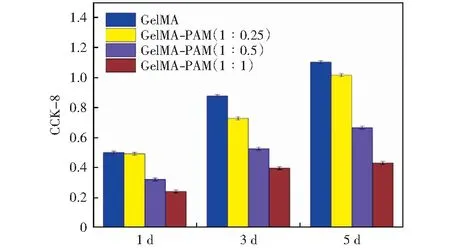
图7 GelMA-PAM复合水凝胶上细胞活性Fig.7 Graph of cell viability on GelMA-PAM composite hydrogels
综上所述,GelMA与PAM比例为1∶0.25的复合水凝胶在机械性能上优于纯GelMA水凝胶,同时具有良好的细胞相容性,且雪旺细胞在该支架上的增殖和分化效果良好。因此,GelMA-PAM(1∶0.25)复合水凝胶可作为支撑雪旺神经细胞存活、生长、发育的基底材料。
3 结论
通过制备不同比例的GelMA-PAM复合水凝胶支架,并对其形貌、理化特性、机械性能及体外的生物相容性、神经细胞轴突的分化情况进行了测试。结果表明当GelMA与PAM比例为1∶0.25时,复合水凝胶支架具有良好的理化性能和机械性能,同时支架上的雪旺细胞可以进行良好的生长与分化。因此,本文构建的GelMA-PAM复合水凝胶材料兼顾了支架的机械性能和生物相容性,可作为一种理想的组织工程神经构建物。
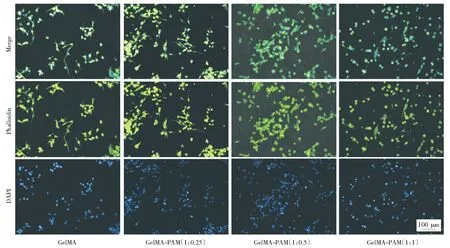
图8 GelMA-PAM复合水凝胶上细胞骨架染色图Fig.8 Cytoskeleton staining on GelMA-PAM composite hydrogels
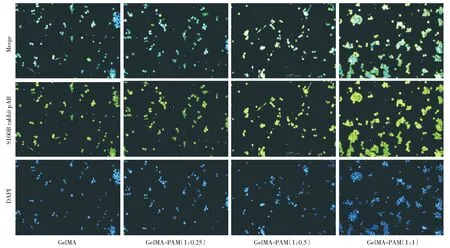
图9 GelMA-PAM复合水凝胶上细胞的免疫荧光染色图Fig.9 Immunofluorescence staining of cells on GelMA-PAM composite hydrogels
