纳豆芽胞杆菌发酵对小米糠膳食纤维结构和理化特性的影响
2023-02-02杨多王安陆兆新吕凤霞别小妹孟凡强赵海珍
杨多,王安,陆兆新,吕凤霞,别小妹,孟凡强,赵海珍
(南京农业大学食品科学与技术学院,江苏 南京 210095)
膳食纤维(dietary fiber,DF)是一组不能被人体内源性酶消化,但可以被肠道菌群部分或完全发酵的碳水化合物聚合物或低聚物,根据其在水中的溶解度,DF分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)[1]。近年来,丰富的物质生活增加了人们罹患心脑血管病、肥胖症和糖尿病等疾病的风险。在对这些疾病的研究过程中,DF因具有降血脂、降血糖、预防肥胖和调节肠道菌群等作用受到了广泛关注[2]。因此,改善DF的结构和特性,进一步提高其预防和治疗疾病的效果,是目前学者们研究的重点之一。
小米是亚洲、欧洲(主要是俄罗斯)和非洲部分地区的重要粮食作物,中国的小米年产量高达约450万t,其副产物小米糠主要由种皮、糊粉层、果皮、胚和淀粉质胚乳组成,年产量约40万t[3]。小米糠含有丰富的木质素、纤维素和半纤维素等,是DF的潜在优质来源之一[4]。然而,大量的小米糠主要用作动物饲料或直接被当作废料处理,造成了巨大的资源浪费。目前,关于谷物DF的研究以稻米糠、麦麸和豆粕等居多[5],而对小米糠DF的研究相对较少,且研究方法主要为物理法、酶法或两者结合的方法。Wei等[6]研究了高温、高压和超声波处理对小米糠SDF理化性质和结构的影响,发现超声波处理最显著改善了小米糠SDF的理化性质。姜龙波等[7]通过优化纤维素酶和木聚糖酶复合改性制备小米糠SDF的条件,将小米糠SDF的得率提高到12.46%。丁彩云等[8]利用高温-复合酶法有效改善了小米糠DF的结构和特性,处理后SDF的得率达到17.27%。
近年来,微生物法越来越受到人们的关注,利用微生物发酵农副产品制备DF具有成本低、产量高和环境污染小等优势,菌株发酵的过程还可以赋予DF独特的风味和营养活性成分。Jia等[9]优化了绿色木霉发酵脱脂米糠制备SDF的条件,将米糠SDF的产量从10.5%提高到33.4%,并且使SDF的结构变得更疏松,功能特性也得到不同程度的提高。纳豆芽胞杆菌是枯草芽孢杆菌属的一个亚种,从日本传统食品纳豆中分离出来,因其具有良好的益生作用而被广泛应用[10]。研究表明,纳豆芽胞杆菌可以分泌酶活性较高的纳豆激酶、淀粉酶、蛋白酶和脂肪酶等水解酶[11],在利用底物的同时还能产生多种生物活性物质,进一步提高产品的营养价值(如抗氧化性)[12],因此可以被用作发酵改性和制备DF的优选菌株。在食品行业中,纳豆芽胞杆菌主要应用于功能性饮料、食品添加剂、发酵豆制品和乳制品等的研发中,将其运用到DF的相关研究比较稀少。Chu等[13]通过纳豆芽胞杆菌发酵小米糠增加了总膳食纤维中SDF的占比,并且改善了小米糠总膳食纤维的性质,但并未阐明其中SDF和IDF发生的具体变化。许多研究通常将总膳食纤维特性的改善归功于其中SDF比例的提高,而忽视了IDF的作用。此外,鲜少有研究系统地同时关注处理前后SDF和IDF的差异变化,这些造成了SDF和IDF发展的不平衡以及资源的浪费。
因此,本文研究纳豆芽胞杆菌发酵对小米糠SDF和IDF的组成、结构和理化特性的影响,旨在推动我国小米糠资源的高值化开发利用,推进小米糠DF的研究进展,并为后续试验提供依据。
1 材料与方法
1.1 材料与试剂
小米糠为中国河北省邢台市的黄金谷(Setariaitalic)的副产物;纳豆芽胞杆菌由南京农业大学酶工程实验室分离、保存。大豆油和鸡蛋购自南京当地市场;淀粉葡萄糖苷酶(≥100 000 U·mL-1)、耐高温α-淀粉酶(≥20 000 U·mL-1)、中性蛋白酶(≥100 U·mL-1)、碱性蛋白酶(≥200 U·mL-1)和3,5-二硝基水杨酸(DNS)购自上海源叶生物科技有限公司;胆固醇(≥99%)和胆酸钠(≥98%)购自上海麦克林生化有限公司;正己烷、无水乙醇、盐酸、氢氧化钠和丙酮等购自国药集团化学试剂有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)、单糖标品购自上海晶纯生化科技股份有限公司;其他化学品和试剂均为分析纯,购自南京化学试剂有限公司。
1.2 仪器与设备
DF-101S数显电动恒温油水浴搅拌器购自河南豫华仪器科技有限公司;Mastersizer 3000激光粒度分析仪购自英国马尔文公司;MCR301流变仪购自德国安东帕公司;Eppendorf 5804R台式高速冷冻离心机购自德国Eppendorf公司;XL-30ESEM扫描电子显微镜购自荷兰PHILIPS公司;UltiMate 3000高效液相色谱购自美国Thermo公司;NEXUS870光谱仪购自美国NICOLET公司;Smartlab 9kw X-射线衍射仪购自日本Rigaku公司。
1.3 试验方法
1.3.1 发酵前后膳食纤维样品的制备和纯化1)小米糠的脱脂处理。以1∶2.5的比例向小米糠中加入正己烷,搅拌2 h后弃去上清液,重复3次。脱脂后的小米糠置于通风橱中,干燥10 h后储存在-20 ℃备用。
2)脱脂小米糠膳食纤维的制备。采用朱玉[14]的方法进行:10 g脱脂小米糠中加入100 mL蒸馏水,在95~100 ℃加热15 min后,将混合物在50 ℃搅拌30 min。将体系pH值调至6.2,加入耐高温α-淀粉酶于95 ℃搅拌1 h,再加入淀粉葡萄糖苷酶(pH4.5)于60 ℃继续反应1 h。然后,pH值调至7.5,将混合物与中性蛋白酶混合,并在45 ℃孵育2 h。最后,在沸水中加热15 min以灭酶。混合物冷却后,8 000 r·min-1离心5 min,用75 ℃的蒸馏水洗涤沉淀3次,合并上清液。将沉淀冷冻干燥并标记为小米糠不溶性膳食纤维(R-IDF)。向合并的上清液中加入4倍体积的95%乙醇,置于4 ℃醇沉12 h,8 000 r·min-1离心5 min,获得沉淀并冷冻干燥,记为小米糠可溶性膳食纤维(R-SDF)。
3)脱脂小米糠的发酵及其膳食纤维的制备。采用Chu等[13]的方法进行:将活化的纳豆芽胞杆菌单菌落接种到100 mL的种子培养基[蛋白胨1 g、NaCl 0.5 g、牛肉膏0.3 g、蒸馏水100 mL,pH(7.0~7.2)]中进行复苏(37 ℃、180 r·min-1培养24 h)。用0.9%的生理盐水将菌体密度调至107~108CFU·mL-1,然后以3%(体积分数)的接种量接种到灭菌后的发酵培养基中(脱脂小米糠10 g、葡萄糖0.1 g、NaCl 0.5 g、蒸馏水100 mL,pH8.0)。于37 ℃、180 r·min-1发酵48 h后,将发酵产物离心(8 000 r·min-1,5 min)。用75 ℃蒸馏水洗涤沉淀3次,合并上清液。将沉淀冷冻干燥,标记为发酵不溶性膳食纤维(F-IDF)。合并的上清液加入4倍体积95%乙醇于4 ℃醇沉12 h,8 000 r·min-1离心5 min,得到沉淀并冷冻干燥,记为发酵可溶性膳食纤维(F-SDF)。
4)膳食纤维的纯化。采用Sevag法[15]去除R-SDF和F-SDF中的蛋白质以获得脱蛋白的SDF。采用酶法对IDF进行脱蛋白。分别向10 g R-IDF和F-IDF中加入100 mL蒸馏水,并将pH值调至9.0。然后,加入碱性蛋白酶于55 ℃搅拌3 h。将混合物用中性蛋白酶(pH7.5)在 45 ℃酶解3 h后,8 000 r·min-1离心5 min。随后,向沉淀中加入10倍体积的80%乙醇并在40 ℃搅拌30 min。最后,将混合物离心(8 000 r·min-1,5 min)冻干以获得脱蛋白的IDF。在后续试验中,均使用此纯化的SDF和IDF。
1.3.2 基本成分测定1)SDF和IDF的得率根据下式计算:
SDF或IDF的得率=SDF或IDF的质量/原料小米糠的质量×100%
(1)
2)SDF和IDF的灰分、水分、脂肪和蛋白质含量分别按《食品安全国家标准 食品中灰分的测定:GB 5009.4—2016》《食品安全国家标准 食品中水分的测定:GB 5009.3—2016》《食品安全国家标准 食品中脂肪的测定:GB 5009.6—2016》和《食品安全国家标准 食品中蛋白质的测定:GB 5009.5—2016》进行测定,膳食纤维含量即纯度的测定参照《食品安全国家标准 食品中膳食纤维的测定:GB 5009.88—2014》。
1.3.3 单糖组成分析采用王文秀[16]的方法测定SDF和IDF的单糖组成并对检测条件稍做修改:单糖标品为葡萄糖、鼠李糖、半乳糖、半乳糖酸酸、阿拉伯糖、木糖、葡萄糖醛酸、甘露糖、核糖和岩藻糖。使用配备紫外检测器的UltiMate 3000高效液相色谱进行测定。检测条件:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相为83%(体积分数)的磷酸盐缓冲液(0.10 mol·L-1,pH6.7)和17%的乙腈;流速为0.70 mL·min-1;柱温为30 ℃;检测波长为245 nm。单糖的含量通过相应标品的标准曲线计算得到,最终计算出样品中每种单糖组成的摩尔百分比。
1.3.4 扫描电子显微镜观察用双面导电胶带分别将适量干燥至恒重的SDF和IDF固定在样品台上,放入离子溅射仪中镀上10 nm金膜,并在XL-30ESEM扫描电子显微镜上观察膳食纤维的表观形态。在 5 000 倍放大倍数下拍摄各样品的扫描电子显微镜照片。
1.3.5 粒径分析分别将0.5 g的SDF和IDF分散在30 mL蒸馏水中,采用Mastersizer 3000激光粒度分析仪进行测量。试验参数:折射率为1.47;遮光度为5%~12%;分散剂折射率为1.33;粒径范围为0.02~2 000 μm。
1.3.6 傅里叶变换红外光谱分析将2 mg的SDF和IDF分别与200 mg KBr混合并研磨均匀,进行压片处理。采用NEXUS870光谱仪记录4 000~400 cm-1范围内样品的傅里叶变换红外光谱。扫描64次,分辨率为4 cm-1。
1.3.7 X-射线衍射测量Smartlab 9kW X-射线衍射仪被用于测试SDF和IDF的结晶情况。测量条件:测试电压为40 kV;测试电流为40 mA;扫描范围为5~70°(2θ);步长为0.02°;扫描速率为2°·min-1。样品的结晶度用Origin软件计算,结晶度(degree of crystallinity,Dc)由下式得到:
Dc=结晶区面积/(结晶区面积+非晶区面积)×100%
(2)
1.3.8 黏度测定将SDF以1∶25的比例溶解在蒸馏水中。采用MCR301流变仪在25 ℃ 条件下测量SDF的黏度。条件:50 mm不锈钢平板;板间距为1 mm;剪切速率为0.1~1 000 s-1;加样量为1 mL。
1.3.9 持水力、持油力和膨胀力测定1)持水力测定。分别称取0.5 g的SDF和IDF置于离心管中,加入5 mL蒸馏水在37 ℃浸泡2 h,8 000 r·min-1离心5 min,弃上清液后称重,然后于烘箱中烘干再称重,最后取出离心管中的样品残渣并称重。按照如下公式计算持水力:
持水力=(样品和离心管吸水后的湿重-样品和离心管烘干后的质量)/样品残渣的质量
(3)
2)持油力测定。分别称取0.5 g的SDF和IDF置于离心管中,加入5 mL大豆油在37 ℃静置1.5 h,8 000 r·min-1离心5 min后,除去上层油样,收集残渣并称重。按照如下公式计算持油力:
持油力=(样品吸油后的质量-样品吸油前的质量)/样品吸油前的质量
(4)
3)膨胀力测定。分别称取0.5 g的SDF和IDF置于10 mL量筒中(封口),读取干品体积,向其中加入5 mL蒸馏水,室温条件下静置2 h后,读取膨胀体积。按照如下公式计算:
膨胀力=(样品膨胀后的体积-样品的干品体积)/样品的干品质量
(5)
1.3.10 乳化活性(EA)和乳化稳定性(ES)测定向离心管中加入等体积的SDF溶液(20 mg·mL-1)和大豆油,均质成乳液。将混合物1 200g离心5 min以获得乳化层的高度。乳化活性(EA)计算公式如下:
EA=乳化层高度/离心管中液体的总高度×100%
(6)
将上述离心后的乳液在80 ℃加热30 min,然后1 200g离心5 min。根据以下公式计算ES:
ES=加热后乳化层的高度/加热前乳化层的高度×100%
(7)
1.3.11 胆固醇和胆汁酸吸附能力测定1)胆固醇吸附能力(CAC)的测定采用朱玉[14]的方法。取新鲜蛋黄与蒸馏水(1∶9)混合打成蛋黄乳液,分别称取1 g的SDF和IDF于离心管内,加入25 mL蛋黄乳液,分别将pH值调为2.0和7.0。于37 ℃振荡2 h后取出,14 000 r·min-1离心5 min后,取上清液采用邻苯二甲醛法测定胆固醇含量。CAC计算公式如下:
CAC=(吸附前上清液中胆固醇的含量-吸附后上清液中胆固醇的含量)/样品的质量
(8)
2)胆汁酸吸附能力(BAAC)测定。用磷酸盐缓冲液(pH6.9)制备10 μmol·mL-1的标准胆酸钠溶液。分别将0.5 g的SDF和IDF与20 mL的标准胆酸钠溶液在37 ℃搅拌2 h,14 000 r·min-1离心5 min,取上清液,并采用糠醛比色法测定上清液中胆酸钠的含量。BAAC的计算公式如下:
BAAC=(吸附前上清液中胆酸钠的含量-吸附后上清液中胆酸钠的含量)/样品的质量
(9)
1.3.12 葡萄糖吸附能力(GAC)和透析延迟指数(GDRI)测定1)GAC的测定采用黄六容等[17]的方法并略作修改。将0.1 g的SDF和IDF分别与20 mL 50 mmol·L-1的葡萄糖溶液在37 ℃振荡 2 h,然后在 14 000 r·min-1离心10 min获得上清液。使用DNS法检测上清液中葡萄糖的含量,GAC 计算公式如下:
GAC=(吸附前上清液中葡萄糖的含量-吸附后上清液中葡萄糖的含量)/样品的质量
(10)
2)GDRI的测定。将0.5 g的SDF和IDF分别与25 mL葡萄糖溶液(50 mmol·L-1)在37 ℃搅拌1 h。将混合物放入透析袋中,在37 ℃对100 mL蒸馏水透析。分别于10、30、60 和 120 min取样,采用DNS法测定透析液中葡萄糖的含量,以不添加DF的处理作为对照组。GDRI计算公式如下:
GDRI=1-样品组透析液中葡萄糖的含量/对照组透析液中葡萄糖的含量×100%
(11)
1.4 数据统计与分析
2 结果与分析
2.1 纳豆芽胞杆菌发酵对膳食纤维基本成分和单糖组成的影响
可溶性膳食纤维(SDF)和不溶性膳食纤维(IDF)的得率、纯度和基本成分见表1。经过纳豆芽胞杆菌发酵,SDF得率由5.17%增加到19.36%,IDF的得率由42.13%下降到28.73%(P<0.05)。发酵可溶性膳食纤维(F-SDF)和发酵不溶性膳食纤维(F-IDF)的灰分、水分、脂肪和蛋白质含量均显著低于小米糠可溶性膳食纤维(R-SDF)和小米糠不溶性膳食纤维(R-IDF),这使F-SDF(82.44%)的膳食纤维含量即纯度显著高于R-SDF(76.12%),F-IDF(76.01%)的膳食纤维含量即纯度显著高于R-IDF(73.45%)。以上结果表明,纳豆芽胞杆菌发酵可以提高小米糠SDF的得率和DF的纯度。
如表1所示:在SDF和IDF中均检测到葡萄糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖、木糖和阿拉伯糖。在R-SDF和F-SDF中葡萄糖含量均最高,且F-SDF(91.36%)的葡萄糖含量显著高于R-SDF(75.06%)。与R-SDF相比,F-SDF的葡萄糖醛酸含量没有差异,其余单糖含量均显著下降。此外,表中结果显示木糖、阿拉伯糖和葡萄糖是IDF的主要成分。F-IDF的木糖和阿拉伯糖含量分别为34.97%和12.53%,显著低于R-IDF的木糖(53.77%)和阿拉伯糖(16.83%)含量,半乳糖含量没有显著性差异,其余单糖含量均显著高于R-IDF。
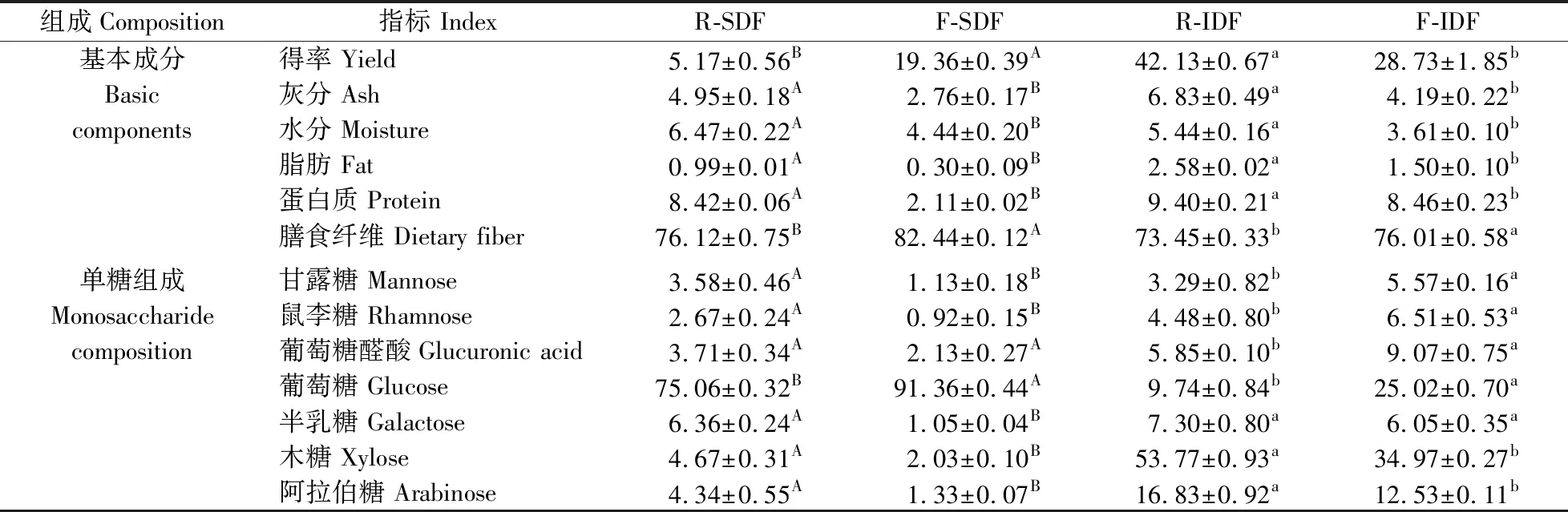
表1 可溶性膳食纤维(SDF)和不溶性膳食纤维(IDF)的基本成分和单糖组成Table 1 The basic components and monosaccharide composition of soluble dietary fiber(SDF) and insoluble dietary fiber(IDF) %

图1 SDF和IDF的扫描电子显微镜图片Fig.1 The scanning electronic micrograph for SDF and IDF
2.2 纳豆芽胞杆菌发酵对膳食纤维表观结构的影响
扫描电子显微镜图片显示各样品之间的表观结构完全不同(图1)。R-SDF呈排列紧密的网状结构,有许多不规则的小空隙;F-SDF则呈蜂窝状结构,表面有大而规则的孔洞,通过这些孔洞可以直接看到内部的空巢结构。孔的大小和深度表明F-SDF的结构更松散,并暴露出更多的表面积;R-IDF的表面呈片状,空隙较少,结构比较光滑致密。经过纳豆芽胞杆菌发酵,F-IDF的表面变得破碎而松散,并伴有较深的沟壑和层状结构,松散的表面形态表明发酵使得IDF的结构也变得疏松。
2.3 纳豆芽胞杆菌发酵对膳食纤维粒径的影响
由图2-A可见:R-SDF的粒度分布曲线范围较广,在1~4 000 μm观察到3个明显的粒度峰。相比之下,F-SDF则显示出非常窄的曲线范围,在0.4~4 μm仅有1个峰。因此,纳豆芽胞杆菌发酵使SDF的粒度变得小且均匀。R-IDF和F-IDF的粒度分布曲线均含有3个峰(图2-B),但发酵减少了F-IDF在800~4 000 μm的颗粒数,并提高了其在1~300 μm的颗粒数,表明纳豆芽胞杆菌发酵使得IDF的粒度也减小了。通过Mastersizer 3000激光粒度分析仪测得的数据可知,F-SDF和F-IDF因其粒径的减小,比表面积分别由(251.60±20.91)和(135.57±2.05)m2·kg-1增加到(3 880.67±4.11)和(176.23±4.69)m2·kg-1。
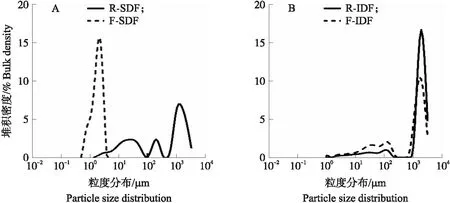
图2 SDF(A)和IDF(B)的粒度分布曲线Fig.2 The particle size distribution curve of SDF(A)and IDF(B)
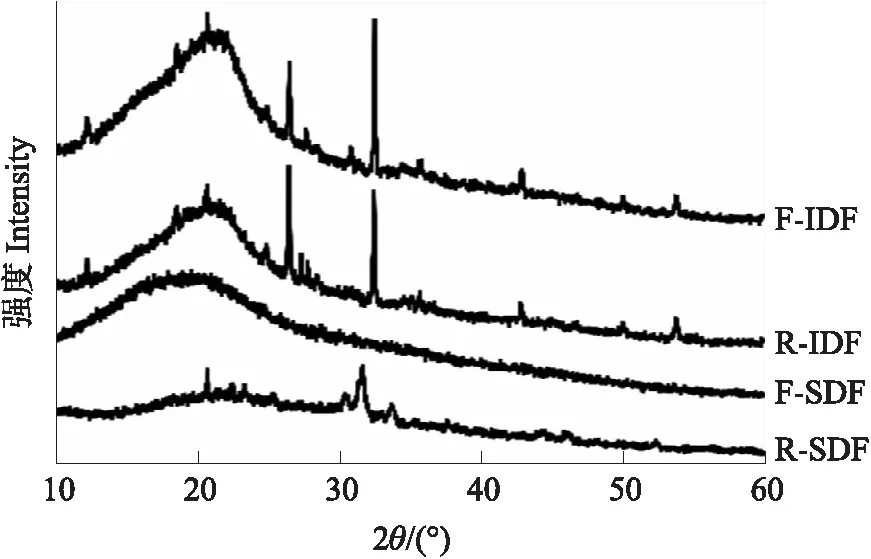
图4 SDF和IDF的X-射线衍射图谱Fig.4 The X-ray diffraction patterns of SDF and IDF
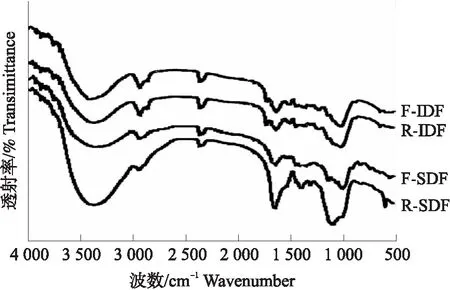
图3 SDF和IDF的傅里叶变换红外光谱Fig.3 The Fourier-transformed infrared spectroscopy spectra of SDF and IDF
2.4 纳豆芽胞杆菌发酵对膳食纤维官能团的影响

2.5 纳豆芽胞杆菌发酵对膳食纤维结晶情况的影响
R-SDF和F-SDF的X-射线衍射图谱(图4)之间的较大差异表明发酵使得SDF的晶体特性发生了显著变化。R-SDF在2θ=20°附近有少量结晶峰,同时在2θ=30~50°存在几个强结晶峰。相比之下,F-SDF的X-射线衍射图谱则变得平坦且无定形,表明发酵使SDF的晶体构型被破坏。Origin软件计算结果显示,R-SDF和F-SDF的结晶度分别为(31.63±2.45)%和(19.79±2.20)%,表明纳豆芽胞杆菌发酵使SDF的结晶度降低了11.84%。IDF的X-射线衍射图谱峰形相似且峰位无明显变化,但是与R-IDF相比,F-IDF的结晶度由(30.62±1.35)%增加到(35.55±0.98)%。
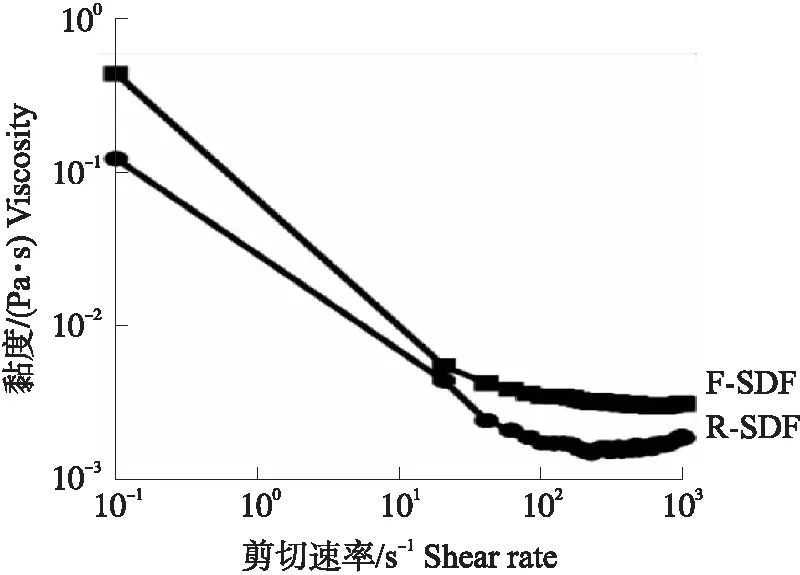
图5 剪切速率对SDF黏度的影响Fig.5 The effect of shear rate on the viscosity of SDF
2.6 纳豆芽胞杆菌发酵对可溶性膳食纤维黏度的影响
SDF的黏度随剪切速率的变化如图5所示。随着剪切速率的升高,SDF的黏度逐渐降低并趋于平缓,表现出剪切稀化现象,显示出假塑性流体的特性。F-SDF的初始黏度为0.43 Pa·s,是R-SDF初始黏度(0.12 Pa·s)的3.58倍,且F-SDF的黏度始终高于R-SDF,表明纳豆芽胞杆菌发酵可以提高SDF的黏度。
2.7 纳豆芽胞杆菌发酵对膳食纤维持水力、持油力、膨胀力和乳化性的影响
如表2所示:F-SDF的持水力和膨胀力分别为6.47 g·g-1和5.96 mL·g-1,分别是R-SDF的1.43和3.57倍。F-IDF的膨胀力为4.55 mL·g-1,是R-IDF(2.25 mL·g-1)的2.02倍,但两者持水力之间没有显著性差异。F-SDF的乳化活性和乳化稳定性分别为24.75%和92.95%,分别是R-SDF的2.35和1.70倍,可能是在纳豆芽胞杆菌发酵的过程中使得一些纤维物质中的疏水基团暴露出来,从而提高了乳化性。SDF和IDF的持油力均无显著性差异。由此可知,纳豆芽胞杆菌发酵改善了SDF和IDF的部分特性。
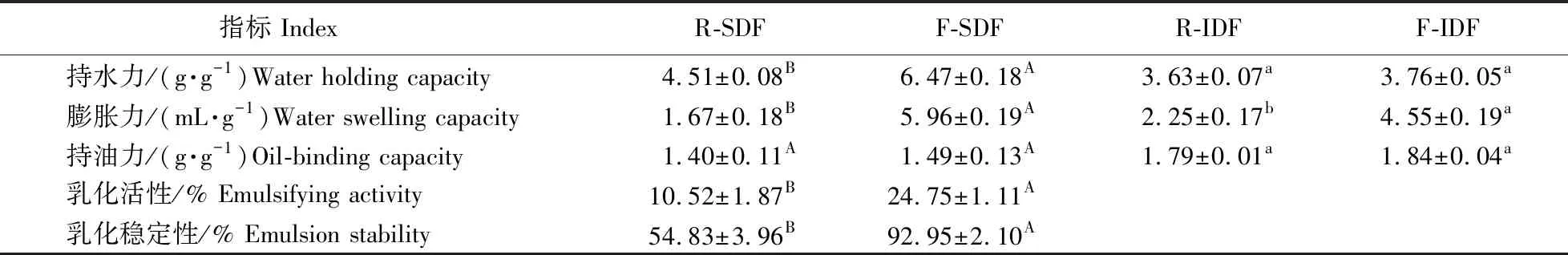
表2 SDF和IDF的持水力、膨胀力、持油力和乳化性Table 2 The water holding capacity,water swelling capacity,oil-binding capacity, and emulsifyingproperties of SDF and IDF
2.8 纳豆芽胞杆菌发酵对膳食纤维胆固醇、胆汁酸和葡萄糖吸附能力的影响
由表3可见:pH值对DF的胆固醇吸附能力有很大影响,每个样品在pH值为2(胃环境)时的胆固醇吸附能力均低于pH值为7(小肠环境)时,可能是强酸性环境影响了DF的结构。当pH值为7时,F-SDF的胆固醇吸附能力为7.61 mg·g-1,是R-SDF的1.82倍。F-IDF的胆固醇吸附能力为6.38 mg·g-1,是 R-IDF 的1.35倍。在胆汁酸吸附能力方面,F-SDF的胆汁酸吸附能力为95.13 μmol·g-1,显著高于R-SDF。F-IDF的胆汁酸吸附能力为42.03 μmol·g-1,显著低于R-IDF(57.99 μmol·g-1)。结果表明,纳豆芽胞杆菌发酵可以提高SDF和IDF的胆固醇吸附能力和SDF的胆汁酸吸附能力。

表3 SDF和IDF的胆固醇、胆汁酸和葡萄糖吸附能力以及葡萄糖透析延迟指数Table 3 The cholesterol,bile acid and glucose absorption capacity and glucose dialysis retardation index of SDF and IDF
如表3所示:所有样品均有一定程度的葡萄糖吸附能力,但彼此间并无显著差异。R-SDF、F-SDF和 F-IDF 的葡萄糖透析延迟指数均逐渐减小并趋于平稳,而R-IDF的葡萄糖透析延迟指数则先增大后减小。F-SDF的葡萄糖透析延迟指数一直显著高于R-SDF;F-IDF的葡萄糖透析延迟指数起初显著高于R-IDF,但随着时间的推移则不再存在显著性差异。
3 讨论与结论
本研究结果表明,纳豆芽胞杆菌发酵显著提高了SDF的得率和DF的纯度。SDF得率的提高可能是纳豆芽胞杆菌通过分泌β-葡萄糖苷酶(一种典型的纤维素分解酶)将IDF部分降解成了可溶性成分[18]。而DF纯度的提高则得益于其他组分含量的降低。其中,水分的减少可能与DF结构变得更加疏松有关,而其余组分的减少是由于纳豆芽胞杆菌在发酵过程中可以分泌一些水解酶,并利用小米糠中的蛋白质和脂肪等物质来维持自身生长[11]。发酵后SDF中单糖组成的变化可能与其中可溶性半纤维素的降解有关,甘露糖、鼠李糖、半乳糖、木糖、阿拉伯糖等是植物细胞壁中半纤维素的主要成分[19],这些单糖含量的降低意味着F-SDF中的可溶性半纤维素含量下降。本研究还发现,木糖和阿拉伯糖是R-IDF和F-IDF的主要成分。因为小米糠IDF很大一部分是由阿拉伯木聚糖组成的,阿拉伯木聚糖是一种半纤维素,可以被水解产生大量的木糖和阿拉伯糖[14]。IDF中木糖和阿拉伯糖含量的降低意味着纳豆芽胞杆菌发酵过程中利用了其中部分的阿拉伯木聚糖。
在结构方面,通过扫描电子显微镜和粒径分析发现DF的结构变得疏松,粒径减小且比表面积变大。松散的结构特征和较大的比表面积均与DF的理化性质有很大关系,例如促进水分子的吸附和保留[20],这可以解释SDF和IDF部分理化特性提高的原因。傅里叶红外变换光谱和X-射线衍射的结果表明,发酵后DF的官能团和结晶情况也发生了改变。发酵前后SDF的傅里叶变换红外光谱峰形有较大不同,表明SDF的官能团组成发生了变化。而IDF仅是发酵前后峰的吸收强度不同,这可能与IDF基本组成的变化有关。本研究发现,与R-SDF相比,F-SDF的X-射线衍射图谱变得平坦且光滑,可能是由于纳豆芽胞杆菌发酵使得SDF的粒径减小且结构变疏松,从而导致其晶体构型变得无序,结晶度下降。对于IDF而言,发酵前后的X-射线衍射图谱均为典型的纤维素I型,属于结晶区和非结晶区共存的状态[21]。发酵后IDF结晶度的升高可能与半纤维素和纤维素有关,Scheller等[22]发现半纤维素通常具有无组织和无定形的结构,很容易被酶水解。同时,纤维素的聚集可以形成结晶纤维素的核心[23]。F-IDF表面的半纤维素可能被纳豆芽胞杆菌分泌的酶水解,暴露出了内部的结晶纤维素核心,导致结晶度升高。
在理化特性方面,纳豆芽胞杆菌发酵提高了SDF的黏度,这与其粒径的减小有关[24]。黏度的升高可以增加DF对物质的吸附能力,这可以解释F-SDF较高的胆固醇吸附能力、胆汁酸吸附能力和葡萄糖透析延迟指数。据报道,高黏度的DF会减慢物质在小肠中的转运时间,降低葡萄糖和胆盐的吸收率,从而使血糖和胆固醇浓度下降[25]。因此,纳豆芽胞杆菌发酵提高了SDF作为功能性食品的潜力。发酵还提高了SDF的持水力(高于蒸汽爆破处理的苦荞麸皮SDF的2.65 g·g-1[26])、膨胀力(高于酶法提取的谷子SDF的1.01 mL·g-1[27])、乳化活性和乳化稳定性。据研究,拥有较高持水力和膨胀力的DF可以增强饱腹感、促进肠道蠕动和缓解便秘[28],高乳化活性和乳化稳定性也有助于保持健康,可以吸附小肠中的胆汁酸,从而降低血液中的胆固醇含量[29]。DF吸附胆固醇可以降低人体血液中的胆固醇含量,预防心脑血管疾病的发生。本研究发现,F-SDF(高于好食脉孢菌发酵的麦麸SDF的2.43 mg·g-1[30])和F-IDF的胆固醇吸附能力均显著性提高。DF还可以吸附胆汁酸并阻止其重吸收,从而影响胆固醇的肝肠循环以降低血脂[14]。发酵使SDF的胆汁酸吸附能力提升,IDF的胆汁酸吸附能力下降。Cornfine等[31]认为影响胆汁酸吸附能力的机制非常复杂,DF的结构、组成和降解程度是其决定因素。因此,可能需要进一步的研究来阐明这一结果。在本研究中,各DF之间的葡萄糖吸附能力无显著性差异,这与Dong等[32]的结果一致。为了进一步探究发酵前后DF对葡萄糖的作用,本研究测量了葡萄糖透析延迟指数,它是有效反映胃肠道葡萄糖延迟吸收的体外指标。结果表明,F-SDF具有较好的葡萄糖扩散抑制作用,这与其较高的黏度和较松散的结构有关。据报道,DF对葡萄糖扩散的抑制作用可归因于2个方面:DF利用黏性网络阻止葡萄糖扩散;由于其结构特征,DF对葡萄糖具有吸附结合作用[33-34]。此外本研究还发现,F-IDF的葡萄糖透析延迟指数起初显著高于R-IDF,但随着时间的推移逐渐失去了显著性差异。原因可能是随着时间的推移,IDF的聚集和沉淀减小了其与葡萄糖的接触面积,造成了上述变化。
综上所述,本研究发现纳豆芽胞杆菌发酵改善了小米糠SDF和IDF的结构和理化特性。其中,发酵对SDF的改善作用更加显著,F-SDF大部分的特性都得到了提高,显示出了成为功能性食品成分的巨大潜力。纳豆芽胞杆菌发酵也显著性提高了小米糠IDF的部分特性,如膨胀力和胆固醇吸附能力,表明其具有较好的应用前景。本研究推动了我国小米糠资源的高值化开发利用,并且推进了小米糠DF的研究进展,后续还需对发酵前后小米糠DF的具体功能展开进一步研究。
