多囊卵巢综合征患者脂联素与游离睾酮指数及胰岛素抵抗的相关性研究
2023-02-01唐子轩李璟黄琦章莹张晗王茜张琳程峣廖鑫
唐子轩,李璟,黄琦,章莹,张晗,王茜,张琳,程峣,廖鑫*
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种以高雄激素血症、无排卵症(常表现为月经稀发、闭经、不孕等)及卵巢多囊样改变为主要表现的综合征[1]。既往有研究表明,PCOS患者血液雄激素水平和胰岛素水平存在相关性,血液中较高的胰岛素水平会促进雄激素合成增加,影响正常的卵泡发育过程,导致多毛、月经紊乱甚至不孕[2-3]。此外血液中雄激素水平的增加还会从多方面影响体内各靶细胞对胰岛素的敏感性,从一定程度上加重了胰岛素抵抗,导致患者患高血压、高脂血症、心血管疾病及2型糖尿病的风险较正常人明显增高[4]。
脂联素(adiponectin,ADPN)是一种蛋白质类激素,在人体中的生理作用包括调控能量代谢、抗炎、促进卵泡发育、诱导排卵、促进宫内胎儿生长发育等方面[5]。ADPN主要由脂肪细胞分泌,可明显影响PCOS患者血清中性激素及胰岛素的水平[6]。动物实验表明,ADPN可以通过影响促黄体生成素受体基因的表达使卵泡膜细胞雄激素的生成减少[5]。同时PCOS患者血清ADPN表达水平与胰岛素抵抗呈负相关,检测血清ADPN水平可对患者胰岛素抵抗的程度进行预测[7]。
本研究通过对PCOS患者游离睾酮指数(free androgen index,FAI)和胰岛素抵抗与ADPN相关性进行初步研究,旨在探究ADPN是否可以作为一个同时评估PCOS患者高雄激素血症和胰岛素抵抗程度的指标。
1 对象与方法
1.1 研究对象 选取2017年10月至2020年4月就诊于遵义医科大学附属医院门诊或住院的116例PCOS患者及45例体检健康的正常育龄期妇女(对照组)为研究对象。
纳入标准:参照鹿特丹标准[7]诊断为PCOS。在排除其他已知内分泌系统相关的性腺疾病(如先天性肾上腺皮质增生,分泌雄激素的肿瘤和库欣综合征)后,符合以下3项中任意2项即可确诊:(1)稀发排卵和/或无排卵;(2)高雄激素血症临床表现和/或高雄激素血症;(3)超声检查发现卵巢多囊样改变,即一侧或双侧卵巢直径2~9 mm的卵泡≥12个和/或卵巢体积≥10 ml。
排除标准:(1)患有其他易引起雄激素水平增高或ADPN水平变化的疾病,包括但不限于内分泌疾病,如先天性肾上腺皮质增生,分泌雄激素的肿瘤和库欣综合征等;(2)妊娠期妇女;(3)6个月内服用过类固醇激素等药物的妇女。
本研究经遵义医科大学附属医院伦理委员会审核批准〔伦审(2022)1-254号〕,研究对象均签署知情同意书。
1.2 一般资料及实验室检查指标 一般资料:记录研究对象的年龄,测量身高、体质量、腰围、臀围,计算体质指数(BMI)、腰臀比(WHR)。WHR=腰围/臀围。实验室检查:月经规律者于月经周期第3~5天或月经不规律者在B超检查未见优势卵泡时,禁食12 h后由专人采集患者空腹肘静脉血检测以下生化指标:空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、卵泡刺激素(FSH)、促黄体生成素(LH)、孕酮、睾酮(TEST)、性激素结合球蛋白(SHGB)、硫酸脱氢表雄酮(DHEA-S)、ADPN。计算稳态模型评估的胰岛素抵抗指数(HOMAIR)及FAI。HOMA-IR=FPG(mmol/L)×FINS(μU/ml)/22.5,FAI=TEST(nmol/L)/SHGB(nmol/L)×100。
1.3 分组方法 根据既往指南将伴有高雄激素血症定义为血清TEST水平≥2.44 nmol/L[8]。本研究将PCOS患者按照是否合并高雄激素血症分为2组:PCOS伴高雄激素血症组(HA组,n=65)和PCOS不伴高雄激素血症组(非HA组,n=51)。进一步按血清TEST水平的四分位数将HA组和非HA组分别划分为4个亚组:HA 组(Q1亚 组:TEST<2.62 nmol/L,n=12;Q2亚 组:2.62 nmol/L≤ TEST<2.77 nmol/L,n=15;Q3亚组:2.77 nmol/L≤ TEST<3.16 nmol/L,n=21;Q4亚组,TEST≥ 3.16 nmol/L,n=17); 非 HA组(Q1'亚组:TEST<1.01 nmol/L,n=10;Q2'亚 组:1.01 nmol/L≤ TEST<1.23 nmol/L,n=11;Q3'亚 组:1.23 nmol/L≤ TEST<1.65 nmol/L,n=18;Q4'亚 组:TEST≥ 1.65 nmol/L,n=12)。
按照BMI将研究对象进行分组:BMI<24 kg/m2的PCOS患者为PCOS正常体质量亚组(PCOS+NW亚组,n=47),BMI值≥24 kg/m2的PCOS患者为PCOS超重亚组(PCOS+OW亚组,n=69)。对照组按照BMI分为非PCOS正常体质量亚组(非PCOS+NW亚组,n=21)和非PCOS超重亚组(非PCOS+OW亚组,n=24)。
1.4 统计学方法 采用SPSS 22.0软件进行统计学处理,所有数据在充分控制混杂因素并平衡基线数据后进行分析。符合正态分布的计量资料用(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),多组间两两比较采用LSD-t检验;非正态分布的计量资料用M(P25,P75)表示,组间比较采用Kruskal-Wallis检验。采用Pearson相关性分析探讨各指标间相关性。通过多元线性回归分析的Stepwise法来判断自变量和因变量的相互关系。以P<0.05为差异具有统计学意义。
2 结果
2.1 对照组、HA组、非HA组一般资料及实验室检查指标比较 与对照组相比,PCOS患者非HA组及HA组体质量、BMI、腰围、臀围、WHR、FPG、FINS、HOMA-IR、HbA1c、TG、LDL、FSH、TEST、FAI 增加,HDL降低,差异有统计学意义(P<0.05)。与非HA组相比,HA组HOMA-IR、TG、TEST、FAI增高,HDL、FSH、孕酮、SHBG、ADPN降低,差异有统计学意义(P<0.05),见表1。
表1 三组研究对象的一般资料及实验室检查指标比较(±s)Table 1 Comparison of general information and clinical biochemical indexes among three groups
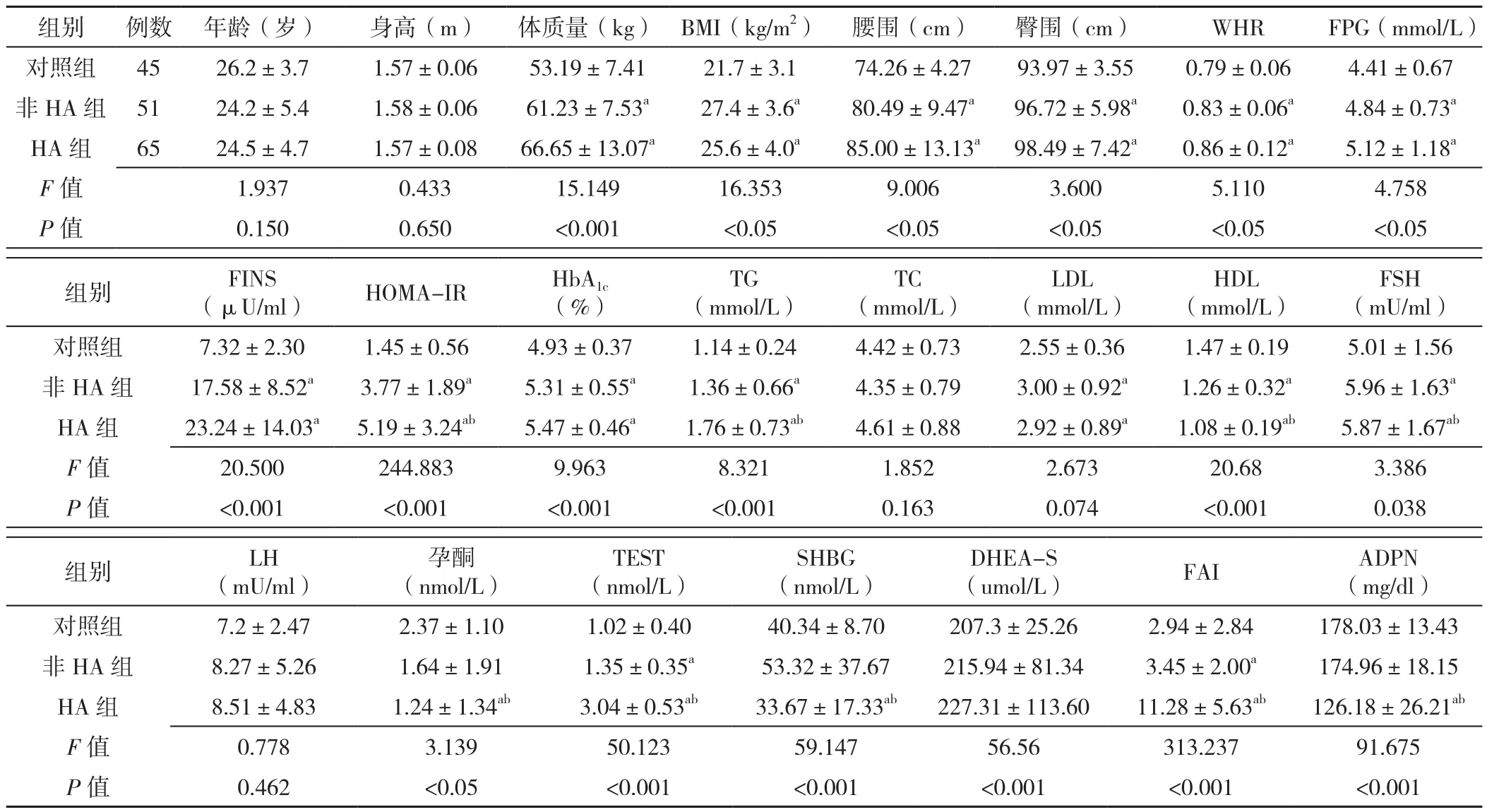
表1 三组研究对象的一般资料及实验室检查指标比较(±s)Table 1 Comparison of general information and clinical biochemical indexes among three groups
注:HA=高雄激素血症,BMI=体质指数,WHR=腰臀比,FPG=空腹血糖,FINS=空腹胰岛素,HOMA-IR=稳态模型评估的胰岛素抵抗指数,HbA1c=糖化血红蛋白,TG=三酰甘油,TC=总胆固醇,LDL=低密度脂蛋白,HDL=高密度脂蛋白,FSH=卵泡刺激素,LH=促黄体生成素,TEST=睾酮,SHBG=性激素结合球蛋白,DHEA-S=硫酸脱氢表雄酮,FAI=游离睾酮指数,ADPN=脂联素;a表示与对照组相比P<0.05,b表示与非HA组相比P<0.05
组别 例数 年龄(岁) 身高(m) 体质量(kg) BMI(kg/m2) 腰围(cm) 臀围(cm) WHR FPG(mmol/L)对照组 45 26.2±3.7 1.57±0.06 53.19±7.41 21.7±3.1 74.26±4.27 93.97±3.55 0.79±0.06 4.41±0.67非HA组 51 24.2±5.4 1.58±0.06 61.23±7.53a 27.4±3.6a 80.49±9.47a 96.72±5.98a 0.83±0.06a 4.84±0.73a HA 组 65 24.5±4.7 1.57±0.08 66.65±13.07a 25.6±4.0a 85.00±13.13a 98.49±7.42a 0.86±0.12a 5.12±1.18a F值 1.937 0.433 15.149 16.353 9.006 3.600 5.110 4.758 P 值 0.150 0.650 <0.001 <0.05 <0.05 <0.05 <0.05 <0.05 FSH(mU/ml)对照组 7.32±2.30 1.45±0.56 4.93±0.37 1.14±0.24 4.42±0.73 2.55±0.36 1.47±0.19 5.01±1.56非 HA 组 17.58±8.52a 3.77±1.89a 5.31±0.55a 1.36±0.66a 4.35±0.79 3.00±0.92a 1.26±0.32a 5.96±1.63a HA 组 23.24±14.03a 5.19±3.24ab 5.47±0.46a 1.76±0.73ab 4.61±0.88 2.92±0.89a 1.08±0.19ab 5.87±1.67ab F值 20.500 244.883 9.963 8.321 1.852 2.673 20.68 3.386 P 值 <0.001 <0.001 <0.001 <0.001 0.163 0.074 <0.001 0.038组别 FINS(μU/ml) HOMA-IR HbA1c(%)TG(mmol/L)TC(mmol/L)LDL(mmol/L)HDL(mmol/L)组别 LH(mU/ml)孕酮(nmol/L)TEST(nmol/L)SHBG(nmol/L)(umol/L)FAIADPN(mg/dl)DHEA-S对照组 7.2±2.47 2.37±1.10 1.02±0.40 40.34±8.70 207.3±25.26 2.94±2.84 178.03±13.43非 HA 组 8.27±5.26 1.64±1.91 1.35±0.35a 53.32±37.67 215.94±81.34 3.45±2.00a 174.96±18.15 HA 组 8.51±4.83 1.24±1.34ab 3.04±0.53ab 33.67±17.33ab 227.31±113.60 11.28±5.63ab 126.18±26.21ab F值 0.778 3.139 50.123 59.147 56.56 313.237 91.675 P 值 0.462 <0.05 <0.001 <0.001 <0.001 <0.001 <0.001
2.2 不同TEST水平亚组ADPN比较 HA组与非HA组内不同TEST水平亚组的ADPN比较,差异均有统计学意义(HA组:F=15.536,P<0.001;非HA组:F=30.409,P<0.05)。HA组中,Q2、Q3、Q4亚 组ADPN水平低于Q1亚组,Q3、Q4亚组ADPN水平低于Q2亚组,Q4亚组ADPN水平低于Q3亚组,差异均有统计学意义(P<0.05);非HA组中,Q2'、Q3'、Q4'亚组ADPN水平低于Q1'亚组,Q3'、Q4'亚组ADPN水平低于Q2'亚组,Q4'亚组ADPN水平低于Q3'亚组,差异均有统计学意义(P<0.05),见表2、3。
表2 HA组不同TEST水平亚组ADPN比较(±s,mg/dl)Table 2 Comparison of ADPN in different TEST levels subgroups in HA group

表2 HA组不同TEST水平亚组ADPN比较(±s,mg/dl)Table 2 Comparison of ADPN in different TEST levels subgroups in HA group
注:a表示与Q1亚组相比P<0.05,b表示与Q2亚组相比P<0.05,c表示与Q3亚组相比P<0.05
组别 例数 ADPN Q1亚组 12 158.32±15.92 Q2亚组 15 146.18±11.29a Q3亚组 21 136.08±12.98ab Q4亚组 17 121.54±13.36abc F值 15.536 P值 <0.001
表3 非HA组不同TEST水平亚组ADPN比较(±s,mg/dl)Table 3 Comparison of ADPN in different TEST levels subgroups in non-HA group

表3 非HA组不同TEST水平亚组ADPN比较(±s,mg/dl)Table 3 Comparison of ADPN in different TEST levels subgroups in non-HA group
注:a表示与 Q1'亚组相比 P<0.05,b表示与 Q2'亚组相比P<0.05,c表示与 Q3'亚组相比 P<0.05
组别 例数 ADPN Q1'亚组 10 181.77±11.10 Q2'亚组 11 172.40±10.13a Q3'亚组 18 160.25±6.53ab Q4'亚组 12 145.16±4.26abc F值 30.409 P值 <0.05
2.3 不同BMI亚组一般资料及实验室检查指标比较 4个不同BMI亚组的体质量、BMI、腰围、臀围、WHR、FPG、FINS、HOMA-IR、HbA1c、TG、LDL、HDL、孕酮、TEST、FAI比较,差异均有统计学意义(P<0.05)。与非PCOS+NW亚组相比,PCOS+NW亚组HDL、孕酮、ADPN降低,体质量、BMI、FINS、HOMA-IR、HbA1c、TG、LDL、FSH、TEST、FAI升高,差异均有统计学意义(P<0.05);与非PCOS+OW亚组相比,PCOS+OW亚组HDL、孕酮、ADPN降低,BMI、腰围、臀围、FINS、HOMA-IR、HbA1c、TEST、FAI升高,差异均有统计学意义(P<0.05),见表4。
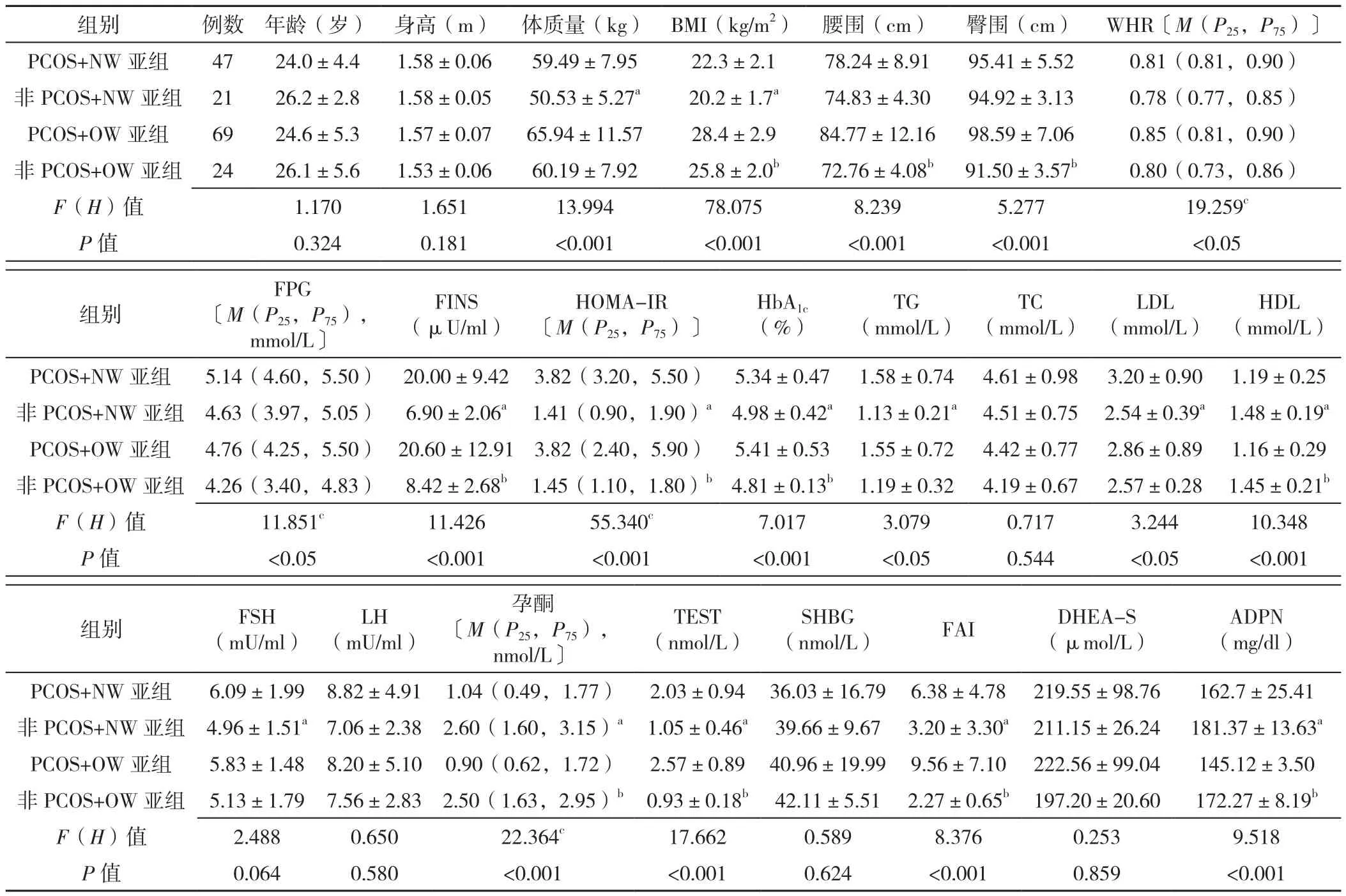
表4 不同BMI亚组一般资料及实验室检查指标比较Table 4 Comparison of general conditions and clinical biochemical indicators after grouping all subjects according to BMI
2.4 校正BMI后ADPN与其他指标的相关性分析在校正BMI后,PCOS患者的ADPN与HOMA-IR(r=-0.485,P<0.001)、FAI(r=-0.607,P<0.001)、TEST呈负相关(r=-0.725,P<0.001)。在 HA组,ADPN 与 HOMA-IR(r=-0.352,P=0.018)、FAI(r=-0.405,P=0.006)、TEST(r=-0.542,P<0.001)呈负相关;在非HA组中ADPN与HOMA-IR(r=-0.469,P=0.032)、FAI(r=-0.583,P=0.006)呈负相关,与TEST无相关关系(r=-0.416,P=0.061)。
2.5 多元线性回归分析 以FAI为因变量,以年龄、体质量、BMI、腰围、臀围、WHR、FPG、FINS、HOMA-IR、HbA1c、TG、HDL、孕酮、TEST、SHBG、DHEA-S、ADPN为自变量(均为连续变量);以ADPN为因变量,以年龄、体质量、BMI、腰围、臀围、WHR、FPG、FINS、HOMA-IR、HbA1c、TG、HDL、孕酮、TEST、SHBG、DHEA-S自变量(均为连续变量),分别采用Stepwise法对数据进行多元线性回归分析。校正混杂因素后的结果表明,非HA组中,ADPN、BMI是FAI的影响因素,HOMA-IR、FAI、BMI是ADPN的影响因素(P<0.05),见表5。在HA组中,ADPN是FAI的影响因素,HOMA-IR、FAI是ADPN的影响因素(P<0.05),见表 6。

表5 非HA组FAI、ADPN影响因素的多元线性回归分析Table 5 Multiple linear regression analysis of influencing factors of FAI and ADPN in the non-HA group

表6 HA组FAI、ADPN影响因素的多元线性回归分析Table 6 Multiple linear regression analysis of influencing factors of FAI and ADPN in the HA group
3 讨论
PCOS是育龄期妇女生殖功能异常的主要原因[8]。患有PCOS的妇女多伴有各系统代谢功能紊乱,如高胰岛素血症、高雄激素血症,以及其导致的糖尿病、冠心病、高血压、高脂血症等[9]。由于PCOS发病机制复杂且尚不明确,目前临床上对该疾病的诊断尚未有明确的指标,主要根据临床表现进行综合诊断。
ADPN发挥着抗动脉粥样硬化、参与类固醇激素合成、改善胰岛素抵抗等多种作用[10],已有大量研究证实其与PCOS的诊断关系极为密切[11]。研究表明,PCOS患者的卵巢表达ADPN受体的比例明显少于正常女性[12],通过增加ADPN水平可以使双氢睾酮诱导的PCOS实验小鼠代谢功能得到改善,并且使卵巢内FSH和胰岛素样生长因子1(IGF-1)诱导的孕酮和雌二醇的合成增加;TEST可通过作用于脂肪组织上调各级炎症信号通路,降低以白介素(IL)-6及肿瘤坏死因子(TNF)-α为代表的诸多炎性因子水平,影响ADPN分泌[6]。此外,高雄激素水平对前脂肪细胞的增殖和分化有不同的调节作用。对雄激素受体基因敲除小鼠的研究发现,雄激素可能会影响前脂肪细胞的增殖和分化[13]。SINGH 等[14]、NIKBAKHT 等[15]研究认为,ADPN、胰岛素抵抗及雄激素间的相互关系可能主要包括以下几点:(1)ADPN降低时可诱发胰岛素抵抗,相对性增加了胰岛素水平,促进P450c17α对卵巢及肾脏的作用,导致雄激素或其前体增多。(2)体内过多的TEST抑制胰岛素与靶细胞结合并相对性上升胰岛素水平,而这在PCOS患者中会加重胰岛素抵抗程度,从而进一步导致ADPN减少。
FAI是临床上评估PCOS患者合并高雄激素血症最常用的指标,但PCOS患者中ADPN与FAI的关系目前尚未明确。ALATAS等[16]在以BMI分组后的PCOS妇女中未发现ADPN与FAI有明显相关,KO等[17]在一项针对116例诊断为PCOS的女性患者中的相关性分析结果显示FAI与ADPN呈负相关,但Logistic回归分析结果提示两者无明显相关性。笔者分析存在差异的原因主要是由于FAI易受以TEST为主的其他雄激素指标影响,进而导致了其与ADPN关系受到影响所致。且PCOS的分型复杂多样,不同患者的TEST水平不总是集中于某一段范围内,若要通过ADPN与FAI的关系来间接判断其与高雄激素血症的关系,必须要在充分平衡不同患者的TEST水平后进行。故本研究在依据高雄激素血症进行分组的基础上进一步按TEST水平的四分位数进行分组,结果显示ADPN水平随TEST水平增加而逐渐下降,这提示了即使在较高或是较低TEST水平下,ADPN的变化情况依然能很好地反映患者的雄激素水平变化。此外,BMI分组的结果提示了在针对雄激素及ADPN的研究中应该充分考虑BMI这一变量的影响。
校正BMI后的相关性分析表明,无论是否合并高雄激素血症,随着TEST水平升高,ADPN水平会随着FAI值的上升而下降。这进一步提示TEST或许还可以通过作用于脂肪组织以外的其他胰岛素抵抗靶器官影响ADPN的分泌。有针对性地提高ADPN水平后或许可以改善PCOS患者的高雄激素血症症状及胰岛素抵抗,进一步改善PCOS疾病的发生和发展。
目前临床上诊断PCOS伴高雄激素血症通常依据血清TEST水平,但PCOS患者分型复杂,此方法漏诊率较大。结合临床表现的诊断方法虽然精确度更高,但主观性较强[15,18]。既往研究显示PCOS患者的ADPN水平较正常人明显较低,并可以作为PCOS疾病发展的预测因子[19]。本研究通过多元回归分析的方法验证了在不同TEST浓度水平下ADPN、FAI、胰岛素抵抗的关系,校正BMI后的多元线性回归分析结果提示ADPN是FAI的主要影响因素,FAI及HOMA-IR也是ADPN的主要影响因素。同时,本研究并未发现FAI及ADPN与年龄、孕酮、LH、FSH等有相互影响作用,提示ADPN可以作为一个较稳定的预测疾病的指标。
综上,结合FAI、ADPN、胰岛素抵抗来看,ADPN作为影响PCOS患者胰岛素、雄激素、血脂代谢等水平的蛋白质类激素,其与游离睾酮指数密切相关并互为主要影响因素,且这一关系不受TEST水平影响,通过测定血清ADPN水平既可以反映PCOS患者的高雄激素水平又可以反映胰岛素抵抗程度,故通过对PCOS患者ADPN水平的测定有望成为该疾病诊断和病情评估的重要参考指标。
作者贡献:唐子轩提出研究选题方向,负责病例资料的收集和整理,撰写论文初稿;李璟进行病例资料的收集和整理;黄琦负责论文的修订;章莹、张晗、王茜、张琳、程峣负责病例资料的提供;廖鑫负责文章的质量控制及审校,对文章整体负责;所有作者确认了论文的最终稿。
本文无利益冲突。
