猪腹泻病毒一步法多重TaqMan荧光定量RT-PCR检测法的建立及应用
2023-02-01王一丹杨发龙陈弟诗向华任玉鹏
王一丹,杨发龙,陈弟诗,向华,任玉鹏
猪腹泻病毒一步法多重TaqMan荧光定量RT-PCR检测法的建立及应用

1西南民族大学畜牧兽医学院,成都 610041;2四川省动物疫病预防控制中心,成都 610041
【】建立一种可同时检测猪流行性腹泻病毒(PEDV)野毒株、猪A群轮状病毒(GARV)、猪德尔塔冠状病毒(PDCoV)、猪阿尔法冠状病毒(SADS-CoV)及猪捷申病毒(PTV)5种猪腹泻病毒的一步法多重TaqMan荧光定量RT-PCR检测法。为猪腹泻病的快速诊断和流行病学调查提供高效灵敏的工具。【】对 PEDV 多个基因型毒株ORF3基因比对分析,以PEDV野毒株为模板,对疫苗株ORF3基因稳定缺失区域设计特异性探针,并在两端保守区域设计上下游引物;在靠近GARV G3、G4、G5和G9型 NSP5基因5′端保守碱基区域设计引物及探针,并加入简并碱基。同时,分别选择PDCoV M基因、PTV 5′UTR序列、SADS-CoV N基因等保守基因设计特异性引物及探针,用于多重荧光定量PCR方法的建立。对引物、探针浓度和退火温度进行优化;用RStudio参照代码绘制ROC曲线,确定检测方法的敏感度值、特异度值及曲线下面积AUC,并计算Youden指数,最终确定检测临界值;从阳性核酸中扩增靶基因,并克隆至pEASY-T1载体。通过体外转录,获得5种标准品分别命名为:cRNA-PEDV、cRNA-GARV、cRNA-PDCoV、cRNA-PTV和cRNA-SADS-CoV。对检测方法的敏感性、特异性和重复性等进行评估;并与同类方法对临床样本的检测符合率进行比较。【】得到了5种病原检测的最佳引物、探针浓度和最佳退火温度。根据ROC曲线确定PEDV、GARV、PDCoV、PTV和SADS-CoV临界CT值分别为:35.78、34.25、34.98、34.60和35.70;5种病原的检测下限均可达到1×102copies/µL,标准曲线线性关系良好,扩增效率在96.3%—104%之间;该方法对PEDV CV777疫苗株、PEDV AJ1102疫苗株、猪传染性胃肠炎病毒(TGEV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)、猪霍乱沙门氏菌()、多杀性巴氏杆菌()、大肠杆菌()、猪链球菌()和葡萄球菌()等多种菌毒株均不检出,具有良好的特异性;经重复性检验,组内变异系数在0.22%—3.08%之间,组间变异系数在0.89%—4.0%之间;对242份临床样本检测并与同类方法的检测结果进行比较,符合率分别为:PEDV 97.9%、GARV 98.8%、PDCoV 100%、PTV98.3%和SADS-CoV100%,Kappa值均大于0.9。对PEDV野毒株的检测准确性高于同类方法。此外,对临床样本检测结果显示,当前四川省腹泻猪群中尚无SADS-COV检出;但PEDV、GARV、PDCoV和PTV仍持续流行,其总体阳性率分别达到:10.7%(26/242)、13.6%(33/242)、18.2%(44/242)和14.5%(35/242),且各腹泻病原之间存在不同形式和程度的混合感染,使感染猪腹泻病情加剧。故需进一步加强几种猪腹泻病毒在本地区猪群中流行情况调查和遗传变异规律研究,为制定更具针对性的防控措施提供依据。【】本研究成功建立了一种同时检测PEDV野毒、PDCoV、SADS-CoV和 GARV、PTV多基因型的一步法多重TaqMan荧光定量RT-PCR,为猪腹泻病的快速鉴别诊断和流行病学调查提供了一种高效灵敏的工具。
一步法多重TaqMan荧光定量RT-PCR;猪腹泻相关病毒;鉴别诊断;检测临界值
0 引言
【研究意义】猪病毒性腹泻是国内外生猪健康养殖过程中常见的一类重要疫病。在引起猪腹泻的病毒中,α冠状病毒属的猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)和呼肠孤病毒科的猪A群轮状病毒(porcine group A rotavirus, GARV)在国内外分布最广,常引起猪只剧烈腹泻,导致仔猪存活率和育肥猪饲料转化率下降。调查显示,2015—2018年国内22个省市543份样本中,PEDV和GARV核酸检测阳性率分别达到66.85%(363/543)和20.07%(109/543),尤其是PEDV抗体阳性率达到100%[1]。同时,近年还出现了两种新型猪冠状病毒,猪急性腹泻综合征病毒(swine acute diarrhea syndrome coronavirus, SADS-CoV)和猪δ冠状病毒(porcine delta coronavirus, PDCoV),也可引起仔猪腹泻,且极易与PEDV或GARV发生混合感染,并显著提高死亡率[2]。尤其是PDCoV在我国各地猪群中流行趋势逐步上升,2015—2019年,在山东[3]、河南[4]、广东[5]、广西[6]和四川[7]等地样本中均有检出,部分猪群中核酸阳性率达36.43%(94/258)。此外,小RNA病毒科的猪捷申病毒(porcine teschovirus, PTV)也可引起仔猪严重的神经性脑炎和腹泻症状,与PEDV或PDCoV的混合感染率可高达62.53%[1],增加了猪腹泻病因的复杂性。在已报道的13个血清型中,PTV1、PTV2、PTV3、PTV6、PTV8和PTV11[8-9]等均可引起仔猪腹泻[10]。上述5种病毒感染猪只过程中具有极为相似的临床症状和病理变化,还常呈现不同形式的混合感染,使病情加剧,给鉴别诊断和疫病防控带来困难。因此,建立一种可同时检测PEDV、GARV、PDCoV、SADS-CoV和PTV的一步法多重TaqMan荧光定量RT-PCR方法对于猪腹泻病的早期诊断、病原流行病学调查和深入研究多病原混合感染机制都至关重要。【前人研究进展】在猪腹泻病毒检测方法研究中,以荧光定量PCR为代表的分子生物学检测技术具有灵敏度高、特异性强和时效性好的优点,应用最为广泛[11]。但现有方法仍存在不足,如:对PEDV的检测,常靶向其保守性较高的M基因[12]和N基因[13],导致大部分方法不能区分PEDV野毒株和疫苗株。研究发现,连续传代的PEDV弱毒疫苗株ORF3基因中存在50 bp左右碱基缺失,是区分强弱毒株的重要分子标志[14]。目前基于该基因也已建立部分鉴别PEDV野毒株和疫苗株的RT-PCR和SYBRⅠ实时荧光定量PCR检测法[15-16];但在TaqMan荧光定量PCR中研究较少,尤其在多重TaqMan荧光定量PCR中实现对PEDV野毒株的针对性检测尚未见报道。此外,GARV不同基因型毒株间差异较大,通过一种引物和探针实现对所有基因型GARV的检出十分困难。据调查显示,GARV G3型、G4型、G5型和G9型在国内腹泻猪中最常见,是当前流行GARV的优势基因型[17-18]。因此,理论上可在保证敏感性和特异性前提下设计引物和探针,实现对GARV优势毒株的同时检出,减少兽医临床上对GARV的漏检。此外,虽然当前已有部分关于PDCoV、SADS-CoV和PTV检测方法的研究,但通过TaqMan荧光定量PCR实现对几种病毒同时鉴别的方法尚未见报道。【本研究切入点】综合上述5种猪腹泻相关病毒的研究现状并结合兽医临床诊断实际需求,本研究拟以PEDV ORF3基因、GARV NSP5基因、PDCoV M基因、SADS-CoV N基因和PTV 5′UTR基因为靶基因设计5对探针及引物,优化反应条件,初步确定检测临界值,评估其特异性、灵敏性和重复性,以期建立一种可以同时检测PEDV野毒株、GARV优势基因型、PDCoV、SADS-CoV和PTV的一步法多重TaqMan荧光定量RT-PCR检测法。【拟解决的关键问题】为5种猪病毒性腹泻病原的快速鉴别诊断、流行病学调查和多病原混合感染模式及机制研究提供新型可靠的手段。
1 材料与方法
试验于2020年4月至2021年8月在西南民族大学动物医学实验室及四川省动物疫病预防控制中心完成。
1.1 菌毒株
研究所用菌毒株主要用于方法建立过程中的基因扩增,反应条件优化及特异性检验,主要包括:PEDV疫苗株和野毒株、GARV 3个基因型核酸、PDCoV、PTV 2个基因型核酸、猪传染性胃肠炎病毒(TGEV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)、猪霍乱沙门氏菌()、猪源巴氏杆菌()、猪源大肠杆菌()、猪链球菌()和葡萄球菌(),详细信息见表1。
1.2 主要试剂
猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒多联快速实时荧光RT-PCR检测试剂盒购自北京世纪元亨动物防疫技术有限公司(批号:TPR20191102P);KOD OneTMPCR Master Mix购自东洋纺(上海)生物科技有限公司;E.Z.N.A.® Gel Extraction Kit、Plasmid Mini Kit质粒小量提取试剂盒购自美国OMEGA生物技术公司;Trizol核酸提取试剂、Transcription T7 Kit(for siRNA Synthesis)和One Step PrimeScript™ RT-PCR Kit(Perfect Real Time)购自TaKaRa公司;pEASY®- Blunt Cloning Kit、Trans1-T1 Phage Resistant感受态细胞购自北京全式金生物技术有限公司;SADS-CoV N基因(登录号:MK651076.1)[19]克隆载体(pUC57- SADS-CoV)由生工生物工程(上海)股份有限公司合成。
1.3 样本来源及处理
研究所用临床样本采自2020—2021年,四川省绵阳、乐至、雅安、巴中、南充等地区腹泻猪肛门棉拭子样本共242份。采集实验级巴马小型猪肛门棉拭子用猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒多联快速实时荧光RT-PCR检测试剂盒及参考文献报道的TaqMan探针荧光检测法分别对PEDV、GARV、PDCoV[12]、PTV[20]和SADS-CoV[21]进行检测,获得90份真阴性样本。所有样本按1﹕3(v/v)加入无菌 PBS,低温保存送样至实验室。后经震荡混匀,反复冻融3次,离心取上清,用Trizol法提取总核酸,存于-80℃冰箱备用。
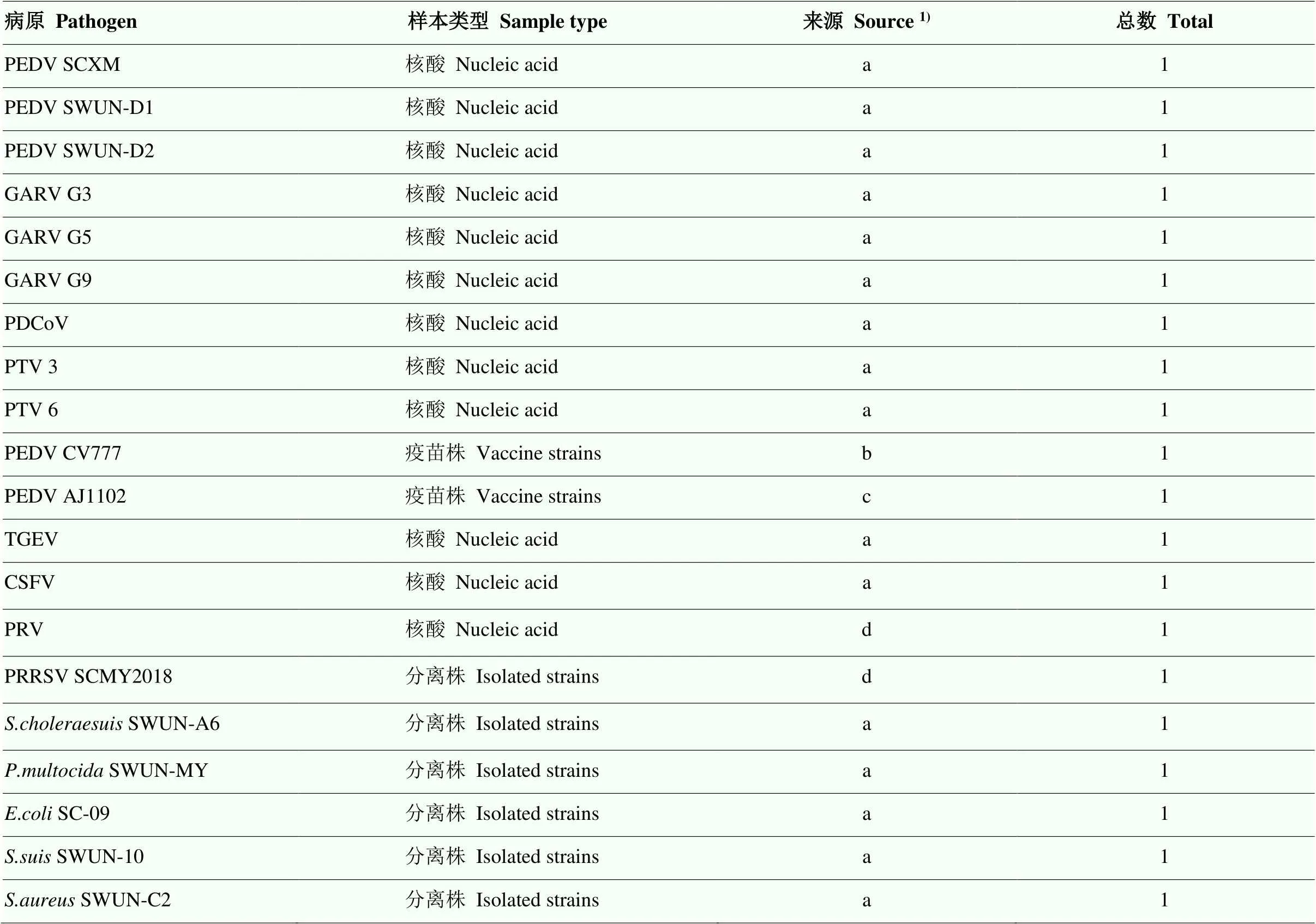
表1 用于特异性试验的菌毒株信息
1)a:西南民族大学动物医学实验室;b:哈尔滨维科生物技术有限公司;c:武汉科前生物股份有限公司;d:四川省动物疫病预防控制中心
1)a: College of Animal medical laboratory of Southwest Minzu University; b: Harbin Harvac biotechnology co. Ltd; c: Wuhan Keqian biology co. Ltd; d: Sichuan Animal Disease Prevention and Control Center
1.4 探针、引物的设计与合成
使用Megalign将GenBank中已登录的包括PEDV G1a、G1b、G2a和G2b等4种基因亚型共24个野毒株和减毒疫苗株(CV777DR13AJ1102P-5)的ORF3基因进行比对分析发现,弱毒疫苗株ORF3基因244—295位均存在50—51 bp碱基缺失,这与SU等[22]的研究结论相符。根据这一特征,本研究以该区域为靶点设计特异性探针(230—255 bp),使其仅针对PEDV野毒株进行检测;上下游引物分别位于ORF3基因178—197位和336—354位保守区域(表2)。
对GARV引物及探针设计时,首先对已登录的4种G型GARV NSP5基因序列比较,发现靠近5′端约290个碱基同源性可达(96.3%—100%),是所有基因节段中最为保守的区域;以NSP5基因为靶点,根据其保守区域设计引物(103—121 bp、269—286 bp)及探针(242—265 bp),并加入简并碱基,在理论上确保该方法对G3、G4、G5和G9型GARV毒株的检出。
此外,对PDCoV M基因、PTV 5′UTR基因、SADS-CoV N基因的保守区域分别设计特异性引物及探针,用于多重荧光定量RT-PCR方法的建立,详细信息见表2。同时,分别对上述靶基因全基因序列进行扩增,用于cRNA标准品的构建,详细信息见表3。所有引物和探针均由生工生物工程(上海)股份有限公司合成。

表2 PEDV、GARV、PDCoV、PTV和SADS-CoV靶基因扩增引物

表3 荧光定量RT-PCR引物和探针
1.5 标准品的制备
将PEDV、GARV、PDCoV、PTV阳性核酸和 pUC57-SADS-CoV 用靶基因扩增引物扩增(表2)。回收纯化扩增产物并连接至pEASY®-Blunt Cloning Kit,转化Trans1-T1 Phage Resistant感受态细胞。筛选阳性克隆菌提取质粒,送至生工生物工程(上海)股份有限公司进行测序。
将GARV、PDCoV、PTV和SADS-CoV阳性质粒用限制性内切酶Ⅰ、PEDV用限制性内切酶H Ⅰ线性化处理后,用DNA纯化试剂盒纯化回收,用Transcription T7 Kit 试剂盒进行体外转录,反应体系为:10×Transcripition Buffer 2 µL、4种dNTP Solution各2 µL、RNase Inhibitor 0.5 µL、T7RNA Polymerase 2 µL、RNase free dH2O 1.5 µL、linear template DNA 6 µL;反应程序为:42℃,2 h。反应结束后,加5 µL RNase free DNaseⅠ,37℃ 30 min,用Trizol法纯化cRNA。将标准品分别命名为:cRNA-PEDV、cRNA-GARV、cRNA-PDCoV、cRNA- PTV和cRNA-SADS-CoV。用NanoDorp2000测定cRNA浓度,用RNase free dH2O将cRNA浓度统一调整到5×108copies/µL并等体积混匀备用,混匀后各标准品浓度为1×108copies/µL。cRNA拷贝数用以下公式计算:
copies/µL
1.6 一步法多重TaqMan荧光定量RT-PCR反应体系及条件的优化
用5种病毒cRNA标准品作为模板,分别对各引物浓度(0.04—4 µmol·L-1)、探针浓度(0.04—4 µmol·L-1)、退火温度(50℃—60℃)进行优化。反应程序为:42℃ 5 min,95℃ 10 s;95℃ 5 s,退火 30 s,采集荧光信号,40个循环。
1.7 检测临界值的确定
将每种病毒cRNA等量混合并稀释到101、102、103拷贝各30份,再分别与真阴性样本总RNA按1﹕1(v/v)等体积混合,作为真阳性样本。分别用本研究建立的多重荧光定量RT-PCR方法对真阴性样本及cRNA真阳性样本进行检测,用RStudio参照代码绘制ROC曲线(Receiver operating characteristic curve,ROC曲线),确定检测方法的敏感度值(sensitivity, Se值)、特异度值(specificity, Sp值)及曲线下面积AUC,并计算Youden指数(Youden index)(Youden index=Se+Sp-1)。Youden指数较大值所对应的数值为检测临界值。
1.8 标准曲线的建立
将各病毒cRNA标准品等体积混合后,进行101—108稀释,并进行一步法多重TaqMan荧光定量RT-PCR反应,以拷贝数的对数为横坐标,CT值为纵坐标,建立标准曲线,计算扩增效率。E=[10-(1/slope)-1] ×100%。
1.9 敏感性测试
cRNA标准品混合物10倍倍比稀释,进行一步法多重TaqMan荧光定量RT-PCR反应,评价该方法的灵敏性。
1.10 特异性检验
用多重TaqMan荧光定量RT-PCR方法对PEDV(SCXM株、SWUN-D1株、SWUN-D2株、CV777疫苗株、AJ1102疫苗株)、GARV(G3、G5、G9型)、PDCoV、PTV(3、6型)、cRNA-SADS-CoV、TGEV、CSFV、PRV、PRRSV、、、和等13种猪常见的细菌病毒进行检测,用真阴性核酸作阴性对照,无菌水为空白对照,进行特异性检验。
1.11 重复性试验
分别用102、104、106拷贝的cRNA标准品混合物稀释液,在第1、7、30天分别进行3次重复试验,计算组内和组间变异系数,评价方法的重复性。
1.12 临床样本检测
用本研究建立的一步法多重TaqMan荧光定量RT-PCR法对采自2020—2021年四川省5个地区242份肛门棉拭子样本进行检测。同时,用商品化试剂盒及参考文献报道的同类方法再次检测临床样本进行复核,比较不同方法[12,20-21]的检测效果和符合率。
2 结果
2.1 最佳反应条件
分别对引物、探针浓度及退火温度进行优化,获得最佳反应体系为:2×One Step RT-PCR Buffer Ⅲ 25 µL,TaKaRa Ex Taq HS 1 µL,PrimeScripeRT Enzyme Mix Ⅱ 1 µL,PEDV(引物0.56 µmol·L-1,探针0.36 µmol·L-1),GARV(引物0.2 µmol·L-1,探针0.1 µmol·L-1),PDCoV(引物0.2 µmol·L-1,探针0.32 µmol·L-1),PTV(引物0.32 µmol·L-1,探针0.12 µmol·L-1),SADS-CoV(引物0.36 µmol·L-1,探针0.12 µmol·L-1),Total RNA 7.5 µL,RNase Free dH2O 3.3 µL;最佳退火温度58℃。
2.2 检测临界值
根据绘制的ROC曲线结果显示(图1),本方法对PEDV、GARV、PDCoV、PTV和SADS-CoV的CT临界值分别为:35.78(Sp值0.93、Se值0.87、Youden指数0.8)、34.25(Sp值0.78、Se值0.84、Youden指数0.62)、34.98(Sp值0.80、Se值0.95、Youden指数0.75)、34.60(Sp值0.92、Se值0.7、Youden指数0.62)、35.70(Sp值0.90、Se值为0.77、Youden指数0.67)。AUC值均大于0.8,表明检测准确性良好。
2.3 标准曲线的建立
5种猪腹泻病毒的标准曲线见图2,结果显示,各组拷贝数与CT值有良好的线性关系,扩增效率较高:PEDV(2= 0.9901,E=104%),GARV(2= 0.9976,E=102%),PDCoV(2= 0.9961,E=102%),PTV(2= 0.9984,E=98.7%),SADS-CoV(2= 0.9993,E=96.3%)。
2.4 敏感性试验
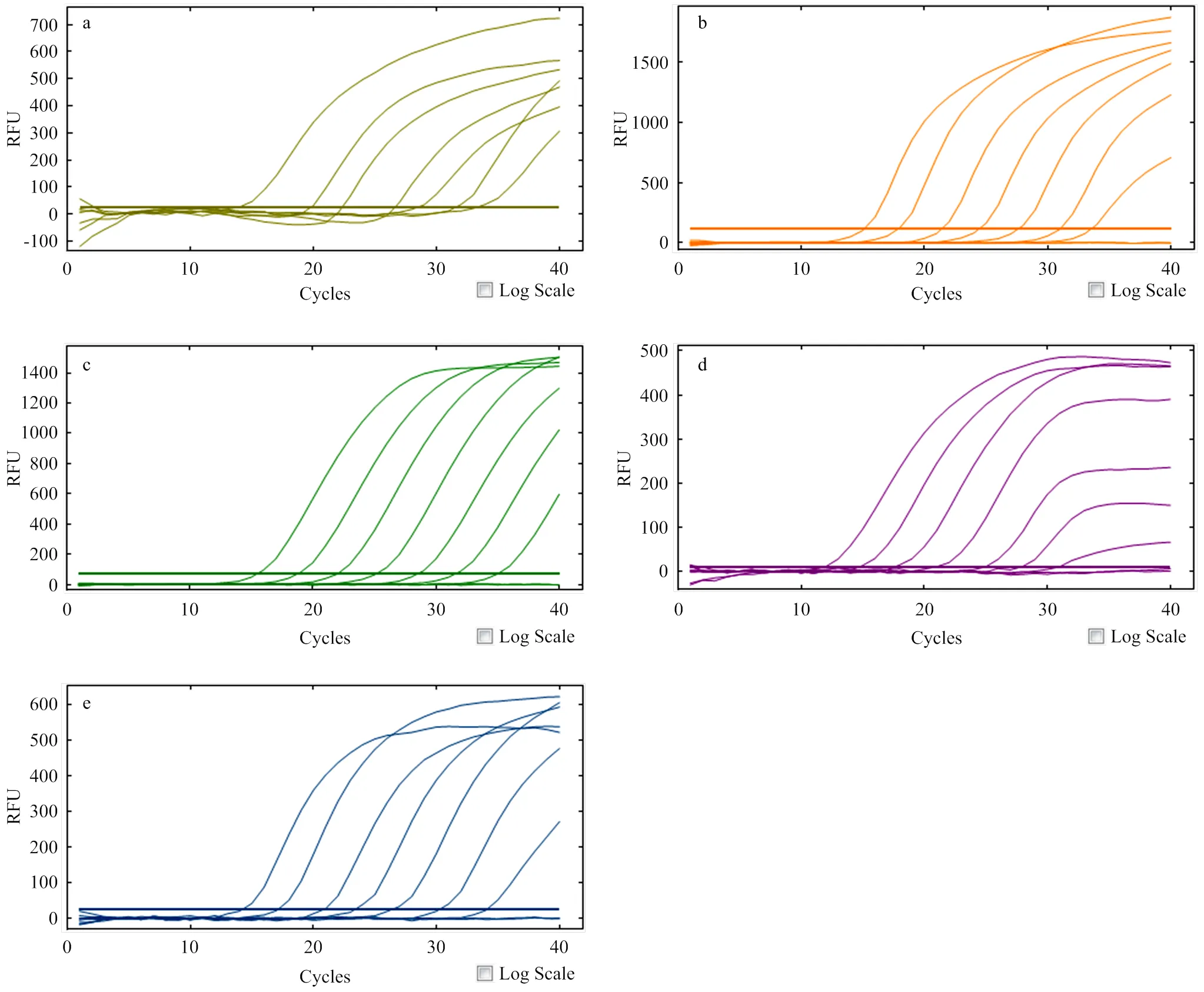
根据敏感性测试结果并结合检测临界值判定,PEDV、GARV、PDCoV、PTV和SADS-CoV最低检测限均可达到1×102copies/µL(图3);其中,对SADS-CoV检测时,1×101copies/µL样本对应CT值为37.42(表4),但通过ROC曲线确定的临界CT值为35.11,表明该方法无法检测到1×101copies/µL的SADS-CoV cRNA。

a. PEDV; b. GARV; c. PDCoV; d. PTV; e. SADS-CoV

表4 一步法多重TaqMan荧光定量RT-PCR敏感性
2.5 重复性试验
重复性试验结果如表5所示,PEDV组内变异系数为1.06%—2.64%,组间变异系数为0.47%—2.07%;GARV组内变异系数为0.22%—2.31%,组间变异系数为0.89%—1.99%; PDCoV组内变异系数为1.95%—2.46%,组间变异系数为1.03%—4.0%;PTV组内变异系数为0.42%—1.76%,组间变异系数为0.91%—3.80%;SADS-CoV组内变异系数为1.16%—3.08%,组间变异系数为0.77%—1.78%。以上数据表明,一步法多重TaqMan荧光定量RT-PCR具有良好的稳定性及重复性。

a. PEDV;b. GARV;c. PDCoV;d. PTV;e. SADS-CoV

表5 一步法多重TaqMan荧光定量RT-PCR重复性CT值分析
a. PEDV; b. GARV; c. PDCoV; d. PTV; e. SADS-CoV
2.6 特异性试验
特异性试验结果显示,该方法只检出PEDV野毒株、GARV(G3、G5、G9型)、PDCoV、PTV(3、6型)、cRNA-SADS-CoV,对PEDV弱毒疫苗株及其他猪常见病原均无非特异性扩增曲线(图4),结果表明该方法特异性良好。
2.7 临床样本检测
用本研究建立的一步法多重TaqMan荧光定量RT-PCR法对2020—2021年四川省5个地区242份腹泻猪样本进行检测。同时用商品化荧光定量试剂盒及文献报道方法[12, 20-21]与本方法进行检测符合率比较。结果显示,对PEDV、GARV、PDCoV、PTV和SADS-CoV符合率分别为:97.9%(=0.9)、98.8%(=0.95)、100%(=1)、98.3%(=0.93)和100%(=1)(表6)。其中,商品化试剂盒比本研究建立方法,多检出5份PEDV阳性样本,漏检3份GARV阳性样本和4份PTV阳性样本。笔者进一步对上述样本中,PEDV ORF3基因、GARV NSP5基因和PTV 5′ UTR序列分别进行了普通PCR扩增和测序分析(引物序列见表2)。结果显示,本方法未检出的5个PEDV ORF3基因与CV777 弱毒株(登录号:GU372744.1)基因序列同源性均高于99%,且存在碱基缺失,表明样本中存在PEDV疫苗毒且对试剂盒检测结果造成了干扰。对GARV NSP5基因和PTV 5′ UTR基因的测序结果经BLAST分析表明,与GenBank中登录序列同源性均高于97%。表明本研究建立的一步法多重荧光定量检测法对GARV和PTV的检测灵敏度更高。

1. PEDV SCXM株;2. PEDV SWUN-D1株;3. PDCoV;4. PEDV SWUN-D2株;5-7. GARV(G3、G5、G9型);8. cRNA-SADS-CoV;9-10. PTV(3、6型);11-30. PEDV(CV777株、AJ1102株)、TGEV、CSFV、PRV、PRRSV、S.choleraesuis、P.multocida、E.coli、S.suis、S.aureus、健康猪样本、无菌水

表6 一步法多重TaqMan荧光定量RT-PCR与同类方法比较的检测
此外,根据本次调查,在四川省5个地区均无SADS-CoV检出;但PEDV、GARV、PDCoV和PTV群体阳性率分别:60%(3/5)、80%(4/5)、60%(3/5)和60%(3/5),总体阳性率分别为:10.7%(26/242)、13.6%(33/242)、18.2%(44/242)和14.5%(35/242)(表7)。此外, PEDV和GARV混合感染率为2.5%(6/242),PEDV和PDCoV混合感染率为6.2%(15/242),PDCoV和PTV混合感染率为2.9%(7/242),PEDV、GARV和PDCoV混合感染率为1.7%(4/242)。上述结果表明,目前PEDV、GARV、PDCoV和PTV在四川地区腹泻猪群中仍广泛存在,且还出现不同程度的混合感染,加剧猪腹泻发病率和死亡率,需要进一步对该地区猪腹泻病原感染情况和遗传变异特征进行调查,制定更具针对性的防控措施。
3 讨论
3.1 一步法多重TaqMan荧光定量RT-PCR在病原检测中的优势
在所有病毒检测技术中,以荧光定量PCR为代表的分子生物学技术不论在检测灵敏度、特异性或稳定性方面都具有明显优势。尤其是TaqMan荧光定量PCR,通过探针与模板靶向结合释放荧光信号,增强了反应的特异性,实现了对病毒核酸拷贝数的定量检测。经比较研究,TaqMan荧光定量PCR的检测限通常能达到101—102copies/µL,分别是SYBR Green І染料法荧光定量PCR和普通PCR的100倍和1 000倍[23]。但TaqMan荧光定量PCR也存在试剂及耗材价格贵,单次试验成本高的不足。若将多对引物及探针加入同一反应体系,实现一次试验对多病原的检测,则可大幅缩短操作时间,减少聚合酶的消耗量。此外,将反转录酶加入TaqMan荧光定量PCR反应体系,实现RNA反转录和cDNA扩增的一体化,这也是许多RNA病毒检测方法研究过程或商品试剂盒中的常见做法[24]。其优点在于可有效简化加样程序,减少污染,缩短检测时间。基于此,本研究针对5种具有相似临床特征的猪腹泻病毒建立了一种一步法多重TaqMan荧光定量RT-PCR检测方法,优化获得其最佳反应体系和条件,可用于批量样本中5种猪腹泻病毒的快速检测、鉴别诊断和流行病学调查。
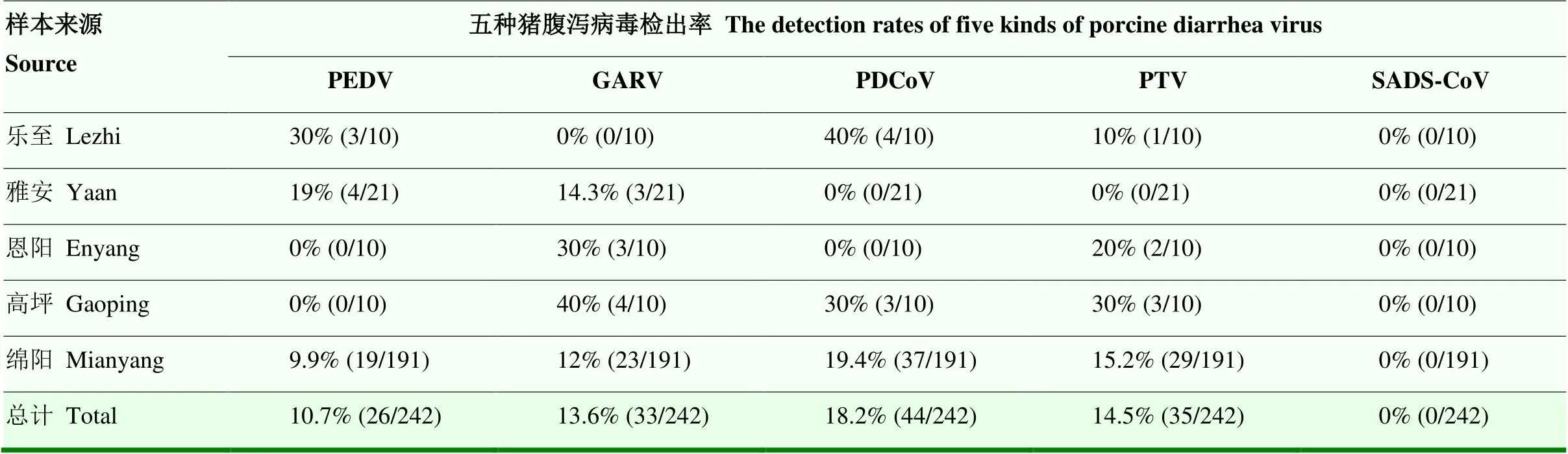
表7 临床样本阳性检出率
3.2 多重TaqMan荧光定量PCR靶基因的选择
靶基因的选择是影响TaqMan荧光定量PCR灵敏性和特异性的重要因素之一。在本试验设计过程中,除选择对PEDV自然感染毒株和减毒疫苗株有鉴别作用的ORF3基因为靶点外[22],还分别对GARV、G3、G4、G5和G9型多个毒株的11个基因节段进行了比较,在NSP5基因靠近5′ 端区域发现一个约290个碱基的保守区域(同源性为96.3%—100%),以此为靶点设计特异性引物和探针,理论上确保了对G3、G4、G5和G9型GARV毒株的检出。此外,对PTV 13种血清型基因比对发现,5′UTR 相对保守,仅存在少数位点的突变,可作为靶基因来设计引物和探针,同时加入简并碱基提高了方法的敏感性。PDCoV M基因和SADS-CoV N基因也是冠状病毒检测常用的保守靶基因[21,25],不同毒株间同源性都在96%以上。故本研究选用上述靶基因建立检测法,在完成对PEDV、GARV、PDCoV、SADS-CoV和PTV同时鉴别检测的基础上,最大程度保证本方法对不同毒株的检出率,尤其是对PEDV野毒株的针对性检出和对GARV优势基因型的检出。
3.3 同类检测方法对临床样本中病原检出率的比较分析
本研究中,用该方法和同类方法同时检测临床样本,结果对PEDV、GARV、PDCoV、PTV和SADS-CoV的检测符合率分别为:97.9%(k=0.9)、98.8%(k=0.95)、100%(k=1)、98.3%(k=0.93)和100%(k=1)。此外,本研究建立的一步法多重荧光定量RT-PCR比商品化试剂盒多检出5份PEDV阳性样本,经测序分析为PEDV疫苗株;而本方法对GARV和PTV也具有更高的检测灵敏性。对2020—2021年四川部分地区猪腹泻病因调查发现,PEDV、GARV、PDCoV和PTV仍广泛存在,且还出现不同程度的混合感染,加剧猪腹泻病毒发病率和死亡率,提示该地区还需进一步对猪腹泻病原的流行病学及遗传变异特征进行调查,制定更具针对性的防控措施。
3.4 ROC曲线在检测临界值确定中的应用分析
在TaqMan荧光定量PCR检测方法建立过程中,检测临界值的确定是难点之一。在大部分研究阶段,检测临界值主要根据对倍比稀释标准品的检测CT值来确定,即通常默认检测下限对应的CT值为临界点,或默认临界CT值为40。但从统计学角度看,这种方式不够严谨,易受多种试验因素影响导致临界值偏高或偏低[26]。ROC曲线即受试者工作特征曲线,是反映检测方法敏感度和特异度连续变量的综合指标。在曲线绘制过程中,将连续变量设定多个不同的临界点,分别计算Se和Sp值,以Se值为纵坐标,1-Sp值为横坐标绘制ROC曲线,Se值与Sp值成反比,而最佳临界点对应的特异度与敏感度均为最佳,即曲线最左上方Youden指数最大的切点[27]。在临床上,ROC曲线已被用于评估多种诊断方法的最佳临界点[28]。如:LAAMIRI等[27]基于ROC曲线分析,确定了针对4种禽呼吸道病毒的多重TaqMan荧光定量PCR检测法的临界CT值和检测下限,为ROC曲线在荧光定量PCR检测临界值确定中的应用提供了参考。本研究基于上述原理,根据多重TaqMan荧光定量RT-PCR方法对真阳性和真阴性样本的检测结果,通过ROC曲线分析确定了检测方法临界CT值分别为:PEDV 35.78、GARV 34.25、PDCoV 34.98、PTV 34.60 和 SADS-CoV 35.70。此外,构建的ROC曲线中AUC值均大于0.8,表明检测方法准确性良好[27]。
4 结论
建立了一种可同时检测PEDV野毒株、PDCoV、SADS-CoV、PTV以及GARV多种优势基因型的一步法多重TaqMan荧光定量RT-PCR检测法。经验证,该方法具有良好的特异性和敏感性;初步应用于临床样本检测取得理想的效果。该方法的建立为猪腹泻病毒的快速鉴别诊断和流行情况监测提供了可靠工具,对猪腹泻病的预防控制具有重要意义。同时,研究所采用的ROC曲线法确定临界CT值,可为今后其他同类方法的建立和研究提供理论参考。
[1] SU M J, LI C Q, QI S S, YANG D, JIANG N, YIN B S, GUO D H, KONG F Z, YUAN D W, FENG L, SUN D B. A molecular epidemiological investigation of PEDV in China: Characterization of co-infection and genetic diversity of S1-based genes. Transboundary and Emerging Diseases, 2020, 67(3): 1129-1140. doi:10.1111/tbed. 13439.
[2] SAENG-CHUTO K, MADAPONG A, KAEOKET K, PIÑEYRO P E, TANTITUVANONT A, NILUBOL D. Coinfection of porcine deltacoronavirus and porcine epidemic diarrhea virus increases disease severity, cell trophism and earlier upregulation of IFN-α and IL12. Scientific Reports, 2021, 11: 3040. doi:10.1038/s41598-021- 82738-8.
[3] SUN W C, WANG L, HUANG H X, WANG W, CAO L, ZHANG J Y, ZHENG M, LU H J. Genetic characterization and phylogenetic analysis of porcine deltacoronavirus (PDCoV) in Shandong Province, China. Virus Research, 2020, 278: 197869. doi:10.1016/j.virusres. 2020.197869.
[4] ZHANG H L, LIANG Q Q, LI B X, CUI X G, WEI X L, DING Q W, WANG Y B, HU H. Prevalence, phylogenetic and evolutionary analysis of porcine deltacoronavirus in Henan Province, China. Preventive Veterinary Medicine, 2019, 166: 8-15. doi:10.1016/j. prevetmed.2019.02.017.
[5] MAI K, FENG J, CHEN G, LI D, ZHOU L, BAI Y, WU Q, MA J. The detection and phylogenetic analysis of porcine deltacoronavirus from Guangdong Province in Southern China. Transboundary and Emerging Diseases, 2018, 65(1): 166-173. doi:10.1111/tbed.12644.
[6] 严瑾, 施开创, 黎宗强, 尹彦文, 陆文俊, 屈素洁. 2017—2019年猪德尔塔冠状病毒广西流行毒株遗传多样性分析. 中国兽医科学, 2020, 50(9): 1147-1158. doi:10.16656/j.issn.1673-4696.2020.0163.
YAN J, SHI K C, LI Z Q, YIN Y W, LU W J, QU S J. Genetic diversity of porcine deltacoronavirus in Guangxi Province from 2017 to 2019. Chinese Veterinary Science, 2020, 50(9): 1147-1158. doi:10.16656/j.issn.1673-4696.2020.0163. (in Chinese)
[7] FENG Y, XU Z W, ZHU L. Prevalence and phylogenetic analysis of porcine deltacoronavirus in Sichuan Province, China. Archives of Virology, 2020, 165(12): 2883-2889. doi:10.1007/s00705-020- 04796-z.
[8] YANG T T, LI R C, YAO Q, ZHOU X F, LIAO H Y, GE M, YU X L. Prevalence of Porcine teschovirus genotypes in Hunan, China: Identification of novel viral species and genotypes. The Journal of General Virology, 2018, 99(9): 1261-1267. doi:10.1099/jgv.0. 001129.
[9] 王丽瑄, 周群, 付能胜, 曹慧, 何欣怡, 方鹏飞, 胡承哲, 张斌. 藏猪源捷申病毒的检测和遗传演化分析. 畜牧兽医学报, 2021, 52(1): 185-194.
WANG L X, ZHOU Q, FU N S, CAO H, HE X Y, FANG P F, HU C Z, ZHANG B. Detection and genetic evolution ofof Tibetan pig origin in Sichuan. Acta Veterinaria et Zootechnica Sinica, 2021, 52(1): 185-194. (in Chinese)
[10] MATIAS FERREYRA F, ARRUDA B, STEVENSON G, SCHWARTZ K, MADSON D, YOON K J, ZHANG J Q, PIÑEYRO P, CHEN Q, ARRUDA P. Development of polioencephalomyelitis in cesarean- derived colostrum-deprived pigs following experimental inoculation with eitherA serotype 2 or serotype 11. Viruses, 2017, 9(7): 179. doi:10.3390/v9070179.
[11] 王玉倩, 薛秀花. 实时荧光定量PCR技术研究进展及其应用. 生物学通报, 2016, 51(2): 1-6.
WANG Y Q, XUE X H. The application and development of real-time fluorescent quantitative PCR. Microbiology China, 2016, 51(2): 1-6. (in Chinese)
[12] 罗尚星, 范京惠, 刘宝京, 师乾凯, 侯林杉, 左玉柱. 猪丁型冠状病毒与猪流行性腹泻病毒双重实时荧光定量RT-PCR方法的建立和初步应用. 畜牧兽医学报, 2018, 49(4): 852-858.
LUO S X, FAN J H, LIU B J, SHI Q K, HOU L S, ZUO Y Z. Establishment and application of the real-time reverse transcription quantitative PCR assay for porcine epidemic diarrhea virus and porcine. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(4): 852-858. (in Chinese)
[13] 杨峰, 杨猛超, 周宏超, 许信刚, 张为民, 张琪. 猪流行性腹泻病毒实时荧光定量RT-PCR检测方法的建立及初步应用. 动物医学进展, 2018, 39(7): 1-5. doi:10.16437/j.cnki.1007-5038.2018. 07.001.
YANG F, YANG M C, ZHOU H C, XU X G, ZHANG W M, ZHANG Q. Establishment and preliminary application of real-time qPCR method for detection of PEDV. Progress in Veterinary Medicine, 2018, 39(7): 1-5. doi:10.16437/j.cnki.1007-5038.2018. 07.001. (in Chinese)
[14] PARK S J, MOON H J, LUO Y Z, KIM H K, KIM E M, YANG J S, SONG D S, KANG B K, LEE C S, PARK B K. Cloning and further sequence analysis of the ORF3 gene of wild- and attenuated-type porcine epidemic diarrhea viruses. Virus Genes, 2008, 36(1): 95-104. doi:10.1007/s11262-007-0164-2.
[15] 修金生, 陈小权, 王斌, 李涛. 基于SYBR Ⅰ实时荧光定量PCR对猪流行性腹泻病毒野毒和疫苗弱毒鉴别诊断方法的建立. 中国动物传染病学报, 2012, 20(5): 16-21.
XIU J S, CHEN X Q, WANG B, LI T. Development of sybr greenⅰbased real-time rt-pcr for differentiation of wild type porcine epidemic diarrhea virus infected and vaccinated pigs. Chinese Journal of Animal Infectious Diseases, 2012, 20(5): 16-21. (in Chinese)
[16] 宋予震, 董青, 梁中涛, 霍军. PEDV疫苗株与野毒株RT-PCR鉴别诊断方法的建立及临床应用. 中国兽医杂志, 2016, 52(10): 6-8, 11.
SONG Y Z, DONG Q, LIANG Z T, HUO J. Development and clinical application of RT-PCR differential diagnosis method for vaccine strains and wild strains of PEDV. Chinese Journal of Veterinary Medicine, 2016, 52(10): 6-8, 11. (in Chinese)
[17] 周群, 陈小飞, 阚蕊慈, 李玉, 曹慧, 彭艳伶, 张斌. 2017—2019年四川地区猪A群轮状病毒的分子流行病学调查. 中国农业科学, 2021, 54(5): 1063-1072.
ZHOU Q, CHEN X F, KAN R C, LI Y, CAO H, PENG Y L, ZHANG B. Molecular epidemiological investigation of porcine group Ain Sichuan from 2017 to 2019. Scientia Agricultura Sinica, 2021, 54(5): 1063-1072. (in Chinese)
[18] 苗艳, 朱庆贺, 陈亮, 李丹, 李阳, 兰世捷, 徐馨, 史同瑞. 猪轮状病毒的分子流行病学研究进展. 动物医学进展, 2020, 41(1): 93-97. doi:10.16437/j.cnki.1007-5038.2020.01.013.
MIAO Y, ZHU Q H, CHEN L, LI D, LI Y, LAN S J, XU X, SHI T R. Progress on molecular epidemiology of porcine. Progress in Veterinary Medicine, 2020, 41(1): 93-97. doi:10.16437/j.cnki.1007- 5038.2020.01.013. (in Chinese)
[19] ZHOU L, LI Q N, SU J N, CHEN G H, WU Z X, LUO Y, WU R T, SUN Y, LAN T, MA J Y. The re-emerging of SADS-CoV infection in pig herds in Southern China. Transboundary and Emerging Diseases, 2019, 66(5): 2180-2183. doi:10.1111/tbed.13270.
[20] CANO-GÓMEZ C, BUITRAGO D, FERNÁNDEZ-PINERO J, FERNÁNDEZ-PACHECO P, MANSILLA C, AGÜERO M, JIMÉNEZ-CLAVERO M A. Evaluation of a fluorogenic real-time reverse transcription-polymerase chain reaction method for the specific detection of all known serotypes of porcine teschoviruses. Journal of Virological Methods, 2011, 176(1/2): 131-134. doi:10. 1016/j.jviromet.2011.05.035.
[21] ZHOU L, SUN Y, WU J L, MAI K J, CHEN G H, WU Z X, BAI Y, LI D, ZHOU Z H, CHENG J, WU R T, ZHANG X B, MA J Y. Development of a TaqMan-based real-time RT-PCR assay for the detection of SADS-CoV associated with severe diarrhea disease in pigs. Journal of Virological Methods, 2018, 255: 66-70. doi:10.1016/j. jviromet.2018.02.002.
[22] SU Y F, LIU Y C, CHEN Y M, XING G X, HAO H F, WEI Q, LIANG Y, XIE W T, LI D L, HUANG H M, DENG R G, ZHANG G P. A novel duplex TaqMan probe-based real-time RT-qPCR for detecting and differentiating classical and variant porcine epidemic diarrhea viruses. Molecular and Cellular Probes, 2018, 37: 6-11. doi:10.1016/ j.mcp.2017.10.003.
[23] ZHOU X R, ZHANG T S, SONG D P, HUANG T, PENG Q, CHEN Y J, LI A Q, ZHANG F F, WU Q, YE Y, TANG Y X. Comparison and evaluation of conventional RT-PCR, SYBR green I and TaqMan real-time RT-PCR assays for the detection of porcine epidemic diarrhea virus. Molecular and Cellular Probes, 2017, 33: 36-41. doi:10. 1016/j.mcp.2017.02.002.
[24] 于新友, 李天芝. 猪瘟病毒和猪繁殖与呼吸综合征病毒一步法双重荧光RT-PCR检测方法的建立及应用. 中国动物检疫, 2018, 35(4): 88-91.
YU X Y, LI T Z. Establishment and application of an one-step fluorescent RT-PCR method for dection of CSFV and PRRSV. China Animal Health Inspection, 2018, 35(4): 88-91. (in Chinese)
[25] 江珊, 李富强, 李秀丽, 王利丽, 郑丽, 张莉, 路超, 鄢明华. 猪德尔塔冠状病毒TaqMan荧光定量PCR检测方法的建立及应用. 动物医学进展, 2019, 40(10): 10-17. doi:10.16437/j.cnki.1007-5038. 2019.10.003.
JIANG S, LI F Q, LI X L, WANG L L, ZHENG L, ZHANG L, LU C, YAN M H. Establishment and application of TaqMan fluorescence quantitative PCR for detecting porcine. Progress in Veterinary Medicine, 2019, 40(10): 10-17. doi:10.16437/j.cnki.1007- 5038.2019.10.003. (in Chinese)
[26] BUSTIN S A, BENES V, GARSON J A, HELLEMANS J, HUGGETT J, KUBISTA M, MUELLER R, NOLAN T, PFAFFL M W, SHIPLEY G L, VANDESOMPELE J, WITTWER C T. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry, 2009, 55(4): 611-622. doi:10.1373/clinchem.2008.112797.
[27] LAAMIRI N, AOUINI R, MARNISSI B, GHRAM A, HMILA I. A multiplex real-time RT-PCR for simultaneous detection of four most common avian respiratory viruses. Virology, 2018, 515: 29-37. doi:10. 1016/j.virol.2017.11.021.
[28] 侯伟, 李连谦, 武文龙, 肖博文. 未成熟粒细胞百分率在重症急性胰腺炎早期评估中的临床价值. 中国普通外科杂志, 2020, 29(3): 341-347. doi:10.7659/j.issn.1005-6947.2020.03.012.
HOU W, LI L Q, WU W L, XIAO B W. Clinical value of immature granulocyte percentage in early evaluation of severe acute pancreatitis. Chinese Journal of General Surgery, 2020, 29(3): 341-347. doi:10. 7659/j.issn.1005-6947.2020.03.012. (in Chinese)
One-Step Multiple TaqMan Real-time RT-PCR for Simultaneous Detection of Swine Diarrhea Viruses

1College of Animal Science and Veterinary Medicine, Southwest Minzu University, Chengdu 610041;2Sichuan Provincial Center for Animal Disease Prevention and Control, Chengdu 610041
【】 The aim of this study was to establish a one-step multiplex real-time RT-PCR method to simultaneously detect and quantify five swine diarrhea related viruses, PEDV, GARV, PDCoV, SADS-CoV and PTV, so as to provide an efficient and sensitive tool for rapid diagnosis and epidemiological investigation of porcine diarrhea.【】The ORF3 gene sequences of several genotypes of PEDV were analyzed, and then the primers and probes were designed for detection of PEDV field strains by referring to the ORF3 genes, which contained deletion mutations in attenuated strains. The 5'-end conserved region of NSP5 genes of GARV G3, G4, G5 and G9 strains were analyzed for design of probes and primers. The specific primers and probes targeting to the conserved regions of PDCoV M, PTV 5'UTR and SADS-CoV N genes were designed for detection of the pathogens. The ROC curves were completed by referring to parameters that were set in RStudio. The specificity value, sensitivity value, and areas under the curves (AUC) and Youden value were calculated according to ROC curves to determine the cut-off CT value.The amplified fragments were cloned into pEASY-T1 vector. The standards prepared throughtranscription were named as cRNA-PEDV, cRNA-GARV, cRNA-PDCoV, cRNA-PTV and cRNA-SADS-CoV. The sensitivity, specificity and repeatability of one-step multiplex real-time RT-PCR were evaluated. Coincidence rate between this and another similar method were compared in the detection of clinical samples. 【】 Both the annealing temperature and optimal concentrations of primers and probes were obtained for detection of the five pathogens. According to the ROC curve, the CT cut off values for detection of PEDV, GARV, PDCoV, PTV, and SADS-CoV were set as 35.78, 34.25, 34.98, 34.60, and 35.70, respectively. The detection sensitivity of this method for the five pathogens could reach 1×102copies/µL. The standard curves had a good linear relationship and the amplification efficiency was between 96.3% and 104%. The established method could not detect the PEDV vaccine strains and other swine infecting viruses and bacteria including TGEV, CSFV, PRV, PRRSV,,,,and. The repeatability test showed the range of intra-assay and inter-assay coefficients of variability: 0.22% to 3.08% and 0.89% to 4.0%, respectively. The detection coincidence rates of the established detection method and another similar method for the five pathogens in 242 clinical samples were 97.9%, 98.8%, 100%, 98.3% and 100% for PEDV, GARV, PDCoV, PTV and SADS-CoV, respectively. The Kappa values were all higher than 0.9. The method had advantage over a commercial diagnostic kit for detection of PEDV wild strains in accuracy. Detection results with clinical samples showed that positive rates of PEDV, GARV, PDCoV and PTV was 10.7% (26/242), 13.6% (33/242), 18.2% (44/242) and 14.5% (35/242), respectively, demonstrating the prevalence state of the four pathogens in Sichuan province in the years. SADS-CoV was not detectable in any areas, but the phenomenon of coinfection with different diarrhea causing viruses was common. Therefore, it was necessary to strengthen the surveillance of several porcine diarrhea viruses in Sichuan province for preventive control. 【】In this study, a one-step multiplex real-time RT-PCR was established for simultaneous detection of PEDV wild strains, PDCoV, SADS-COV and GARV, PTV multiple genotypes, which provided an efficient and sensitive tool for the differential diagnosis and epidemiological investigation of swine diarrhea disease.
one-step multiple TaqMan real-time RT-PCR; swine diarrhea related virus; differential diagnosis; cut off value
2021-09-22;
2022-01-23
中央高校基本科研业务费专项资金(2020NQN29)
王一丹,E-mail:872502834@qq.com。通信作者任玉鹏,E-mail:renyupeng1986@163.com
(责任编辑 林鉴非)
