葡萄VlCKX4表达特性分析与转录调控预测
2023-02-01李旭飞杨盛迪李松琦刘海楠裴茂松韦同路郭大龙余义和
李旭飞,杨盛迪,李松琦,刘海楠,裴茂松,韦同路,郭大龙,余义和
葡萄表达特性分析与转录调控预测
李旭飞,杨盛迪,李松琦,刘海楠,裴茂松,韦同路,郭大龙,余义和*
河南科技大学园艺与植物保护学院/河南省园艺植物品质调控工程技术研究中心,河南洛阳 471023
【】通过克隆细胞分裂素脱氢酶/氧化酶基因及其启动子,进行表达特性分析和启动子活性分析并进行转录因子预测,为深入解析介导细胞分裂素信号途径调控葡萄坐果的分子机制提供依据。【】使用生物信息学方法分析‘巨峰’葡萄(×)细胞分裂素氧化酶/脱氢酶4()的序列特征;利用PCR技术克隆该基因以及它的启动子,使用实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)分析的表达特性,GUS活性试验用于分析其启动子活性;利用PlantTFDB、CisBP等转录调控数据库对的转录调控关系进行预测分析,输出结果使用Gephi软件进行可视化。【】全长1 582 bp,其中包含1 566 bp的开放阅读框,编码522个氨基酸,具有家族特征的FAD结构域和细胞分裂素结合(ck-binding)结构域。qRT-PCR结果表明在花序中高表达,其次是叶片,在卷须中表达量最低;细胞分裂素CPPU处理后表达量先下降后上升,细胞分裂素抑制剂洛伐他汀(Lov)处理后表达量先上升后下降。顺式元件分析表明启动子中含有吲哚乙酸、茉莉酸甲酯等响应元件;GUS化学组织染色试验表明,响应这些激素的处理。转录调控预测分析结果显示,MYB、DOF和WRKY类转录因子对其进行转录调控,结合转录组数据和共表达关系确定、和为关键候选转录因子。【】葡萄受到细胞分裂素CPPU的诱导,启动子受到和转录因子的调控,参与促进葡萄坐果过程。
‘巨峰’葡萄;细胞分裂素;;启动子活性;调控
0 引言
【研究意义】葡萄是最古老的果树之一,在世界范围内广泛种植。葡萄中富含多种营养物质,包括白藜芦醇、原花青素,以及黄酮类物质,具有极高的营养价值,备受消费者喜爱[1-3]。据统计,2020年中国葡萄总种植面积达78.3万hm2,其中鲜食葡萄占比32%[4]。在众多的鲜食葡萄类型中,‘巨峰’(×)因其果实大、味道鲜美、抗病性好[5]、品质高等优点成为鲜食葡萄的主栽品种。在‘巨峰’葡萄的栽培过程中会出现3次生理落果,第一次最严重,平均落果率高达80%[6],成为限制‘巨峰’葡萄栽培面积的主要因素之一,也给果农的栽培管理带来了严峻的挑战。【前人研究进展】坐果是果树重要的性状,是产量和品质的决定因素之一[7]。目前,生产中用于促进葡萄坐果的生长调节剂有赤霉素、细胞分裂素、油菜素内酯等[8]。其中,赤霉素主要促进细胞分裂以及中果皮细胞增大来使果实增大,最新的研究从基因调控层面表明,赤霉素能够调节葡萄和的特异性表达,从而影响坐果,但会对葡萄花芽发育产生不利影响[9]。细胞分裂素是植物五大激素之一,通过调节拟南芥分生组织、胚珠等的形成,对拟南芥种子的产量进行调节[10-11]。人工合成的细胞分裂素6-BA通过提高叶绿素含量,提高光合性能,延缓叶片衰老[12],从而增加玉米籽粒数。另外一种人工合成的细胞分裂素CPPU(forchlorfenuron, N-(2-chloro-4-pyridinyl)-N-phenylurea)促进坐果的效应更强[13-21],在低浓度条件下就可促进葡萄的生长,并且能够有效减少葡萄穗轴坏死,促进葡萄单性结实[6,22]。植物细胞分裂素氧化酶/脱氢酶(cytokinin oxidase/ dehydrogenase,CKXs)是植物体中存在的一种不可逆降解细胞分裂素的酶,因此,它对植物维持体内细胞分裂素稳态具有重要作用。一些CKX基因已经被证明与植物的生长发育相关,例如过表达拟南芥,导致拟南芥叶片变小,植株发育延缓,侧根和花的数量显著增加[23]。同样,过表达可以增加初生根的生长速率以及不定根和侧根的长度[10];而表达量的增加会导致叶片变厚变硬。沉默水稻之后水稻分蘖数增加,产量也得到了提升[24-25],也有研究表明的表达降低导致细胞分裂素在花序分生组织中积累并增加生殖器官的数量,从而提高谷物产量[25]。沉默也能提高水稻籽粒数,不同的是通过延缓叶片衰老起到提高产量的作用[26]。前期通过CPPU处理葡萄花序,发现葡萄坐果率提高40%左右[27],说明CPPU在促进葡萄坐果功能上效果显著。在花后第5天进行CPPU处理,在处理后的1、2、4和8 d采样用于转录组测序并进行分析,结果显示细胞分裂素脱氢酶/氧化酶(CKXs)家族基因表达量在处理和对照之间差异显著。研究人员为验证该基因家族在CPPU促进葡萄坐果过程中发挥的作用,进行了基因家族成员鉴定和表达量分析,基因家族鉴定结果显示葡萄中CKX家族共有8个成员,均含有FAD结构域和CK结合结构域,且该家族绝大部分成员都受到CPPU的诱导,其中发现变化最为显著[28],暗示该基因可能发挥重要作用。【本研究切入点】使用植物生长调节剂CPPU是目前有效提高葡萄坐果率的方法,但其潜在的分子机制还不清楚。【拟解决的关键问题】从‘巨峰’葡萄基因组中克隆和它的启动子,通过生物信息学分析、表达特性分析、GUS组织化学染色、转录调控预测等方法,对的功能以及转录调控模式进行初步探索,为后续进一步研究细胞分裂素促进坐果分子机制的解析奠定基础。
1 材料与方法
1.1 材料及处理
试验材料为8年生的‘巨峰’葡萄(L.×L. Kyoho),种植于河南洛阳偃师葡萄种植区。处理时间为2019年5月18日,以10 mg∙L-1的细胞分裂素(CPPU)和1.62 g·L-1的细胞分裂素合成抑制剂洛伐他汀(Lov)对盛花后5 d的葡萄花序进行处理,处理方式为浸蘸,时间为15 s,以清水处理作为对照。采样时间为处理后1、2、4和8 d。采集后的果实在液氮中速冻,-80℃冷藏备用。本试验所用的引物见表1,由金唯智生物科技有限公司(江苏,中国)合成。

表1 在本研究中使用到的引物
1.2 试验方法
1.2.1 RNA提取与使用RNA提取试剂盒(天根生物,北京)提取‘巨峰’葡萄RNA,使用反转录试剂盒(Takara,大连)获得葡萄果实全长cDNA,以此为模板,扩增得到全长(Vitvi11g01371)。扩增使用50 μL体系:正反向引物FL-F/R各1 μL、高保真酶(PrimeSTAR Max Premix,Takara,大连)25 μL、ddH2O 19 μL、模板2 μL。反应程序:98℃预变性2 min、98℃变性10 s、58℃复性30 s、72℃延伸150 s、共35个循环,然后在72℃条件下继续延伸10 min。获得的产物经琼脂糖凝胶电泳(1.0%)检测后使用胶回收试剂盒(康为世纪,北京)回收目标片段,经苏州金唯智公司测序得到序列。
1.2.2 实时荧光定量PCR 使用反转录试剂盒(诺唯赞,南京)进行反转录获取片段cDNA,经内参基因(GenBank:CA808925)检测后在-40℃保存备用。RT-qPCR反应体系为10 μL:QT-F/R各0.3 μL、ddH2O 3.4 μL、2×TransStart® Top Green qPCR Super Mix 5 μL。反应在Bio-Rad IQ5Real-Time PCR检测(Bio-Rad Laboratories, Hercules CFX96 Touch,CA, USA)仪器上进行,使用两步法程序:94℃ 30 s、94℃ 5 s、60℃退火30 s,共循环40次,每个样品设置3次重复。采用2-ΔΔCT法计算基因的相对表达量,并使用Excel、SPSS软件对所得数据进行分析。
1.2.3 启动子的克隆与载体构建 采用改良CTAB法[29]提取葡萄果实的DNA。使用同源重组[30]的方法进行载体构建。使用添加同源臂的引物,以DNA为模板,使用高保真酶PrimerSTAR Max Premix(Takara,大连)扩增目的基因的启动子区域。同时对载体pC0390-35S-GUS进行双酶切,使用的限制性内切酶为R I和d III(Takara,大连)。使用无缝克隆试剂盒Seamless Cloning Kit(碧云天,上海)将回收的目的基因产物与载体进行连接,使用20 μL连接体系,按照说明书的程序进行操作。之后,将连接产物转化进大肠杆菌感受态()中,涂在添加抗生素的培养基上培养用于筛选阳性克隆,挑选单克隆菌落至浑浊,进行菌液PCR以及提质粒做酶切鉴定,后送至苏州金唯智生物科技有限公司进行测序。测序完成后将质粒转化至农杆菌感受态GV3101中。以pC0390-GUS载体为阴性对照,带有35S启动子的GUS载体作为阳性对照,使用农杆菌介导的烟草瞬时转化法,进行GUS组织化学染色试验。
1.2.4 烟草瞬时转化及GUS组织化学染色 利用真空渗透方法进行烟草叶片的瞬时转化。在浸染之后,分别用GA3(200 μmol·L-1)、脱落酸(ABA)(100 μmol·L-1)、茉莉酸甲酯(MeJA)(100 μmol·L-1)、CPPU(40 μmol·L-1)喷施烟草叶片,之后正常光照条件下培养24 h。将培养好的烟草叶片放进一次性培养皿中,加入GUS染色剂(华越洋生物,北京),使叶片完全浸入,放在37℃培养箱中过夜培养,期间使用封口膜将容器封闭避免GUS染色液挥发。后使用70%乙醇脱色6—8 h,80%乙醇脱色9 h,期间可多次更换乙醇,直到绿色完全脱去,观察GUS染色情况并拍照记录。
1.2.5 靶向的转录因子调控预测 利用PlantTFDB4.0数据库葡萄转录因子信息,用Hmmscan对参考基因组葡萄基因组序列(http://plants.ensembl.org/index.html)中的所有基因进行转录因子家族分析,通过Blast 进行转录因子注释,截取 Hmmscan E- value≤0.05、Blast E-value≤0.05为标准鉴定并统计所有转录因子(表2)。提取Ensembl数据库中葡萄的GFF3注释文件和葡萄基因组文件中的启动子序列(上游2 000 bp)作为预测富集背景,并提交给PlantTFDB和Cis-bp数据库进行调控预测(http://plantregmap.gao-lab.org)。FIMO用于判断启动子中的TF结合位点,根据10-5为截取阈值筛选预测结果。获取预测信息并将其导入Gephi0.9.2软件,并使用“Fruchterman Reingold”布局将数据可视化,并计算节点的平均权重,以区分节点的关键程度。

表2 靶向VlCKX4的转录因子预测
1.2.6理化性质分析及进化树构建 使用在线网站Expasy(https://www.expasy.org/#opennewwindow)分析VlCKX4的理化性质,使用在线网站TMHMM(https://www.psc.edu/user-resources/software/tmhmm)预测VlCKX4蛋白跨膜结构,使用在线网站PSORT (https://services.healthtech.dtu.dk/service.php?TargetP-2.0)预测的亚细胞定位。将已经获得的VlCKX4氨基酸序列在NCBI数据库进行BLAST比对,并使用MAGA7软件将葡萄的序列与其他植物的序列进行ClustalW比对,采用邻接法(neighbor-joining,NJ)构建系统发育树,自展值(Boot-strap)设置为1 000。
1.2.7 基因转录因子共表达关系预测 使用R包(GINE3),并使用随机森林(Random Forest)模型,计算基因和转录因子之间表达量的相关性,并将该相关性值体现在靶向关系图中转录因子的节点大小上,基因与转录因子之间相关性越强,节点越大;反之,相关性越弱,节点越小。
2 结果
2.1 VlCKX4克隆及生物信息学分析
前期通过对细胞分裂素促进坐果的转录组进行分析发现,细胞分裂素氧化酶/脱氢酶(CKXs)基因家族在葡萄坐果过程中发挥重要作用,其中在处理和对照组前期差异最显著。为进一步对的功能进行探究,使用FL-F/R引物扩增到全长(图1-A)。开放阅读框(ORF)长度为1 566 bp,编码521个氨基酸,具有CKXs特征结构域-细胞分裂素结合位点(CK-binding)和核黄素腺嘌呤二核苷酸(FAD)(图2-A)。氨基酸序列分析发现,VlCKX4属于稳定蛋白,分子质量为58.1 kD,理论等电点(PI)为6.68,不稳定系数和脂肪系数分别为32.42、95.05。亚细胞定位预测结果表明VlCKX4所在的位置属于胞外。进化树结果显示,VlCKX4与茶树、烟草等在同一分枝,说明葡萄VlCKX4和茶树的CKX同源性最高,其次是烟草(图2-B)。

Marker: DL2000
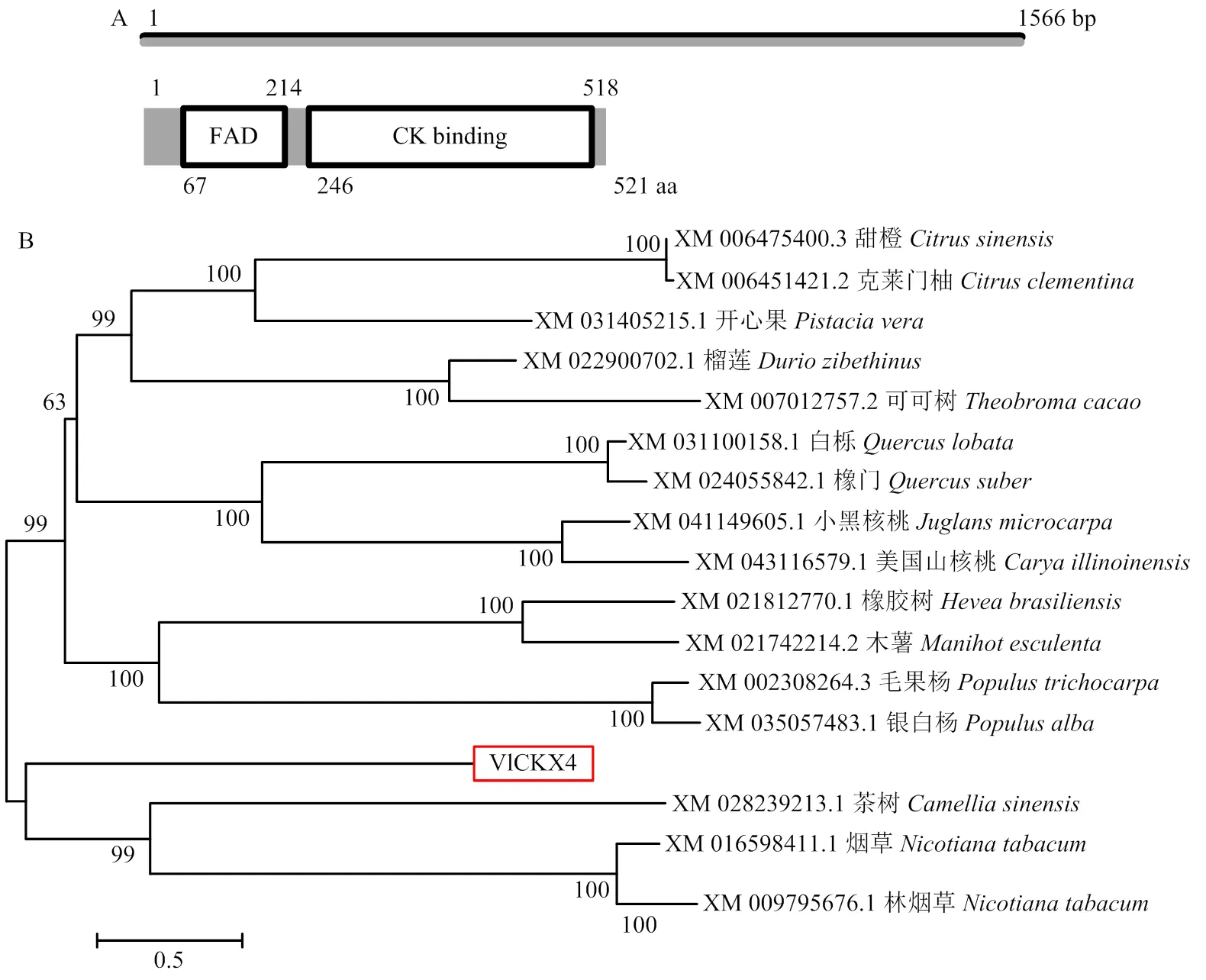
图2 VlCKX4结构示意图和进化树
2.2 VlCKX4表达特性分析
检测‘巨峰’根、茎、叶、花、卷须中的表达情况,结果显示在葡萄花序中高表达,其次是叶和茎,在卷须中表达量最低(图3-A)。检测自然发育时期和CPPU处理后同一时期的果实中的表达情况,结果显示,在CPPU处理后表达受到显著诱导,在处理后第2天(D2)表达量达到峰值,在处理后第1天(D1)、处理后第4天(D4)、处理后第8天(D8)均显著上调(图3-B)。而Lov处理后葡萄呈现下调趋势,并且在D4和D8阶段显著下调(图3-C)。
2.3 VlCKX4启动子克隆及顺式作用元件分析
使用引物Pro-F/R克隆得到了5′端上游2 075 bp序列(图1-B)。使用PlantCARE网站对启动子序列进行预测分析,结果表明该启动子区域存在多个顺式作用元件,除了核心的元件TATA-box以及增强元件CAAT-box外,还包括节律调节、低温逆境响应等元件。在的启动子区域发现多种植物激素的响应元件,包括脱落酸(ABA)、生长素、赤霉素(GA3)、茉莉酸甲酯(MeJA)等激素的响应元件,其中跟茉莉酸甲酯响应相关的元件数量最多,其次是跟脱落酸响应相关的元件(表3)。
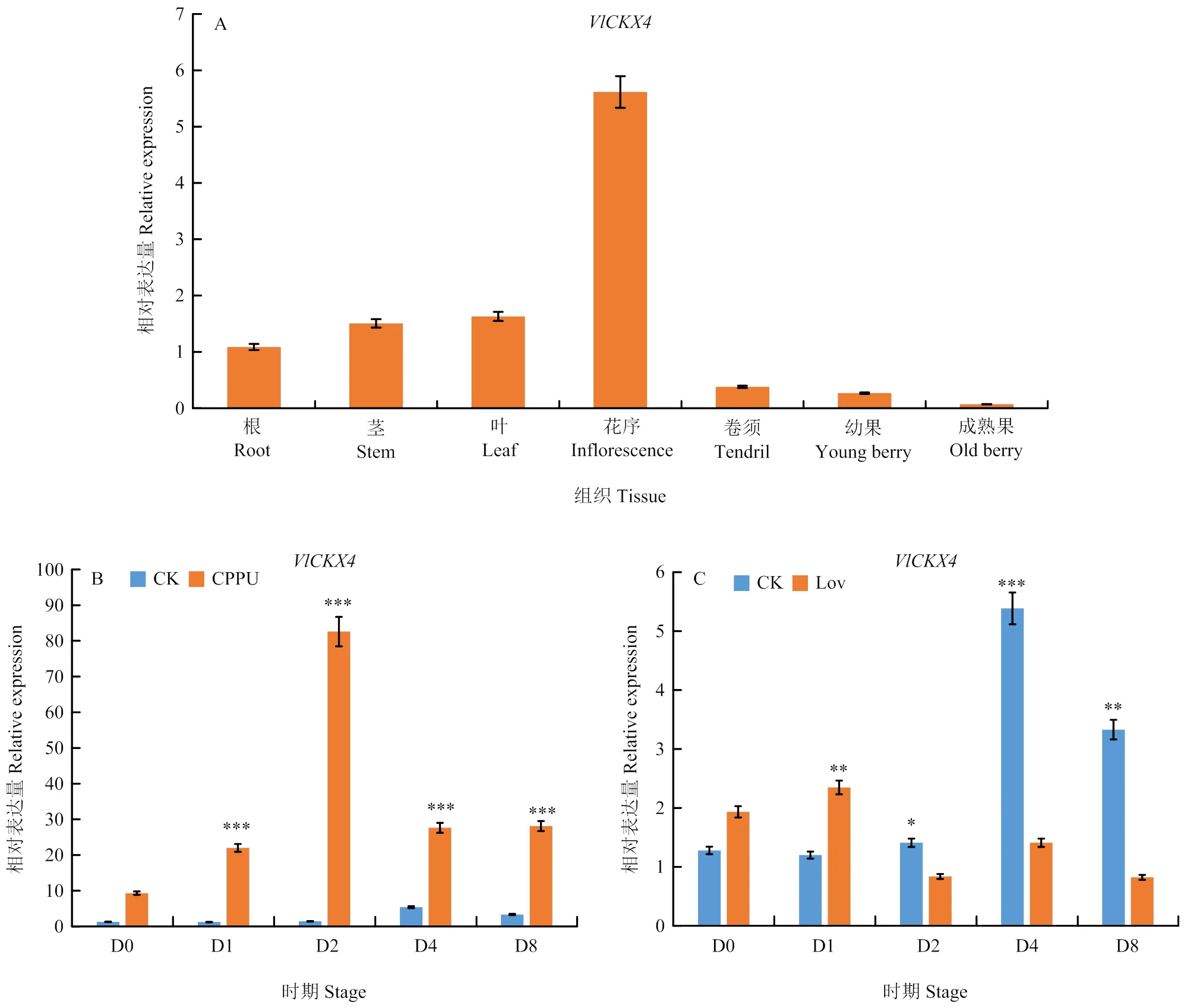
*: P<0.05; **: P<0.01; ***: P<0.001

表3 VlCKX4启动子顺式作用元件预测
2.4 VlCKX4启动子活性分析
与对照相比,显著增强了GUS基因的活性。此外,分别用GA3、IBA、ABA、CPPU、MeJA等植物生长调节剂喷施到烟草叶片中并进行GUS染色,结果显示的启动子活性受到上述这些植物生长调节剂的影响(图4)。其中CPPU对它的启动子增强效果最为明显,其次是ABA。

图4 植物生长调节剂处理后GUS组织化学染色
2.5 靶向VlCKX4的转录因子调控网络预测
利用PlantTFDB和CisBP数据库对靶向的转录因子进行预测,以10-5为阈值截取,共获得27个可能参与葡萄坐果过程的转录因子(表2),绘制Treemap图显示调控的转录因子类型主要有MYB类、WRKY类、DOF类等,其中MYB类最多,其次是WRKY、MAKC和DOF类(图5-A)。将这些转录因子信息导入Gephi0.9.2软件,个数大于1的每一类转录因子赋予一种颜色。并且依据转录组数据中的FPKM值,利用R包GINE3中的随机森林模型计算出与这些转录因子的共表达系数,系数越高,共表达关系越强。节点的大小反映该转录因子与基因共表达关系的强弱。结果表明,对靶向效应强且与具有较强共表达关系的是的分别为、、、、和(图5-B)。为了进一步缩小范围,依据CPPU转录组数据,挑选在坐果过程中差异表达(log2FC≥1或log2FC≤-1)的转录因子,并分别以-adjust值和log2FC(Fold change)值为依据绘制热图,结果显示、、、、、、、在转录组中差异显著(图5-C)。综上,可能受到多种转录因子的调控,同时结合靶向关系预测和转录组数据,、、为关键候选转录因子,可能在CPPU促进坐果的过程中起关键的调控作用。
3 讨论
3.1 VlCKX4参与细胞分裂素介导的葡萄坐果
细胞分裂素在调节植物生长发育方面发挥重要作用。CKX是在体内发挥不可逆降解细胞分裂素功能的一种酶,因此,这个酶对于维持植物体内细胞分裂素的稳定十分重要。CKXs家族的特征结构域为CK结合结构域以及FAD结合结构域[31],分别位于C端和N端。本研究对的氨基酸序列进行分析,发现它具有完整的两个特征结构域,这表明可以编码有功能的蛋白,并因此参与到细胞分裂素的生物代谢进程。同时,进化树分析结果表明在进化过程中具有比较高的保守性。
课题组前期分别使用CPPU和Lov处理‘巨峰’葡萄花序,CPPU处理后坐果率显著提高,Lov处理后坐果率显著降低。与其相对应地,的表达水平在CPPU处理后显著升高,在Lov处理后显著降低。此外,Lov处理后呈现出先上升后下降的趋势,在D1上调,D2、D4、D8下调,表明不仅受细胞分裂素调控,还受到其他因素的诱导,因此,该基因表达量在细胞分裂素含量下降之后,仍能有所上升。
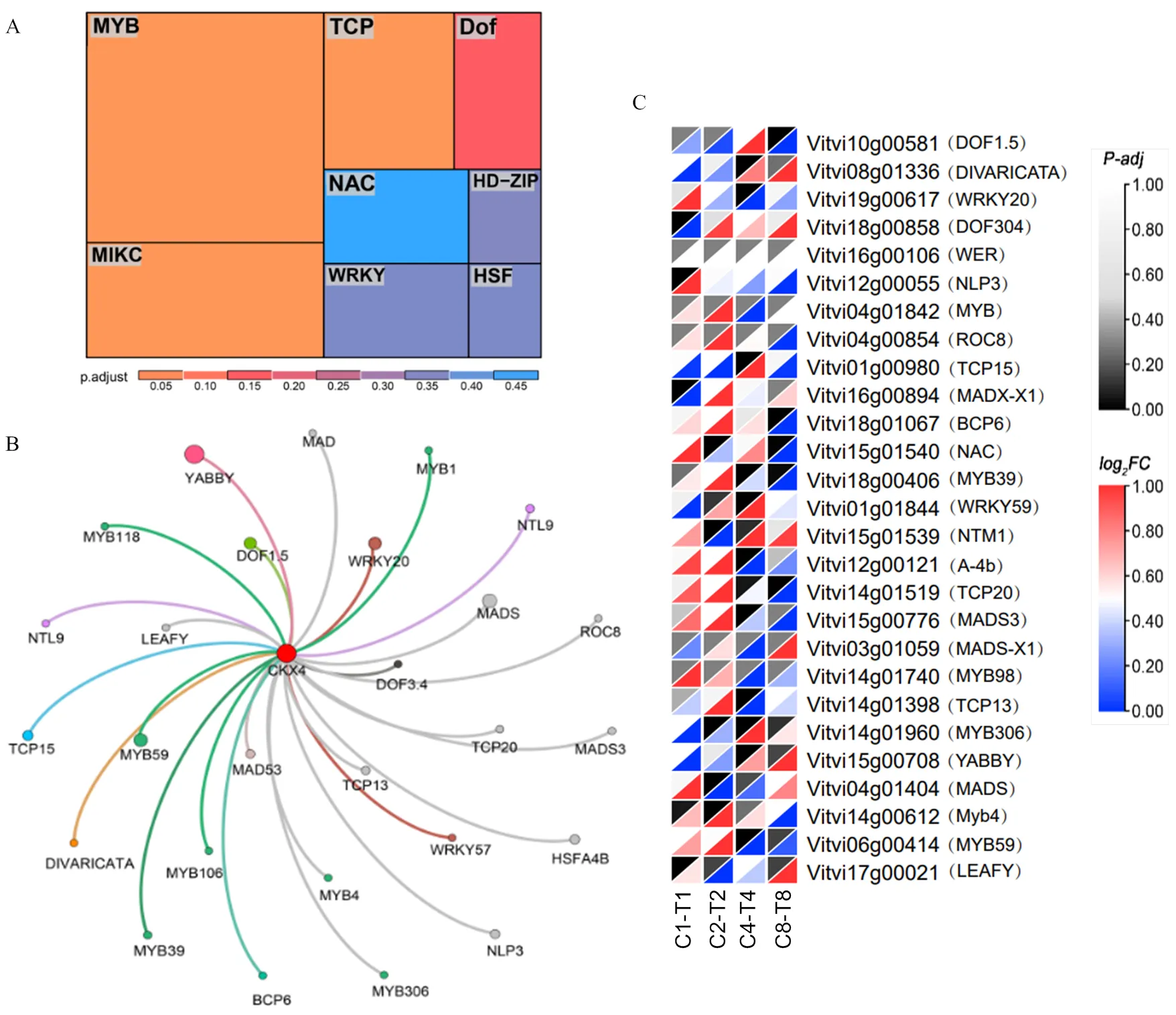
A:调控VlCKX4的转录因子富集,面积越大,代表该类型转录因子越多,颜色代表调控关系的强弱;B:VlCKX4的靶向关系图,圆圈与圆圈之间的连线代表具有靶向关系,相同的颜色代表同种类型转录因子,少于一个的统一使用灰色。共表达关系的强弱体现在节点的大小上,节点越大,该转录因子与VlCKX4的共表达关系越强,反之亦然
3.2 VlCKX4响应多种激素处理,参与到激素串扰过程
植物基因表达调控包括转录和翻译水平,前者主要是由顺式作用元件和转录因子介导[32-34],顺式作用元件已经被证明与基因响应外界多种刺激相关[35-37]。因此,对于启动子区域的研究对了解基因转录调控机制至关重要。启动子是基因结构的重要组成部分,影响了基因的转录起始时间、表达水平以及空间位置。本研究克隆得到起始密码子ATG上游2 075 bp的启动子序列,顺式作用元件分析发现该基因包含多个与植物激素响应相关的元件。除此之外,还有环境相关的元件,这暗示的表达可能受外界激素以及环境变化的影响,这与大多数CKXs基因家族的研究结果一致。在外源施加CPPU后,的启动子活性与对照相比显著增强,说明能够明显响应外源CPPU处理,这与CPPU处理之后的表达水平提高结果一致,也表明参与到细胞分裂素介导的促进葡萄坐果的过程。之前有研究发现细胞分裂素与生长素、赤霉素之间存在一定的串扰现象[38],在本研究中,使用赤霉素、生长素等激素处理也能使的启动子活性得到增强,也暗示受这些激素的影响,参与到多种激素通路中发挥作用。
3.3 MYB39、MYB306等是潜在靶向VlCKX4的转录因子
利用基因之间的共表达关系对植物中存在的调控关系进行转录调控预测,已经成为研究基因和转录因子调控关系的一种重要手段。在葡萄冷应激反应中,通过共表达网络分析找到可能是的下游靶点,参与到该应激过程[39]。此外,在葡萄响应干旱胁迫研究中,也通过转录结合位点预测,筛选到15个可能调控AQPs的关键转录因子[40]。本研究通过分析靶向转录因子的调控网络和转录因子结合启动子的预测位点,筛选出27个可能调控的关键转录因子,它们分别属于MYB、WRKY、DOF、MAKC转录因子家族,MYB作为植物中最大的转录因子家族之一,与植物生长发育和其他生理过程相关[41]。烟草中15个CKX基因的系统发育关系已经被阐明,通过对它们启动子上游分析发现在CKX中也含有大量的MYB顺式作用元件,且对外源ABA和盐胁迫都有反应[42]。此外,拟南芥在细胞分裂素反应中的全基因组表达谱分析结果表明,细胞分裂素在早期反应期间诱导不同类型的转录因子,其中就包括两种MYB和两种WRKY[39]。通过共表达关系筛选到的转录因子进一步结合转录组表达量数据进行缩小范围,最终锁定、、、、和这六个转录因子,作为调控的关键转录因子后续可进行功能验证。
4 结论
对CPPU促进坐果转录组分析,筛选到了关键的。通过对其启动子区域进行克隆和分析,发现该基因受赤霉素、脱落酸等激素的显著诱导。此外,通过转录预测手段和转录组表达量相结合,推测、、和可能在CPPU促进坐果的过程中起关键的调控作用。
[1] OKATAN V. Antioxidant properties and phenolic profile of the most widely appreciated cultivated berry species: A comparative study. Folia Horticulturae, 2020, 32(1): 79-85.
[2] SOVAK M. Grape extract, resveratrol, and its analogs: a review. Journal of Medicinal Food, 2001, 4(2): 93-105.
[3] YU Y H, BIAN L, YY K K, YANG S D, GUO D L.functions as a transcriptional activator and enhances drought stress resistance via suppression of reactive oxygen species. Journal of Berry Research, 2020, 10(4): 547-558.
[4] YU Y H, MENG X X, GUO D L, YANG S D, ZHANG G H, LIANG Z C. Grapevine U-box E3 ubiquitin ligasenegatively regulates fruit ripening by facilitating abscisic- aldehyde oxidase degradation. Plant and Cell Physiology, 2020, 61(12): 2043-2054.
[5] GUO D L, XI F F, YU Y H, ZHANG X Y, ZHANG G H, ZHONG G Y. Comparative RNA-Seq profiling of berry development between table grape ‘Kyoho’ and its early-ripening mutant ‘Fengzao’. BMC Genomics, 2016, 17(1): 795.
[6] ZABADAL T J, BUKOVAC M J. Effect of CPPU on fruit development of selected seedless and seeded grape cultivars. HortScience, 2006, 41(1): 154-157.
[7] QUINET M, BUYENS C, Dobrev P I, MOTYKA V, JACQUEMART A L. Hormonal regulation of early fruit development in european pear (cv. ‘Conference’). Horticulturae, 2019, 5(1). doi: 10.3390/horticulturae5010009.
[8] SARKAR M D, SHAH M, KABIR M H. Flower and fruit setting of summer tomato regulated by plant hormones. Applied Science Reports, 2014, 7: 117-120.
[9] HWANG I. Cytokinin signaling networks. Annual review of plant biology, 2012, 63: 353-380.
[10] Werner T, Motyka V, Laucou V, Smets R, Van Onckelen H, Schmülling T. Cytokinin-deficient transgenicplants show multiple developmental alterations indicating opposite functions of cytokinins in the regulation of shoot and root meristem activity. The Plant Cell, 2003, 15(11): 2532-2550.
[11] BECHTOLD N, BOUCHEZ D. In planta Agrobacterium-mediated transformation of adultplants by vacuum infiltration. Gene Transfer to plants, 1995:19-23.
[12] KRIZEK B A. Making bigger plants: Key regulators of final organ size. Current Opinion in Plant Biology, 2009, 12(1): 17-22.
[13] KOPECNY D, BRIOZZO P, POPELKOVA H, SEBELA M, KONCITIKOVA R, SPICHAL L, NISLER J, MADZAK CATHERINE, FREBORT I, LALOUE M, HOUBA H N. Phenyl- and benzylurea cytokinins as competitive inhibitors of cytokinin oxidase/dehydrogenase: A structural study. Biochimie, 2010, 92(8): 1052-1062.
[16] SMITH R. Effects of CPPU, a synthetic cytokinin, on fruit set and yield. Sonoma Ctry Grape Day, 2008, 7: 2008.
[17] CURRY E A, GREENE D W. CPPU influences fruit quality, fruit set, return bloom, and preharvest drop of apples. HortScience, 1993, 28(2): 115-119.
[18] NIMBOLKAR P K, RAI P N, MISHRA D S, Singh S K, SINGH A K, KUMAR J. Effect of CPPU, NAA and salicylic acid on vegetative growth, fruit retention and yield of pear [(Burm.) Nakai] cv Gola. Environment and Ecology, 2016, 34(2): 462-465.
[19] ASSAD S A. Effect of CPPU on fruit set, drop, yield and fruit quality of Hollywood and Santarosa plum cultivars. Egyptian Journal of Horticulture, 2013, 2(40): 187-204.
[20] CHEN L, ZHAO J, SONG J C, JAMESON P E. Cytokinin dehydrogenase a genetic target for yield improvement in wheat. Plant Biotechnology Journal, 2020, 18 (3): 614-630.
[21] ANTOGNOZZI E, FAMIANI F, PROIETTI P, TOMBESI A, FRENGUELLI G. Effect of CPPU (Cytokinin) treatments on fruit anatomical structure and quality in actinidia deliciosa. Acta Horticulturae, 1997, 444(2): 459-465.
[22] LEWIS D H, BURGE G K, HOPPING M E, JAMESON P E. Cytokinios and fruit development in the kiwifruit () effects of reduced pollination and CPPU application. Horticultural Science, 1996, 98(1): 187-195.
[23] KÖLLMER I, NOVÁK O, STRNAD M, SCHMÜLLING T, WERNER T. Overexpression of the cytosolic cytokinin oxidase/ dehydrogenase () fromcauses specific changes in root growth and xylem differentiation. The Plant Journal, 2014, 78(3): 359-371. doi: 10.1111/tpj.12477.
[24] ASHIKARI M, SAKAKIBARA H, LIN S, YAMAMOTO T, TAKASHI T, NISHIMURA A, ANGELES E R, QIAN Q, KITANO H, MATSUOKA M. Cytokinin oxidase regulates rice grain production. Science, 2005, 309(5735): 741-745. doi: 10.1126/science. 1113373.
[25] TSAI Y C, WEIR N R, HILL K, ZHANG W J, KIM H J, SHIU S H, SCHALLER G E, KIEBER J J. Characterization of genes involved in cytokinin signaling and metabolism from rice. Plant Physiology, 2012, 158(4): 1666-1684. doi: 10.1104/pp.111.192765.
[26] ZHANG W, PENG K X, CUI F B, WANG D L, ZHAO J Z, ZHANG Y H, YU N N, WANG Y Y, ZENG D L, WANG Y H, ZHENG Z K, ZHANG K W. Cytokinin oxidase/dehydrogenasecoordinates source and sink relationship in rice by simultaneous regulation of leaf senescence and grain number. Plant Biotechnology Journal, 2020, 19(2): 335-350.
[27] YU Y H, LI X F, YANG S D, BAN L, YU K K, MENG X X, LIU H N, PEI M S, WEI T L, GUO D L. CPPU-induced changes in energy status and respiration metabolism of grape young berry development in relation to Berry setting. Scientia Horticulturae, 2021, 283: 110084.
[28] YU K K, YU Y H, BIAN L, NI P Y, YANG Y J. Genome-wide identification of cytokinin oxidases/dehydrogenase (CKXs) in grape and expression during berry set. Scientia Horticulturae, 2021, 280(223): 109917.
[29] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
LI H S. Principles and Techniques of Plant Physiological and Biochemical Experiments. Beijing: Higher Education Press, 2000. (in Chinese)
[30] CLOUGH S J, BENT A F. Floral dip: A simplified method for-mediated transformation of. The Plant Journal, 1998, 16(6): 735-743. doi: 10.1046/j.1365-313x.1998. 00343.x.
[31] GU R L, FU J J, GUO S, DUAN F Y, WANG Z K, MI G H, YUAN L X. Comparative expression and phylogenetic analysis of maize cytokinin dehydrogenase/oxidase (CKX) gene family. Journal of Plant Growth Regulation, 2010, 29(4): 428-440. doi: 10.1007/s00344- 010-9155-y.
[32] LIU L X, WANG W Q, YANG J, ZHANG Y, ZHANG G Y, MA Z Y, WANG X F. Molecular cloning ofpromoters fromand G. hirsutum and functional analysis inresistance. Plant Cell, Tissue and Organ Culture, 2018, 135(3): 535-544.
[33] MENG X B, ZHAO W S, LIN R M, WANG M, PENG Y L. Identification of a novel rice bZIP-type transcription factor gene, OsbZIP1, involved in response to infection of Magnaporthe grisea. Plant Molecular Biology Reporter, 2005, 23(3): 301-302. doi: 10.1007/BF02772762.
[34] WANG C H, GAO G, CAO S X, XIE Q J, QI H Y. Isolation and functional validation of the CmLOX08 promoter associated with signalling molecule and abiotic stress responses in oriental melon,var.Makino. BMC Plant Biology, 2019, 19(1): 75. doi: 10.1186/s12870-019-1678-1.
[35] CHEN C L, YUAN F, LI X Y, MA R C, XIE H. Jasmonic acid and ethylene signaling pathways participate in the defense response of Chinese cabbage to Pectobacterium carotovorum infection. Journal of Integrative Agriculture, 2021, 20(5): 1314-1326.
[36] VLOT A C, DEMPSEY D A, KLESSIG D F. Salicylic Acid, a multifaceted hormone to combat disease. Annual Review of Phytopathology, 2009, 47: 177-206. doi: 10.1146/annurev.phyto. 050908.135202.
[37] LI F F, ZHANG L, JI H K, XU Z Y, ZHOU Y, YANG S S. The specific W-boxes ofpromoter bound byare involved in drought stress response in wheat. Plant Science, 2020, 296: 110460. doi: 10.1016/j.plantsci.2020.110460.
[38] CONG L, WU T, LIU H T, WANG H B, ZHANG H Q, ZHAO G P, WEN Y, SHI Q R, XU L F, WANG Z G. CPPU may induce gibberellin-independent parthenocarpy associated with
[39] WANG Z M, WONG D C J, WANG Y, XU G Z, REN C, LIU Y F, KUANG Y F, FAN P G, LI S H, XIN H P, LIANG Z C. GRAS-domain transcription factor PAT1 regulates jasmonic acid biosynthesis in grape cold stress response. Plant Physiology, 2021, 186(3): 1660-1678. doi: 10.1093/plphys/kiab142.
[40] 杨盛迪, 郭大龙, 裴茂松, 刘海楠, 韦同路, 余义和. 干旱胁迫下葡萄AQP基因家族的鉴定及转录调控网络预测. 果树学报, 2021, 38(10): 1638-1652.
YANG S D, GUO D L, PEI M S, LIU H N, WEI T L, YU Y H. Identification of grapevine AQP family and prediction for transcriptional regulatory network under drought stress. Journal of Fruit Science, 2021, 38(10): 1638-1652. (in Chinese)
[41] 牛义岭, 姜秀明, 许向阳. 植物转录因子MYB基因家族的研究进展. 分子植物育种, 2016(8): 2050-2059.
NIU Y L, JIANG X M, XU X Y. Reaserch advances on transcription factor MYB gene family in plant. Molecular Plant Breeding, 2016(8): 2050-2059. (in Chinese)
[42] CHEN W, Wang G, Yi M. Whole-Genome identification and salt-and aba-induced expression trends of theCKX gene family. Research Square, 2021: 1-17.
Analysis ofExpression Characteristics and Prediction of Transcriptional Regulation in Grape
LI XuFei, YANG ShengDi, LI SongQi, LIU HaiNan, PEI MaoSong, WEI TongLu, GUO DaLong, YU YiHe*
College of Horticulture and Plant Protection, Henan University of Science and Technology/Henan Engineering Technology Research Center of Quality Regulation and Controlling of Horticultural Plants, Luoyang 471023, Henan
【】The cytokinin dehydrogenase/oxidaseand its promoter in grape () were cloned to analyze the expression characteristics, promoter activity and transcription factor prediction, so as to provide a basis for the molecular mechanism thatinvolved in cytokinin-mediated berry set in grape. 【】The gene sequence of cytokinin oxidase/dehydrogenase 4 () in Kyoho grape (×) was studied by bioinformatics method. The gene and its promoter were cloned by PCR. The expression characteristics ofwere analyzed by real-time quantitative PCR (qRT-PCR). GUS activity assay was used to analyze the promoter activity. The transcriptional regulatory relationship ofwas predicted by PlantTFDB, CisBP databases, and the output results were visualized by Gephi software. 【】The total length ofwas 1 582 bp, which contained 1 566 bp open reading frame (ORF), encoded 522 amino acids, and had the family characteristic FAD domain and cytokinin binding (CK-binding) domain. qRT-PCR results showed thatwas highly expressed in inflorescence and leaf, but the expression of tendril was lowest. The expression ofdecreased first and then increased after treatment with cytokinin (CPPU), while the expression ofincreased first and then decreased after treatment with the cytokinin inhibitor lovastatin (Lov). Cis-element analysis showed that thepromoter contained response elements of methyl jasmonate (MeJA) and other hormones. GUS histochemical staining showed thatresponded to the hormones. Predictive analysis of transcriptional regulation showed that MYB, DOF and WRKY transcription factors were involved in transcriptional regulation of. Combined with transcriptomic expression data and coexpression relation,,andwere identified as key candidate transcription factors. 【】was induced by CPPU and participates in the process of promoting grape berry set, during which prediction was regulated by transcription factors, such as,and.
Kyoho; Cytokinin;; promoter activity; regulation

2022-03-19;
2022-07-19
国家自然科学基金(32072517)、河南省高校科技创新人才支持计划(21HASTIT035)、河南省高校科技创新团队支持计划(21IRTSTHN021)、洛阳市科技发展计划(2101102A)
李旭飞,E-mail:lixufei8023 @163.com。通信作者余义和,E-mail:yuyihe@haust.edu.cn
(责任编辑 赵伶俐)
