芒果MiZAT10A和MiZAT10B功能分析
2023-02-01莫文静朱嘉伟何新华余海霞江海玲覃柳菲张艺粒李雨泽罗聪
莫文静,朱嘉伟,何新华,余海霞,江海玲,覃柳菲,张艺粒,李雨泽,罗聪
芒果MiZAT10A和MiZAT10B功能分析
莫文静,朱嘉伟,何新华,余海霞,江海玲,覃柳菲,张艺粒,李雨泽,罗聪
广西大学农学院/亚热带农业生物资源保护与利用国家重点实验室/植物科学国家级实验教学示范中心,南宁 530004
【】锌指蛋白(zinc finger protein,ZFP)在植物非生物胁迫应答中起重要的作用,研究两个锌指蛋白基因和转入拟南芥对盐、干旱、重金属以及外源激素等非生物胁迫的应答,为抗逆育种提供理论依据。【】利用在线软件PLACE和MEME分别对芒果和进行启动子顺式作用元件以及motif预测和分析,并利用TBtools软件和‘四季蜜芒’基因注释文件(GFF文件,未公开)绘制染色体定位图;通过实时荧光定量分析和的组织表达模式;构建芒果和超量表达载体,采用农杆菌花序浸染法转化模式植物拟南芥,观察并记录转基因拟南芥开花表型以及在盐、干旱、重金属以及外源激素脱落酸和赤霉素处理下的根生长情况。【】启动子顺式元件分析显示,两个基因的启动子区域都有许多光响应元件、激素响应元件和非生物胁迫响应元件。表达模式分析显示,与在芽和花中表达水平最高。和分别获得了9株和14株转基因拟南芥,开花表型分析显示,和转基因拟南芥提早开花。在盐胁迫、干旱胁迫和重金属胁迫以及GA3和ABA激素处理下,两个超量表达转基因拟南芥的根长显著长于WT。【】超量表达的与可使转基因拟南芥提前开花并提高其对盐、干旱、重金属及外源激素GA3和ABA的抗性。
芒果;非生物胁迫;锌指蛋白;表达模式;基因功能分析
0 引言
【研究意义】芒果(L.)是著名的热带亚热带水果,逆境胁迫影响芒果的开花、生长发育、产量以及果实品质,严重的胁迫会导致芒果死亡。常见的非生物胁迫包括低温、盐、干旱、重金属等[1]。因此,研究并挖掘芒果与非生物胁迫有关的基因,为后续芒果的抗性育种提供理论依据。【前人研究进展】锌指蛋白(zinc finger protein,ZFP)是一类具有‘指状’结构域的III型转录因子,广泛存在于真核生物中,人类基因组中甚至有近1%的序列含有这种结构[2]。锌指蛋白具有特殊二级结构的小肽域,其分类依据为Cys和His残基的数目和位置,目前研究得最广泛和最深入的锌指蛋白类型是C2H2型锌指蛋白,也称为TFIIIA型或Kruppel-like型[3-4]。C2H2型锌指蛋白在植物生长发育、抗病以及逆境胁迫中都发挥了重要的作用,并参与了GA信号传导、ABA信号传导、CBF途径平行的低温信号转导途径以及光和信号传导等多种信号途径[5-6]。目前,拟南芥[6]、水稻[7]、玉米[8]、芸薹属蔬菜[9]、黄瓜[10]、番木瓜[11]、葡萄[12]等多种植物的C2H2型锌指蛋白基因被陆续分离鉴定。C2H2型锌指蛋白是植物生长发育中的主要调控者,拟南芥直接或间接影响器官脱落的过程[13];番茄可以与互作,通过调控的表达影响番茄的开花时间[14];在苹果中,通过降低的表达,促进叶片的衰老[15];参与盐胁迫和渗透胁迫反应[16];受到调节H2调控的抑制脂质过氧化和活性氧(ROS)爆发,提高耐盐性[17];过表达转基因苹果苗、愈伤组织及拟南芥均表现出降低干旱抗性的表型[15];超表达转基因柠檬使ROS维持在较低水平,增强了植株抗寒能力[18];马铃薯可能通过ABA依赖途径来参与干旱和盐胁迫的反应[19]。【本研究切入点】C2H2型锌指蛋白在植物成花调控、非生物胁迫响应等方面起重要的调控作用。笔者课题组前期通过cDNA-SCOT差异显示获得了两个C2H2型锌指蛋白基因,命名为()和()[20],表达模式分析显示,两个基因均受低温、干旱和盐胁迫的诱导[21],但其功能未知。【拟解决的关键问题】构建超量表达载体,将芒果两个和分别转入模式植物拟南芥中,探讨和在转基因拟南芥成花和逆境胁迫应答中的功能。
1 材料与方法
1.1 材料与菌株
芒果试验材料栽培于广西大学农学院果树标本园。芒果童期样品采集于2年生‘四季蜜芒’幼树的叶、茎、芽,成年期样品采集于16年生‘四季蜜芒’的叶、茎、花、幼果(花后20 d)、成熟果(花后100 d)。采样时间为2021年10月12日下午5:00—6:00,所有试验材料采集后立刻用液氮速冻,写好标签后放入-80℃超低温冰箱中保存备用。拟南芥为哥伦比亚野生型拟南芥。
1.2 生物信息学分析
利用软件TBtools和基因组GFF文件绘制芒果和在‘四季蜜芒’品种中的染色体定位图;利用MEME(https://meme-suite.org/ meme/tools/meme)对MiZAT10A和MiZAT10B蛋白质序列保守基序进行分析,参数设置为基序长度8—100个氨基酸,寻找3个基序;利用在线数据库PLACE(https://www.dna.affrc.go.jp/PLACE/?action= newplace)预测和在‘四季蜜芒’中ATG上游-2.0 kb区域的启动子顺式作用元件。
1.3 MiZAT10A和MiZAT10B的组织表达分析
为了研究芒果和的组织表达模式,采用美基公司的多糖多酚植物总RNA小提试剂盒提取芒果不同组织的总RNA,然后逆转录为cDNA,用于后续试验。用在线软件Primer 3.0 Plus(https://www. bioinformatics.nl/cgi-bin/primer3plus/ primer3plus.cgi)设计特异引物(表1),通过实时荧光定量qRT-PCR对和的表达进行检测,采用2-ΔΔCT方法对定量数据进行处理,以芒果为内参基因[22],使用IBM SPSS Statistics 24.0进行数据处理。qRT-PCR试验使用TaKaRa公司的SYBR Green试剂,仪器为Applied Biosystems 7500实时定量PCR仪。

表1 引物序列
1.4 转基因拟南芥的获取、鉴定及培养
将和的全长ORF构建到35S启动子启动的pBI121载体中,采用农杆菌介导的花序侵染法侵染野生型拟南芥[23],通过抗生素筛选和PCR检测鉴定转基因阳性植株,其中DNA提取参照余海霞等[24]改良的方法。
1.5 转基因拟南芥阳性植株成花表型试验
以野生型拟南芥(WT)和转空载体拟南芥(pBI1121)为对照,观察转基因纯合T3代植株的表型,统计第一朵花开放的时间、抽薹时(0.5 cm)的莲座叶数以及第一朵花开花时的植株高度。每个株系统计12棵苗,结果采用Excel进行数据处理,SPSS19.0进行方差分析。以纯合株系的叶片组织为材料提取RNA,逆转录为cDNA并统一稀释浓度为50 ng·µL-1,保存在-20℃。以拟南芥基因(AT3G18780)为内参基因通过半定量法检测芒果基因在转基因拟南芥中的表达水平。反应体系为:Easy Buffer 2.5 µL、AtACTIN2u/d或MiZAT10Au/d或MiZAT10Bu/d 1 µL,DNA 2 µL,dNTP 0.5 µL、Taq 0.25 µL,超纯水补至25 µL。反应程序:95℃ 3 min;95℃ 20 s,56℃ 20 s,72℃ 20 s,30个循环;72℃ 5 min。1.5%琼脂糖电泳检测。
1.6 逆境胁迫处理
逆境胁迫下拟南芥的根长试验:完成消毒播种后的拟南芥经过2 d的4℃春化,培养3 d,然后转入逆境1/2MS培养基的方皿中,方皿竖直放置于培养箱中培养5 d后观察记录野生型和转基因拟南芥的根长表型,并拍照记录,每个株系5棵单株,每个处理做3个重复。逆境胁迫处理所用的试剂及浓度设计如下:氯化钠(NaCl)模拟盐胁迫,浓度为0和150 mmol∙L-1;甘露醇(mannitol)模拟干旱胁迫,浓度为0和400 mmol·L-1;激素类有0、5 μmol·L-1脱落酸(ABA)和10 μmol·L-1赤霉素(GA3);氯化铝(AlCl3)模拟重金属胁迫,浓度为0和50 μmol·L-1。
2 结果
2.1 MiZAT10A和MiZAT10B生物信息学分析
定位于19号染色体上,定位于10号染色体上(图1)。对和进行保守基序分析发现,两个基因高度相似的基序可能和其功能一致有关。
分别选取和ATG上游-2.0 kb区域的启动子序列进行元件分析,两个基因均包含多个光响应元件、脱落酸响应元件,赤霉素响应元件、水杨酸响应元件、茉莉酸响应元件和逆境胁迫响应元件等(图2),说明这两个表达受光、温度、盐胁迫、干旱胁迫等环境因子的影响;同时,脱落酸和赤霉素等多种激素也对其表达产生影响,从而共同调控芒果的生长发育。
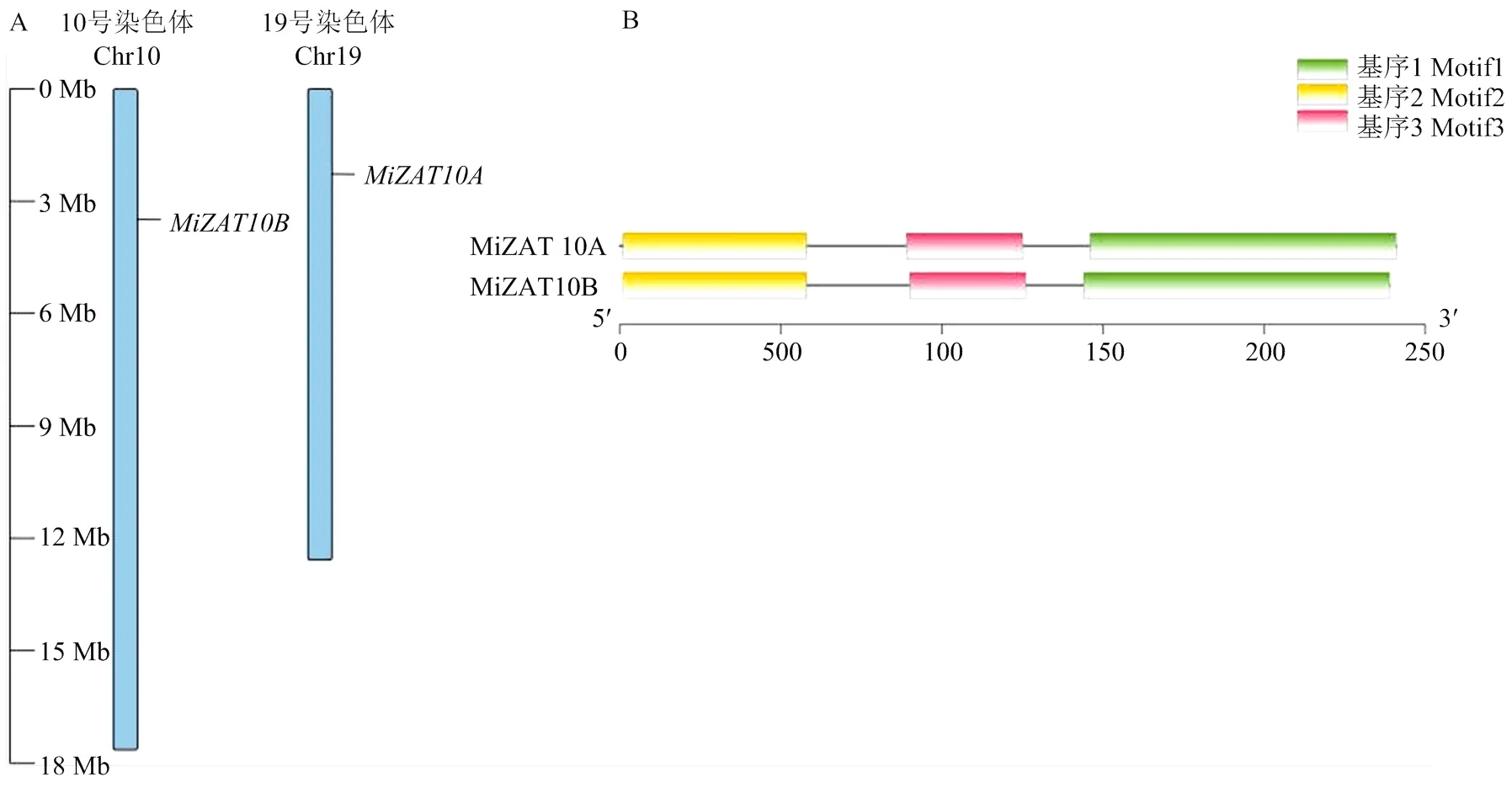
A:MiZAT10A和MiZAT10B的染色体定位图;B:MiZAT10A和MiZAT10B蛋白保守基序分布图

图2 MiZAT10A和MiZAT10B启动子的顺式元件分析
2.2 MiZAT10A和MiZAT10B的组织表达分析
为了明确和在‘四季蜜芒’不同生长发育时期的表达特性,利用实时荧光定量PCR对和的表达模式进行分析(图3)。结果显示,两个在‘四季蜜芒’中表达模式类似,和在营养组织和生殖组织中均表达,其中在童期的顶芽和成年期的花中表达水平最高,而在成年期的茎中表达水平最低。
2.3 MiZAT10A和MiZAT10B转基因对拟南芥开花的影响
采用花序浸染法将和转入模式植物拟南芥中,通过PCR检测共获得9株转基因株系和14株转基因株系。半定量PCR分析显示,和在野生型和转pBI121空载体植株中表达水平为零,而在各个转基因株系中,和可以正常表达(图4)。

A:MiZAT10A组织表达;B:MiZAT10B组织表达。不同小写字母代表在P<0.05水平上差异显著。下同

A1:过表达MiZAT10A转基因拟南芥开花图;A2:过表达MiZAT10A转基因拟南芥开花数据;B1:过表达MiZAT10B转基因拟南芥开花图;B2:过表达MiZAT10B转基因拟南芥开花数据 A1: Flowering photos of overexpressed MiZAT10A gene in Arabidopsis thaliana; A2: Flowering data of overexpressed MiZAT10A gene in Arabidopsis thaliana; B1: Flowering photos of overexpressed MiZAT10B gene in Arabidopsis thaliana; B2: Flowering data of overexpressed MiZAT10B gene in Arabidopsis thaliana
分别选取的OE-1、OE-4和OE-8以及的OE-7、OE-15和OE-31作为进一步研究的对象,以野生型拟南芥(WT)和转空载体pBI121拟南芥为对照,对其开花时间进行统计分析。结果显示,阳性对照和阴性对照植株的开花时间分别为27.1 d和26.4 d,而超量表达的35S::MiZAT10A和35S::MiZAT10B转基因植株的开花时间都平均约为24.5 d。因此,转芒果和可以诱导转基因拟南芥提早成花。
2.4 MiZAT10A和MiZAT10B转基因植株对逆境胁迫应答的影响
为确定超量表达的锌指蛋白基因是否能提高抗逆性,选取长势一致的野生和T3代转基因拟南芥,进行根的逆境胁迫处理(图5)。由结果可知,对照组,即正常培养条件下,野生型拟南芥和超量表达和转基因拟南芥之间长势无显著差异,说明和的超量表达并不影响拟南芥的根长生长;然而,150 mmol·L-1NaCl和300 mmol·L-1甘露醇处理下的拟南芥根长生长受到抑制,但超量表达和转基因拟南芥的根长受到的抑制程度显著小于野生型拟南芥,说明超量表达的和提高了拟南芥的抗盐和抗干旱能力;在5 μmol·L-1ABA和10 μmol·L-1GA3处理下,野生型拟南芥的根长生长受到抑制,而超量表达的和转基因拟南芥在ABA的根长显著长于野生型,在GA3处理下几乎不受抑制,说明超量表达的和降低了ABA和GA3对拟南芥根长的敏感性;50 μmol·L-1AlCl3处理下,野生型拟南芥和超量表达和转基因拟南芥的根长生长出现显著差异,转基因拟南芥的根长优于野生型,说明超量表达和转基因增强了拟南芥对重金属铝的耐受性。
3 讨论
3.1 MiZAT10A和MiZAT10B启动子的顺式元件分析
近年来,转录因子在植物抗逆过程中的作用是研究的热点[25],如CBF/DREB、MYB、CUC(NAC)、锌指蛋白等[26]。启动子不仅具有核心启动元件,还在高等植物的基因表达调控中发挥着重要作用,为研究植物基因功能提供了新的思路[27]。比如,大部分毛果杨锌指蛋白基因[28]、苹果[29]、麻风树[30]启动子区域包含光响应元件、激素响应元件和逆境胁迫响应元件。本研究也得到类似的结果,在和中含有激素响应元件、非生物胁迫响应元件、光响应元件以及多个转录因子结合位点,推测两个基因可能受到光照、激素和逆境胁迫的影响。
3.2 MiZAT10A和MiZAT10B组织特异性表达分析
在葡萄中,的表达受脱落酸、干旱、高盐、SA和MeJA的诱导,并对白粉病的感染也有快速反应[31];小麦受盐诱导后,其表达量在根和叶中上调[32];6个巨桉锌指蛋白均受到盐的诱导表达[33];芒果()和()受到干旱、盐和低温的诱导表达[21],表明其可能与非生物胁迫有关。水稻锌指蛋白在花穗中表达[34];毛果杨主要参与花的发育[28];蒺藜苜蓿C2H2锌指蛋白在花中特异性表达[35]。本研究中和在芽和花中的表达量较高,且芽到花呈上升趋势,这表明两个基因与芒果花芽分化有关。
3.3 MiZAT10A和MiZAT10B影响开花及逆境胁迫
前人研究发现,沙冬青可能参与成花[36];小拟南芥表现为提前开花[37];番茄促进开花[38]。本研究结果显示超量表达的和分别使转基因拟南芥提前2—3 d开花,证实其参与芒果的花期调控。
锌指蛋白与植物的非生物胁迫密切相关。水稻过表达增强了其对盐、冷、干旱胁迫的耐受性[39];转基因的小麦拟南芥在盐胁迫下根长显著长于野生型[40]。本研究也得到类似的结果,超量表达和的转基因拟南芥在盐、干旱和外源激素ABA的胁迫下,根长均优于野生型拟南芥,说明超量表达的和提高了拟南芥对这些胁迫的抗性。GA3对主根的生长具有两面性,低浓度的GA3会抑制根的生长,而高浓度GA3则会促进主根生长[41],高浓度ABA抑制主根的生长[42]。本研究中,ABA抑制了WT主根的伸长,而转基因拟南芥的主根受ABA抑制的程度显著轻于对照,说明超量表达和减轻了ABA对拟南芥主根的胁迫。而GA3也抑制了WT主根的伸长,但转基因拟南芥不受GA3的抑制。重金属危害植物生长发育,尤其是根部[43],本研究结果表明,重金属处理下的超量表达和增强了拟南芥对重金属铝的耐受性。

A1:过表达MiZAT10A转基因拟南芥逆境胁迫根长数据;A2:过表达MiZAT10B转基因拟南芥逆境胁迫根长数据;B1:过表达转MiZAT10A拟南芥根长数;B2:过表达MiZAT10B拟南芥根长;*表示在0.05水平上差异显著
4 结论
超量表达芒果和可以诱导转基因拟南芥提早2—3 d开花;同时,可以提高拟南芥在盐胁迫、干旱胁迫和重金属胁迫下的适应能力,并能降低拟南芥对外源激素GA3和ABA的敏感性。
[1] MAHAJAN S, TUTEJA N. Cold, salinity and drought stresses: An overview. Archives of Biochemistry and Biophysics, 2005, 444(2): 139-158. doi: 10.1016/j.abb.2005.10.018.
[2] 黄骥, 王建飞, 张红生. 植物C2H2型锌指蛋白的结构与功能. 遗传, 2004, 26(3): 414-418.
HUANG J, WANG J F, ZHANG H S. Structure and function of plant C2H2zinc finger protein. Hereditas, 2004, 26(3): 414-418. (in Chinese)
[3] IUCHI S. Three classes of C2H2zinc finger proteins. Cellular and Molecular Life Sciences, 2001, 58(4): 625-635. doi: 10.1007/ PL00000885.
[4] KIEŁBOWICZ-MATUK A. Involvement of plant C2H2-type zinc finger transcription factors in stress responses. Plant Science, 2012, 185/186: 78-85. doi: 10.1016/j.plantsci.2011.11.015.
[5] 张佳, 刘俊芳, 赵婷婷, 任婧, 许向阳. 植物C2H2型锌指蛋白研究进展. 分子植物育种, 2018(2): 427-433.
ZHANG J, LIU J F, ZHAO T T, REN J, XU X Y. Research progress of C2H2zinc finger protein in plant. Molecular Plant Breeding, 2018(2): 427-433. (in Chinese)
[6] ENGLBRECHT C C, SCHOOF H, BÖHM S. Conservation, diversification and expansion of C2H2zinc finger proteins in thegenome. BMC Genomics, 2004, 5(1): 39. doi: 10.1186/1471-2164-5-39.
[7] AGARWAL P, ARORA R, RAY S, SINGH A K, SINGH V P, TAKATSUJI H, KAPOOR S, TYAGI A K. Genome-wide identification of C2H2zinc-finger gene family in rice and their phylogeny and expression analysis. Plant Molecular Biology, 2007, 65(4): 467-485. doi: 10.1007/s11103-007-9199-y.
[8] WEI K F, PAN S, LI Y. Functional characterization of maize C2H2zinc-finger gene family. Plant Molecular Biology Reporter, 2016, 34(4): 761-776. doi: 10.1007/s11105-015-0958-7.
[9] LAWRENCE S D, NOVAK N G. Comparative analysis of the genetic variability within the Q-type C2H2zinc-finger transcription factors in the economically important cabbage, canola and Chinese cabbage genomes. Hereditas, 2018, 155(1): 29.
[10] CHEN Y, WANG G, PAN J, WEN H F, DU H, SUN J X, ZHANG K Y, LV D, HE H L, CAI R, PAN J S. Comprehensive genomic analysis and expression profiling of the C2H2Zinc finger protein family under abiotic stresses in cucumber (L.). Genes, 2021, 11(2): 171. doi: 10.21203/rs.3.rs-215409/v1.
[11] JIANG L, PAN L J. Identification and expression of C2H2transcription factor genes inunder abiotic and biotic stresses. Molecular Biology Reports, 2012, 39(6): 7105-7115. doi: 10.1007/s11033-012-1542-y.
[12] ARREY-SALAS O, CARIS-MALDONADO J C, HERNÁNDEZ- ROJAS B, GONZALEZ E. Comprehensive genome-wide exploration of C2H2zinc finger family in grapevine (L.): Insights into the roles in the pollen development regulation. Genes, 2021, 12(2): 302. doi: 10.3390/genes12020302.
[13] CAI S Q, LASHBROOK C C. Stamen abscission zone transcriptome profiling reveals new candidates for abscission control: Enhanced retention of floral organs in transgenic plants overexpressing. Plant Physiology, 2008, 146(3): 1305-1321. doi: 10.1104/pp.107.110908.
[14] WANG L, BAI X D, ZHAO F F, LI R, HAN X. Manipulation of flowering time and branching by overexpression of the tomato transcription factor. Plant Biotechnology Journal, 2016, 14(12): 2310-2321. doi: 10.1111/pbi.12584.
[15] 杨阔. 苹果C2H2型锌指蛋白MdZAT10调控叶片衰老和干旱胁迫的机理研究[D]. 泰安: 山东农业大学, 2021.
YANG K. Molecular mechanism of C2H2-type zinc finger protein MdZAT10 regulating leaf senescence and drought stress in apple [D]. Taian: Shandong Agricultural University, 2021. (in Chinese)
[16] ZHANG A D, LIU D D, HUA C M, YAN A, LIU B H, WU M J, LIU Y H, HUANG L L, ALI I, GAN Y B. Thegene() is involved in salt stress and osmotic stress response. PLoS ONE, 2016, 11(12): e0168367. doi: 10.1371/journal. pone.0168367.
[17] XIE Y J, MAO Y, LAI D W, ZHANG W, SHEN W B. H2Enhancessalt tolerance by manipulating-mediated antioxidant defence and controlling sodium exclusion. PloS ONE, 2012, 7(11): e49800. doi: 10.1371/journal.pone.0049800.
[18] 杜娟. 枳低温响应基因和转化柑橘及转基因植株鉴定[D]. 武汉: 华中农业大学, 2016.
DU J.transformation ofcold-responsive genesandand analysis of transgenic plants [D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[19] TIAN Z D, ZHANG Y, LIU J, XIE C H. Novel potato C2H2-type zinc finger protein gene,, which responds to biotic and abiotic stress, plays a role in salt tolerance. Plant Biology, 2010, 12(5): 689-697. doi: 10.1111/j.1438-8677.2009.00276.x.
[20] LUO C, HE X H, HU Y, YU H X, OU S J, FANG Z B. Oligo-dT anchored cDNA-SCoT: A novel differential display method for analyzing differential gene expression in response to several stress treatments in mango (L.). Gene, 2014, 548(2): 182-189. doi:10.1016/j.gene.2014.07.024.
[21] 余海霞, 罗聪, 樊琰, 张秀娟, 王逸涵, 黄方, 卢新喜, 何新华. 芒果和基因克隆与表达模式分析. 分子植物育种, 2019, 17(23): 7692-7699. doi: 10.13271/j.mpb.017.007692.
YU H X, LUO C, Fan Y, ZHANG X J, WANG Y H, HUANG F, Lu X X, He X H. Cloning and expression analysis ofandgenes in mango. Molecular Plant Breeding, 2019, 17 (23): 7692-7699. doi: 10.13271/j.m pb. 017.007692. (in Chinese)
[22] LUO C, HE X H, CHEN H, HU Y, OU S J. Molecular cloning and expression analysis of four actin genes () from mango. Biologia Plantarum, 2013, 57(2): 238-244.
[23] CLOUGH S J, BENT A F. Floral dip: A simplified method for Agrobacterium-mediated transformation of. Plant Journal, 1998, 16(6): 735-743. doi: 10.1046/j.1365-313x.1998. 00343.x.
[24] 余海霞, 罗聪, 徐趁, 何新华. 一种简单高效提取高质量转基因拟南芥和烟草DNA的方法. 分子植物育种, 2016, 14(6): 1436-1440. doi: 10.13271/j.mpb.014.001436.
YU H X, LUO C, XU C, HE X H. A simple and efficient method for high quality DNA extraction from transgenicand tobacco. Molecular Plant Breeding, 2016, 14(6): 1436-1440. doi: 10.13271 / j.mpb.014.001436. (in Chinese)
[25] 王翠, 兰海燕. 植物bHLH转录因子在非生物胁迫中的功能研究进展. 生命科学研究, 2016, 20(4): 358-364. doi: 10.16605/j.cnki.1007- 7847.2016.04.013.
WANG C, LAN H Y. Advances in functional studies of plant bHLH transcription factors under abiotic stress. Life Science Research, 2016, 20(4): 358-364. doi: 10.16605/j.cnki.1007-7847. (in Chinese)
[26] LUO X, BAI X, ZHU D, LI Y, JI W, CAI H, WU J, LIU B H, ZHU Y M. GsZFP1, a new Cys2/His2-type zinc-finger protein, is a positive regulator of plant tolerance to cold and drought stress. Planta, 2012, 2012, 235(6): 1141-1155. doi: 10.1007/s00425-011-1563-0.
[27] 王雪, 王盛昊, 于冰. 转录因子和启动子互作分析技术及其在植物应答逆境胁迫中的研究进展. 中国农学通报, 2021, 37(33): 112-119.
WANG X, WANG S H, YU B. Interaction analysis of transcription factors and promoters and its application in response of plants to stress. Chinese Agricultural Science Bulletin, 2021, 37(33): 112-119. (in Chinese)
[28] LIU Q G, WANG J C, XU X M, ZHANG H Z, LI C H. Genome-wide analysis of C2H2zinc-finger family transcription factors and their responses to abiotic stresses in Poplar (). PLoS ONE, 2015, 10(8): e0134753. doi: 10.1371/journal.pone.0134753.
[29] YANG K, LI C Y, AN J P, WANG D R, WANG X, WANG C K, YOU C X. The C2H2-type zinc finger transcription factor MdZAT10 negatively regulates drought tolerance in apple. Plant Physiology and Biochemistry, 2021, 167: 390-399. doi: 10.1016/j.plaphy.2021.08.014.
[30] 李诗娟, 张伟, 魏磊, 黄晓明, 林娜, 徐莺, 陈放. 一个麻疯树C2H2型锌指蛋白基因的克隆与表达分析. 四川大学学报(自然科学版), 2014, 51(1): 206-212.
LI S J, ZHANG W, WEI L, HUANG X M, LIN N, XU Y, CHEN F. Cloning and expression analysis of a C2H2type zinc finger protein, JcZFP1, fromL. Journal of Sichuan University (Natural Science Edition), 2014, 51(1): 206-212. (in Chinese)
[31] YU Y H, LI X Z, WU Z J, CHEN D X, LI G R, LI X Q, ZHANG G H. VvZFP11, a Cys2His2-type zinc finger transcription factor, is involved in defense responses in. Biologia Plantarum, 2016, 60(2): 292-298. doi: 10.1007/s10535-016-0598-2.
[32] SUN B G, ZHAO Y J, SHI S Y, YANG M Y, XIAO K. TaZFP1, a C2H2type-ZFP gene of T., mediates salt stress tolerance of plants by modulating diverse stress-defensive physiological processes. Plant Physiology and Biochemistry, 2019, 136: 127-142.
[33] WANG S, WEI X L, CHENG L J, TONG Z K. Identification of a C2H2-type zinc finger gene family fromand its response to various abiotic stresses. Biologia Plantarum, 2014, 58(2): 385-390. doi: 10.1007/s10535-014-0399-4.
[34] 孙姝璟. 水稻TFIIIA型锌指蛋白ZFP179和ZFP182的功能分析[D]. 南京: 南京农业大学, 2010.
SUN S J. Functional analysis of TFIIIA-type Zinc finger proteins ZFP179 and ZFP182 from rice (L.) [D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese)
[35] JIAO Z J, WANG L P, DU H, WANG Y, WANG W X, LIU J J, HUANG J H, HUANG W, GE L F. Genome-wide study of C2H2zinc finger gene family in Medicago truncatula. BMC Plant Biology, 2020, 20(1): 401. doi: 10.1186/s12870-020-02619-6.
[36] 任美艳, 王志林, 郭慧琴, 薛敏, 殷玉梅, 王茅雁.沙冬青C2H2型锌指蛋白基因的克隆与表达分析. 华北农学报, 2017, 32(2): 8-13. doi: 10.7668/hbnxb.2017.02.002.
REN M Y, WANG Z L, GUO H Q, XUE M, YIN Y M, WANG M Y. Cloning and expression analysis of, A C2H2-typegene from. Acta Agriculturae Boreali-Sinica, 2017, 32(2): 8-13. doi: 10.7668 / HBNXB 2017.02.002. (in Chinese)
[37] 刘慧, 郭丹丽, 蔡大润, 黄先忠. 小拟南芥基因异源超表达促进拟南芥开花并提高耐逆性. 植物学报, 2016, 51(3): 296-305. doi: 10.7668/hbnxb.2017.02.002.
LIU H, GUO D L, CAI D R, HUANG X Z. Heterologous overexpression ofpromotes flowering and improves abiotic tolerance in. Bulletin of Botany, 2016, 51(3): 296-305. doi: 10.7668 / HBNXB 2017.02.002. (in Chinese)
[38] WENG L, ZHAO F F, LI R, XU C J, CHEN K S, XIAO H. The zinc finger transcription factornegatively regulates abscisic acid biosynthesis and fruit ripening in tomato. Plant Physiology, 2015, 167(3): 931-49. doi: 10.1104/pp.114.255174.
[39] HUANG J, SUN S J, XU D Q, LAN H G, SUN H, WANG Z F, BAO Y M, WANG J F, TANG H J, ZHANG H S. A TFIIIA-type zinc finger protein confers multiple abiotic stress tolerances in transgenic rice(L.). Plant Molecular Biology, 2012, 80(3):337-350. doi: 10.1007/s11103-012-9955-5.
[40] MA X L, LIANG W J, GU P H, HUANG Z J. Salt tolerance function of the novel C2H2-type zinc finger protein TaZNF in wheat. Plant Physiology and Biochemistry, 2016, 106:129-140. doi: 10.1016/j. plaphy.2016.04.033.
[41] 赵栗. 外源GA3和SA对棉花幼苗根系生长的影响. 安徽农学通报, 2021, 27(10): 45-48.
ZHAO L. Effects of gibberellins and salicylic acid on cotton seedling root growth. Anhui Agricultural Science Bulletin, 2021, 27(10): 45-48. (in Chinese)
[42] 张幸福, 韩栓, 王伟, 江静. ABA和GA刺激的ROS代谢调节水稻幼根伸长分析. 河南大学学报(自然科学版), 2010(1): 62-66.
ZHANG X F, HAN S, WANG W, JIANG J. Analysis of ABA-and GA-stimulated reactive oxygen species mediating the elongation of rice seeding roots. Journal of Henan University (Natural Science Edition), 2010(1): 62-66. (in Chinese)
[43] 葛坤, 王培军, 邵海林, 郭家雁, 杜宾. 重金属胁迫对植物生理生化的影响及其抗性机理研究. 山西林业科技, 2021, 50(3): 43-46.
GE K, WANG P J, SHAO H L, GUO J Y, DU B. Study on the effects of heavy metal stress on plant physiology and biochemistry and its resistance mechanism. Shanxi Forestry Science and Technology, 2021, 50(3): 43-46. (in Chinese)
Functional Analysis ofandGenes in Mango
MO WenJing, ZHU JiaWei, HE XinHua,YU HaiXia, JIANG HaiLing,QIN LiuFei,ZHANG YiLi,LI YuZe, LUO Cong
College of Agriculture, Guangxi University/State Key Laboratory of Subtropical Agricultural Biological Resources Protection and Utilization/National Experimental Teaching Demonstration Center of Plant Science, Nanning 530004
【】Zinc finger protein (ZFP) plays an important role in plant abiotic stress response. Therefore, to provide a theoretical basis for stress resistance breeding, this study aimed to analyze the response of two zinc finger protein genes ofandtransgenicto abiotic stresses, such as salt, drought, heavy metals and exogenous hormones. 【】The promoteracting elements and motif of mangoandgenes were predicted and analyzed by online software PLACE and MEME, respectively. The chromosome location map was drawn by TBtools software and SiJiMi gene annotation file (GFF file and unpublished). Tissue expression patterns ofandgenes were analyzed by qRT-PCR. The overexpression vectors ofandgenes were constructed and transformed intobyfloral-dip method. The phenotype ofandtransgenic plant were observed and recorded under salt, drought, heavy metals, abscisic acid and gibberellin treatments. 【】Promoter cis element analysis showed that there were many light response elements, hormone response elements and abiotic stress response elements in the promoter region ofandgenes. Expression analysis showed thatandwere highly expressed in buds and flowers. 9 ofand 14 oftransgenicstrains were obtained. Overexpression ofandsignificantly resulted early flowering compared with the control lines. The root length ofandoverexpressing transgenicwas significantly longer than that of control lines under salt stress, drought stress, heavy metal stress, GA3and ABA hormone treatments. 【】Overexpression ofandnot only promoted transgenicflowering early but also improved salt, drought, heavy metals and exogenous hormones GA3and ABA resistance.
mango; abiotic stress; zinc finger protein; expression; function analysis

2022-03-02;
2022-05-12
广西自然科学基金(2015GXNSFAA139052)、国家现代农业产业技术体系广西芒果创新团队栽培与病虫害防治岗位项目(nycytxgxcxtd- 2021-06-02)、科技先锋队‘强农富民’‘富六个一’专项行动(202204)
莫文静,E-mail:tuanzy97616@163.com。朱嘉伟,E-mail:zhujiaweiii1206@163.com。莫文静和朱嘉伟为同等贡献作者。通信作者罗聪,E-mail:22003luocong@163.com
(责任编辑 赵伶俐)
