紫薇LiHY5基因的克隆、亚细胞定位与不同光质下的表达分析
2023-01-31邓涪元乔中全王晓明李春霞陆柳淑李雪露
邓涪元,乔中全,王晓明,李春霞,陆柳淑,李雪露,何 钢*
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.湖南省林业科学院 林木无性系育种湖南省重点实验室,湖南 长沙 410004)
【研究意义】植物在生长发育过程中表现出不同的颜色主要取决于花青素和叶绿素。花青素是自然界一类广泛存在于植物中的水溶性天然色素,植物中的主要呈色物质大部分与之有关。花青素属于黄酮类化合物,不同种类的花青素呈现的颜色不同,因此花青素的含量与种类直接影响着园艺植物的观赏品质。紫薇(Lagerstroemia indica)属于桃金娘目(Myrtales)千屈菜科(Lythraceae)紫薇属(Lagerstroemia),落叶或常绿灌木或小乔木[1-2]。紫薇品种繁多、色彩丰富,因其通常在盛夏开花且花期较长,故被广泛用于公园、庭院建设和城市道路的绿化与装饰等。近年来随着人们生活品质的提高,丰富多样的园林绿化正成为城市建设的主流,因此对紫薇色彩的研究与选育具有重要的意义。【前人研究进展】植物对于光的依赖,不仅是因为植物光合作用需要光作为能量,光也是作为激活植物生长发育相关基因的重要信号之一。植物通过不同的光感受器感知光信号,并影响多种发育过程,包括幼苗光形态发生,种子发芽以及避荫和光周期反应。植物已经进化出复杂的光调节转录网络,这些转录网络介导着光发育变化[3]。Elongated hypocotyl 5(HY5)是光信号通路中的关键转录因子之一,它隶属于bZIP 转录因子家族,通过直接与光诱导基因的启动子结合参与调控光形态建成、叶绿体发育和色素积累等生物学过程[4-6]。在拟南芥中,AtHY5在介导光激活花青素积累和CHS基因表达方面发挥了积极作用,AtHY5可以直接激活CHS、DFR等花青素结构基因启动子促进花青素积累。在体外,AtHY5通过G-box 基序特异性结合CHS1 启动子的最小光响应启动子单元[7]。苹果中的MdHY5可以结合转录因子MdMYB10基因启动子区域的G-box 元件,进而调控花青素合成途径中关键结构基因的表达,这表明MdHY5能与转录因子的上游元件相互作用,从而直接或间接促进苹果花青素的合成[8];在血橙中,血橙果皮中花青素的积累由CsRuby1启动子内的G-Box(CACGTC)调节。HY5通过与G-Box 结合来正向调节MYB 家族Ruby1 的转录[9]。此外,草莓[10]、葡萄[11]、桃[12]和茄子[13]等多种植物中的其他HY5基因也被证明能促进光诱导的花青素的生物合成和积累。【本研究切入点】‘丹红紫叶’是由湖南省林业科学院以美国紫叶紫薇为试验材料,选育出的优良新品种[14]。‘丹红紫叶’叶色稳定,在正常光照下幼嫩时期叶片为紫红色,叶片展开后颜色由紫红色加深至黑紫色,成熟叶片叶色维持在稳定的黑紫色不变[15]。【拟解决的关键问题】鉴于HY5基因在植物光信号转导过程中的重要性,本研究通过紫薇转录组数据,克隆出1个LiHY5基因,并进行基因结构分析与不同光质影响下的基因表达量的测定,同时在烟草中进行了亚细胞定位。为深入研究紫薇LiHY5基因的功能奠定理论基础。
1 材料与方法
1.1 材料与试剂
植物材料:试验所用‘丹红紫叶’紫薇种植于湖南省林业科学院试验林场。选择红光(R,730 nm)、蓝光(B,450 nm)、红蓝组合光(R∶B,1∶1)处理,以白光(W)作为对照。LED光源用扎带固定在植株顶部,用黑色遮光布遮挡,植株与光源距离可调,光暗周期的温度为25 ℃/16 ℃,光照时间用计时器设定为12 h/d(06:00—18:00)。选取长势基本一致无病斑、虫害的扦插苗(苗高约40 cm),剪去多余的枝条,单株移栽到装有育苗基质的塑料盆中,每个光源处理10 株,每种处理植株重复3 次,置于不同LED 光源下,7,14,21,28 d后随机剪下较嫩的叶片,液氮速冻,-80 ℃保存备用。
试剂与载体:RNA 提取试剂盒、连接试剂盒和质粒小提试剂盒均购自北京艾德莱生物科技有限公司;2×Rapid Master Mix 高保真酶、逆转录试剂盒、荧光定量试剂均购自诺唯赞生物公司;KpnI和BamH I快切酶、T4 DNA连接酶购自Takara公司;大肠杆菌DH5α感受态细胞购自上海唯地生物公司。
1.2 引物设计
根据紫薇转录组数据,筛选出一条unigene 序列片段,用Primer Premier 5 软件根据编码序列从两端设计上下游特异引物LiHY5-F、LiHY5-R 进行基因克隆。同时依据CDS 序列设计荧光定量PCR 的引物和带有KpnI和BamH I酶切位点的引物连接植物载体pCAMBIA1300-35S-GFP(表1)。

表1 试验所用引物Tab.1 Primers used in the experiment
1.3 紫薇LiHY5基因的克隆
按照多糖多酚复杂植物RNA提取试剂盒说明书提取‘丹红紫叶’紫薇叶片总RNA,并检测RNA的质量。将无降解的RNA 直接反转录合成cDNA 并稀释。按照以下反应体系进行扩增:cDNA 2.0 μL,克隆引物LiHY5-F、LiHY5-R各0.5 μL,2×Rapid Master Mix 10 μL,ddH2O补足体积至20 μL。扩增程序按照高保真酶说明书设置,退火温度63 ℃,33 个循环。PCR 产物纯化后连接转化,挑单菌落并小摇6 h,选择浑浊菌液进行PCR,将电泳条带大小与目的基因一致的菌液,送至华大基因公司进行测序。
1.4 LiHY5基因的生物信息学分析
将LiHY5基因编码序列翻译成氨基酸序列后,利用NCBI 结构域预测软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测LiHY5 蛋白保守结构域;运用ExPASy 在线分析软件(https://web.expasy.org/protparam/)对LiHY5 蛋白的理化性质进行分析;SignalP5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)分析其是否带有信号肽位点,TMHMM2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测蛋白质跨膜结构区域;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白质二级结构;利用Swiss-Model(https://swissmodel.expasy.org/)建立蛋白质三维空间结构模型,Pymol对蛋白质三维图像进行处理;imageJ对荧光图像进行优化;DNAMAN 对不同的植物进行序列比对;MEGA11构建系统进化树。
1.5 LiHY5基因的亚细胞定位
将LiHY5基因的编码序列双酶切与pCAMBIA1300-35S-GFP 质粒连接,转化至大肠杆菌并测序,得到序列正确的pCAMBIA1300-35S-LiHY5-GFP 重组质粒,转化至EHA105 农杆菌,将含有农杆菌的注射液注射至烟草下表皮,暗处理2 d后,光照1 d。轻轻撕取注射孔附近的烟草叶片下表皮并将其放置在显微镜下观察。
1.6 花青素的提取
精准称取‘丹红紫叶’紫薇不同光质处理下的新鲜叶片0.1 g 并剪碎,放入10 mL 离心管中,用0.1%的盐酸甲醇溶液定容至5 mL,用封口膜封住,放入冰箱4 ℃浸提24 h,直至溶液呈紫色,叶片呈无色,每个样品重复3 次。在波长530 nm 处测量浸提液的吸光度,并计算出花青素含量。相对含量A=吸光度×0.01,花青素相对含量(mg/g)=OD530/g·FW。
1.7 不同光质下LiHY5基因的表达量
为了探究LiHY5基因在不同光质下的表达水平,利用荧光定量PCR 进行基因表达量的检测。根据LiHY5基因编码序列设计荧光引物(表1),以白光作为样本对照,18S基因作为内参基因。每个样品模板连续稀释4倍、16倍、64倍、256倍后计算扩增效率,反应体系和扩增程序按照说明书设定,选择标准程序并选择2-ΔΔCt进行数据分析。
2 结果与分析
2.1 LiHY5基因的克隆
提取‘丹红紫叶’紫薇幼嫩叶片总RNA(图1A),通过电泳图显示28S、18S条带清晰且28S∶18S=2∶1,说明RNA 无污染降解,可以进行后续实验。将‘丹红紫叶’紫薇总RNA 进行反转录得到cDNA。设计LiHY5-F、LiHY5-R(表1)为克隆引物,扩增得到清晰且单一的目的片段(图1B)。经过测序得到510 bp的序列,与目的片段相似度94.78%,通过NCBI 中BLAST 比对,与数据库中多种植物的HY5基因具有较高的同源性,因此将紫薇该基因命名为LiHY5。

图1 LiHY5基因PCR扩增产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of LiHY5 gene PCR products
2.2 LiHY5基因的理化性质与保守结构域预测
LiHY5基因的CDS 序列长510 bp,编码169 个氨基酸。将其放入ExPASy 预测蛋白基本理化性质,结果显示该蛋白分子式为C755H1277N263O267S4,分子量18 439.29 Da,理论等电点pI 为9.80,总原子个数为2 566,氨基酸含量占比最多是精氨酸和丝氨酸,为12.4%。不稳定指数为59.42,为不稳定蛋白质。带负电残基总数为25,带正电残基总数为30,脂肪系数为59.59。亲水性指数-1.143,属于亲水性蛋白。信号肽位点预测LiHY5 无信号肽位点,同时预测显示LiHY5 没有跨膜结构,故不属于膜蛋白。利用NCBI 在线分析工具Conserverd Domain Serch 在线分析LiHY5 蛋白的保守结构域,结果显示如图2,该蛋白在第92~143 位存在典型的bZIP-HY5-Like 特定位点,属于bZIP 超家族。bZIP 结构含有亮氨酸拉链结构和碱性结构域,可参与高等植物的光转录调控。

图2 LiHY5蛋白保守结构域预测Fig.2 Prediction of conserved domain of LiHY5 protein
2.3 LiHY5蛋白空间结构预测
LiHY5 蛋白的二级结构预测结果分析如图3,LiHY5 蛋白169 个氨基酸中87 个氨基酸形成无规则卷曲,占51.48%;80个为α螺旋,占47.34%;β转角和延伸链只有1个,均只占0.59%。蛋白质三级结构预测见图4,LiHY5蛋白三维图像呈典型亮氨酸拉链结构,与bZIP转录因子的空间结构一致。
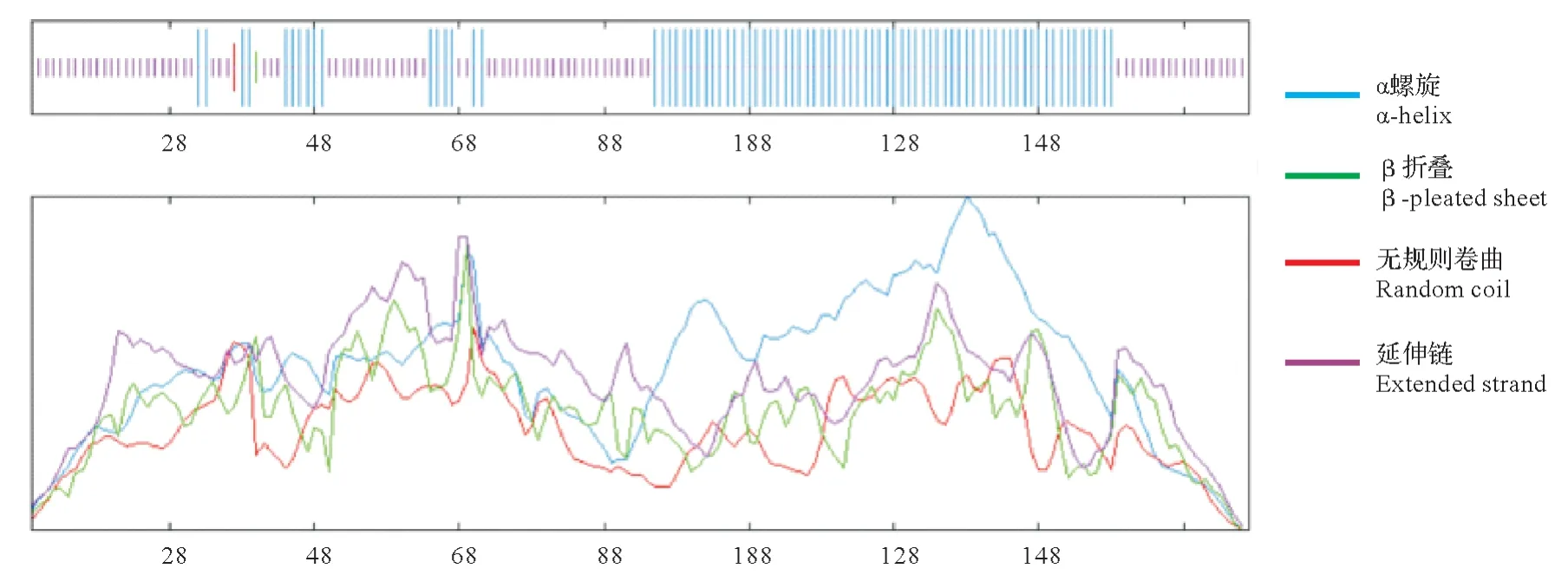
图3 LiHY5蛋白质二级结构预测Fig.3 Secondary structure prediction of LiHY5 protein

图4 LiHY5蛋白质三级结构预测Fig.4 Prediction of LiHY5 protein tertiary structure
2.4 LiHY5蛋白多序列比对与系统进化分析
将石榴(XP_031407456.1)、蒲桃(XP_030440254.1)、玫瑰木(XP_030548349.1)、大桉(XP_010048982.1)、毛果杨(XP_002308656.1)、甜樱桃(XP_021827650.1)、橙子(KAH9760741.1)、白桦(AHY20043.1)、月季(XP_024165510.1)、大麻(XP_030495238.1)、沙梨(QRR19189.1)、枣(XP_015868446.1)12种HY5蛋白序列与紫薇HY5蛋白序列比对分析,总相似性达到85.32%(图5),其中与石榴的蛋白序列相似度最高,达到88.17%。

图5 不同物种HY5蛋白的氨基酸序列对比Fig.5 Comparison of amino acid sequences of HY5 proteins in different species
选择石榴Punica granatum、大桉Eucalyptus grandis、栓皮栎Quercus suber、橙子Citrus sinensis、蓖麻Ricinus communis、蒲桃Syzygium oleosum、玫瑰木Rhodamnia argentea、毛果杨Populus trichocarpa、白桦Betula platyphylla、枣Ziziphus jujuba、月季Rosa chinensis、大麻Cannabis sativa、沙梨Pyrus pyrifolia、甜樱桃Prunus avium、番木瓜Carica papaya一共15种植物的HY5蛋白序列作为参照,采用Neighbor Joining 法构建系统发育树,并利用Bootstrap 进行检测,采用重复抽样1 000 次。进化分析结果显示(图6),紫薇与石榴、蒲桃、大桉、玫瑰木亲缘关系较近,LiHY5与石榴PgHY5归为同一分支,说明二者的同源蛋白可能具有相似的功能。

图6 不同植物HY5氨基酸序列的进化分析Fig.6 Evolutionary analysis of HY5 amino acid sequences in different plants
2.5 LiHY5基因的亚细胞定位
亚细胞定位预测显示LiHY5 蛋白定位于细胞核中,为验证紫薇LiHY5基因在细胞中的位置,采用双酶切法构建了LiHY5-pCAMBIA1300-35S-GFP 重组载体。将重组载体双酶切并转化农杆菌,采用农杆菌介导法转化烟草叶片进行亚细胞定位。结果显示,空载中荧光主要分布在细胞膜和细胞质中;转化带有LiHY5基因的质粒注射至烟草叶片中,荧光主要分布在细胞核中(图7)。
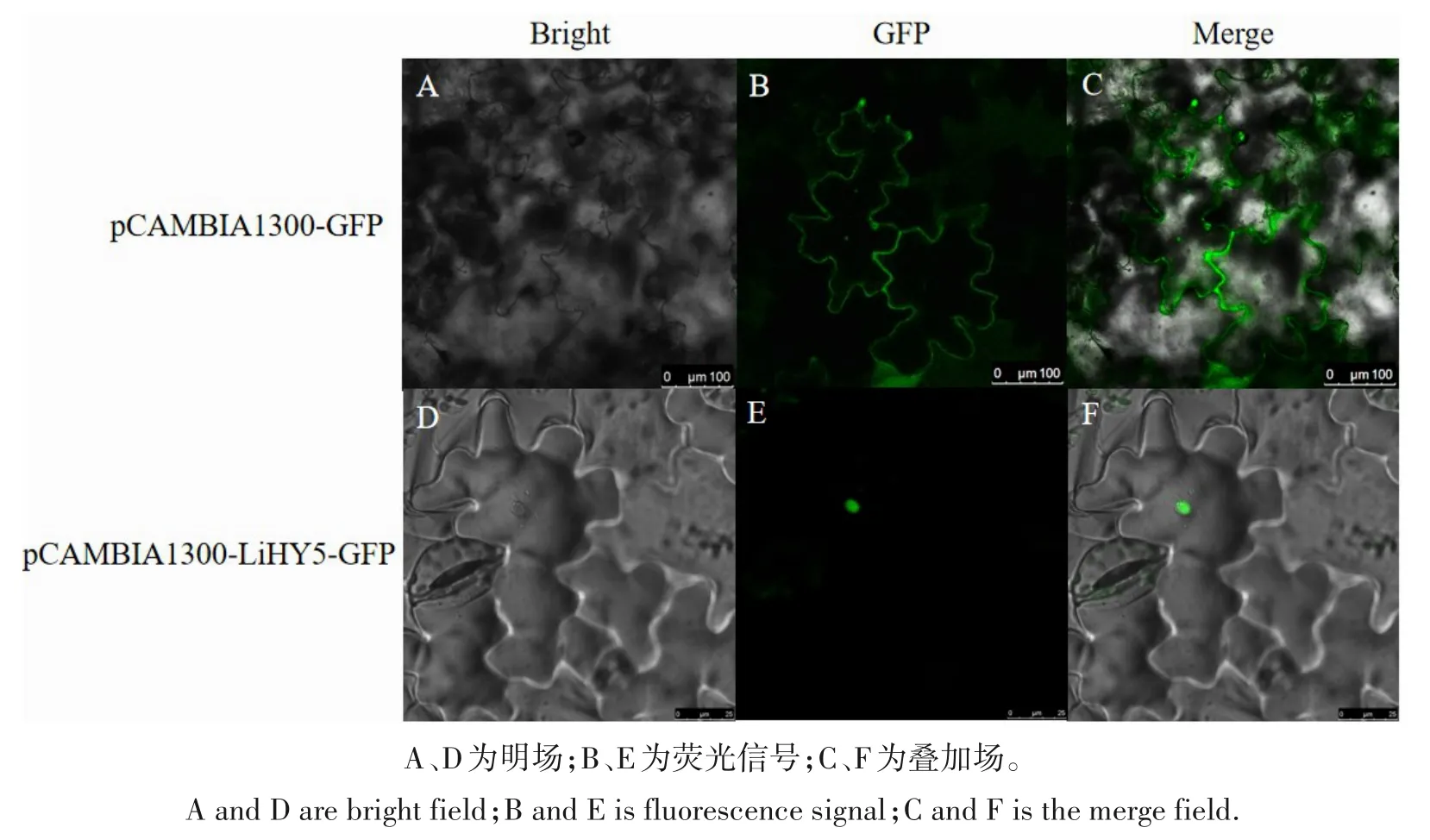
图7 LiHY5基因的亚细胞定位Fig.7 Subcellular localization of LiHY5 gene
2.6 紫薇叶片花青素含量与LiHY5基因表达量相关性分析
为探究LiHY5基因表达量与花青素含量的关系,笔者提取了不同时间光处理的紫薇叶片花青素。由图8可知:不同时间的光处理下花青素含量均有上调,且均呈现先上升后下降的趋势。其中红蓝组合光>红光>蓝光>白光,红蓝组合光影响最为显著,在14 d时含量最高,28 d时花青素含量降至最低,在不同时间段均高于其他光处理。说明不同光质的处理能促进紫薇叶片花青素的积累。通过qPCR 技术检测LiHY5基因在红光、蓝光以及红蓝组合光下的基因表达量,以白光作为对照,结果如图9 所示。由图9可知LiHY5基因表达量在不同光的处理下呈先升高后降低趋势,在7 d 时3 种不同颜色的光基因表达量均有下调,14 d 时红光和红蓝光表达量明显上调,28 d 时下调至最低。这些结果说明不同光质均对LiHY5基因的表达有影响。其中,红蓝组合光>红光>白光>蓝光,说明红光和红蓝光在14 d时对LiHY5基因发挥了积极的作用;而蓝光在28 d的处理下花青素含量和基因表达量对比白光差别不大,说明短时间的蓝光对LiHY5基因影响效果不明显。

图8 ‘丹红紫叶’紫薇叶片花青素含量Fig.8 Anthocyanin content in leaves of Lagerstroemia indica

图9 LiHY5基因在不同光处理下的基因表达量Fig.9 Gene expression of LiHY5 gene under different light treatments
通过分析紫薇叶片花青素含量与LiHY5基因相对表达量的相关性,结果表明紫薇叶片花青素的含量与LiHY5基因的相对表达量相关系数为0.603,说明紫薇中花青素的含量与LiHY5基因的相对表达量相关性显著。花青素含量与LiHY5基因相对表达量呈线性关系。
3 结论与讨论
HY5基因在植物幼苗生长发育中起着重要作用,并且是光形态发生的正调节因子。近年来对HY5基因的研究日益增多,HY5基因的功能也逐渐被人们发掘:HY5基因不仅感知光信号参与色素积累,也有研究报道HY5基因诱导了植物幼根的发育[16]、控制冷诱导基因的表达以促进植物的冷适应[17]。在幼苗发育中,HY5直接与细胞核中COP1相互作用,负性调节其活性[18]。COP1(Constitutive Photomorphogeneic 1)是一种具有WD-40重复序列的环指蛋白,与HY5作用相反,其核丰度受光负调控。在黑暗下COP1定位在细胞核,与HY5蛋白相互作用后,COP1可作为泛素蛋白连接酶E3聚集E2泛素结合酶,靶向HY5和其他底物进行泛素化并随后被蛋白酶体降解;在可见光下,COP1与上游光感受器相互作用抑制自身功能,COP1随后在细胞核泛素化并被排出到核外[19]。
花青素属于黄酮类化合物,广泛存在植物花序和果实中。花青素色素是植物颜色的主要决定因素,可使植物呈现红色和紫色,是成熟果实中传粉者的视觉信号[20]。HY5在花青素生物合成的控制中扮演着十分重要的角色。核内的HY5等光形态建成正调控因子将积累并激活R2R3 MYBs转录因子和类黄酮合成途径中的结构基因,结合基因启动子区域的顺式作用元件,从而在光照条件下促进植物花青素等类黄酮物质合成[21]。
紫薇作为重要的园艺观赏植物,通过研究紫薇花色形成机制实现紫薇颜色的多样对观赏育种以及满足市场需求有重要的意义。本研究成功克隆得到了紫薇LiHY5基因,长度510 bp,由169 个氨基酸组成,含有典型的bZIP-HY5-Like 保守结构域。系统进化分析显示LiHY5 与石榴PgHY5、蒲桃SoHY5 氨基酸序列亲缘关系最近,可能是由于它们都属于桃金娘目,因此发挥相似的功能。亚细胞定位结果说明LiHY5基因在核内发挥功能,这与转录因子的基本特征相符合,与马媛等[22]对日本结缕草的亚细胞定位结果一致。花青素含量在不同时间的光质影响下先升高后降低,说明短时间内不同光质的干预可以促进花青素的合成,但28 d时均降低。推测可能是由于单一光质的影响使得紫薇生长受到限制。qPCR 结果显示不同时间、不同光质处理对LiHY5基因影响较大,且与花青素含量的相关性较高,说明光照尤其是红蓝组合光可以促进紫薇LiHY5基因的表达与花青素的合成。这与前人对草莓的研究结果类似[23]。本研究对LiHY5基因进行了初步的预测分析,为接下来验证LiHY5基因的功能、探究紫薇遗传转化体系提供理论基础。
致谢:长沙市杰出创新青年培养计划(kq2106090)同时对本研究给予了资助,谨致谢意!
