核酸适配体结合胶体金比色法检测氧氟沙星
2023-01-31许高鼎张丹枫熊建华
许高鼎,张丹枫,熊建华,杜 娟
(江西农业大学 食品科学与工程学院,江西 南昌 330045)
【研究意义】氧氟沙星(ofloxacin,OFL)是第三代喹诺酮类抗生素,因其具有良好的抗菌效果和广谱抗菌活性,同时交叉耐药性低、价格低廉,曾被广泛应用到治疗人类、畜禽及水产动物的多种感染性疾病中。但其可降解性差,长期使用会在环境和食物中富集,并会导致过敏反应和胃肠道疾病,严重的会损坏肝脏器官及中枢神经系统[1-2]。2015年9月,农业部发布第2292号公告,宣布自2016年12月31日起禁止使用OFL 用于食品动物[3],但是OFL 在食品动物中被检出的情况仍有发生,亟需开发简单、快速、灵敏的检测方法。【前人研究进展】氧氟沙星(OFL)的检测方法有高效液相色谱法(HPLC)[4]、液相色谱串联质谱法(HPLC-MS)[5]、酶联免疫法(ELISA)[6]和电化学法(ES)[7]。其中HPLC 和LC-MS不仅灵敏度和精密度较高,而且可以同时测定多种目标待测物,是目前检测OFL 最为常见的方法之一,但HPLC 和LC-MS 需要相对复杂的预处理,耗时长且依赖于昂贵的大型仪器,检测不便。ELISA 法需要制备抗体,成本较高;ES法需合成电极材料,步骤较为繁琐。因此,开发一种简单、快速、灵敏的检测方法是必要的。核酸适配体(aptamer,Apt)结合金纳米粒子(gold nanoparticles,AuNPs)在快速检测领域的应用是目前研究的热点[8-10]。AuNPs是目前研究和使用最多的金属纳米材料,当AuNPs在溶液中处于分散状态或聚集状态时,溶液分别呈现出酒红色或蓝灰色,并且具有独特的光学特性[11-12]。Apt被称为化学抗体,是通过体外指数富集配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选制备的单链DNA 或RNA[13]。其具有类似抗体的特异性识别功能,且毒性低、稳定性好、纯度高、存储条件温和[14],同时可以通过键能吸附于AuNPs 表面,因此,正逐步替代抗体应用于检测领域中。相比于传统的检测方法,通过Apt结合AuNPs 建立的检测传感体系不仅操作简单,耗时短,不需依赖大型仪器,且具有较好的灵敏度,有望成为快速检测领域的新趋势。【本研究切入点】经柠檬酸钠制备的AuNPs遇到带正电荷的阳离子表面活性剂时,AuNPs 表面静电平衡状态被破化,导致AuNPs 聚集,然而加入Apt 后,可以有效阻止AuNPs的聚集。但反应体系存在靶标时,Apt因其具有类似抗体的特异性识别功能[15],会优先与靶标特异性结合,导致AuNPs 重新聚集。【拟解决的关键问题】鉴于此,本研究利用AuNPs 在阳离子表面活性剂十六烷基三甲基溴化铵(cationic surfactant hexadecyltrimethylammonium bromide,CTAB)作用下的颜色变化,结合Apt对OFL的特异性识别功能,建立OFL检测的比色分析方法,通过优化相应条件,提高反应体系的检测灵敏度。相比于普通的金属离子聚集AuNPs 的体系,CTAB 不仅可以破坏AuNPs 表面的静电平衡,而且可以与Apt 形成超分子结构[16-17],通过Apt、CTAB 和OFL 之间的竞争关系,更有利于提高反应灵敏度。
1 材料与方法
1.1 实验原理
核酸适配体结合胶体金可视化检测氧氟沙星的原理如图1所示,当Apt溶液中存在OFL 靶标时,Apt会与OFL 靶标特异性结合形成刚性结构[18],再加入AuNPs 后,Apt 将无法通过其N 元素与Au 元素形成Au-N键吸附于AuNPs表面[19]。CTAB是一种阳离子表面活性剂,可以与带负电荷的Apt结合成超分子结构[16-17]。同时CTAB 带正电荷,可以破坏表面带负电荷AuNPs 之间的静电平衡[20]。因此加入CTAB 后,由于AuNPs表面无Apt吸附,从而发生聚集现象,AuNPs溶液呈蓝灰色。当无OFL靶标时,结合于AuNPs表面的Apt会与CTAB 静电结合,从而阻止了AuNPs 表面的静电平衡被破坏,AuNPs 溶液呈酒红色。因此,OFL的浓度变化可以影响到纳米金的聚集程度,根据这一变化规律可以实现对OFL的检测。

图1 基于核酸适配体结合纳米金比色法检测氧氟沙星实验原理Fig.1 Schematic diagram of the Apt-AuNPs colorimetric assay for the detection of ofloxacin
1.2 材料和试剂
氧氟沙星(OFL)、恩诺沙星(enrofloxacin,ENR)、环丙沙星(ciprofloxacin,CIP)、盐酸沙拉沙星(sarafloxacin hydrochloride,SFX)、诺氟沙星(norfloxacin,NOR)、培氟沙星(pefloxacin,PFL)、洛美沙星(lomefloxacin,LOM)和氯霉素(chloramphenicol,CAP)(标准品,金克隆生物技术有限公司);四水合氯金酸(1 g,国药集团化学试剂有限公司);二水合柠檬酸钠、乙酸(西陇化学试剂有限公司);十六烷基三甲基溴化铵(CTAB)(天津市光复精细化工研究所);3-(N-吗啡啉)丙磺酸钠(MOPS-Na)(上海生工生物技术有限公司);甲醇(色谱级,安徽天地高纯溶剂有限公司)。氧氟沙星核酸适配体(Apt)由上海生工生物技术有限公司合成序列为5′-ATA CCA GCT TAT TCA ATT AGT TGT GTA TTG AGG TTT GAT CTA GGC ATA GTC AAC AGA GCA CGA TCG ATC TGG CTT GTT CTA CAA TCG TAA TCA GTT AG-3′[21]。适配体使用时5 000 r/min离心1 min,然后用超纯水溶解,稀释成100 nmol/L的适配体储备液,4 ℃保存。
1.3 仪器
Specord 200紫外-可见分光光度计(德国耶拿分析仪器股份公司);DF-101S集热式恒温加热磁性搅拌器(上海鹰迪仪器设备有限公司);HC-2518R 台式高速冷冻离心机(安徽中科中佳科学仪器有限公司);KB3旋涡混合器(海门市其林贝尔仪器制造有限公司);FEI Tecnai F20透射电子显微镜(美国FEI公司);Zeta Nano ZS纳米粒度仪(英国Malvern公司)。
1.4 AuNPs的制备
根据Du 等[22]报道合成AuNPs。所有玻璃器皿及搅拌子用王水浸泡30 min,然后直接用超纯水清洗干净,置于烘箱烘干后待用。用移液管准确量取超纯水80 mL,然后加入2 mL 1%的氯金酸,放于磁力搅拌器上加热搅拌至沸腾状态,然后迅速加入8 mL 1%的柠檬酸钠溶液,将混合物继续加热搅拌,溶液先由淡黄色变为淡紫色,然后由淡紫色变成酒红色。15 min后停止加热,放于室温下继续搅拌30 min使溶液形成稳定的AuNPs,然后用超纯水定容至100 mL,保存于4 °C。
1.5 检测条件
在离心管中分别加入30 μL Apt 溶液(终浓度为1.5 nmol/L)和100 μL 不同浓度的OFL 标准溶液,然后加入1 180 μL MOPS-Na(10 mmol/L pH 7.0)缓冲液,混匀后于37 ℃孵育30 min,然后加入500 μL AuNPs,混匀后于37 ℃继续孵育30 min,最后加入190 μL 10 μmol/L CTAB,反应体系最终体积为2 mL,反应15 min 后用全波段紫外分光光度计扫描400~800 nm 波长下的光谱图。以不加入OFL 目标物为对照体系,计算ΔA650/A520的值。
1.6 检测条件优化
1.6.1 CTAB 浓度优化 分别将体积为0,40,80,100,120,140,160,180,190,200,220,240,260 μL 的10 μmol/L CTAB 溶液添加到含有500 μL AuNPs 的体系中,其中含有适量体积的MOPS-Na 缓冲液,使反应体系的最终体积为2 mL,体系中CTAB 溶液的最终浓度分别为0,0.2,0.4,0.5,0.6,0.7,0.8,0.9,0.95,1.0,1.1,1.2,1.3 μmol/L。充分震荡混匀后,于37℃孵育15 min 后,用紫外-可见分光光度计扫描400~800 nm 的吸收光谱,测量溶液的650 nm 和520 nm 处的吸光值,得到的吸光度比值A650/A520的平均值为纵坐标、CTAB 浓度为横坐标作图,选择使AuNPs颗粒完全聚集即达到最大的A650/A520值对应的浓度作为最佳的CTAB浓度。
1.6.2 Apt浓度优化 为保证反应体系的灵敏度,试验采用差值法优化Apt浓度。首先设置存在30 ng/mL的OFL 的试验组A1和不存在OFL 的空白组A,然后将终浓度为1.0,1.5,2.0、2.5,3.0、3.5,4.0、4.5,5.0 nmol/L 的Apt溶液和适量的MOPS-Na 缓冲液分别与试验组和空白组在37℃孵育30 min,接着向每个溶液中加入500 μL AuNPs溶液再进行30 min的反应,最后加入此前最佳浓度的CTAB溶液。在15 min的相互作用后,测定吸光度获得A1和A,并计算得到ΔA=A1-A,以吸光度比值的差值ΔA 的平均值为纵坐标,Apt浓度为横坐标作图,选择最大ΔA值处的浓度作为最优的Apt浓度。
1.7 标准曲线的建立及反应的特异性分析
根据上述优化的试验条件,通过改变靶标OFL 的浓度建立标准工作曲线。固定加入100 μL 不同浓度的OFL,使最终浓度为0,5,12.5,25,50,75,150,200 ng/mL,然后加入最优浓度的Apt 和1 180 μL MOPS-Na(10 mmol/L pH 7.0)缓冲液、混匀后于37 ℃孵育30 min,接着加入500 μL 的AuNPs 涡旋混匀后于37 ℃孵育30 min,最后加最佳体积的10 μmol/L CTAB 混匀在37 ℃孵育15 min 后扫描400~800 nm 波长的吸收光谱。测量520 nm 和650 nm 的吸光值,以OFL 浓度为横坐标,A650/A520为纵坐标。通过加入OFL与空白对照的吸光度比值的差值ΔA得到标准工作曲线图。
对于反应体系的特异性考察,根据上述优化好的条件,在优化的检测系统中选择多种不同的干扰物代替OFL,包括ENR、LOM、NOR、PFL、CIP、SFX 和CAP,以及包括OFL 在内的8 种抗生素的混合物,所有抗生素的浓度均为30 ng/mL,并用紫外分光光度计分别测定A650/A520,并以不加测定物为空白对照组,并计算各干扰物与空白组的差值ΔA。以ΔA为纵坐标,各类干扰物的名称为横坐标作坐标图,判断该反应体系的特异性。
2 结果与分析
2.1 反应的发生
为了验证方法的可行性,试验中测定了加入了CTAB 及适配体前后AuNPs 的吸收光谱。如图2a 所示,AuNPs 在波长520 nm 处有明显的特征吸收峰;当加入阳离子表面活性剂CTAB 时,AuNPs表面的柠檬酸根离子电荷平衡被破坏,此时AuNPs 溶液发生聚集,可以观测到其520 nm 处的吸收峰下降,650 nm 附近的吸收峰上升(图2d);在AuNP 溶液中加入Apt 时,Apt 会吸附在AuNPs 表面,阻止了AuNPs 溶液的聚集(图2b),同时从图中可以看到,吸收峰变宽,最大吸收波长略有红移,这是因为Apt不是处于完全饱和状态,仍有部分AuNPs 发生了聚集现象[23]。然而,当反应体系中存在OFL 时,AuNPs 溶液又重新出现聚集现象,520 nm 处的吸光度强度降低,而650 nm处出现的新峰强度增加(图2c)。图3显示了不同聚集状态下AuNPs的透射电子显微镜(transmission electron microscope,TEM)图。单独的AuNPs 分散均匀,颗粒规则(图3a);加入CTAB 后,AuNPs 完全聚集(图3b);在Apt存在的情况下,AuNPs分散良好,仅有极少部分聚集(图3c);最后加入OFL后,AuNPs又发生聚集(图3d)。这一现象结果也与紫外-可见分光光谱一致。Zeta 电位可以用于确认溶液中AuNPs 与Apt 的结合状态。如图4 所示,合成的AuNPs 溶液由于表面带有柠檬酸根,zeta电位呈负值[24],为(-31.70±1.06)mV,与Apt孵育30 min后,zeta电位变为(-36.20±1.07)mV,绝对值增大,表明Apt与AuNPs发生了结合[25-26]。

图2 不同状态下AuNPs的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectra of AuNPs under different conditions

图3 不同状态下AuNPs的透射电子显微镜表征Fig.3 The characterization by transmission electron microscope of AuNPs under different conditions

图4 不同状态下AuNPs的zeta电位Fig.4 The zeta potentials of AuNPs under different conditions
2.2 检测条件优化
CTAB 作为AuNPs 聚集的诱导剂,CTAB 的浓度对AuNPs 的聚集效果有重要影响。CTAB 的浓度太低,AuNPs无法完全聚集,故CTAB 的浓度优化是必要的[17]。如图5所示,随着CTAB 浓度的增大,A650/A520比值逐渐增大,当CTAB 浓度达到0.95 μmol/L 时,A650/A520比值达到最大值,随着继续增大CTAB 浓度,A650/A520比值仍保持在最大值,这一过程说明当CTAB 浓度达到0.95 μmol/L 时,AuNPs的聚集达到饱和状态,因此在后续的试验中选择0.95 μmol/L作为CTAB的使用浓度。

图5 CTAB浓度对反应体系的影响Fig.5 Effect of CTAB concentration on the reactive system
Apt 的浓度同样影响着AuNPs 的聚集效果。当Apt 浓度过高时,部分Apt 与OFL 优先结合后,多余的Apt会继续吸附到AuNPs表面,AuNPs都会被Apt保护从而无法聚集;当Apt浓度过低时,AuNPs 表面无法被Apt吸附完全,无论OFL 存在与否,在CTAB 的存在下都会使AuNPs 聚集,这一现象容易导致试验结果假阳性[27],故Apt 的浓度优化尤为重要。试验结果如图6 所示,随着Apt 浓度的增大,无OFL 的空白组A 与存在OFL 的试验组A1都呈下降趋势,表明Apt 起到了阻止AuNPs 聚集的作用,A1相对大于A,这是因为Apt 优先与OFL 结合,剩余的Apt 起到了一定的保护作用。与A1相比,A的降低趋势较缓,表明Apt浓度处于阻止CTAB聚集AuNPs 的饱和状态。当Apt浓度为1.5 nmol/L 时,A1与A 的差值达到最大,因此Apt最优使用浓度为1.5 nmol/L。

图6 Apt浓度对反应体系的影响Fig.6 Effect of Apt concentration on the reactive system
2.3 线性范围与检出限测定
为了研究该体系检测OFL 的可行性,在最佳试验条件下,测定了不同浓度OFL 下检测体系的吸光度的变化。随着OFL 浓度的升高,在650 nm 处的吸光强度逐渐升高(图7a),A650/A520随着OFL 浓度的增加而增加,在5~75 ng/mL OFL 内,ΔA650/A520与OFL 浓度呈良好的线性关系,线性回归方程为Y=0.012 5X+0.036 2(R2=0.988 3)(图7b)。通过计算得到该方法的检出限(LOD)为0.295 ng/mL,如表1 所示,与其他检测方法相比,该方法不需要使用大型仪器,且操作简便快速,并具有更高的灵敏度。

表1 不同OFL检测方法的比较Tab.1 Comparison of different ofloxacin detection methods
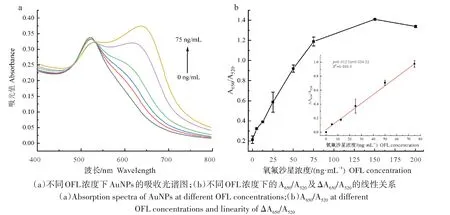
图7 不同浓度OFL对反应体系的影响Fig.7 Effect of the ofloxacinof different concentration on the reactive system
2.4 特异性评价
选择6 种氟喹诺酮类药物ENR、LOM、NOR、PFL、CIP 和SFX,以及1 种氯霉素类药物CAP,在相同条件下反应,研究该体系的特异性。结果如图8所示,加入OFL的ΔA650/A520值明显高于其他7种药物,表明该检测体系对OFL 的特异性识别强于其他药物,所有药物混合后其吸光值与OFL 相比,有了较小的增大。这些结果表明,该比色分析法对OFL 的检测具有良好的特异性。ENR 的吸光值较高可能是其化学结构特征与OFL相似[31-32]。

图8 核酸适配体结合胶体金比色法检测OFL体系的特异性分析Fig.8 Specific analysis of the aptamer combined with AuNPs colorimetric method for the detection of ofloxacin
3 讨论与结论
本研究采用氧氟沙星核酸适配体对氧氟沙星的特异性识别功能及阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)聚集金纳米粒子产生的光学变化,初步建立了一种快速检测氧氟沙星的比色分析方法,优化了CTAB 和Apt 的浓度,评估了检测体系的灵敏度和特异性。在CTAB浓度为0.95 μmol/L,Apt 浓度为1.5 nmol/L 的条件下,OFL 浓度在5~75 ng/mL 具有良好的线性关系,最低检测限为0.295 ng/mL。本方法利用适配体的特异性识别能力,灵敏度较高,基于纳米金粒子的聚集特性实现比色检测,无需使用大型仪器,操作简便、快速,有望制成快速检测试剂盒,应用到实际样品现场检测中。
