柳叶腊梅叶黄酮类化合物对金黄色葡萄球菌攻毒小鼠的肝保护作用研究
2023-01-31王文君
周 欢,王文君
(江西农业大学 食品科学与工程学院,江西 南昌 330045)
【研究意义】金黄色葡萄球菌(Staphylococcus aureus)可引起人类及动物的皮肤和软组织感染、肺炎、败血症和心内膜炎等多种疾病,长期使用抗生素会致使其产生耐药性[1-5]。抗生素耐药性是一个不可避免的生物过程,严重威胁了全球农业生计、粮食安全和人类健康[6-7]。因此,迫切需要开发新型抑菌剂以控制病原体引起的感染。【前人研究进展】长期以来,许多植物天然产物由于其独特的化学特性和丰富的生物活性,能够更有效地与生物目标结合[8-9],被用于治疗疾病。Al-Awsi 等[10]研究了药蜀葵甲醇提取物的抑菌活性,结果表明其富含黄酮类化合物,在体内外均有抑菌作用,对金黄色葡萄球菌和铜绿假单胞菌皮肤感染模型小鼠均有保护作用。Mordmuang 等[11]报道了毛桃叶乙醇提取物对金黄色葡萄球菌诱导的乳腺炎模型小鼠,可作为控制金黄色葡萄球菌天然抑菌剂。Liu 等[12]报道由桔梗和甘草组成的解更汤对金黄色葡萄球菌诱导的急性肺损伤小鼠具有保护作用,可显著改善小鼠肺组织病理形态、减少肺部细菌负荷及抑制感染后24 h 炎性细胞因子的表达。Wang 等[13]报道柳叶腊梅叶醇提物对3 种细菌和4 种真菌具有抑制作用,并且采用棋盘法证明其能与链霉素产生协同作用(ΣFIC≤0.38)。柳叶腊梅(Chimonanthus salicifoliusS.Y.Hu,FCS)种属于腊梅属,又称黄金茶、香风茶和食凉茶等,主要分布于江西三清山、浙江开化、淳安、湖南、湘西等地[14]。研究表明,柳叶腊梅含有多糖、黄酮、挥发油和生物碱等多种活性成分,以及香豆素类、脂肪酸、微量元素、氨基酸和维生素[15-18]等。其中,黄酮类化合物是柳叶腊梅叶的主要成分之一。黄酮类化合物具有抗氧化[7,15]、抑菌[7]、保肝[19-20]、抗癌[21]、抗炎[22-23]、降血糖[24]等多种功能作用。【本研究切入点】实验室前期的研究系统地阐述了柳叶腊梅叶黄酮类化合物的体外抑菌活性和作用机制[13,25],但其在小鼠体内是否有抑菌活性,对金黄色葡萄球菌感染引起的小鼠肝脏损伤是否有保护作用等问题仍有待研究。【拟解决的关键问题】以柳叶腊梅叶为原料,研究柳叶腊梅黄酮类化合物(flavonoids ofC.salicifolius,FCS)在金黄色葡萄球菌诱导的细菌感染小鼠体内的肝保护作用,探讨FCS 对食源性致病菌的体内抑菌机制。
1 材料与方法
1.1 材料和试剂
柳叶腊梅叶购于中国浙江省丽水市。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、蛋白定量(BCA)测定盒、丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)检测试剂盒购于南京建成生物工程研究所(中国南京)。ELISA 试剂盒(TNF-α、IL-6和IL-1β)购于武汉博士德生物科技有限公司(中国武汉)。Luria Bertani 肉汤(LB)购于青岛希望生物科技有限公司(中国青岛)。琼脂粉购于北京索莱宝科技有限公司(中国北京)。其他所有使用的化学品和试剂均为分析级。
1.2 仪器和设备
5415D 小型高速冷冻离心机(德国Eppendorf 公司),TGL-20000-cR 型高速台式冷冻离心机(上海安亭科学仪器厂)。DE-1000gA型高速粉碎机(浙江红景天工贸有限公司),HF-20B型超声循环提取机(北京宏祥隆生物科技公司),RE-52AA 型旋转蒸发器(上海亚荣生化仪器厂),TSGP15D 型数显恒温水浴锅(赛默飞世尔科技公司),Scientz-10N型冷冻干燥机(宁波新芝生物科技股份有限公司),M2型酶标仪(美国Molecular Device 公司),MLS-3751L-PC 型高压蒸汽灭菌锅(日本松下健康医疗器械株式会社),SHP-160型生化培养箱(上海三发科学仪器有限公司),TS-2102C型恒温摇床(上海天呈实验仪器制造有限公司),HFsafe-1200LC型生物安全柜(上海力申科学仪器有限公司),KZ-II高速组织研磨仪(武汉赛维尔生物科技有限公司)。
1.3 试验动物
试验动物为SPF 级雌性ICR 小鼠,体质量18~22 g,购于湖南斯莱克实验动物有限公司,许可证号:SCXK(湘)2019-0004。小鼠实验前适应性喂养一周,饲养环境为温度(23±2)℃,相对湿度40%~60%,昼夜循环12 h/12 h,每天换水,隔天更换垫料,允许小鼠自由进食。所有试验均严格按照中国实验动物科学协会《实验动物护理与使用指南》进行,并经江西农业大学动物护理与使用委员会批准(JXAUA01)。
1.4 试验方法
1.4.1 菌株的培养 金黄色葡萄球菌(ATCC 25923)由江西农业大学天然产物与功能食品重点实验室提供。首先,将金黄色葡萄球菌接种于LB 液体培养基中37 ℃震荡培养12 h。次日再接种到LB 固体培养基于37 ℃恒温培养24 h。随后在培养基上挑选单菌落接种到LB肉汤中,37 ℃震荡培养12 h。将浑浊的菌悬液以3%的比例接种到新鲜LB肉汤中,培养1~3 h达到对数生长期后取出。预试验时用分光光度计测得对数期的菌悬液OD600值约为0.5,用平板计数法测得菌悬液浓度约为108CFU/mL。通过离心(4 ℃,12 000 r/min,5 min)收集对数期细菌,无菌生理盐水洗涤3 次,然后用菌悬液1%体积的生理盐水重悬得浓缩的金黄色葡萄球菌菌液(约1010CFU/mL)。取适量的菌悬液用生理盐水梯度稀释至所需浓度,用于后续试验。此外,取少量浓缩的菌悬液梯度稀释后涂布平板,每个浓度梯度设置3 个平行。平板置于37 ℃恒温培养24 h,选取菌落数在30~300 CFU、无蔓延菌落生长的平板计数菌落总数,计算平均值并乘以稀释倍数后可得攻毒菌悬液实际浓度。
1.4.2 FCS 的制备 FCS 的制备参照赵梓桐等[26]试验方法稍作修改。干燥的柳叶腊梅叶粉碎后过60 目筛,称取1 kg 粉末于60%乙醇溶液中浸泡过夜。超声辅助提取2 次,合并滤液。超声提取条件为∶料液比1∶20(g/mL),超声时间60 min,超声功率1 500 W,超声温度55 ℃。所得滤液经过抽滤、离心、减压浓缩和冷冻干燥后得到柳叶腊梅叶粗提物粉末。将得到的粗提物粉末用蒸馏水复溶,经D1400 大孔树脂层析柱分离纯化。先用蒸馏水洗至流出液接近无色,再用40%乙醇溶液洗脱。将40%乙醇洗脱液用旋转蒸发器减压浓缩,冷冻干燥,所得粉末被定义为柳叶腊梅叶黄酮类化合物(FCS)。以芦丁为标准品,以亚硝酸钠-硝酸铝-氢氧化钠为显色体系,利用分光光度法定量[27]测得FCS总黄酮百分含量为(84.2±2.0)%。
1.4.3 金黄色葡萄球菌半数致死剂量的测定 为得到可导致实验动物50%死亡的菌浓度,即半数致死剂量(50% lethal dose,LD50),将60 只小鼠随机分为6 组,每组10 只。对各组小鼠腹腔注射新鲜制备的菌悬液进行攻毒,浓度分别为2.9×105CFU/mL、2.9×106CFU/mL、2.9×107CFU/mL、2.9×108CFU/mL、2.9×109CFU/mL、2.9×1010CFU/mL,注射剂量为每只0.5 mL。观察小鼠外观及精神状态,并统计24 h 内生存情况计算存活率,得到金黄色葡萄球菌半数致死剂量(LD50)进行以下试验。
1.4.4 LD50金黄色葡萄球菌攻毒小鼠模型 取50 只小鼠随机分为5 组(每组10 只):正常组(NC),模型组(MC),FCS 低剂量组(FCS-L,100 mg/kg/d),FCS 中剂量组(FCS-M,200 mg/kg/d),FCS 高剂量组(FCS-H,400 mg/kg/d)。NC 组和MC 组灌胃生理盐水,FCS 组灌胃相应浓度的FCS,灌胃剂量为每只0.2 mL,灌胃频率为每天1 次。连续灌胃14 d 后,NC 组小鼠腹腔注射0.5 mL 生理盐水,其余4 组小鼠腹腔注射0.5 mL LD50金黄色葡萄球菌(2.9×108CFU/mL)建立小鼠细菌感染模型。次日各组小鼠继续灌胃生理盐水或FCS,持续4 d。观察小鼠存活情况并计算存活率,4 d 后仍存活的小鼠眼眶取血后颈部脱臼致死,迅速取出肝脏、肾脏和脾脏等器官于-80 ℃保存备用。
1.4.5 体质量和脏器指数测定 腹腔注射金黄色葡萄球菌后,每天称量并记录各组小鼠体质量。将解剖取出的动物器官(肝、肾、脾)用生理盐水冲洗干净,滤纸吸水后称重记录,脏器指数=小鼠器官质量/小鼠体质量×100%。
1.4.6 肝功能转氨酶ALT和AST含量测定 通过眼球采血法收集小鼠血液,室温静置1 h后在4 °C下以3 500 r/min离心15 min,取上清液保存于-80 °C备用。根据试剂盒说明书测定血清ALT和AST水平。
1.4.7 肝脏中SOD、CAT、GSH-Px、MDA 含量测定 肝脏组织与事先预冷的生理盐水按1∶9(w/v)混合,高速组织研磨仪匀浆。将匀浆好的肝脏组织在4 ℃下以2 500 r/min 离心10 min,取上清液保存于-80 ℃备用。根据样品数量,依照BCA 试剂盒说明书指示配制适量BCA 工作液,现用现配。在96 微孔板中分别加入10 μL蒸馏水、10 μL 524 μg/mL 蛋白标准液、10 μL待测样品,然后每孔加入250 μL BCA 工作液,混匀。将96微孔板置于37 ℃恒温培养箱孵育30 min,使用酶标仪测定562 nm处吸光度值。根据BCA试剂盒说明书计算样品蛋白浓度,将各样品蛋白浓度调整至一致。采用试剂盒检测样品SOD、CAT、GSHPx和MDA含量。
1.4.8 肝脏细胞因子TNF-α、IL-6 和IL-1β 测定 10%肝匀浆制备方法同1.4.7,通过离心(2 500 r/min,10 min)分离得上清液,采用BCA 法将各组样品蛋白浓度调整一致。按照ELISA 试剂盒说明书,进行预实验以确定样品适当的稀释倍数。正式试验时,先将样品适当稀释,按照试剂盒说明书构建标准曲线,并根据每个样品的OD 值计算相应的细胞因子含量。细胞因子含量乘以样品稀释倍数即得肝脏组织样品实际的TNF-α、IL-6和IL-1β含量。
1.4.9 肝脏H&E染色 剪取适量肝脏用无菌生理盐水冲洗干净,固定在4%多聚甲醛溶液中24 h。依次用70 %、80%、85%、90%、95%、100%梯度乙醇脱水,渗透并用石蜡包埋。然后,将组织切片后用苏木素和伊红(H&E)染色,用无水乙醇和二甲苯脱水封片,最后使用显微镜(Nikon Eclipse E100,日本)观察组织病理学变化。
1.5 数据分析
数据分析使用IBM SPSS Statistics 25 软件,组间统计分析采用单因素方差分析(one-way ANOVA),组间差异采用最小显著性差异(LSD)检验,#P表示与NC 组相比具有显著性差异(P<0.05),*P表示与MC组相比具有显著性差异(P<0.05)。结果表示为平均值±标准差(mean±SD)。
2 结果与分析
2.1 金黄色葡萄球菌攻毒剂量的测定
腹腔注射不同浓度金黄色葡萄球菌攻毒小鼠,各组小鼠呈现不同的生理特征。低剂量攻毒组(2.9×105CFU/mL)小鼠无明显变化,中剂量攻毒组(2.9×106CFU/mL 和2.9×107CFU/mL)小鼠活力下降、发抖、嗜睡和聚集,2 d后生理状态逐渐恢复正常。高剂量攻毒组(2.9×108、2.9×109和2.9×1010CFU/mL)小鼠毛发蓬乱,眼睑分泌脓液,肛周肿胀,甚至死亡,且小鼠的死亡发生在24 h 内。如图1A 所示,2.9×105、2.9×106和2.9×107CFU/mL 金黄色葡萄球菌攻毒组无小鼠死亡,2.9×108、2.9×109和2.9×1010CFU/mL 金黄色葡萄球菌攻毒组小鼠死亡率分别为50%、90%和100%。结果表明金黄色葡萄球菌引起小鼠剂量依赖性死亡,半数致死剂量(LD50)为2.9×108CFU/mL。
2.2 LD50金黄色葡萄球菌感染小鼠模型
为确定使实验动物半数死亡的菌悬液浓度,进行了金黄色葡萄球菌攻毒剂量试验,结果表明半数致死剂量LD50为2.9×108CFU/mL。通过腹腔注射0.5 mL LD50金黄色葡萄球菌悬液建立小鼠细菌感染模型,观察小鼠存活情况。小鼠存活率如图1B 所示,NC 组无小鼠死亡,MC 组小鼠在腹腔注射金黄色葡萄球菌后第6 h 死亡率达40%。这表现了金黄色葡萄球菌毒力的同时也进一步反应了模型建立成功。攻毒4 d 后,MC 组小鼠存活率为60%。FCS-L、FCS-M 和FCS-H 组小鼠存活率分别为40%、70%和90%,结果表明中高剂量FCS可提高金黄色葡萄球菌小鼠的存活率。
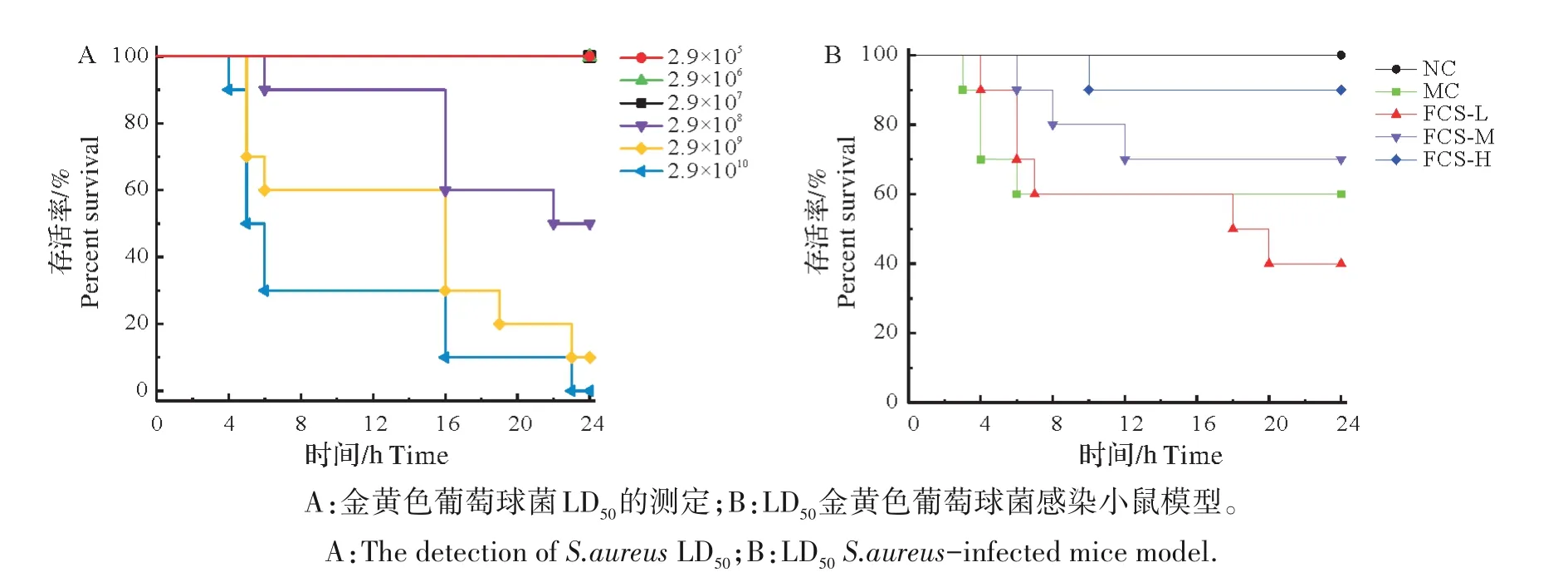
图1 FCS对小鼠存活率的影响(n=10)Fig.1 Effects of FCS on the survival rate of mice(n=10)
2.3 FCS对小鼠体质量和脏器指数的作用
小鼠体质量变化如表1所示。攻毒4 d后,NC组小鼠体质量增加了1.03 g,而MC组小鼠体质量下降了3.42 g,提示腹腔注射金黄色葡萄球菌导致小鼠体质量降低。此外,FCS-L 和FCS-M 组小鼠体质量分别下降了0.7 g 和0.4 g,表明低、中剂量的FCS 可缓解金黄色葡萄球菌引起的体质量下降。同时,FCS-H 组小鼠在攻毒4 d后增加了0.12 g,说明高剂量FCS能有效地逆转金黄色葡萄球菌导致的体质量下降趋势。小鼠脏器指数如表1 所示,NC 组小鼠的器官指数(肝、肾、脾)最低。攻毒金黄色葡萄球菌后,MC 组小鼠的器官指数显著升高(P<0.05)。与MC 组相比,FCS-L 组、FCS-M 组、FCS-H 组的肝指数分别降低了3.21%、11.23%、14.62%,并且MC 组、FCS-L 组和FCS-M 组的肝指数与NC 组存在极显著差异(P<0.01),而FCS-H 组肝指数与NC 组仅存在显著差异(P<0.05)。与NC 组相比,MC 组小鼠肾指数上升了0.59%,存在显著性差异(P<0.05)。经FCS 处理后,FCS 各剂量组小鼠肾指数与NC 组都不存在显著性差异(P>0.05)。此外,FCS处理组小鼠脾指数有轻微降低的趋势,但差异无统计学意义(P>0.05)。
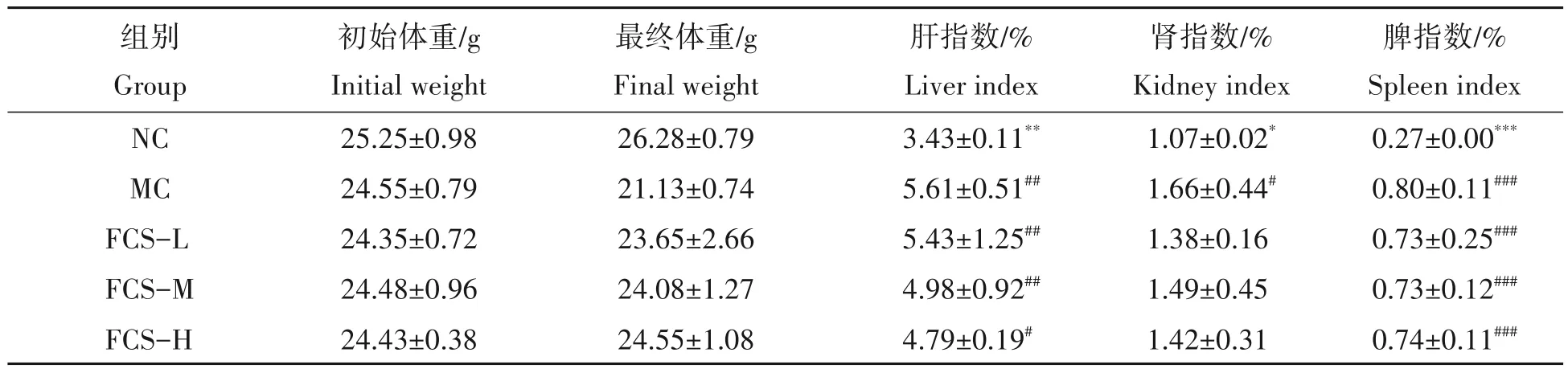
表1 FCS对小鼠体质量和脏器指数的作用Tab.1 Effects of FCS on body weight and organ index in mice
2.4 FCS对小鼠肝功能转氨酶ALT和AST的作用
小鼠肝功能转氨酶ALT 和AST 含量如图2A-B 所示。与NC 组相比,金黄色葡萄球菌攻毒后,MC 组小鼠血清中ALT 含量显著增加(P<0.05)。经FCS处理后,FCS-L、FCS-M 和FCS-H 组小鼠ALT 含量分别下降29.62%、59.89%和65.76%,与MC 组差异显著(P<0.001)。此外,与NC 组相比,MC 组小鼠AST 含量增加了109.27%,具有显著性差异(P<0.05)。经低、中、高剂量FCS 处理的小鼠AST 含量与MC 组比较分别下降22.64%、9.09%、48.57%,其中FCS-H 组AST含量显著低于MC组(P<0.05),且与NC组相近。结果表明FCS可抑制金黄色葡萄球菌攻毒导致的小鼠血清ALT和AST含量上升,且高剂量FCS效果最佳。
2.5 FCS对小鼠肝脏SOD、CAT、GSH-Px、MDA的作用
小鼠肝脏氧化应激指标SOD、CAT、GSH-Px、MDA 测定结果如图2C-F 所示。与NC 组相比,小鼠经腹腔注射金黄色葡萄球菌攻毒后,MC组小鼠肝脏SOD、CAT、GSH-Px含量显著降低,MDA含量显著升高(P<0.001)。与MC 组相比,FCS-M 和FCS-H 组小鼠SOD 含量显著增加(P<0.05),FCS-L 组小鼠SOD 含量增加但无统计学意义(P>0.05)。经100,200,400 mg/kg/d FCS 处理后,CAT 含量分别增加78.8%、113.18%和113.51%,与MC 组差异显著(P<0.05)。且MC 组和FCS-L 组CAT 含量显著低于NC 组,经中、高剂量FCS 处理的小鼠CAT 含量与NC 组相近,无显著性差异。此外,与MC 组相比,FCS-L、FCS-M、FCS-H 组小鼠的GSH-Px 含量分别增加8.2%,15.1%和18.82%,与MC 组相比,MDA 含量分别减少28.53%、21.61%和33.52%。数据显示,FCS 可增加金黄色葡萄球菌感染小鼠肝脏SOD、CAT、GSH-Px 含量并抑制MDA 含量升高。结果表明FCS 通过调整肝脏氧化应激水平以保护小鼠免受金黄色葡萄球菌攻毒导致的伤害。
2.6 FCS对小鼠肝脏TNF-α、IL-6和IL-1β的作用
小鼠肝脏中炎症细胞因子TNF-α、IL-6 和IL-1β 水平变化如图2G-I 所示。腹腔注射金黄色葡萄球菌后,MC组小鼠肝脏TNF-α、IL-6和IL-1β含量均升高,且与NC组差异显著(P<0.05)。给予400 mg/kg/d FCS 灌胃后,肝脏TNF-α(88.05 pg/mL)、IL-6(159.47 pg/mL)和IL-1β(83.72 pg/mL)浓度分别降低了50.90%、22.80%和26.16%,与MC 组差异显著(P<0.05)。灌胃低、中、高剂量FCS 的小鼠肝脏TNF-α、IL-6 和IL-1β 含量均下调,且呈浓度依赖性关系。其中FCS-H 组的TNF-α 含量与NC 组差异不显著,并且FCS-M、FCS-H 组小鼠的IL-6 和IL-1β 含量与NC 组相近,差异不显著(P>0.05)。结果表明FCS可抑制金黄色葡萄球菌攻毒导致的炎症细胞因子(TNF-α、IL-6 和IL-1β)含量增加,从而减轻小鼠炎症反应。
2.7 FCS对小鼠肝脏的保护作用
肝脏组织学观察结果如图3 所示,NC 组小鼠肝脏细胞排列整齐、结构完整,无病理改变。腹腔注射金黄色葡萄球菌后,MC 组小鼠肝脏组织出现明显的炎症表现,包括炎性细胞浸润、血管淤血、细胞核破碎甚至部分溶解等。经FCS 灌胃小鼠的肝脏组织的炎症病理变化减轻,并且400 mg/kg/d 的FCS 对小鼠表现出显著的保护作用,其肝脏外观正常,细胞质保存完好,细胞排列紧密整齐,细胞核突出,核仁可见,表明FCS 具有良好的肝保护作用。这说明肝脏H&E 染色的组织病理学观察与生化分析的结果一致。
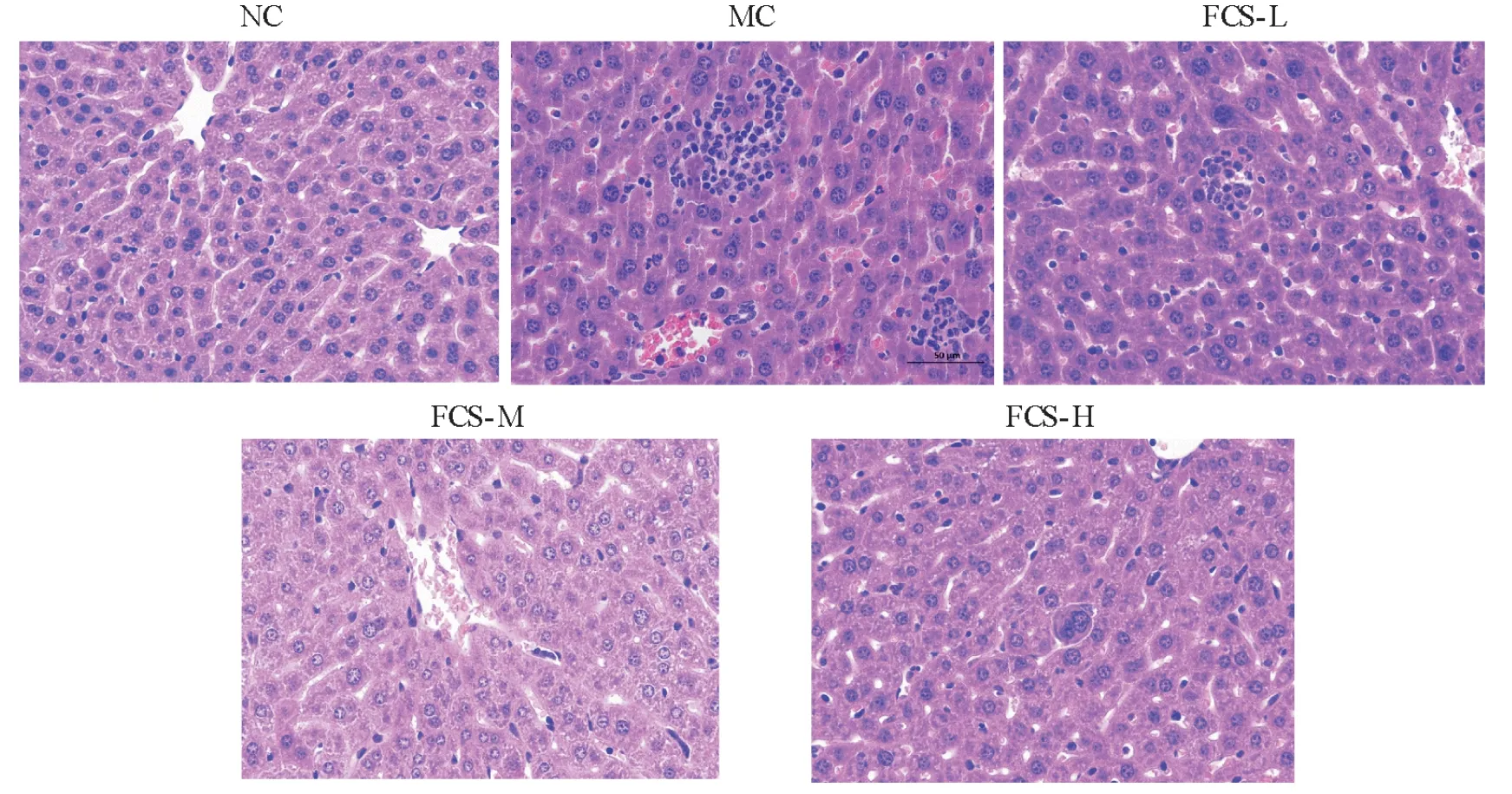
图3 FCS对LD50金黄色葡萄球菌感染小鼠肝脏病理形态学的影响(400×)Fig.3 Effects of FCS on pathological physiology of liver in mice infected by LD50 S.aureus(400×)
3 讨论与结论
实验室前期研究结果表明柳叶腊梅叶黄酮类化合物在体外对多种细菌和真菌(如金黄色葡萄球菌、大肠杆菌、沙门氏菌、青霉菌和黑曲霉等)均有一定程度的抑菌活性,其中对金黄色葡萄球菌的抑菌效果最好[13,25]。金黄色葡萄球菌是主要的革兰氏阳性菌,属于兼性病原体,可以在人和动物中引发多种感染疾病。长期使用抗生素期间可产生耐药性,并对抑菌药物具有广泛的耐药性[28]。因此,以金黄色葡萄球菌作为指示菌,研究柳叶腊梅叶黄酮类化合物FCS在动物体内的抑菌活性,为FCS作为一种新型抑菌剂提供理论依据。
研究发现,腹腔注射金黄色葡萄球菌诱导的小鼠细菌感染,可在短时间内导致小鼠死亡,且灌胃给药需较长时间通过消化道进入血液。因此,为评价FCS 在金黄色葡萄球诱导小鼠感染模型中是否能发挥抑菌作用,本试验选择在感染前14 d开始给药。为确定使实验动物半数死亡的菌悬液浓度,进行了金黄色葡萄球菌攻毒剂量试验。结果表明,金黄色葡萄球菌使小鼠剂量依赖性死亡,且半数致死剂量LD50为2.9×108CFU/mL。在LD50金黄色葡萄球菌感染模型中,MC 组小鼠存活率为60%,经中、高剂量FCS 灌胃的小鼠存活率提高,分别为70%和90%,表明FCS 对小鼠的保护作用。而FCS-L 组的存活率低于MC组,这可能是小鼠个体的差异及试验随机误差造成的。
试验中通常用感染期间的体质量变化来衡量疾病严重程度。此外,动物被细菌感染后,受损器官的重量可能会发生改变,器官指数也会随之改变。试验结果显示FCS 可减轻金黄色葡萄球菌攻毒小鼠的体质量下降,以及缓解小鼠的肝、肾、脾脏器指数的上升,说明FCS对腹腔注射金黄色葡萄球菌诱导的细菌感染小鼠有一定的保护作用。
肝细胞合成了体内大部分的血清蛋白,因此,血清中肝细胞蛋白水平构成了反映系统过程和肝脏状态的重要生物标志物[29]。血清中ALT 和AST 水平的高低是临床监测肝损伤的重要指标,当肝损伤发生时,它们能从肝细胞进入血液循环[30-31]。试验结果显示,MC 组小鼠血清内ALT 和AST 的水平与NC 组相比显著上升,表明细菌感染引起小鼠肝脏损伤。然而FCS 组小鼠血清内ALT 和AST 水平与MC 组小鼠相比显著降低,与NC 组无显著性差异,表明FCS 可以增加细胞膜的稳定性,保持肝细胞结构的完整性。
氧化应激是许多疾病发病的罪魁祸首[32],肝脏中的氧化应激会直接损害动物的生产性能[32-33]。为确定FCS 对抗氧化防御的作用测定了肝脏抗氧化指标。结果显示,腹腔注射金黄色葡萄球菌后小鼠肝脏SOD、CAT和GSH-Px含量显著降低,MDA含量显著升高。FCS-M、FCS-H组小鼠肝脏SOD、CAT和GSHPx 含量均显著高于MC 组,说明FCS 能够通过提高小鼠肝脏内的SOD、CAT 和GSH-Px 活性缓解氧化应激。此外,FCS组MDA 水平均显著低于MC 组,且FCS-H 组与NC 组无显著差异,说明FCS能够降低感染小鼠肝脏内氧化水平。
细菌进入体内后可触发机体的炎症反应和免疫系统异常激活,产生大量炎症细胞因子,如TNF-α、IL-6、IL-1β 等,这也是衡量动物疾病发生和器官损伤的常用指标[34-35]。TNF-α 可加速中性粒细胞迁移,促进中性粒细胞产生蛋白水解酶和ROS,并可导致肝损伤[36]。此外,IL-6 和IL-1β 在肝损伤的积累中起重要作用,其水平升高可导致一些炎症性疾病和恶性肿瘤[37]。一方面,这些细胞因子可以局部作用于免疫组织以调节免疫应答。另一方面,它们可以系统地作用于大脑、肝脏、脂肪和骨骼肌,改变机体激素水平,导致免疫应激,导致动物采食量下降、生长缓慢和亚健康[38]。肝脏中炎症细胞因子结果显示,腹腔注射金黄色葡萄球菌攻毒后,小鼠肝脏的TNF-α、IL-6 和IL-1β 含量显著升高,与NC 组差异显著。与MC 组相比,FCS 组小鼠的TNF-α、IL-6 和IL-1β 含量显著降低。因此,这表明FCS 可能通过免疫调节功能以浓度依赖性方式下调炎症细胞因子,保护机体防止过度系统性炎症造成的损伤。
肝脏作为重要的免疫器官,能帮助清除体内病原菌,在抵御感染过程中发挥作用。研究表明,黄酮类化合物具有极高的生物活性,对肝脏能起到良好的保护作用[19-20]。因此对肝脏进行了组织学检查,研究FCS 对肝脏器官损伤的保护作用。结果表明肝组织病理程度有所缓解,这也与以上试验结果保持一致。
综上所述,本研究首次报道了FCS 对金黄色葡萄球菌的体内抑菌活性。结果表明FCS 可提高细菌感染小鼠的存活率,减轻病理状态和器官损伤,缓解肝脏氧化应激,下调肝脏炎症细胞因子IL-1β、IL-6和TNF-α 的分泌。研究证实了FCS 对感染金黄色葡萄球菌小鼠具有肝保护作用,表明FCS 对金黄色葡萄球菌具有良好的体内抑菌活性,有潜力作为一种新型抑菌剂应用于金黄色葡萄球菌引起的疾病,有利于提高柳叶腊梅的利用率。
致谢:江西省农业农村厅牛羊产业体系专项资金(JXARS-13)和江西农业大学研究生创新专项基金项目(NDYC2020-S013)同时对本研究给予了资助,谨致谢意!
